稠杂嘧啶衍生物及其制备方法和应用与流程
本发明涉及稠杂嘧啶衍生物及其制备方法和应用,具体为该衍生物可以预防或治疗GPR119相关的疾病,尤其是糖尿病、代谢性疾病以及肥胖等疾病。
背景技术:
代谢病是指伴随如肥胖症、糖尿病、高甘油三酯血症、高血压、其他心血管疾病和凝血障碍的风险因素的综合征。根据美国国家胆固醇教育计划(US NationalCholesterol Education Program,NCEP)ATP III,当患者显示以下五种风险因素中的至少三种时,可以做出代谢综合征的诊断:①腹部肥胖,表现为男性腰围为40英寸(102cm)或更多,以及女性腰围为35英寸(88cm)或更多,②高甘油三酯血症,表现为甘油三酯为150mg/dL或更多,③在男性中HDL胆固醇为40mg/dL或更少,在女性中为50mg/dL或更少,④高血压,表现为血压为130/85mmHg或更高,以及⑤空腹血糖为110mg/dL或更多。由于肥胖人和久坐生活方式的增加,全世界糖尿病的流行率正在快速增加,根据国际糖尿病联合会(IDF),糖尿病患者的数目预计会爆发式增长至2030年的4.35亿。
GPR119为G-蛋白偶联受体,其主要表达在胰脏的β细胞及肠的K-和L-细胞中。体外研究显示GRP119的激动剂通过在肠和胰脏衍生细胞系活化cAMP途径而分别介导GLP-1和胰岛素的分泌。这支持了以下假说:GPR119调节剂(具体地为激动剂)通过增加胰岛素和肠激素(如GIP、GLP-1和PYY)的分泌可用于治疗糖尿病及相关病症。由于已发现胰岛素的分泌严格地为葡萄糖依赖型,因此可极大地避免低血糖症发作。此外,可从肠肽的释放预期有益效应,如减少进食。通过活化GPR119刺激β细胞也可改善β细胞功能和β细胞质量。啮齿类动物中GPR119激动剂的研究显示所预测的降低葡萄糖效应。对于一些此类动物研究,报道了进食减少和体重减轻。最近,使用GPR119激动剂的临床试验增加证据支持对脂质参数的阳性效应,即提高人类的HDL并降低LDL和甘油三酯。WO2013/070463A2披露了GPR119激动剂可用于治疗血脂异常。总之,GPR119的调节剂(具体地为激动剂)可具有预防和/或治疗哺乳动物尤其是人类的代谢性病症的治疗效用。所述病症和疾病的实例包括2型糖尿病、1型糖尿病、葡萄糖耐量降低(impaired glucose tolerance)、胰岛素抵抗(insulin resistance)、β细胞功能丧失、高血糖症(hyperglycemia)、高胆固醇血症(hypercholesterolemia)、血脂障碍、高甘油三酯血症(hypertriglyceridemia)、X综合征、代谢综合征、肥胖、脂肪肝(fattyliver)、脂肪变性、脂肪性肝炎(steatohepatitis)、肝硬化、微血管和大血管病症、高血压、慢性低度炎症、视网膜病(retinopathy)、神经病(neuropathy)、肾病(nephropathy)、动脉粥样硬化、冠心病、内皮功能障碍和骨骼相关性疾病诸如骨质疏松症、类风湿性关节炎或骨关节炎。
由于低分子药物激活GPR119具有有效的降糖作用和对胰岛β细胞的积极作用,突出了其作为2型糖尿病治疗剂改善脂质代谢的价值,所述脂质代谢是慢性心血管风险因素。在这样的背景下,本发明人继续进行对用于代谢病治疗剂的研究,合成了新的激活GPR119的小分子化合物,其被鉴定为具有有效的GPR119激活作用,由此完成了本发明。
技术实现要素:
本发明提供具有GPR119激动剂活性的新的化合物,并提供用于制备具有GPR119激动剂活性的新的化合物的方法以及包含作为有效组分的新的化合物和用于治疗或预防糖尿病、代谢性疾病以及肥胖的药物组合物。
具有GPR119激动剂活性的化合物具有式(I)的结构,
其中,R1选自下列基团:
R2选自:氢原子、卤素、羟基、硝基、胺基、羧基、氰基、烷基、烷氧基、酯基、芳基、杂芳基、被卤素或羟基或氰基取代的烷基、被烷基取代的胺基、被卤素或羟基或氰基取代的烷氧基、被卤素或羟基或氰基取代的芳基、被卤素或羟基或氰基取代的杂芳基;
R3选自:氢原子、卤素、羟基、硝基、氰基、胺基、羧基、甲磺酰基、取代或未取代的烷基或取代或未取代的烷氧基;
X选自:O或NR5;
R4选自下列基团:
R5选自:氢原子、取代或未取代烷基或取代或未取代烷氧基;
进一步的,
R2优选为:氢原子、卤素、羟基、硝基、胺基、羧基、氰基、烷基或烷氧基
R3优选为:氢原子、卤素、硝基、氰基、甲磺酰基、烷基或烷氧基;
R5优选为:氢原子、烷基;
进一步的,
R2优选为:氢原子、卤素或烷基;
R3优选为:2-F-4-Ms,2-F-4-CN,2-Cl-4-Ms,Ms代表甲磺酰基;
R5优选为:氢原子;
烷基进一步优选为C1-6烷基,例如可以举出:甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、异戊基、和己基等;
烷氧基进一步优选为C1-6烷氧基,例如可以举出:甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、叔丁氧基、戊基氧基、异戊基氧基、和己基氧基等;
芳基进一步优选为C6-10芳基,更优选为苯基、萘基。
杂芳基进一步优选为C6-10杂芳基,更优选C6-10杂芳基中含有1-3个杂原子,杂原子优选为N,S或O,更优选为O或N。例如:呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、噻二唑基、异噻唑基、吡啶基、哒嗪基、吡嗪基、嘧啶基、喹啉基、异喹啉基、苯并呋喃基、苯并噻吩基、吲哚基、吲唑基。
另一方面,本发明提供上述化合物的立体异构体、互变异构体、对映异构体、非对映异构体、外消旋异构体、其与酸所形成的医学上可接受的盐。
成盐的酸可以是有机酸或无机酸,例如:与盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、碳酸等无机酸的盐;与甲酸、乙酸、丙酸、三氟乙酸、邻苯二甲酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苯甲酸、甲磺酸、乙磺酸、苯磺酸、对甲苯磺酸等有机酸的盐;与赖氨酸、精氨酸、鸟氨酸、谷氨酸、天冬氨酸等氨基酸的盐。
进一步地,本发明提供下列化合物或立体异构体、互变异构体、对映异构体、非对映异构体、外消旋异构体、其与酸或碱所形成的医学上可接受的盐:
进一步地,本发明提供下列化合物或立体异构体、互变异构体、对映异构体、非对映异构体、外消旋异构体、其与酸或碱所形成的医学上可接受的盐:
另一方面,本发明提供式(I)化合物的制备方法。
当X为O时,其制备方法为:
步骤(1):以4,6-二氯-5-甲氧基嘧啶和R3取代苯胺为原料,在有机溶剂中碱性环境下生成式(II)化合物
碱性环境优选使用K2CO3;
有机溶剂优选DMF(N,N-二甲基甲酰胺),DMSO(二甲基亚砜)。
步骤(2):式(II)在有机溶剂中脱去甲基得到式(III)化合物
有机溶剂优选二氯甲烷、乙腈或四氢呋喃;
优选使用BBr3脱去甲基;
步骤(3):式(III)化合物与1-溴-2-氯乙烷在碱性条件下反应生成式(IV)化合物
碱性环境优选使用K2CO3;
有机溶剂优选DMF(N,N-二甲基甲酰胺),DMSO(二甲基亚砜)。
步骤(4):式(IV)化合物与R1H在Pd催化剂存在下反应生成式(I)化合物(X为O)
Pd催化剂优选Pd2(dba)3。
对于X为NR5时,其合成路线如下:
步骤(1):以4,6-二氯-5-R5取代的胺基嘧啶为原料与R3取代的苯胺在Pd催化剂存在下进行反应生成式(V)化合物
Pd催化剂优选Pd2(dba)3;
步骤(2):式(V)化合物与1-溴-2-氯乙烷在碱性条件下反应生成式(VI)
化合物
碱性环境优选使用K2CO3;
有机溶剂优选DMF(N,N-二甲基甲酰胺),DMSO(二甲基亚砜)。
步骤(3):式(VI)化合物与R1H在Pd催化剂存在下反应生成式(I)
化合物(X为NR5)
Pd催化剂优选Pd2(dba)3。
另一方面,本发明提供一种包含式(I)化合物或其医学上可接受的盐和制药学上可接受的载体的药物组合物。
另一方面,本发明提供一种式(I)化合物作为预防或治疗与GPR119相关的疾病,该疾病优选为糖尿病、代谢性疾病以及肥胖的药物。
本发明化合物或其生理学上可接受的盐与一种或多种已知GPR119活性物质组合可同时、分开或依序使用。
含有本发明化合物或其医学上可接受的盐作为有效成分的治疗剂或预防剂,可以使用通常用于制剂化的载体或赋形剂、其他的添加剂来制备。作为制剂用的载体或赋形剂,可以是固体或液体,例如可以举出:硬脂酸镁、淀粉、滑石、明胶、琼脂、果胶、阿拉伯胶、橄榄油、芝麻油、可可脂、和乙二醇等常用的物质。给药可以是如下的任一形态:基于片剂、丸剂、胶囊剂、颗粒剂、散剂、液剂等的经口给药,或者是基于静脉注射、肌肉注射等的注射剂、栓剂、经皮等的肠胃外给药。
达到期望治疗效果的本发明化合物的剂量取决于许多因素,例如所选择的具体化合物、预期用途、给药模式和患者的临床状况。日剂量范围通常为0.3mg至100mg(典型地为3mg至50mg)/天/千克体重,例如3-100mg/kg/天。静脉内剂量范围可为例如0.3mg至1.0mg/kg,其适于以10ng至100ng/千克/分钟的输注形式给药。为此目的,合适的输注溶液可含有例如每毫升0.1ng至100mg,典型地为1ng至100mg。单剂量可含有例如1mg至10g活性成分。因此,注射用.含有例如1mg至100mg,并且可口服给药的单剂量制剂例如片剂或胶囊可含有例如1.0至1000mg,典型地为10至600mg。为了预防和/或治疗上述病症,式I化合物本身可作为化合物使用,但是它们优选与相容性载体呈现为药物组合物的形式。
附图说明
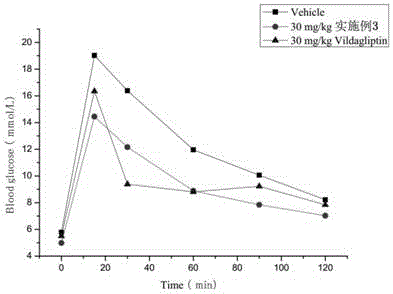
图1:单次给药实施例3和维格列汀对C57BL/6cnc小鼠的各时间点血糖。
具体实施方式
以下通过实施例对本发明的实施方式进行更详细的说明,但本发明不限于此。
实施例1:叔丁基(endo)-3-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)-8-氮杂双环[3.2.1]辛烷-8-羧酸酯
步骤1:4-((6-氯-5-甲氧基嘧啶-4-基)氨基)-3氟苯乙腈
在100mL两颈烧瓶中依次加入4,6-二氯-5-甲氧基嘧啶(1 g,5.7 mmol),2-氟-4-氰基苯胺(0.6 g,4.4 mmol),碳酸钾(2.4 g,17 mmol)和20 mLDMF。反应升温至65℃,搅拌过夜反应。将反应液倒入冰水中,用乙酸乙酯萃取2次,饱和氯化钠洗涤2次,无水硫酸钠干燥,减压蒸干得到粗品。经硅胶柱层析纯化(石油醚(PE):乙酸乙酯(EA)=3:1)得0.68 g棕黄色固体,收率55%。MS-ESI:[M+H]+:279.3。
步骤2:4-((6-氯-5-羟基嘧啶-4-基)氨基)-3-氟苯乙腈
在100 mL两颈烧瓶中加入4-((6-氯-5-甲氧基嘧啶-4-基)氨基)-3氟苯乙腈(0.5g,1.9 mmol)和无水15 mL二氯甲烷。室温下滴加BBr3二氯甲烷溶液(5.7 mL,5.7mmol,1M)。反应升温回流反应2h,用水淬灭反应,二氯甲烷萃取2次,饱和氯化钠洗涤2次,无水硫酸钠干燥,减压蒸干得到粗品。经硅胶柱层析纯化(石油醚(PE):乙酸乙酯(EA)=1:1)得0.2g棕黄色固体,收率42%。MS-ESI:[M+H]+:265.1。
步骤3:4-(4-氯-6,7-二氢-8H-嘧啶并[5,4-b][1,4]噁嗪-8-基)-3-氟苯乙腈
在50mL单颈烧瓶中依次加入4-((6-氯-5-羟基嘧啶-4-基)氨基)-3-氟苯乙腈(0.4g,1.4mmol),1-氯-2-溴乙烷(0.62g,4.3mmol),碳酸钾(0.6g,4.3mmol)和DMF(10mL)。该反应在40℃过夜反应,将反应液倒入冰水中,用乙酸乙酯萃取2次,饱和氯化钠洗涤2次,无水硫酸钠干燥,减压蒸干得到粗品。经硅胶柱层析纯化(石油醚(PE):乙酸乙酯(EA)=2:1)得0.3g棕黄色固体,收率72%。MS-ESI:[M+H]+:291.5。
步骤4:叔丁基(endo)-3-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)-8-氮杂双环[3.2.1]辛烷-8-羧酸酯
在50mL反应瓶中依次加入4-(4-氯-6,7-二氢-8H-嘧啶并[5,4-b][1,4]噁嗪-8-基)-3-氟苯乙腈(0.2g,0.7mmol),endo-N-Boc托品胺(0.23g,1.0mmol),Pd2(dba)3(0.14mmol),X-Phos(0.14mmol),CS2CO3(1.75mmol)和无水二氧六环(8mL)。反应液氮气保护,回流过夜反应。反应结束后,用乙酸乙酯萃取反应液2次,饱和氯化钠洗涤2次,无水硫酸钠干燥,蒸干得到粗品。经硅胶柱层析纯化(PE:EA=1:1)得0.17g黄色固体,收率52%。
1H-NMR(600MHz,CDCl3)δ7.93(s,1H),7.54–7.50(m,1H),7.47(m,2H),5.38(d,J=7.0Hz,1H),4.46–4.37(m,2H),4.33(m,2H),4.22(s,1H),3.89(s,2H),2.39(s,1H),2.30–2.20(m,1H),2.12(t,J=7.4Hz,2H),2.07–1.92(m,2H),1.84(d,J=27.1Hz,2H),1.49(s,9H).HRMS-TOF(m/z)calcd for C25H29FN6O3[M+H]+:481.2285,found 481.2436.
实施例2:叔丁基-4-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)哌啶-1-羧酸酯
参照实施例1的制备方法。1H-NMR(600MHz,CDCl3)δ7.93(s,1H),7.56–7.51(m,1H),7.48(m,2H),4.83(d,J=8.1Hz,1H),4.42–4.35(m,2H),4.22–4.11(m,2H),4.11–4.01(m,1H),3.94–3.82(m,2H),2.98(m,2H),2.14–1.99(m,2H),1.49(s,9H),1.41(m,2H).HRMS-TOF(m/z)calcd for C23H27FN6O3[M+H]+:455.2207,found 455.2304.
实施例3:异丙基(endo)-3-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)-8-氮杂双环[3.2.1]辛烷-8-羧酸酯
参照实施例1的制备方法。1H-NMR(600MHz,CDCl3)δ7.93(s,1H),7.56–7.51(m,1H),7.48(m,2H),5.38(d,J=6.9Hz,1H),4.98(dt,J=12.5,6.2Hz,1H),4.43–4.37(m,3H),4.34(m,2H),3.93–3.84(m,2H),2.37(m,1H),2.31–2.18(m,1H),2.13(m,2H),2.02(m,2H),1.87(m,2H),1.28(d,J=6.2Hz,6H).HRMS-TOF(m/z)calcd for C24H27FN6O3[M+H]+:467.2207,found 467.2282.
实施例4:4-(4-(((endo)-8-(5-乙基嘧啶-2-基)-8-氮杂双环[3.2.1]辛烷-3-基)氨基)-6,7-二氢-8H-嘧啶并[5,4-b][1,4]噁嗪-8-基)-3-氟苯乙腈
参照实施例1的制备方法。1H-NMR(600MHz,CDCl3)δ8.22(s,2H),7.92(s,1H),7.55–7.51(m,1H),7.47(m,2H),5.52(d,J=7.2Hz,1H),4.78(s,2H),4.43–4.37(m,2H),4.30(q,J=6.6Hz,1H),3.92–3.85(m,2H),2.50(q,J=7.6Hz,2H),2.38(m,2H),2.25–2.18(m,2H),2.13(m,2H),1.89(d,J=14.2Hz,2H),1.23(t,J=7.6Hz,3H).HRMS-TOF(m/z)calcd for C26H27FN8O[M+H]+:487.2370,found 487.2462.
实施例5:4-(4-(((endo)-8-(5-氯嘧啶-2-基)-8-氮杂双环[3.2.1]辛烷-3-基)氨基)-6,7-二氢-8H-嘧啶并[5,4-b][1,4]噁嗪-8-基)-3-氟苯乙腈
参照实施例1的制备方法。1H-NMR(600MHz,CDCl3)δ8.27(s,2H),7.92(s,1H),7.55–7.50(m,1H),7.47(m,2H),5.48(d,J=7.1Hz,1H),4.76(s,2H),4.44–4.36(m,21H),4.29(q,J=6.6Hz,1H),3.94–3.84(m,2H),2.34(m,2H),2.22(m,2H),2.15(m,2H),1.91(d,J=14.2Hz,2H).HRMS-TOF(m/z)calcd for C24H22ClFN8O[M+H]+:493.1667,found 493.1751.
实施例6:叔丁基((R)-1-(2-((endo)-3-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)-8-氮杂双环[3.2.1]辛烷-8-基)乙酰基)哌啶-3-基)羧酸酯
参照实施例1的制备方法。1H NMR(600MHz,CDCl3)δ7.92(s,1H),7.52(m,1H),7.47(m,2H),5.47–5.32(m,2H),4.44–4.35(m,2H),4.30(m,1H),3.88(m,2H),3.74–3.67(m,3H),3.61–3.15(m,6H),2.49–2.30(m,2H),2.23(m,2H),1.97(m,2H),1.93–1.74(m,6H),1.48(s,9H).HRMS-TOF(m/z)calcd for C32H41FN8O4[M+H]+:621.3313,found 621.3405.
实施例7:叔丁基4-(2-((endo)-3-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)-8-氮杂双环[3.2.1]辛烷-8-基)乙酰基)哌啶-1-羧酸酯
参照实施例1的制备方法。1H-NMR(600MHz,CDCl3)δ7.92(s,1H),7.55–7.50(m,1H),7.47(m,2H),5.34(d,J=7.1Hz,1H),4.44–4.35(m,2H),4.26(q,J=6.7Hz,1H),3.91–3.84(m,2H),3.72–3.67(m,2H),3.60(s,2H),3.53–3.47(m,2H),3.43(m,2H),3.32(m,2H),3.28(m,2H),2.29(m,2H),2.21–2.13(m,2H),1.96(m,2H),1.83(d,J=14.3Hz,2H),1.50(s,9H).HRMS-TOF(m/z)calcd for C31H39FN8O4[M+H]+:607.3157,found 607.3239.
实施例8:异丙基4-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)哌啶-1-羧酸酯
参照实施例1的制备方法。1H NMR(600MHz,CDCl3)δ7.93(s,1H),7.56–7.51(m,1H),7.48(m,2H),4.95(dt,J=12.5,6.2Hz,1H),4.83(d,J=8.1Hz,1H),4.43–4.33(m,2H),4.27–4.08(m,3H),3.93–3.85(m,2H),3.00(t,J=12.0Hz,2H),2.13–2.04(m,2H),1.50–1.37(m,2H),1.27(d,J=6.3Hz,6H).HRMS-TOF(m/z)calcd for C22H25FN6O3[M+H]+:441.2050,found 441.2144.
实施例9:4-(4-((1-(5-乙基嘧啶-2-基)哌啶-4-基)氨基)-6,7-二氢-8H-嘧啶并[5,4-b][1,4]噁嗪-8-基)-3-氟苯乙腈
参照实施例1的制备方法。1H NMR(600MHz,CDCl3)δ8.20(s,2H),7.95(s,1H),7.56–7.51(m,1H),7.48(m,2H),4.87(d,J=8.2Hz,1H),4.68(m,2H),4.42–4.32(m,2H),4.32–4.17(m,1H),3.92–3.84(m,2H),3.24–3.10(m,2H),2.49(q,J=7.6Hz,2H),2.21–2.12(m,2H),1.50(m,2H),1.21(t,J=7.6Hz,3H).HRMS-TOF(m/z)calcd for C24H25FN8O[M+H]+:461.2214,found 461.2318.
实施例10:4-(4-((1-(5-氯嘧啶-2-基)哌啶-4基)氨基)-6,7-二氢-8H-嘧啶并[5,4-b][1,4]噁嗪-8-基)-3-氟苯乙腈
参照实施例1的制备方法。1H NMR(600MHz,CDCl3)δ8.25(s,2H),7.95(s,1H),7.58–7.51(m,1H),7.48(m,2H),4.86(d,J=8.1Hz,1H),4.74–4.61(m,2H),4.47–4.33(m,2H),4.28(m,1H),3.96–3.79(m,2H),3.27–3.11(m,2H),2.21–2.12(m,2H),1.48(m,2H).HRMS-TOF(m/z)calcd for C22H20ClFN8O[M+H]+:467.1511,found 467.1613.
实施例11:叔丁基4-(2-(4-((8-(4-氰基-2-氟苯基)-7,8-二氢-6H-嘧啶并[5,4-b][1,4]噁嗪-4-基)氨基)哌啶-1-基)乙酰基)哌嗪-1-羧酸酯
参照实施例1的制备方法。1H NMR(600MHz,CDCl3)δ7.91(s,1H),7.54–7.49(m,1H),7.46(m,2H),4.84(d,J=8.1Hz,1H),4.50–4.30(m,2H),4.01(m,1H),3.94–3.81(m,2H),3.59(s,4H),3.51–3.45(m,2H),3.42(s,2H),3.22(s,2H),2.89(m,2H),2.32(m,2H),2.08(m,2H),1.65–1.53(m,2H),1.49(s,9H).HRMS-TOF(m/z)calcd for C29H37FN8O4[M+H]+:581.3000,found 581.3136.
实施例12:GPR119激动活性测试
首先将含有人GPR119基因的DNA片段转染到HEK293细胞(人胚肾293细胞)中,通过培养得到稳定表达GPR119的细胞株,在96孔板上接种该细胞株。细胞在37℃,5%CO2条件下培养48h后,移去培养液,加入100μL缓冲液,并于室温孵育15min。再给予不同浓度的待测化合物,孵育30min后,移去缓冲液,加入75μL预冷的裂解液,并在冰上孵育20min,适当地振荡。将裂解液转移到1.5mL离心管中,以13000rpm的转速离心10min。取50μL上清液,采用HTRF cAMP试剂盒标准步骤,以GSK-1292263为阳性对照,测定细胞内cAMP的浓度,由剂量依赖的cAMP浓度变化获得化合物EC50值,用于评价化合物对受体的亲和力强弱,计算化合物刺激cAMP作用与GSK-1292263产生最大作用的比值(%max),用于比较化合物对受体的内在活性(IA)。
表1:hGPR119激动活性测试结果
如上表中所示,证实了本发明的化合物、其异构体或其药学上可接受的盐具有对GPR119的激动剂活性。由此,预期实施例的上述化合物具有对糖尿病、代谢性疾病以及肥胖的治疗效果或预防效果。
实施例13:小鼠的口服糖耐量试验(oGTT)
取C57BL/6cnc小鼠24只,饥饿过夜,自由饮水,按体重、饥饿血糖随机分为3组,每组8只,分别口服灌胃给药,4h后口服灌胃给3g/kg的葡萄糖,于给糖前、给糖后15、30、60、90和120分钟点测血糖,记录给药时间和体重。测定给糖前、给糖后15、30、60、90和120min时的血糖值,计算2h内的血糖曲线下面积(AUC)。
AUC0-2h(mmol/L)=(BG0+BG15)×0.25/2+(BG15+BG30)×0.25/2+(BG30+BG60)×0.5/2+(BG60+BG90)×0.5/2+(BG90+BG120)×0.5/2
BG0、BG15、BG30、BG60、BG90和BG120分别代表给糖前、给糖后15、30、60、90和120min时的血糖值。
平均降糖率=(空白对照组-给药组)/(空白对照组)×100%
受试药物实施例3化合物(30mg/kg)和维格列汀(30mg/kg)经口服灌胃给药后,4h后给糖,曲线下面积明显降低,降糖率分别为23.4%和17.9%(见图1所示),表明受试药物对小鼠口服葡萄糖耐受力有明显影响。
在特别的部分中详细地描述了本发明,对于本领域技术人员而言明显的是这样的特别的技术仅仅是优选示例性实施方式,而不限制本发明的范围。因此,本发明的实质范围将由所附的权利要求和其等价物限定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测动物源食品中甲巯咪唑残留的酶联免疫试剂盒及其应用
- 咪唑[1,2-c]-噻吩[2,3-e]嘧啶-7(8H)酮杂环化合物及其合成方法
- 双咪唑磺酸基功能化离子液体选择性脱除油品中的氮化物的制作方法
- 一种6-芳基取代的咪唑并[4,5-c]吲哚并[2,3-a]咔唑衍生物及其制备方法
- 用作激酶活性调节剂的新颖的咪唑-哌啶基衍生物的制作方法
- 取代的咪唑并哒嗪的制作方法
- 一种菲并咪唑对称衍生物主体材料及电致发光器件的制作方法
- 8-甲氧基甲酸乙酯咪唑并[1,2a]吡啶-3-甲酸乙酯的合成方法
- 溴代β-1-咪唑-2,3,4,6-四羟基-D-吡喃葡萄糖的合成及用图
- 含二元吩噻嗪并咪唑类衍生物、制备方法及有机发光器件的制作方法