一类含有苯并三氮唑结构的化合物及其制备方法和应用与流程
本发明涉及有机材料技术领域,特别是涉及一类含有苯并三氮唑结构的化合物及其制备方法和应用。
背景技术:
人类可视察到的光波长为400~700nm。其中,波长为400~500nm为蓝光,在可见光中波长最短,能量最高。人眼中色素感光细胞数量最多的部位是黄斑区,其健康程度决定了视力好坏。研究结果表明,蓝光杀伤人眼活性细胞的能力是绿光的10倍。蓝光能够直达视网膜,如长期接触大量低波长的蓝光会造成大量人眼活性细胞被杀死,从而对视力造成不可逆损伤。由于儿童的视网膜黄斑区对蓝光的吸收能力弱,同样的光照强度下,透过的蓝光辐射量是成年人的两倍左右,所以蓝光辐射对儿童视网膜的危害更大。处于生长发育期的低龄人群若长期使用这些电子产品,轻者会诱发致盲眼病,重者会造成终身的视力低下,甚至白内障。
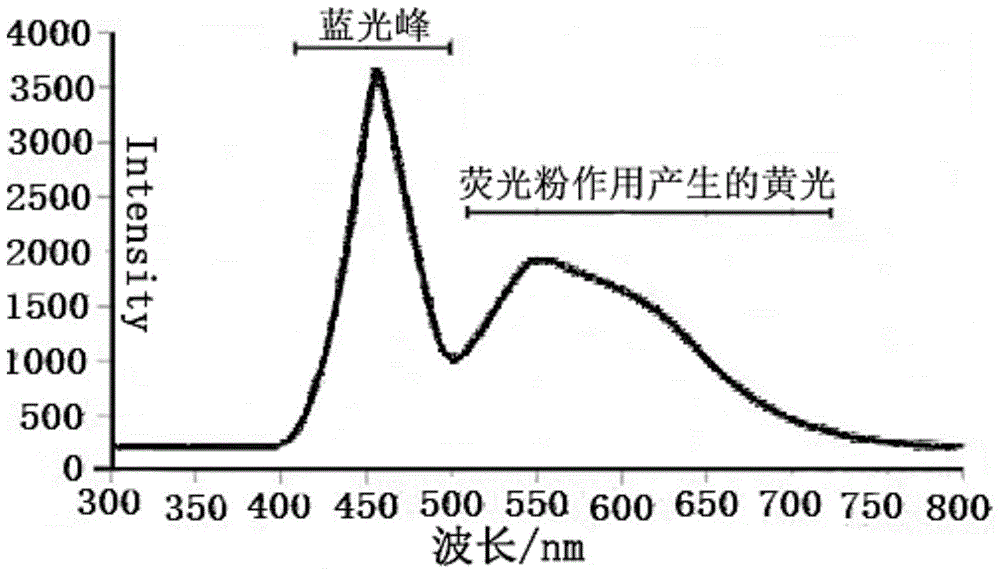
目前,家庭和办公室所使用的照明灯、手机、电脑、平板电脑、电视等几乎都是采用led光源。该光源通常是由主峰为465nm的蓝光和黄光组成。led光源所发出的光的光谱曲线如附图1所示。从图1可看出,人们通常接触到的电子产品所发出的光,波长在450nm的光占比较大。所以,人们每天都在接受着大量波长在450nm的光的辐射。
为了减轻或阻止高能短波蓝光对眼睛的危害,有必要研发一类蓝光吸收材料,应用于眼镜、手机、电脑屏幕、电视机等领域的眼视光学类防护产品,有效吸收高能量的紫外光和部分短波长蓝光,从而起到保护视力的目的。
技术实现要素:
为了克服现有技术存在的问题,本发明的目的之一在于提供一类含有苯并三氮唑结构的化合物,本发明的目的之二在于提供这类含有苯并三氮唑结构的化合物的制备方法,本发明的目的之三在于提供这类含有苯并三氮唑结构的化合物的应用。这类化合物是一种具有苯并三氮唑类结构单元的新型有机材料,可用作为紫外-短波长蓝光吸收剂。
为了实现上述目的,本发明所采取的技术方案是:
本发明提供了一类含有苯并三氮唑结构的化合物,其结构式如式(ⅰ)~式(ⅲ)所示:
其中,r1、r2分别独立选自氢、烷基、烷氧基、烷酰基、氰基、卤素或芳基。
式(ⅰ)和式(ⅱ)所示的化合物可名为5-(4-取代苯基)-2-(2-羟基-5-甲基)苯基苯并三氮唑。
式(ⅲ)所示的化合物可名为5-(4-取代苯基)-2-(2-羟基-5-甲基-3(4-取代苯基))苯基苯并三氮唑。
优选的,式(ⅰ)中,r1选自氢、c1~c6的烷基、c1~c6的烷氧基、c1~c6的烷酰基、氰基、苯基或萘基;进一步优选的,式(ⅰ)中,r1选自氢、叔丁基、乙酰基、甲氧基、氰基、苯基或萘基。
优选的,式(ⅲ)中,r2选自c1~c6的烷基;进一步优选的,式(ⅲ)中,r2为叔丁基。
本发明还提供了上述这类含有苯并三氮唑结构的化合物的制备方法。
一种如权利要求1所述化合物的制备方法,其特征在于:包括以下步骤:
1)将
2)将
3)将
4)将
或者是将
或者是将
本发明化合物的制备线路图如附图2所示。结合图2,对本发明化合物的制备方法进一步说明如下:先将4-溴-2-硝基苯胺重氮化、得到的重氮盐与取代苯酚耦合反应得到偶氮苯类化合物;偶氮苯类化合物再还原,得到5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑。将中间体5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑通过以下三种制备路线,可以分别得到式(ⅰ)~式(ⅲ)所示结构的化合物。
将5-溴-2-(2-羟基-5-甲基苯基)苯并三唑与取代的苯硼酸进行耦合反应,得到目标化合物ⅰ。
将5-溴-2-(2-羟基-5-甲基苯基)苯并三唑与2-萘硼酸进行耦合反应,得到目标化合物ⅱ。
将5-溴-2-(2-羟基-5-甲基苯基)苯并三唑经过溴代反应,得到5-溴-2-(2-羟基-5-甲基-3-溴苯基)苯并三氮唑,再与取代的苯硼酸进行耦合反应,得到目标化合物ⅲ。
优选的,制备方法的步骤1)中,重氮化反应的温度为0℃~5℃,反应的时间为30min~120min。
优选的,制备方法的步骤1)中,
优选的,制备方法的步骤1)中,盐酸为浓盐酸,hcl浓度为36%。
优选的,制备方法的步骤2)中,耦合反应具体是将
优选的,制备方法的步骤2)中,耦合反应的温度为0℃~5℃,反应的时间为30min~120min。
优选的,制备方法的步骤3)中,还原反应具体是将
优选的,制备方法的步骤4)中,耦合反应均是在碱作用下进行。所用的碱优选为碳酸钾。耦合反应还加入钯类催化剂参与反应,钯类催化剂优选为四(三苯基膦)钯。碱和催化剂的用量以满足反应进行为宜,属于本领域的常见方法。
优选的,制备方法的步骤4)中,
优选的,制备方法的步骤4)中,耦合反应的温度为70℃~90℃,耦合反应的时间为10h~15h。耦合反应是在保护气氛下进行,如在氮气气氛下进行。
优选的,制备方法的步骤4)中,将
本发明还提供了上述含有苯并三氮唑结构的化合物的应用。
上述含有苯并三氮唑结构的化合物在制备光学防护产品中的应用。
优选的,这种应用中,光学防护产品为眼镜、手机、电视机、电脑屏幕或游戏机的眼睛视力防护产品。这种眼睛视力防护产品可以吸收电子显示屏的紫外光和部分短波长蓝光。眼睛视力防护产品可以是防护膜或者防护镜。
本发明提供了一种紫外-可见光吸收剂,包括上述含有苯并三氮唑结构的化合物。
本发明提供了一种光学树脂组合物,包括上述含有苯并三氮唑结构的化合物。
优选的,这种光学树脂组合物中,含有苯并三氮唑结构的化合物的质量百分比为0.1%~0.5%;进一步优选的,这种光学树脂组合物中,含有苯并三氮唑结构的化合物的质量百分比为0.2%~0.3%。
优选的,这种光学树脂组合物为苯乙烯基树脂组合物。
优选的,这种光学树脂组合物为镜片树脂材料。
优选的,这种光学树脂组合物中,包括如下质量百分比的组分:78%~82%苯乙烯、3%~5%环戊二烯类树脂、1%~3%氰基类树脂、0.005%~0.015%光稳定剂、0.005%~0.015%抗氧化剂、0.4%~0.8%脱模剂、3%~7%分散剂、0.2%~1%分子量调节剂、0.2%~1%固化剂、0.1%~0.5%含有苯并三氮唑结构的化合物。
这种光学树脂组合物中,环戊二烯类树脂可选用etermer3386树脂;氰基类树脂可选用etermer2264树脂;光稳定剂优选为光稳定剂uv770;抗氧化剂优选为抗氧化剂264;脱模剂优选为聚环氧乙烷类脱模剂,分子量范围在200~2000,如选用脱模剂t15;分散剂优选为纳米分散剂,如纳米硅分散剂。
本发明的有益效果是:
本发明公开的这类化合物具有苯并三氮唑型紫外吸收剂的结构单元,即具有可以形成稳定分子内氢键的结构单元,凭借这种氢键的形成和断裂,可以消除紫外线的破坏作用,因此对紫外光可表现出很高的稳定性;同时其光吸收波长范围在360-390nm,提高其使用量时,光吸收范围可覆盖至蓝光区域约420nm,具有吸收蓝光的特点,应用前景十分广阔。
附图说明
图1是led灯发光的光谱曲线图;
图2是本发明化合物的制备线路图;
图3是化合物uv-329在二氯甲烷中的紫外吸收图;
图4是化合物uv-326在二氯甲烷中的紫外吸收图;
图5是化合物uv-p在二氯甲烷中的紫外吸收图;
图6是化合物2在二氯甲烷中的紫外吸收图;
图7是化合物4在二氯甲烷中的紫外吸收图;
图8是化合物5在二氯甲烷中的紫外吸收图;
图9是化合物7在二氯甲烷中的紫外吸收图;
图10是化合物8在乙酸乙酯中的紫外吸收图。
具体实施方式
以下通过具体的实施例对本发明的内容作进一步详细的说明。实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到。除非特别说明,试验或测试方法均为本领域的常规方法。
具体实施方式中涉及的化合物编号及结构式如表1所示。
表1化合物编号及结构式
以下参照图2,具体说明表1所示化合物的制备方法如下。
实施例1
5-苯基-2-(2-羟基-5-甲基苯基)苯并三氮唑(化合物1)的制备。
首先合成5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑
经检测,5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:10.86(s,1h),8.14(dd,j=18.9,1.2hz,2h),7.82(dd,j=9.0,0.6hz,1h),7.55(dd,j=9.0,1.7hz,1h),7.17(dd,j=8.6,1.9hz,1h),7.09(d,j=8.4hz,1h),2.40(s,3h)。13cnmr(100mhz,cdcl3)δ:147.55,143.75,141.54,131.71,131.56,129.86,124.67,121.44,121.19,120.08,119.00,118.90,20.55.esi-ms,m/z304.0[m+h]+。
参考文献和专利制备实施例中的耦合反应条件,包括:miyaura,n.;suzuki,a.chem.rev.1995,95,2457-2483;miyaura,n.;suzuki,a.j.chem.soc.chem.comm.1979,590,866-867;suzuki,a.chem.commun.2005,38,4759-4763;suzuki,a.j.organomet.chem.2002,653,83-90;suzuki,a.;yamamoto,y.chem.lett.2011,40,894-901;cn110396069a。在80ml甲苯、16ml乙醇和32ml水的混合物中分别加入5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑10.0mmol(3.01g),苯硼酸12.0mmol(1.46g),碳酸钾5.4g,四(三苯基膦)钯0.40g。该混合物通过减压-充氮气方法,处理6次,保证该反应体系中无氧气存在。并在氮气保护下,于81℃反应12小时。分离除去水,并用水洗涤(50ml×3次),除去碳酸钠。减压蒸馏除去溶剂,柱分离纯化得到目标产物2.68g,产率89%。
经检测,化合物1的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.12(s,1h),8.21(s,1h),8.08(s,1h),7.98(d,j=8.9hz,1h),7.75(d,j=8.9hz,1h),7.69(d,j=7.2hz,2h),7.50(t,j=7.5hz,2h),7.42(t,j=7.4hz,1h),7.16(dd,j=8.4,2.0hz,1h),7.10(d,j=8.4hz,1h),2.41(s,3h)。13cnmr(100mhz,cdcl3)δ:147.51,143.45,142.31,141.04,140.49,131.28,129.68,128.99,128.47,127.92,127.48,124.88,121.08,118.77,117.81,114.94,20.56.esi-ms,m/z302.1[m+h]+。
实施例2
2-(2-羟基-5-甲基苯基)-5-(4-叔丁基苯基)苯并三唑(化合物2)的制备。
参考实施例1的耦合反应条件,将3.03g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和1.78g4-叔丁基苯硼酸(10mmol)耦合得到目标产物3.20g,产率90%。
经检测,化合物2的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.12(s,1h),8.21(s,1h),8.07(s,1h),7.97(d,j=8.9hz,1h),7.76(d,j=8.9hz,1h),7.64(d,j=8.0hz,2h),7.53(d,j=8.1hz,2h),7.16(d,j=8.3hz,1h),7.10(d,j=8.3hz,1h),2.41(s,3h),1.39(s,9h)。13cnmr(100mhz,cdcl3)δ:151.11,147.51,143.53,142.28,140.90,137.54,131.22,129.67,128.49,127.13,125.98,124.92,121.08,118.76,117.72,114.54,34.64,31.35,20.56.esi-ms,m/z358.2[m+h]+。
实施例3
2-(2-羟基-5-甲基苯基)-5-(4-氰基苯基)苯并三唑(化合物3)的制备。
参考实施例1的耦合反应条件,将3.03g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和1.47g4-氰基苯硼酸(10mmol)耦合得到目标产物2.80g,产率86%。
经检测,化合物3的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.02(s,1h),8.24–8.20(m,1h),8.13(s,1h),8.05(d,j=8.7hz,1h),7.80(s,4h),7.72(dd,j=8.9,1.6hz,1h),7.19(dd,j=8.4,1.9hz,1h),7.12(d,j=8.4hz,1h),2.42(s,3h)。13cnmr(100mhz,cdcl3)δ:147.62,144.93,143.25,142.71,138.88,132.80,131.69,129.85,128.12,127.67,124.78,121.18,118.91,118.68,118.50,115.99,111.66,20.57.esi-ms,m/z327.1[m+h]+。
实施例4
2-(2-羟基-5-甲基苯基)-5-(4-乙酰基苯基)苯并三唑(化合物4)的制备。
参考实施例1的耦合反应条件,将3.03g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和1.64g4-乙酰基苯硼酸(10mmol)耦合得到目标产物3.15g,产率92%。
经检测,化合物4的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.05(s,1h),8.21(s,1h),8.14(s,1h),8.09(d,j=8.3hz,2h),8.02(d,j=8.9hz,1h),7.81-7.74(m,3h),7.18(dd,j=8.4,1.6hz,1h),7.11(d,j=8.4hz,1h),2.67(s,3h),2.41(s,3h)。13cnmr(100mhz,cdcl3)δ:197.58,147.58,144.96,143.32,142.61,139.64,136.35,131.53,129.78,129.08,128.01,127.61,124.82,121.14,118.85,118.19,115.68,26.71,20.57.esi-ms,m/z344.1[m+h]+。
实施例5
2-(2-羟基-5-甲基苯基)-5-(4-甲氧基苯基)苯并三唑(化合物5)的制备。
参考实施例1的耦合反应条件,将3.03g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和1.52g4-甲氧基苯硼酸(10mmol)耦合得到目标产物3.01g,产率91%。
经检测,化合物5的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.13(s,1h),8.22–8.19(m,1h),8.01(d,j=0.5hz,1h),7.95(dd,j=8.9,0.7hz,1h),7.72(dd,j=8.9,1.6hz,1h),7.65–7.60(m,2h),7.16(dd,j=8.4,1.9hz,1h),7.10(d,j=8.4hz,1h),7.05-7.01(m,2h),3.88(s,3h),2.40(s,3h)。13cnmr(100mhz,cdcl3)δ:159.65,147.47,143.54,142.08,140.64,132.93,131.17,129.64,128.52,128.36,124.89,121.03,118.74,117.69,114.44,113.97,55.39,20.55.esi-ms,m/z332.1[m+h]+。
实施例6
2-(2-羟基-5-甲基苯基)-5-(2-萘基)苯并三唑(化合物6)的制备。
参考实施例1的耦合反应条件,将3.03g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和1.72g2-萘硼酸(10mmol)耦合得到目标产物3.05g,产率87%。
经检测,化合物6的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.14(s,1h),8.26–8.19(m,2h),8.15(s,1h),8.04(d,j=8.9hz,1h),8.00-7.87(m,4h),7.83(dd,j=8.5,1.8hz,1h),7.58–7.50(m,2h),7.17(dd,j=8.4,1.7hz,1h),7.12(d,j=8.3hz,1h),2.42(s,3h)。13cnmr(100mhz,cdcl3)δ:147.53,143.52,142.38,140.94,137.75,133.61,132.86,131.31,129.71,128.75,128.63,128.30,127.70,126.58,126.45,126.37,125.48,124.90,121.10,118.79,117.91,115.23,20.57.esi-ms,m/z352.1[m+h]+。
实施例7
2-(2-羟基-5-甲基苯基)-5-(4-苯基苯基)苯并三唑(化合物7)的制备。
参考实施例1的耦合反应条件,将3.04g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和1.98g4-联苯硼酸(10mmol)耦合得到目标产物3.09g,产率82%。
经检测,化合物7的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.12(s,1h),8.23(s,1h),8.15(s,1h),8.02(d,j=8.9hz,1h),7.85-7.72(m,5h),7.67(d,j=7.2hz,2h),7.49(t,j=7.6hz,2h),7.39(t,j=7.4hz,1h),7.18(dd,j=8.3,1.7hz,1h),7.12(d,j=8.3hz,1h),2.42(s,3h)。13cnmr(100mhz,cdcl3)δ:147.53,143.52,142.39,140.84,140.55,140.44,139.34,131.32,129.72,128.89,128.36,127.85,127.73,127.56,127.08,124.90,121.10,118.80,117.91,114.81,20.58。
实施例8
2-(2-羟基-5-甲基苯基)-5-(4-(1-萘基)苯基)苯并三氮唑(化合物8)的制备。
参考实施例1耦合反应条件,将3.04g5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)和2.48g4-(1-萘基)苯基硼酸(10mmol)耦合得到目标产物3.37g,产率79%。
经检测,化合物8的核磁共振测试结果如下:1hnmr(300mhz,cdcl3)δ:11.14(s,1h),8.19(dt,j=15.6hz,1.5hz,2h),8.02(dd,j=9.0hz,0.9hz,2h),7.88-7.81(m,5h),7.63(d,j=8.4hz,2h),7.56-7.48(m,4h),7.17-7.13(m,2h),2.42(s,3h)。13cnmr(75mhz,cdcl3)δ:142.4,131.3,130.8,128.4,127.9,127.3,127.0,126.2,125.9,125.4,121.1,118.8,118.0,114.9,20.5。
实施例9
5-溴-2-(2-羟基-5-甲基-3-溴苯基)苯并三氮唑(化合物9)的制备。
参考cn110396069a完成溴代反应。在100ml的圆底烧瓶中分别加入5-溴-2-(2-羟基-5-甲基苯基)苯并三氮唑(10mmol)3.03g,二氯乙烷40ml,搅拌使其溶解。缓慢滴加1.92g溴素(12mmol),室温搅拌下反应8小时。把混合物倒入水中,用固体碳酸氢钠中和至中性。分离出有机层,水层用二氯乙烷(10ml×2)萃取两次。合并有机层,用无水硫酸钠干燥,旋转蒸发除去溶剂后,用二氯乙烷重结晶得到目标产物3.64g,产率95%。
经检测,化合物9的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.60(s,1h),8.13(d,j=13.5hz,2h),7.81(d,j=9.0hz,1h),7.57(d,j=9.0hz,1h),7.47(s,1h),2.39(s,3h)。13cnmr(100mhz,cdcl3)δ:144.7,143.6,141.5,134.8,132.0,130.5,125.1,121.9,120.6,120.0,119.0,112.2,20.3.m/z379.9[m-h]-。熔点173.6-175.9℃。
实施例10
5-(4-叔丁基)苯基-2-(2-羟基-3-(4-叔丁基苯基)-5-甲基)苯基苯并三唑(化合物10)的制备。
参考实施例1的耦合反应条件,将3.83g5-溴-2-(2-羟基-5-甲基-3-溴苯基)苯并三氮唑(10mmol)和3.56g4-叔丁基苯基硼酸(20mmol)耦合得到目标产物4.06g,产率83%。
经检测,化合物10的核磁共振测试结果如下:1hnmr(400mhz,cdcl3)δ:11.64(s,1h),8.23(s,1h),8.06(s,1h),7.97(d,j=8.9hz,1h),7.77(d,j=8.9hz,1h),7.57(ddd,j=45.6,12.5,8.3hz,9h),2.45(s,3h),1.39(s,18h)。13cnmr(100mhz,cdcl3)δ:151.12,150.23,145.00,143.46,142.21,140.97,137.55,134.75,132.47,131.54,129.22,129.08,128.54,127.15,125.98,125.33,125.12,120.28,117.71,114.53,34.64,34.61,31.40,31.35,20.65。
吸收光谱测定
测定方法:取一定量的样品溶解在二氯甲烷或乙酸乙酯溶剂中,测定它们的吸收谱图,并以uv-329、uv-326、uv-p为对照。样品的浓度均为1×10-5mol/l。
化合物uv-329、uv-326、uv-326在二氯甲烷中的紫外吸收图分别如附图3~5所示。实施例制得的化合物2、化合物4、化合物5、化合物7在二氯甲烷中的紫外吸收图分别如附图6~9所示。实施例制得的化合物8在乙酸乙酯中的紫外吸收图分别如附图10所示。
对比uv-329、uv-326、uv-p和化合物2、4、5和7在二氯甲烷中的紫外吸收谱图可知,本发明实施例所制得的化合物,某些光吸收主峰处在350nm附近,比常见的苯并三氮唑紫外吸收剂(uv-p和uv-329)的主吸收峰339.5nm红移约10nm,吸收波长明显增加,可满足某些特定行业的使用要求。本发明这些吸收剂吸收波长的覆盖范围达到400nm;提高其使用量时,其吸收波长的覆盖范围会超过420nm;具有吸收短波长蓝光的特性,可作为蓝光吸收剂使用。
应用例
一种树脂体系含有如下质量百分比的组分:80%的苯乙烯、4%的etermer3386树脂、2%的etermer2264树脂、0.01%的uv770光稳定剂、0.01%的抗氧化剂264、0.6%的脱模剂t15、5%的纳米分散剂、0.5%的分子量调节剂、0.5%的固化剂。将化合物7和化合物8分别加入到该体系中,添加量均为0.25%。具体是:将化合物7和化合物8分别以质量百分比0.25%的添加量加入到树脂体系中,搅拌均匀,转移到模具中。烘箱加热到90℃,把盛有样品的模具放入烘箱中,以每分钟1℃的速度程序升温至130℃,然后保温20小时,使其固化。随后自然冷却至室温,脱模得到镜片。通过紫外吸收仪测得产品的截止波长分别为415.0nm(化合物7)与417.0nm(化合物8)。
本发明提供的这类含有苯并三氮唑结构的化合物可以作为一种紫外-短波长蓝光吸收剂,可应用于眼镜镜片的制作,或制作成合适的薄膜来吸收手机、平板电脑、电脑屏幕、电视机等产品所产生的高能量的紫外光和部分短波长蓝光,即有效吸收有害的短波长光,从而起到保护视力的目的。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!