一种用于评价化合物对病理状态下血管生成作用的方法与流程
本发明涉及一种用于评价化合物对病理状态下血管生成作用的方法,属于药物筛选领域。
背景技术:
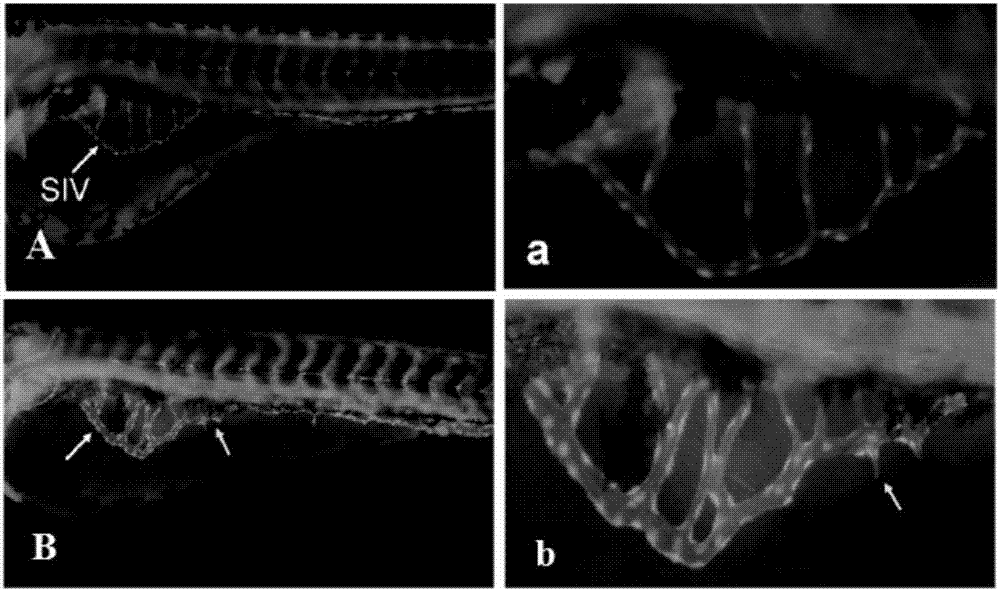
:血管生成是通过人体中存在的诸多互补和复杂的信号途径调节的,与很多疾病的发生和治疗有关。血管生成除可影响肿瘤的发生外,在其他一些疾病,如视网膜病变、风湿性关节炎、动脉粥样硬化、子宫内膜异位症等的发生中也起重要作用。阻止病理状态下的血管生成也已经成为该类疾病的新途径。研究表明,血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)可直接作用于血管内皮细胞,刺激其发生有丝分裂,从而促进新生血管的生长,是最重要的血管形成因子。VEGF是内皮细胞的特异性生长因子,并且是最特异和最关键的血管生成刺激因子,几乎参与了生理性和病理性血管形成的每一步,可以直接作用于血管内皮细胞,刺激其发生有丝分裂,从而促进新生血管的生长。结直肠癌、乳腺癌、肺癌等恶性肿瘤细胞均有自分泌VEGF的功能,发生游走转移的肿瘤细胞在局部可以释放VEGF刺激局部血管的形成。VEGF及其受体在多种肿瘤中表达,而在血管生成活跃组织(如肿瘤等)以外较少表达。因此,在肿瘤等病理状态下,VEGF高表达是最为重要的病理学特征。实验模型是药物研发的重要环节。实验模型的有效性,可决定药物发现的效率,降低研发风险。目前血管生成的体外研究模型,主要是用体外细胞培养的方法,进行内皮细胞培养,观察其对血管生成的影响。血管生成的体内研究模型主要有动物(大鼠,兔等)眼角膜囊(眼前房)、地鼠颊囊、裸鼠外耳皮下和鸡胚绒毛尿囊膜等动物模型。血管生成的体外模型不能很好地反应体内所处的复杂内环境,评价结果的准确性较差。血管生成的体内动物模型研究更为接近人体,但操作繁琐,耗时过长。而新兴的实验动物斑马鱼体现了良好的应用前景。斑马鱼具有体积小,产卵量高,发育成熟时间短,体表富有通透性,饲养条件简单,易于培养等特点,从而可以缩短药物筛选的实验周期,提高筛选效率;减少筛选过程中对受试样品的需要量,有利于微量先导化合物样品的活性筛选实验;可直接将受试药物投入培养基中进行实验,能同时进行多水平多因素的筛选。因此,斑马鱼在用于药物筛选的操作中便捷且经济。同时斑马鱼具有体外受精和个体透明的特征。利用这种特征,可实现在共聚焦显微镜下进行活体观察,既可动态观察其胚胎发育全程以及外源性物质对血管发育的影响,又可进行基因水平上的操作。但是遗憾的是,目前利用斑马鱼模型建立的血管生成模型均为直接观察新生的血管,是在生理状态的血管新生,从严格意义上讲,并不能有效区分正常的血管生成和病理状态下的血管生成。技术实现要素:针对现有技术的不足,本发明提供一种用于评价化合物对病理状态下血管生成作用的方法,该方法建立在病理状态下,可以准确快速评价药物对血管的生成。术语说明:完全肠下外缘静脉长度:肠下外缘静脉以及肠下外缘静脉上生出的棘突长度的总和,见图1。hpf(hourspostfertilization):生物学专用术语,指受精后的时间,如48hpf指受精后48小时的胚胎。本发明的技术方案如下:发明概述:本发明采用血管内皮生长因子(VEGF)处理特定时期斑马鱼幼鱼,模拟病理状态,然后以“完全肠下外缘静脉长度”作为评价指标,成功建立了药物对病理状态血管生成作用的评价方法,具有操作简单、快速、稳定可靠和重复性好的优点。发明详述:一种用于评价化合物对病理状态下血管生成作用的方法,其特征在于,包括步骤如下:(1)将受精后48h的发育正常转基因斑马鱼胚胎移入培养孔中,加入血管内皮生长因子进行处理,得VEGF处理斑马鱼胚胎;将受精后48h的发育正常斑马鱼胚胎不经血管内皮生长因子处理为正常斑马鱼胚胎;(2)一组VEGF处理斑马鱼胚胎连续给药孵育至72hpf,作为加药组,另外一组VEGF处理斑马鱼胚胎加入等量的培养水孵育至72hpf,作为VEGF组,正常斑马鱼胚胎加入培养水孵育至72hpf,作为正常对照组;(3)麻醉加药组、VEGF组及正常对照组的斑马鱼,采集每条斑马鱼肠下静脉(SIVs)区域的荧光显微图像,测量每组每条鱼的完全肠下外缘静脉长度;(4)定量分析得到的每组斑马鱼完全肠下外缘静脉长度以表示,分析比较正常对照组、VEGF组、加药组之间差异的显著性;当加药组斑马鱼的小于VEGF组斑马鱼的且达到统计学上的显著性水平(P<0.05),说明待测药物对VEGF处理斑马鱼的血管生成具有抑制作用。本发明正常对照组的设置用于评价实验材料的稳定性和可靠性。根据本发明优选的,步骤(1)中,所述斑马鱼胚胎为血管荧光标记的转基因斑马鱼胚胎。血管荧光标记的转基因斑马鱼胚胎可采用本领域普通市售产品,如血管荧光转基因斑马鱼Tg(VEGFR2:GFP),山东省科学院斑马鱼药物筛选中心提供。根据本发明优选的,步骤(1)中,培养液中血管内皮生长因子的浓度为1-10ng/mL,优选的,培养液中血管内皮生长因子的浓度为5-10ng/mL。根据本发明优选的,步骤(1)中,血管内皮生长因子加入前需要对斑马鱼胚胎进行脱卵膜处理。进一步优选的,脱卵膜处理具体为将斑马鱼胚胎加入到浓度1-2mg/mL的链酶蛋白酶E溶液中保持2-5min,即可完成脱卵膜处理。根据本发明优选的,步骤(1)中,VEGF处理斑马鱼胚胎的具体处理方法为,将血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到1-10ng/mL,共同孵育4-12h,造成新生血管的异常增生的病理状态,然后移除VEGF;优选的,共同孵育时间为4-6h。进一步优选的,血管内皮生长因子水溶液的浓度为90~100ng/mL。根据本发明优选的,步骤(2)中,加药组、VEGF组及正常对照组的斑马鱼胚胎于28℃控光培养孵育至72hpf,每组斑马鱼10-20条。根据本发明优选的,步骤(3)中,斑马鱼的麻醉为采用质量浓度为0.3‰的三卡因浸泡40~90s进行麻醉。根据本发明优选的,步骤(3)中,采集图像为将斑马鱼胚胎固定侧面体位固定,在荧光显微镜下观察、拍照,获得斑马鱼胚胎的侧位图像。进一步优选的,步骤(3)中,采集的图像是在同一的放大倍数下获得的,图像格式为jpg格式。根据本发明优选的,步骤(3)中测量长度为利用图像处理软件ImageJ对采集的图像进行测量,测量前先校准标尺,得到准确的长度。根据本发明优选的,根据本发明的方法筛选出的待测药物为香附子挥发油、香附醇或丹皮酚。72hpf斑马鱼完全肠下外缘静脉长度与药物抑制病理状态血管生成的作用呈正相关,见表1。评价指标有肠下静脉长度、肠下静脉面积、棘突的根数等。肠下静脉长度是所有肠下静脉(包括外缘血管和内部血管)的长度总和(不包含棘突),存在不足是肠下静脉本身是一个篮球网状的空间结构,受二维平面的图像采集的技术所限,当斑马鱼是侧面位时,左右两侧血管呈重叠状态,通过景深处理不足以完全排除左右两侧血管全部显现出来或者全部不显现出来,造成计量的不确定性和不准确性。肠下静脉面积是整个肠下静脉面积所覆盖的区域面积(以外缘血管为界),不足是当血管变细或内部血管缺失的时候,以整个区域的面积并不足以体现出抑制的效果。棘突的根数仅仅是以长出棘突的根数作为指标,对棘突生长的长度并不关注,也存在明显不足。本发明采用完全肠下外缘静脉长度来评价化合物对病理状态下血管生成作用能够用于反映药物对疾病状态的血管生成的作用,临床意义更显著,评价的结果更加接近疾病真实状态,具有新颖的、实际的意义。本发明的特点及有益效果:1、本发明将斑马鱼完全肠下外缘静脉长度作为药物对疾病状态下血管生成作用评价的指标,与现有的肠下静脉长度(所有肠下静脉的总长度)相比,更加科学、客观,体现了棘突的生成情况,提高了结果的准确性。2、斑马鱼肠下静脉为立体的篮球网状结构,现有的指标如肠下静脉面积等容易受拍照景深的影响,也容易受体位的影响。本发明的完全肠下外缘静脉长度是计算最外缘的血管长度,不受体位影响,准确度高。3、斑马鱼肠下静脉面积大,利用其轮廓进行计算,实施方便、简单。4、本发明建立的方法采用VEGF在活体斑马鱼上模拟了病理状态,与现有的直接观察肠下静脉相比,评价结果可靠。附图说明图1为斑马鱼完全肠下外缘静脉的荧光照片;图中,白色虚线显示为本发明所述的完全肠下外缘静脉长度;图2为正常斑马鱼和VEGF处理后斑马鱼的肠下静脉完全肠下外缘静脉的荧光照片,图中:A为正常斑马鱼肠下静脉完全肠下外缘静脉的荧光照片;a为图A的局部放大图;B为VEGF处理后斑马鱼的肠下静脉完全肠下外缘静脉的荧光照片;b为图B的局部放大图。具体实施方式下面结合实施例及附图对本发明的技术方案作进一步阐述,但本发明所保护范围不限于此。实验动物:采用血管荧光标记的转基因斑马鱼flk(购自山东省科学院斑马鱼药物筛选中心)。雌雄斑马鱼在照明14h/黑暗10h、28℃标准条件下分开饲养,定时喂以颗粒状饵料和丰年虾。用卵时,取健康性成熟的斑马鱼,按雌雄1/1或1/2的比例放入交配缸内,中间放置隔板,置于黑暗环境中,次日亮灯前抽去隔板,光照刺激使其排卵,半小时后将成鱼捞出,使排卵时间控制在半小时内,次日9~10时获得受精卵,收集受精卵,转移至培养水中在28℃控光培养至48hpf。实施例中所用原料均为常规市购产品,其中:血管内皮生长因子(VEGF)CAS为127464-60-2,用时用无菌蒸馏水溶解为溶液备用。香附子挥发油,购自江西百草药业有限公司,外观为琥珀色至棕黄色稠厚液体;主要组成组分含香附烯,香附醇,香附酮;折射率:1.4980~1.5280;旋光度:-11°~+35.5°;相对密度:0.960~0.992,用二甲基亚砜(DMSO)溶解配制。丹皮酚,分子量为166.17,CAS号为552-41-0,用二甲基亚砜(DMSO)溶解配制。反应停,化学名为(+)-沙利度胺,分子量为258.23,CAS号为50-35-1,用二甲基亚砜(DMSO)溶解配制。莪术醇,分子量为236.35,CAS号为4871-97-0,用二甲基亚砜(DMSO)溶解配制。郁金提取物,为棕黄色精细粉末,规格为10:1,用二甲基亚砜(DMSO)溶解配制。实施例1、用于评价化合物对病理状态下血管生成作用的方法(1)将受精后48h的发育正常转基因斑马鱼胚胎移入培养孔中,加入不同剂量的VEGF加入到培养孔中处理4h后,然后移除VEGF,得VEGF处理斑马鱼胚胎;将受精后48h的发育正常斑马鱼胚胎不经血管内皮生长因子处理为正常斑马鱼胚胎;(2)一组VEGF处理斑马鱼胚胎连续给药孵育至72hpf,作为加药组,另外一组VEGF处理斑马鱼胚胎加入等量的培养水孵育至72hpf,作为VEGF组,正常斑马鱼胚胎加入培养水孵育至72hpf,作为正常对照组;(3)麻醉加药组、VEGF组及正常对照组的斑马鱼,采集每条斑马鱼肠下静脉(SIVs)区域的荧光显微图像,测量每组每条鱼的完全肠下外缘静脉长度;(4)定量分析得到的每组斑马鱼完全肠下外缘静脉长度以表示,分析比较正常对照组、VEGF组、加药组之间差异的显著性;结果见表1。表1:不同剂量VEGF对72hpf斑马鱼完全肠下外缘静脉长度组别剂量(ng/mL)完全肠下外缘静脉长度(μm)正常对照组-646.5±83.1VEGF组1663.9±88.92716.2±91.1*5745.4±103.7**8796.6±154.3**10850.5±126.3**注:*:vs正常对照组,p<0.05;**:vs正常对照组,p<0.01。结果显示,使用1-10ng/mL剂量范围内的VEGF处理斑马鱼后,其完全肠下外缘静脉长度逐渐增大,2ng/mL范围内,斑马鱼完全肠下外缘静脉长度与对照组相比,呈现显著性差异(p<0.05);5-10ng/mL范围内,斑马鱼完全肠下外缘静脉长度与对照组相比,呈现极其显著性差异(p<0.01)。实施例2、用于评价化合物对病理状态下血管生成作用的方法(1)将受精后48h的发育正常转基因斑马鱼胚胎移入培养孔中,将配制的浓度为100ng/mL的血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到10ng/mL,共同孵育6h,然后移除VEGF,得VEGF处理斑马鱼胚胎;将受精后48h的发育正常斑马鱼胚胎不经血管内皮生长因子处理为正常斑马鱼胚胎;(2)一组VEGF处理斑马鱼胚胎加入不同剂量香附子挥发油样品孵育至72hpf,作为加药组,另外一组VEGF处理斑马鱼胚胎加入等量的培养水孵育至72hpf,作为VEGF组,正常斑马鱼胚胎加入等量的培养水孵育至72hpf,作为正常对照组;(3)麻醉加药组、VEGF组及正常对照组的斑马鱼,采集每条斑马鱼肠下静脉(SIVs)区域的荧光显微图像,测量每组每条鱼的完全肠下外缘静脉长度;(4)定量分析得到的每组斑马鱼完全肠下外缘静脉长度以表示,分析比较正常对照组、VEGF组、加药组之间差异的显著性;当加药组斑马鱼的小于对照组斑马鱼的且达到统计学上的显著性水平(P<0.05),说明待测药物对病理状态的血管生成具有抑制作用。香附子挥发油的加入量对斑马鱼病理状态下血管生成的作用如下表2所示。表2:香附子挥发油对斑马鱼病理状态下血管生成的作用组别剂量完全肠下外缘静脉长度(μm)正常对照组-664.5±85.2VEGF组10ng/mL873.2±71.8##香附子挥发油组0.01μg/mL868.9±90.40.1μg/mL608.9±80.4**1μg/mL555.3±100.5**注:##:vs正常对照组,p<0.01;*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。实施例3、用于评价化合物对病理状态下血管生成作用的方法(1)将受精后48h的发育正常转基因斑马鱼胚胎移入培养孔中,将浓度为100ng/mL的血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到5ng/mL,共同孵育12h,然后移除VEGF,得VEGF处理斑马鱼胚胎;将受精后48h的发育正常斑马鱼胚胎不经血管内皮生长因子处理为正常斑马鱼胚胎;(2)一组VEGF处理斑马鱼胚胎加入不同剂量丹皮酚样品孵育至72hpf,作为加药组,另外一组VEGF处理斑马鱼胚胎加入等量的培养水孵育至72hpf,作为VEGF组,正常斑马鱼胚胎加入等量的培养水孵育至72hpf,作为正常对照组;(3)麻醉加药组、VEGF组及正常对照组的斑马鱼,采集每条斑马鱼肠下静脉(SIVs)区域的荧光显微图像,测量每组每条鱼的完全肠下外缘静脉长度;(4)定量分析得到的每组斑马鱼完全肠下外缘静脉长度以表示,分析比较正常对照组、VEGF组、加药组之间差异的显著性;当加药组斑马鱼的小于对照组斑马鱼的且达到统计学上的显著性水平(P<0.05),说明待测药物对病理状态的血管生成具有抑制作用。丹皮酚的加入量对斑马鱼病理状态下血管生成的作用如下表3所示。表3:丹皮酚对斑马鱼病理状态下血管生成的作用组别剂量完全肠下外缘静脉长度(μm)正常对照组-681.5±95.2VEGF组10ng/mL888.0±100.4##丹皮酚组0.01μg/mL859.4±90.80.1μg/mL689.4±93.8**1μg/mL439.4±102.7**注:##:vs正常对照组,p<0.01;*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。对比例1同实施例2所述的用于评价化合物对病理状态下血管生成作用的方法,不同之处在于:步骤(1)将浓度为100ng/mL的血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到10ng/mL,共同孵育4h,然后移除VEGF,得VEGF处理斑马鱼胚胎;步骤(2)加药组加入不同剂量的反应停样品孵育至72hpf,其他同实施例2。比较肠下静脉总长度和完全肠下外缘静脉长度两个指标对于评价反应停抑制病理状态血管生成的作用的不同。结果见表4。表4:反应停抑制斑马鱼肠下静脉的作用注:##:vs正常对照组,p<0.01;*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。结果显示,采用1-25μg/mL反应停处理斑马鱼后,发现对于斑马鱼肠下静脉总长度没有显示出显著性的差异;但是对于完全肠下外缘静脉长度则显示出明显的量效关系,反应停的剂量越大,抑制作用越强烈,5-25μg/mL剂量组处理后,完全肠下外缘静脉长度显示出了明显的差异(p<0.05)。对比例2同实施例2所述的用于评价化合物对病理状态下血管生成作用的方法,不同之处在于:步骤(1)将浓度为100ng/mL的血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到10ng/mL,共同孵育4h,然后移除VEGF,得VEGF处理斑马鱼胚胎;步骤(2)加药组加入不同剂量的莪术醇样品孵育至72hpf,其他同实施例2。比较肠下静脉面积和完全肠下外缘静脉长度两个指标对于评价莪术醇抑制病理状态血管生成的作用的不同。结果见表5。表5:莪术醇抑制斑马鱼肠下静脉的作用注:##:vs正常对照组,p<0.01;*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。结果显示,采用0.1-2.5μg/mL莪术醇处理斑马鱼后,发现对于斑马鱼肠下静脉面积没有显示出显著性的差异;但是对于完全肠下外缘静脉长度则显示出明显的量效关系,莪术醇的剂量越大,抑制作用越强烈,0.5-2.5μg/mL剂量组处理后,完全肠下外缘静脉长度显示出了明显的差异(p<0.05)。对比例3同实施例2所述的用于评价化合物对病理状态下血管生成作用的方法,不同之处在于:步骤(1)将浓度为100ng/mL的血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到10ng/mL,共同孵育4h,然后移除VEGF,得VEGF处理斑马鱼胚胎;步骤(2)加药组加入不同剂量的郁金提取物孵育至72hpf,其他同实施例2。比较肠下静脉面积和完全肠下外缘静脉长度两个指标对于评价郁金提取物抑制病理状态血管生成的作用的不同。结果见表6。表6:郁金提取物抑制斑马鱼肠下静脉的作用组别剂量棘突数量(根)完全肠下外缘静脉长度(μm)正常对照组-0661.5±75.2VEGF组10ng/mL2.8±0.3869.2±121.4##郁金提取物组10μg/mL2.8±0.4848.4±90.550μg/mL2.7±0.3785.6±80.5*100μg/mL2.6±0.4435.6±100.7**注:##:vs正常对照组,p<0.01;*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。结果显示,采用10-100μg/mL郁金提取物处理斑马鱼后,发现对于斑马鱼肠下静脉棘突没有显示出显著性的差异;但是对于完全肠下外缘静脉长度则显示出明显的量效关系,郁金提取物的剂量越大,抑制作用越强烈,50-100μg/mL剂量组处理后,完全肠下外缘静脉长度显示出了明显的差异(p<0.05)。对比例4(1)将受精后48h的发育正常转基因斑马鱼胚胎移入培养孔中,将浓度为100ng/mL的血管内皮生长因子水溶液加入到培养孔中,使孔中血管内皮生长因子浓度达到10ng/mL,共同孵育4h,然后移除VEGF,得VEGF处理斑马鱼胚胎;将受精后48h的发育正常斑马鱼胚胎不经血管内皮生长因子处理为正常斑马鱼胚胎;(2)一组VEGF处理斑马鱼胚胎加入不同剂量的姜黄素样品孵育至72hpf,作为加药组,另外一组VEGF处理斑马鱼胚胎加入等量的培养水孵育至72hpf,作为VEGF组,一组正常斑马鱼胚胎加入等量的培养水孵育至72hpf,作为正常对照组;另外一组正常斑马鱼胚胎加入等量的姜黄素孵育至72hpf,作为正常实验组;(3)麻醉加药组、VEGF组、正常对照组及正常实验组的斑马鱼,采集每条斑马鱼肠下静脉(SIVs)区域的荧光显微图像,测量每组每条鱼的完全肠下外缘静脉长度;(4)定量分析计算得到的每组斑马鱼完全肠下外缘静脉长度以表示,分析比较正常对照组、VEGF组、正常实验组、病理实验组之间差异的显著性。结果见表6。同时利用内皮细胞实验说明姜黄素本身的抑制内皮细胞的作用。实验如下:生长良好的内皮细胞(HUVEC)用0.25%胰蛋白酶和0.02%EDTA的混合消化。用培养液调整细胞密度为2×109个/L,接种在6孔培养板内的盖玻片上和48孔板内,培养24-48h后培养板内已有80%的细胞呈汇合状态,换无血清M199同步24h,并将HUVEC分为6组,加入姜黄素,分为空白对照组、姜黄素组。采用MTT法,观察姜黄素对HUVECs增殖能力的影响,采用结晶紫染色法检测对HUVECs黏附及迁移能力的影响。结果见表7.表6:采用VEGF处理前后的实验结果对比组别剂量完全肠下外缘静脉长度(μm)正常对照组-661.5±75.2VEGF组10ng/mL869.2±121.4##正常实验组6.25μg/mL634.7±80.625μg/mL630.3±90.6100μg/mL623.1±77.8病理实验组6.25μg/mL848.4±90.525μg/mL785.6±80.5*100μg/mL635.6±100.7**注:##:vs正常对照组,p<0.01;*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。表7:相应剂量下姜黄素对内皮细胞增殖黏附及迁移的影响组别剂量增殖(OD值)黏附30min(OD)迁移1d(OD)正常对照组-0.221±0.0190.085±0.0030.149±0.017姜黄素组6.25μg/mL0.220±0.0270.088±0.020.147±0.01525μg/mL0.203±0.015**0.081±0.007*0.137±0.018*100μg/mL0.198±0.015**0.074±0.0038**0.113±0.006**注:*:vsVEGF组,p<0.05;**:vsVEGF组,p<0.01。结果显示,在6.25-100μg/mL实验剂量内,25-100μg/mL姜黄素对于经典的内皮细胞显示了明显的抑制内皮细胞增殖、黏附及迁移的作用。但是在斑马鱼实验中,在不加VEGF处理的正常斑马鱼状态下,同样剂量的姜黄素并未显示出明显的抑制血管生长的作用,但是在添加VEGF处理过的斑马鱼模型中,显示了显著的抑制血管生成的活性,进一步说明了本发明的评价方法的可靠性和准确性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1