对抗肠病毒感染的基于腺病毒载体的疫苗的制作方法
本案基于35U.S.C.§119(e),主张基于美国临时专利申请案第61/985,803号于2014年4月29日提出申请的之优先权,其文中所有内容皆以参考文献方式引入本文中。
技术领域
本发明一般关于免疫领域,以及具体地,关于对抗肠病毒感染之基于腺病毒载体之疫苗。
背景技术:
肠病毒,属于微小核糖核酸病毒科,为一种微小、无封套之含有正股RNA之病毒种类。肠病毒属,现包含12种:肠病毒A、肠病毒B、肠病毒C、肠病毒D、肠病毒E、肠病毒F、肠病毒G、肠病毒H、肠病毒J、鼻病毒A、鼻病毒B及鼻病毒C。该等病毒感染肠道,却可造成各种类型之疾病。典型的肠病毒疾病为脑膜炎、麻痹、心肌炎、手足口病(hand,foot and mouth-disease;HFMD)、疱疹性咽峡炎、胸膜痛、肝炎、急性呼吸性疾病(包括肺炎)。目前唯一用于人类之肠病毒疫苗为脊髓灰质炎病毒疫苗,其属于肠病毒C型。目前尚无可供人类使用之对抗非脊髓灰质炎肠病毒疫苗。
于肠病毒A型间,肠病毒71(enterovirus 71;EV71)及克沙奇病毒A群(coxsackievirus A group;CVA)感染系最常见造成手足口病(HFMD)及其他神经性疾病之主因。许多神经性疾病,包括脑炎、急性无力肢体麻痹、肺水肿(pulmonary edema;PE)、及出血、最终导致死亡,尤其是当EV71感染到5岁以下之幼童时,皆有报告过相关病例[1-5]。因为EV71及CVA感染可能对于全球公共健康造成新的危害[1,6-11],因此,亟需一有效的抗病毒药物及预防性疫苗。
肠病毒基因组由单股的开放阅读框架所组成,其编码P1、P2及P3聚合蛋白。该P2及P3区编码非结构性蛋白(如3CD),该蛋白负责病毒之复制及致病性。于病毒RNA转译时,2A蛋白可催化其之顺式N端切位,藉此从P2及P3区之初生非结构性蛋白中,释放P1区中之壳体蛋白。藉由自主酶切方式,将3CD从P3前驱物中释放。有一个3C’切位,位于3CD之3C及3D部分间之多蛋白残基中,以生成2个产物,3C’、及3D’。当P1前驱物由P1区编码时,其可被3C’蛋白酶切割为VP0、VP1及VP3。该3个蛋白自动地组装成二十面体之前壳体,并将RNA基因组装入该前病毒颗粒中,可成为一非感染性之空的(E)颗粒或具感染性之完整的(F)颗粒[12,13]。
人类清道夫受体B类成员2(human scavenger receptor class B,member 2;hSCARB2),及人类P分泌素糖蛋白配体1(P-selectin glycoprotein ligand 1;PSGL-1)已知为EV71感染时重要之细胞受体[14,15]。吾人团队[16]及Fujii等人[17]已成功发展可表现人类hSCARB2受体之转殖基因小鼠。于此有希望之模式中,将临床EV71分离株(B4及B5亚基因型)感染至该转殖基因动物中,可发展类HFMD皮肤疹,而接种EV71C2及C4亚基因型或CVA16者,患有严重的肢体麻痹及死亡。此外,将单株抗EV71 VP1中和抗体N3[26]以被动施予方式给予,可降低EV71B5感染所诱发之症状及保护该转殖基因小鼠,对抗EV71C2诱发之严重的肢体麻痹及死亡。
于先前研究中[13],吾人制备一种福尔马林不活化之EV71E59株(formalin-inactivated EV71;FI-EV71)候选疫苗,其系与铝胶佐剂混合,并发现FI-EV71于hSCARB2-Tg小鼠攻毒模式中,展现效力[16]。于第一期人类临床试验中[18],FI-EV71为安全的,且可诱发高度之中和抗体反应,以对抗目前常在之EV71分离株,但无法保护对抗CVA16之感染。另一方面中,相较于该不活化病毒疫苗,基于VP1(于EV71病毒中最重要之有效抗原)之DNA疫苗(100μg/小鼠)及重组蛋白疫苗(10μg/小鼠),诱发较差的免疫反应,且无法有效保护小鼠对抗病毒感染[19]。
类病毒颗粒,或VLPs,可仿真病毒之外蛋白结构,且不含有遗传物质(DNA或RNA),该遗传物质负责病毒之复制。没有了遗传物质,VLP疫苗自己则无法进行感染,且可同时以最真实之构型来呈现病毒抗原。EV71之VLPs由昆虫细胞生产,亦被证明于小鼠中之效力[20],其中说明了VLP蛋白可于昆虫细胞中表现,且组装成VLPs,经纯化后,将该VLPs引入小鼠以进行免疫,来诱发免疫反应对抗病毒攻毒。然而,由非人类细胞生成之VLPs蛋白,其具有不同之后修饰作用(像是糖化作用),可能于人类中诱发不同之免疫原性。此外,于生产高度纯化之VLPs时亦遇上阻碍。
因此,目前仍亟需开发一有效之疫苗以对抗肠病毒感染。
技术实现要素:
本发明关于一种新颖的基于腺病毒载体之DNA疫苗,用来生成免疫力以对抗肠病毒感染。于一具体实施例中,本发明提供一种重组腺病毒载体,包含表现卡匣,其编码肠病毒之P1蛋白及3CD蛋白酶。于另一具体实施例中,本发明提供一种重组腺病毒载体,包含表现卡匣,其编码肠病毒之3C蛋白酶或3CD蛋白酶。吾人不可预期地发现,本文所述之重组腺病毒载体之疫苗,可诱发增强的保护性免疫力,以对抗肠病毒感染,尤其是细胞的(T细胞)免疫反应。吾人亦发现本文所述之重组腺病毒载体之疫苗,可诱发专一3C之细胞免疫反应,因此可提供广效之交叉保护力,以对抗不同种的肠病毒,至少包括肠病毒71及克沙奇病毒A,系因为3C蛋白酶之氨基酸序列于各种肠病毒间系高度保留的。
因此,于一方面,本发明提供一种重组病毒载体,可生成免疫力以对抗肠病毒感染,其包含表现卡匣,编码肠病毒之P1蛋白及3CD蛋白酶。本发明亦提供一种重组腺病毒载体,可生成免疫力以对抗肠病毒感染,包含表现卡匣,其编码肠病毒之3C蛋白酶或3CD蛋白酶。
于又一方面中,本发明提供一种疫苗组合物,用于生成免疫力,以对抗肠病毒感染,其包含有效量之本文所述的重组腺病毒载体。
于再一方面中,本发明提供一种于个体中诱发免疫反应以对抗肠病毒感染之方法,包含施予该个体一有效量之本文所述重组腺病毒载体或疫苗组合物。本发明亦提供本文所述之该重组腺病毒载体或疫苗组合物,于制造一医药(如疫苗)以于个体中诱发免疫反应,以对抗肠病毒感染之用途。
此外,吾人发现使用本发明之编码P1及3CD蛋白之重组腺病毒载体,于哺乳动物细胞表现系统中,可形成类病毒颗粒。因此,本发明进一步提供一种产生肠病毒之类病毒颗粒之方法,包含:
于可表现该P1蛋白及3CD蛋白酶且可组装该肠病毒之类病毒颗粒的环境中,培养哺乳动物细胞,该细胞经本文所述之重组腺病毒载体所转染;以及
收集培养后之哺乳动物细胞,并从中分离出肠病毒之类病毒颗粒。
本发明之一种或多种具体实施例之细节,系描述于以下说明书中。本发明之其他特征或优点,可配合以下许多具体实施例之详细说明以及所附之申请专利范围得以明晰。
附图说明
先前摘要,以及以下本发明之详细说明,当阅读时可配合所附图式可使人更佳理解其内容。该等于图式中之较佳具体实施例,系为阐述本发明之目的。然而,应可理解的是,本发明不受限于该等所述之明确排列方式及手段。
图式中:
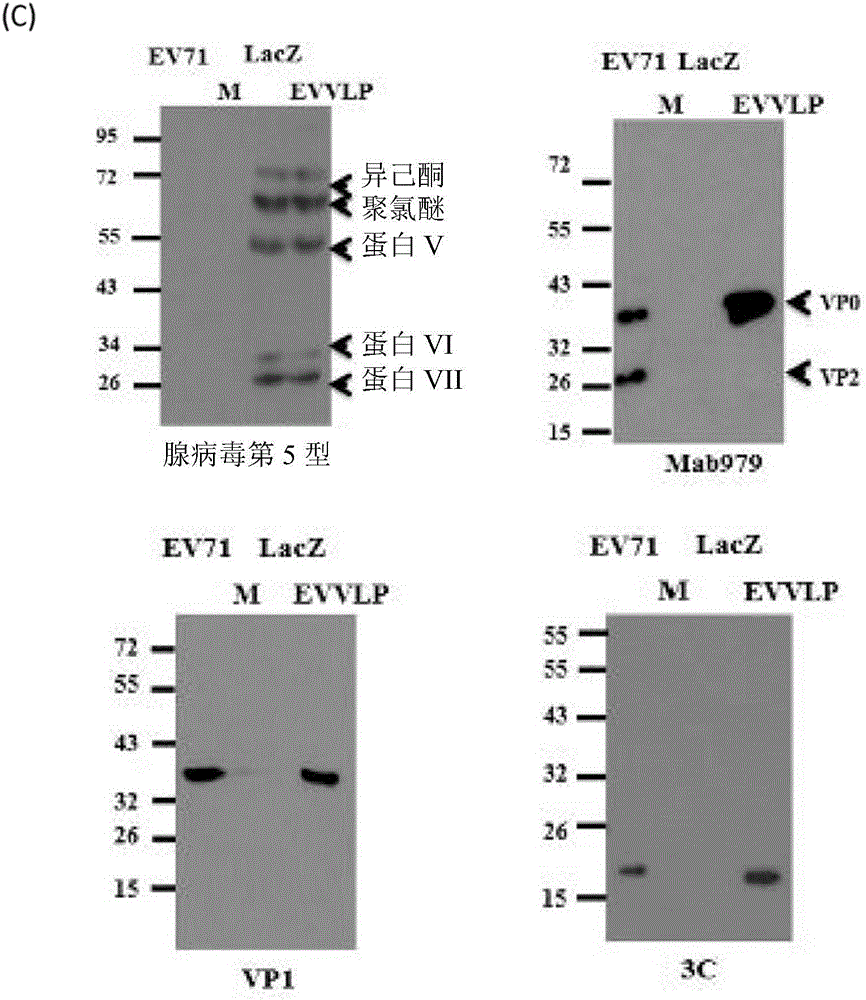
图1为一携带EV71P1及3CD基因之重组腺病毒载体之构筑,且该载体可表现出VLPs。(A)腺病毒构筑体;表现P1基因之Ad-EVVLP,其由VP1至VP4亚单位序列所组成,且由CMV启动子所驱动,以及该3CD基因,系由延长因子-1α启动子(elongation factor-1αpromoter;EF1p)所驱动。(B)使用可辨识P1、3CD及EF1p序列之特定引子,以增幅及侦测P1、3CD及EF-1α启动子是否插入Ad-EVVLP构筑体中。(C)源自293A转染物之溶解物中的Ad-LacZ及Ad-EVVLP,系以免疫墨点法,搭配多株抗Ad5抗体分析。VLP形成之流程如图所示;转译之P1多胜肽系由3CD蛋白酶所生成及切割,该3CD蛋白酶系由3CD RNA所表现,以得到个别之VP0、VP1及VP3亚单位蛋白。VP0、VP1及3C系以Mab979单株抗体或VP0、VP1或3C专一抗体进行侦测。每个孔洞中共有103pfu之纯化的EV71 5746作为抗原,亦作为免疫墨点法之对照组。其中标示含有蛋白标记(M)之电泳道。
图2显示于Ad感染细胞中VLPs及Ad-EVVLP颗粒之同时产生。(A)以MOI=0.1Ad-EVVLP转染293A细胞。经转染24小时后制备细胞溶解物,并以材料及方法章节中所述之碘克沙醇密度梯度片段化。从Vero细胞中所产生之107pfu EV71 5746株之片段。每一个片段遂以Mab979抗体进行西方墨点分析。VP0及VP2条带之讯号强度遂以Image-Pro Plus 6.0软件进行量化,并计算VP0/VP2比率,且表示于下方。(B)将Ad-EVLP片段7及8混合,以及(C)EV71样本之片段8及9,以醋酸铀酰处理,并以TEM检验。箭头所指为对应于直径为30-nm VLPs之完整颗粒。破损之VLPs以f标示呈现。(D)源自Ad-EVVLP感染细胞之溶解物,且未经片段化处理,亦以TEM检验,且可看到约直径100-nm之腺病毒颗粒。
图3显示Ad-EVVLP诱发对EV71专一之IgG,可与E59及5746株交叉反应。将7周龄之BALB/c小鼠,以口服、皮下或腹腔方式将108pfu Ad-EVVLP或Ad-LacZ,个别地初免(primed)及间隔14天后进行补强。收集第21天之血清样本已分析IgG量,该IgG可由热不活化之(A)5746及(B)E59附着之ELISA检测而得。表示每个测试样本之力价结果。对应于平均力价之标准偏差,源自每个实验组中之5只小鼠。
图4显示于Ad-EVVLP免疫小鼠中诱发之VLP专一的细胞激素反应。以PBS、Ad-LacZ、Ad-EVVLP、或FI-EV71皮下方式免疫小鼠两次,并于疫苗补强后第7天牺牲。收集脾细胞,并于存在或不存在有107pfu/mL UV-EV71 5746之环境中培养48小时。收集培养基,并藉由ELISA,及于材料及方法章节中所述之方法定量(A)IFN-γ、(B)IL-4、(C)IL-13、及(D)IL-17A。每组中测试5只小鼠。结果以每毫升微微克的细胞激素浓度表示。
图5显示于Ad-EVVLP免疫小鼠中,诱发VLP专一之CD4+及CD8+T细胞反应。将源自个别小鼠之脾细胞培养于存在或不存在107pfu UV-EV71 5746之环境中48小时,该小鼠系经以PBS、Ad-LacZ、Ad-EVVLP、或FI-EV71皮下免疫两次。(A)以PE-Cy5-共轭之抗CD4抗体进行流式细胞分析,以分析相应于EV71颗粒所生成之CD4+T细胞增生。(B)以PE-Cy5-共轭之抗CD8抗体进行脾细胞之染色,固定后,并以PE共轭之抗IFN-γ抗体染色,并使用流式细胞仪分析。该等结果系以CD4+或CD8+T细胞经抗原刺激后之平均百分比呈现,相较于未经抗原刺激之基础的CD4+T细胞,系设定于0%。每组有5只小鼠被分析。
图6显示于hSCARB2-Tg小鼠中,Ad-EVVLP提供保护力以对抗EV71。(A)以皮下两次预接种方式,于出生后第1天及第7天分别施予PBS(◆)3×107pfu Ad-LacZ(●)、或3×106(■)或3×107(▲)pfu Ad-EVVLP、或0.1μg FI-EV71疫苗(▼),再以3×106pfu EV71 5746进行皮下攻毒,来评估hSCARB2-Tg小鼠之存活率。转殖基因小鼠之数量(N)如图所示。使用对数等级方式来进行统计分析。(B)于感染后第4天,将小鼠牺牲,并从脑干、脊髓及肌肉中萃取RNA进行定量RT-PCR,使用对EV71 RNA之VP1区域专一引子来侦测。另外,使用对β-肌动蛋白基因专一引子进行定量RT-PCR以作为内部对照组。于个别Ad-EVVLP免疫组织中之相对VP1 mRNA表现,系经个别样本中β-肌动蛋白之表现正规化,再以平均相对正规化之VP1 mRNA表现量表示Ad-LacZ免疫样本。每组中有7只小鼠用来计算平均相对表现量。使用非成对之学生t检定及Welch校正以进行统计分析。
图7显示于Ad-EVVLP免疫小鼠中诱发之3C专一抗体,及CD4+及CD8+T细胞反应。以PBS、108pfu Ad-EVVLP或Ad-LacZ、或0.1μg FI-EV71,将BALB/c小鼠个别以皮下方式进行首免及补强,间隔为14天。牺牲小鼠并于第21天收集血清及脾细胞。(A)以抗重组3C附着之ELISA分析血清中之IgG。每一个测试样本之结果系以力价表示。对应于每实验组之平均力价的标准偏差亦表示之。将脾细胞培养于存在有或不存在有1.4μg重组3C蛋白之环境中48小时。(B)以抗CD4之PE-Cy5抗体藉由流式细胞仪分析对应于3C之CD4+T细胞增生。(C)于脾细胞中活化之CD8+T细胞,系以抗CD8之PE-Cy5共轭抗体染色,接着固定后,再以抗IFN-·之PE共轭之抗体染色,接着使用流式细胞仪分析。结果系以经抗原刺激后之CD4+或CD8+T细胞出现之平均百分比呈现,并与未受抗原刺激之基础的CD4+T细胞(设定为0%)比较。每组有5只小鼠被分析。
图8显示Ad-EVVLP,但非FI-EV71,可保护hSCARB2-Tg小鼠免于CVA16之攻毒。将1日龄之hSCARB2-Tg小鼠以(A)PBS(●)、3×107pfu Ad-LacZ(■)、或3×107(▲)pfu Ad-EVVLP、或(B)1μg FI-EV71疫苗(●),于出生后第1天及第7天进行皮下预接种两次,再以5×105pfu CVA16皮下进行攻毒。小鼠之存活率系每天观察,达15天。图上标示有转殖基因小鼠之数量(N)。以对数等级方式进行统计分析。
图9显示,于Ad-EVVLP感染细胞中及源自EV71感染小鼠的血清中,VLP表现之免疫墨点分析。使用源自BALB/c小鼠之多株血清,及免疫墨点法分析经Ad-LacZ-及Ad-EVVLP感染之293A细胞的溶解物,该小鼠系以106pfu EV71 5746腹腔方式注射过。图式中有标示蛋白标记(M)。
图10显示Ad-EVVLP免疫小鼠之脾脏中会分泌IFN-γ及IL-4之细胞的例子。经以Ad-LacZ或Ad-EVVLP腹腔或皮下免疫两次之小鼠,从中制备脾细胞,并以含有鼠的IL-2之环境下培养,且该环境中存在有UV-EV71E59,并于抗IFN-γ(A)或抗IL-4(B)之ELISPOT盘中之捕捉型抗体包覆孔洞培养2天。使用反应试剂及套组所附之方法,观察细胞激素阳性之免疫斑点。每组结果系以专一之细胞激素免疫斑点±2标准偏差之数目表示。
图11显示源自重组3C,并佐以CFA/IFA佐剂之小鼠血清,不会诱发抗EV71及CVA16之中和活性。将7周龄BALB/c小鼠,个别以10μg重组的3C,佐以CFA(3C-CFA),进行皮下首免,接着以相同剂量之3C-IFA,间隔14天后进行皮下补强。从第21天收集之血清,进行分析中和活性,分析方式为在加入RD细胞前,先将不同稀释倍数之个别免疫血清与102pfu EV71或CVA16进行作用。于培养后5天观察CPE。结果系以中和力价呈现,对应于免疫血清之稀释倍数,以降低50%细胞病变反应之TCID50值表示。每组有5只小鼠被分析。不同稀释之Mab979抗体,及收集自以106pfu CVA16感染后14天之BALB/c小鼠之血清,分别进行EV71及CVA16中和试验,以作为阳性对照。
图12显示于Ad免疫小鼠之血清中,Ad5-专一IgG之诱发情形。将7周龄BALB/c小鼠分别以口服、皮下或腹腔方式,使用或未使用108pfu Ad-EVVLP,进行首免,间隔14天后再补强。收集第21天之血清样本,以热不活化之Ad5附着之ELISA分析IgG。每个测试样本之结果系以力价表示。每组实验组中5只小鼠的平均力价系有标准偏差标示。
图13显示Ad-3CD保护hSCARB2-Tg小鼠免于EV71及CVA16攻毒。将1日龄hSCARB2-Tg小鼠以皮下方式,将3×107pfu Ad-3CD于出生后第1及7天进行预接种两次,再以皮下注射3×106pfu(▲)EV71或(▼)CVA16进行攻毒。对照组系以3×107pfu Ad-LacZ进行免疫,并表示于表2中。每日观察小鼠存活率,达15天。图上标示(N)代表转殖基因小鼠之数量。
图14显示于本发明之一具体实施例中之CMP启动子–P1基因-IRES-3CD基因表现卡匣的核苷酸序列(SEQ ID NO:3)。
图15显示于本发明之一具体实施例中之CMP启动子–P1基因-EF-1α启动子-3CD基因表现卡匣的核苷酸序列(SEQ ID NO:4)。
图16显示3C蛋白酶之序列信息,包含EV71之3C蛋白酶及3CD蛋白酶之序列信息。
图17显示EV71之P1蛋白之序列信息。
具体实施方式
除非另有定义,所有本文中技术及科学性术语,与本发明领域具有通常技艺者所习知者具有相同意义。
本文所用之冠词“一(a)”及“一(an)”,系指一种或多于一种(即至少一种)本文中所述之物体。例如,“一组件”意指一种组件或多于一种组件。
“多核苷酸”或“核酸”乙词系指一由核苷酸单位所组成之聚合物。多核苷酸包括天然存在之核酸,像是脱氧核醣核酸(DNA)及核醣核酸(RNA),以及核酸相似物,包括该等具有非天然存在之核苷酸。多核苷酸可被合成,例如,使用自动DNA合成仪。应可理解的是,当核苷酸序列以DNA序列(即A、T、G、C)代表时,亦包括了RNA序列(即A、U、G、C),其中U取代了T。“cDNA”乙词系指一DNA,无论是单股或双股形态,系与一mRNA互补或相同。
“互补”乙词系指两个多核苷酸间之表面交互作用之拓扑兼容性或彼此相符。因此,该两分子可谓互补,且更进一步,接触表面之特征系彼此互补的。如果第一多核苷酸之核苷酸序列与第二多核苷酸结合对象之多核苷酸序列相同,则称第一多核苷酸与第二多核苷酸互补。因此,该多核苷酸之序列5′-TATAC-3′系与多核苷酸之序列5′-GTATA-3′互补。
“编码”乙词系指于一多核苷酸中(如基因、cDNA、或mRNA)之特定核苷酸序列之固有特性,可于生物性反应过程中,作为合成其它聚合物及巨分子之模板,其可能具有一明确之核苷酸序列(即rRNA、tRNA及mRNA),或一明确之氨基酸序列,及所衍生之生物性产物。因此,术语“一基因编码一蛋白”意指由基因产生之mRNA转录及转译,可于细胞中或其他生物系统中生成该蛋白。对于一个具有技艺者应可理解的是多种不同之多核苷酸可编码相同之多胜肽,系因基因密码之简并性。对于一个具有技艺者亦应可理解的是,使用常规技术,可进行核苷酸置换,且不会影响到该等多核苷酸所编码之多胜肽序列,藉此置换以反映于各种特定宿主生物体中欲表达该多胜肽所需使用之密码子。因此,除非特别另有说明,“核苷酸序列编码氨基酸序列”包含所有核苷酸序列,其可能互为简并版本,但编码相同之氨基酸序列。核苷酸序列编码蛋白,以及RNA可能包含内含子。
“重组”核酸乙词系指一多核苷酸或核酸分子,其具有之序列,并非自然就连接在一起。一重组的核酸可能以构筑体形式呈现,如载体。“载体”可能含有所赋予之感兴趣核苷酸序列及调控序列。载体可用于表现所赋予之核苷酸序列或维持所赋予之核苷酸序列以进行复制、操作、或转移至不同位置(如不同生物体间)。载体可被引入一适当之宿主细胞中,以进行前述之目的。
本文所用之“操作式连接”乙词可意指一多核苷酸系与一表现控制之序列连结,以该种连结方式可当一适当分子(如转录因子)结合至该表现控制序列时,使得该多核苷酸进行表现。
本文所用之“表现控制序列”或“调控序列”乙词意指于特定宿主细胞中,一DNA序列可调控与其操作式连接之核酸序列的表现。
本文所用之“表现卡匣”乙词系指一核酸分子之经定义片段,其包含用来生产由该核酸分子所编码之转录或转译产物(RNA或蛋白)所需之最少的组件。例如,表现卡匣包括多核苷酸序列,其编码可被表现之多胜肽,以及可控制其表现之序列,如启动子,以及可选加的增强子序列,包括任何顺式作用转录调控组件的组合。本文所述之腺病毒载体,表现卡匣典型地系指可表现异源性基因产物,而非表现编码于腺病毒基因组中之腺病毒蛋白。
典型地,于载体中,将所赋予之核苷酸序列以操作式连接方式与调控序列连接,即形成表现卡匣,使得当该载体被引入宿主细胞时,该所赋予之核苷酸序列可于该宿主细胞中,受到该调控序列之控制,来进行表现。该调控序列可包含,例如但不限于,启动子序列(如巨细胞病毒(cytomegalovirus;CMV)启动子、猿猴病毒40(simian virus 40;SV40)早期启动子、T7启动子、乙醇氧化酶基因(AOX1)启动子、内部核醣体进入位(internal ribosome entry site;IRES)及延长因子1a启动子)、启始密码子、复制起点、增强子、操作子序列、分泌讯号序列(如交配型因子讯号)、及其他控制序列(如夏因-达尔加诺序列及中止序列)。较佳地,载体可进一步含有一标记序列(如一抗药性标记基因序列),以供后续筛选步骤所用。
“疫苗”乙词系指一种药剂或组合物,包含可于个体中有效诱发保护性免疫力之活性成分,以对抗特定病原菌或疾病。传统上,疫苗之活性成分为源自该疫苗目标病原菌之多胜肽。“DNA疫苗”乙词系指一种疫苗,其中之活性成分系由DNA所组成,例如表现所欲抗原蛋白之DNA构筑体,其可诱发保护性免疫反应。如本文所述,DNA疫苗可意指表现病毒蛋白或病毒VLPs之DNA构筑体,且经免疫后,可于该个体中诱发保护性免疫反应以对抗该病毒。
本文所用之“个体”乙词系指人类或非人类哺乳动物。非人类哺乳动物包括,但不限于灵长目、有蹄类、犬及猫。
本文所用之“腺病毒”乙词系指分离自人类之超过47种的腺病毒亚型,以及许多源自其他哺乳动物及禽类者。请参阅Strauss,“Adenovirus infections in humans,”in The Adenoviruses,Ginsberg,ed.,Plenum Press,New York,N.Y.,pp.451 596(1984)。
本文所用之“腺病毒载体”乙词系指腺病毒,其腺病毒基因组已被改造过,以带有一非原本该腺病毒基因组之核酸序列。因此,本文所用之“重组腺病毒载体”一般包含腺病毒基因组,以及表现卡匣,其中包含至少一编码所欲蛋白(如P1蛋白、或3CD蛋白、或两者兼有)之外源核酸序列。
腺病毒载体较佳地含有至少各末端重复区之一部份,以供病毒DNA复制,较佳地至少约有90%之完整末端重复(inverted terminal repeat;ITR)序列,以及该DNA可将基因组进行壳体化以包入病毒壳体中。源自不同来源之腺病毒可被作为腺病毒载体之病毒基因组的来源。较佳为人类之腺病毒,例如,A亚型(如血清型12、18及31),B亚型(如血清型3、7、11、及14等),C亚型(如血清型1、2、5、及6等),D亚型(如血清型8、9、10、13、15、17、19、及20等),E亚型(如血清型4),F亚型(如血清型40及41)及其他。较佳地,该腺病毒载体为人类C亚型,尤其是血清型2或甚至更佳地为血清型5。
该腺病毒载体可为具有复制能力的。一般来说,该腺病毒载体于宿主细胞中为不能复制的。“不能复制”乙词意指该腺病毒载体中,于负责复制之腺病毒基因组(如E1、E3或E4区)中之一个或多个基因功能或区域有缺损,以致该载体于正常宿主细胞中仅有部分低下的复制能力或根本无法复制,尤其是指该等以腺病毒载体感染于人体中之腺病毒。该无法复制之腺病毒载体可确保疫苗之安全性。于一具体实施例中,该腺病毒载体于E1或E3或两者是缺损的。于基因中之缺损可定义为突变或缺失,以完全性地移除或伤害基因功能,例如像是该基因产物之功能,相较于原本之基因,已被降低至少约2倍、5倍、10倍、20倍或更多倍。所产生之无法复制的腺病毒载体可接受一种或多种外源的核酸序列,已于腺病毒基因组中之适当位置以表现一种或多种所欲之蛋白,且仍可维持包装成腺病毒壳体之能力。为了产生高力价之病毒载体以备用,一般将该无法复制之腺病毒载体于互补细胞株中(像是293细胞)进行生产,其可提供一些基因功能,是于该无法复制之腺病毒载体中所没有的。
于一方面中,本发明提供一重组的腺病毒载体以作为广效DNA疫苗,以产生免疫力来对抗各种不同之肠病毒感染。
于一具体实施例中,本发明重组的腺病毒载体包含编码肠病毒P1蛋白及3CD蛋白酶之表现卡匣。本发明之重组腺病毒载体,Ad-P1-3CD,经转染于宿主细胞中,不仅可表现腺病毒结构蛋白,且也可表现肠病毒壳体蛋白,以及可形成腺病毒颗粒VLPs,系藉由将该等表现后之肠病毒壳体蛋白组装而成,此点可由西方墨点法及穿透式电子显微镜所证明。Ad-P1-3CD可被作为广效的DNA疫苗以产生免疫力对抗各种不同肠病毒之感染,特别是肠病毒A,其包含EV71及CVA。如下实例所示,于动物中,以Ad-P1-3CD进行免疫可诱发中和抗体以对抗EV71及专一之细胞的CD44+及CD8+细胞免疫力,已对抗EV71及CVA;以及Ad-P1-3CD提供动物保护力以对抗EV71及CVA感染(免疫Ad-P1-3CD之小鼠,经EV71或CVA攻毒后,可达100%之存活率,相反的,接受生理食盐水或对照腺病毒载体之小鼠则为0%之存活率)。
为了构筑本发明之重组的腺病毒载体,使用标准的分子生物学及细胞培养技术(像是该等描述于Sambrook et al.,Molecular Cloning,a Laboratory Manual,3rdedition,Cold Spring Harbor Press,Cold Spring harbor,N.Y.(2001)中之方法),将外源之DNA插入该载体之腺病毒基因组中适当位置。当该腺病毒载体包含两种或多种外源核酸序列以表现蛋白时,该多重核酸序列,可以操作式连接方式,与不同或相同之启动子连接,如:两个核酸序列操作式连接至相同启动子,或该两个核酸序列分别操作式连接至不同的启动子。于此方法中,该启动子可为一病毒性启动子,像是T7启动子、CMV启动子、人类免疫缺损病毒(HIV)长末端重复启动子、内部核醣体进入位(IRES)、疱疹胸苷激酶启动子或与腺病毒有关之病毒启动子,如p5启动子及其类似物。或者,该启动子可为细胞的启动子,即于真核细胞(动物细胞或酵母菌细胞)中存在之启动子、像是泛素启动子、EF-1α启动子、热休克蛋白启动子、β活化启动子、或乙醇氧化酶基因(AOX1)启动子。
于一部分具体实施例中,本发明重组的腺病毒载体包含表现卡匣,其包括第一核酸片段,编码P1蛋白,以及第二核酸片段,编码3CD蛋白酶。特定而言,该第一核酸片段可操作式与第一启动子连接,以控制P1蛋白之表现,以及第二核酸片段可操作式与第二启动子连接,以控制3CD蛋白酶之表现,其中第一启动子及第二启动子可为相同的或不同的。于本发明之重组腺病毒载体中的表现卡匣之具体实例,系分别如图14及图15所示,其中之一为CMV启动子可操作式连接至P1基因,并以IRES启动子操作式连接至3CD基因(CMV-P1-IRES-3CD);以及另一者为CMV启动子可操作式连接至P1基因,并与EF-1α启动子操作式连接至3CD基因(CMV-P1-EF-1α-3CD)进行连接。
本文所用之“P1蛋白”为一蛋白产物,系由肠病毒P1基因所表现。该P1蛋白之氨基酸序列,及其对应之核酸系为该领域中可取得者。于部分具体实施例中,本文所述之P1蛋白系指源自EV71者,具体而言是指具有SEQ ID NO:1之氨基酸序列,或源自其他肠病毒株,其与SEQ ID NO:1之氨基酸序列具有至少85%、90%或95%相同性之序列。
本文所用之“3CD蛋白酶”为一蛋白产物,系由肠病毒之3CD基因所表现。该3CD蛋白之氨基酸序列,及其对应之核酸系为该领域中可取得者。于部分具体实施例中,本文所述之3CD蛋白系指源自EV71者,具体而言是指具有SEQ ID NO:2之氨基酸序列,或源自其他肠病毒株,其与SEQ ID NO:2之氨基酸序列具有至少85%、90%或95%相同性之序列。
于特定具体实施例中,该P1蛋白及3CD蛋白酶皆源自相同种类之肠病毒,例如EV71。
于部分实例中,本发明重组的腺病毒载体包含表现卡匣,其包括SEQ ID NO:3(CMV-P1-IRES-3CD)或SEQ ID NO:4(CMV-P1-EF-1α-3CD)之核酸序列。
于本发明中,亦揭露了3C专一细胞免疫力足以保护各种不同之肠病毒感染,至少肠病毒A型之感染,含括EV71及CVA感染。因此,本发明亦提供一种重组腺病毒载体,可用于生成免疫力以对抗肠病毒感染,其包含表现卡匣,编码肠病毒3C蛋白酶或3CD蛋白酶。于一具体实施例中,本发明提供一种重组的腺病毒载体,其包含携有外源DNA之表现卡匣,该外源DNA编码肠病毒之3C蛋白酶。于另一具体实施例中,本发明提供一种重组的腺病毒载体,其包含携有外源DNA之表现卡匣,该外源DNA编码肠病毒之3CD蛋白酶。于特定实例中,该3C蛋白酶或3CD蛋白酶源自EV71。
本文所用之“3C”蛋白系指由肠病毒3C基因所表现之蛋白产物。该3C蛋白之氨基酸序列,及其对应之核酸系为该领域中可取得者。于部分具体实施例中,本文所述之3C蛋白系指源自EV71者,具体而言是指具有SEQ ID NO:5之氨基酸序列,或源自其他肠病毒株,其与SEQ ID NO:5之氨基酸序列具有至少85%、90%或95%相同性之序列。
为了决定两个氨基酸序列之相同性百分比,将序列以最佳比较方式进行排列比对(如可引入间隔于第一氨基酸序列,以与第二氨基酸序列有较佳之排列比对)。于计算相同性百分比时,一般计算完美对应者。两序列间之同源性或相同性之百分比的决定,可使用该领域所熟知之数学算法进行,如BLAST及Gapped BLAST程序、NBLAST及XBLAST程序、或ALIGN程序。
本发明重组腺病毒载体之有效量,系与该活性成分与医药可接受载体调制成之组合物,且为了递送、或吸收、或增强组合物稳定性之目的,以形成适当型态,来决定之。
本文所用之“医药可接受”意指于组合物中,该载剂可与该活性成分兼容,且较佳地可稳定该活性成分,且对于接受治疗之个体是安全的。该载剂可为该活性成分之稀释剂、载体、赋形剂、或基质。病毒载体可调制为溶液、或冻干粉末方式以供非口服方式投药。于使用前,粉末可以适用之稀释液或其他医药可接受之载剂回溶。适用之稀释液,如一般等渗透的生理食盐水溶液,溶于水中之标准5%葡萄糖、或缓冲的钠或醋酸铵溶液。病毒载体可被制备以口服方式施予。部分适当之固体载剂例子,包括乳糖、葡萄糖、蔗糖、山梨糖、甘露糖、淀粉、阿拉伯胶、磷酸钙、海藻酸、黄蓍树胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、灭菌水、糖浆及甲基纤维素。该组合物可额外包含润滑剂,像是滑石、硬脂酸镁、及矿物油;湿润剂;乳化及悬浮剂;防腐剂;像是甲基及丙基羟苯酸酯;增甜剂;及增味剂。经施予至一个体后,本发明之组合物可提供快速、持续、或缓释该活性成分之效果。
本发明之组合物包含本发明重组腺病毒载体,以作为疫苗组合物,可进一步包含佐剂来调制。为了增强疫苗组合物之功效的佐剂典型例子,包括但不限于,铝盐、水包油乳化配方、皂素佐剂、弗氏完全佐剂(complete Freund’s adjuvant;CFA)及弗氏不完全佐剂(incomplete Freund’s adjuvant;IFA)。
本发明进一步提供一种于个体内诱发免疫反应以对抗肠病毒感染之方法,包含施予该个体有效量之重组腺病毒载体或如本文所述之疫苗组合物。亦提供该重组腺病毒载体或本文所述之疫苗组合物用于制造医药(如疫苗),以于个体中诱发免疫反应以对抗肠病毒感染之用途。
“有效量”乙词系指一剂量或数量,足以提供受治疗个体所欲之医疗效果,例如,足以于接受治疗者体内生成或诱发免疫反应以对抗病原菌(如肠病毒)或抗原(如肠病毒之3C或3CD蛋白)。治疗有效量可能因各种理由而改变,像是施予路径及频率、体重、及接受该医药之个体物种、及施予之目的而改变。于该领域具有通常技艺者可于每一个病例中去决定剂量,系依照本文所揭露者、建立之法及其个人经验。例如,于部分具体实施例中,本发明之重组的腺病毒载体系以一剂量为1×107至1×1012噬菌斑形成单位(plaque-forming unit;pfu),如1×107、1×108、1×109、1×1010、1×1011、或1×1012pfu之剂量施予。
“免疫反应”乙词可包括,但不限于体液反应及细胞媒介之免疫反应,如CD4+或CD8+细胞之活化。
病毒载体可以藉由任何生理学上可接受之路径进行施予,像是口服、非经口的(如肌肉、静脉、皮下及腹腔)、经鼻的、直肠给药、经皮吸收的或吸入的。于部分具体实施例中,该病毒载体可以口服、皮下、或腹腔方式施予。免疫可藉由重复之施予以施行,一般包含起始施予,及接续之补强施予。
于本发明中发现,3C专一细胞免疫力足以保护各种不同肠病毒感染。因此,本发明之方法系有效提供交叉保护性免疫力,以对抗不同肠病毒株,系因3C蛋白之氨基酸序列于不同肠病毒株间是呈现高度保留的。于部分具体实施例中,本发明之方法可有效诱发免疫反应以对抗肠病毒A,且含括EV71及CVA,此两者是造成HFMD之主要原因。
本发明亦提供一种于哺乳动物细胞系统中产生肠病毒类病毒颗粒之方法,包含:
于可表现该P1蛋白及3CD蛋白酶且可组装该肠病毒之类病毒颗粒的环境中,培养哺乳动物细胞,该细胞系以一含有编码肠病毒之P1蛋白及3CD蛋白酶之表现卡匣之重组腺病毒载体所转染;以及
收集培养后之哺乳动物细胞,并从培养的哺乳动物细胞中分离出肠病毒之类病毒颗粒。
转染可以任何习知方法施行,且可达到暂时性的或稳定的转染之结果。进行稳定转染可建立一可产生所感兴趣之VLPs的细胞株。
于部分具体实施例中,用于转染哺乳动物细胞之重组腺病毒载体,是可复制的或不可进行复制的。
于部分具体实施例中,该哺乳动物细胞可藉由将该重组腺病毒载体转染入互补细胞中,其可互补所用之无法复制腺病毒载体中腺病毒基因组之缺陷。常见之互补细胞例子为293细胞或其他如US 6,677,156、US 6,913,927或US 20030017595中所述之细胞。
于哺乳动物细胞系统中所生成之VLPs,可被收集并以适用载剂调制后以形成疫苗组合物,以对抗肠病毒感染。根据本发明所制备之VLPs,其价值系与疫苗相同,系因其糖化状态与在人类中相似。
本发明进一步以下列实施例阐述,所提供之例子仅用证明之目的,而非用于限制之目的。于该领域具有技艺者应,可藉由本发明之启发,了解本发明所揭露之具体实施例,在不背离本发明之精神及范畴情况下,可进行各种改变,且可获得相同或相似之结果。
实施例
于本研究中,吾人已设计及藉由基因工程改造一种重组腺病毒载体,带有EV71P1及3CD基因之Ad-EVVLP,该等基因系插入剔除E1/E3之腺病毒基因组中。Ad-EVVLP可于HEK-293A细胞中产出。除了Ad-EVVLP颗粒,藉由与EV71型壳体蛋白VP0、VP1及VP3物理性链接以形成类病毒颗粒(VLP);其中该等壳体蛋白系为P1基因产物。该等病毒颗粒可被3CD蛋白酶酶切,且确认可被Ad-EVVLP-生成细胞所产生,并可藉由穿透式电子显微镜及西方墨点法所辨识。鼠的免疫原性研究显示Ad-EVVLP-免疫的抗血清,可中和EV71型B4及C2基因型。VLP专一之CD4+及CD8+/IFN-γT细胞的活化,系与Th1/Th2-平衡的IFN-·、IL-17、IL-4、及IL-13之诱发有关联;相对的,FI-EV71仅诱导Th2媒介之中和抗体,以对抗EV71型及低VLP专一之CD4+及CD8+T细胞反应。于hSCARB2转殖基因小鼠(hSCARB2-Tg)攻毒模式中,以Ad-EVVLP免疫小鼠,很明显地证实该免疫小鼠具有抗病毒之免疫力,以对抗EV71。经Ad-EVVLP-免疫之小鼠皆100%被保护,且证明可降低CNS及肌肉组织中之病毒载量。Ad-EVVLP成功地诱发抗CVA16免疫力。虽然抗血清对于CVA16没有中和活性,CVA16为3C专一之CD4+及CD8+/IFN-γT细胞,但其媒介了对抗CVA16攻击之保护力。FI-EV71不会诱发3C媒介之免疫力,且对于CVA16攻击不具有效力。该等结果显示,Ad-EVVLP可增强中和抗体及具保护性之细胞免疫反应,以预防EV71型感染,及细胞免疫反应以对抗CV感染。Ad-EVVLP已与医疗需求相符,即如同常用之HFMD疫苗一样,可用来对抗EV71型及CV感染。
1.材料及方法
1.1伦理道德之声明
所有使用之实验动物皆根据台湾财团法人卫生研究院(NHRI)之实验动物中心的规范来进行。动物操作之计划书系经NHRI机构之实验动物照护及使用委员会评审及核定(核定计划书编号NHRI-IACUC-100125-A)。于EV71型攻毒实验中,存活率被作为最终评估对抗EV71型处理之保护效力的方式。于实验动物模式中已有众多研究报告[16,19,21,22],存活率可作为评估EV71型感染致病性之指标。试验完成后,试验动物系以100%CO2吸入5分钟方式,及接续之颈椎错位法进行安乐死,以降低痛苦。为了进行攻毒,在进行皮下或腹腔EV71型免疫前,先将小鼠置于含有异氟烷(起始阶段:5%;维持阶段:1.5%-2.5%)之麻醉吸入箱中1分钟。
1.2细胞、病毒、化合物及抗体
非洲绿猴肾细胞(Vero)(ATCC No.CCL-81)及人横纹肌肉瘤细胞(RD)(ATCC No.CCL-136)系由台湾疾病管制中心(台湾CDC)所提供;原始细胞株系源自美国典型培养物保藏中心(ATCC)。Vero细胞于含有4mM L-麸酰胺酸(Gibco-Invitrogen,CA,USA)之VP-SFM培养基(Gibco-Invitrogen,CA,USA)中培养。该RD细胞株于含有10%胎牛血清(Gibco-Invitrogen,CA,USA)之DMEM培养基中培养。将细胞置于含有5%CO2之37℃培养箱中培养。临床上,EV71型分离株、E59分离株(B4)(GenBank:GQ150746.1)、Neu(pinf7-54A)株(C2)(GeneBank DQ060149)、Tainan/5746/98(C2)(GenBank:AF304457.1)、及CVA16株、及5079株(GenBank:AF177911.1)系源自台湾台南成功大学王贞仁博士,并以Vero细胞,于微载体细胞培养生物系统中继代培养[23,24]。人类腺病毒5(Ad5;ATCC No.VR-1516TM)系购自ATCC,并以293A细胞继代培养。备用之病毒皆存于-80℃。备用病毒之力价系以标准的噬菌斑形成试验测定[25],并以噬菌斑形成单位(pfu)之数量计算。
可辨识VP0/VP2EV71型之殻体蛋白的单株抗体Mab979系购自Millipore,Inc.,MA,USA[26]。自家生产之VP1专一之单株抗体E1系已于先前被叙述过[26]。对人类β-肌动蛋白(Cat.No.A5441)专一之抗体,系购自Sigma-Aldrich MO,USA。辣根过氧化物酶(horse radish peroxidase;HRP)共轭之驴抗鼠抗体(Cat.No.715-036-150)或HRP共轭之兔抗山羊抗体(Cat.No.305-035-003)系购自Jackson Immunoresearch,Inc.,PA,USA。
1.3构筑及生成Ad-EVVLPI及Ad-EVVLPI
将EV71Neu(pinf7-54A)株之P1及3CD基因系以PCR扩增,并将之个别插入运输载体pENTR4(Invitrogen)中。将延长因子-1α(EF-1α)启动子之核苷酸片段插入该P1基因之3’端,以及该3CD基因之5’端,以生成pENTR4-P1/EF-1α/3CD构筑体。将3CD基因单独插入pENTR4中以生成pENTR4-3CD构筑体。将pENTR4-P1/EF-1α/3CD及pENTR4-3CD构筑体以酵素重组方式接入该ΔE1/ΔE3(无法复制的)Ad5载体pAd/CMV/V5-DEST[27]中,以分别形成重组的pAd-EVVLP及pAd-3CD。将pAd DNA转染入293A包裹细胞株中以生成重组的腺病毒,称为Ad-EVVLP及Ad-3CD。将带有荧光素酶报导基因之Ad-LacZ作为对照组载体,系取得自Invitrogen。使用Vivapure adenoPACK 100RT(Satorius Stedin Biotech)以纯化及浓缩该重组的病毒。该纯化的病毒力价系以修改过之标准噬菌斑试验法判定。将各种不同的Ad病毒稀释皆加入6孔组织培养盘之每一孔洞中,其中293A细胞已被置于每一孔洞中。以含有0.75%甲基纤维素之DMEM覆盖该培养物后,将之置于37℃培养10至12天,并计算噬菌斑。通常腺病毒可收获量约为1×109pfu/mL。
1.4西方墨点法
西方墨点法系根据先前叙述之方式进行[25]。使用1至2×106细胞及100μL冰冷的溶解缓冲液(0.5%脱氧胆酸钠,0.1%十二烷基硫酸钠(SDS),0.5%NP-40,50mM TRIS,150mM NaCl),并加上蛋白酶抑制剂混合物(Roche,French)及1mM PMSF(Sigma-Aldrich,CA,USA)以制备总细胞溶解物。将溶解物以10,000rpm、4℃离心20分钟以沈积该细胞碎片。细胞溶解物或片段之蛋白浓度系以Bradford法测定[28]。将含有10μg蛋白之细胞溶解物与追踪染剂混合,并将之加入10%SDS-聚丙烯酰胺凝胶(SDS-PAGE,Amersham Biosciences-GE Healthcare,USA)之每一个孔洞中,并于1x Tris-甘胺酸SDS电泳缓冲液中进行电泳。将溶解之蛋白转移至硝化纤维膜上(Hybond-ECL,Amersham Biosciences-GE Healthcare,USA)。将膜片浸于5%脱脂牛奶及1xPBS中,于室温30分钟,接着以含有0.05%Tween 20之1x PBS(PBS-T)清洗3次。将膜片与鼠抗3C(1:1000)、MAB979(1:5000)、或抗VP1抗体(1:1000)于4℃作用14至16小时,接续以PBS-T冲洗,接着以HRP共轭之抗大鼠或驴抗小鼠(供MAB979使用)抗体作用。经作用1小时后,将膜片以PBS-T清洗5次,接着将Super Signal West Pico化学发光受质(Pierce,IL,USA)覆盖在膜上,并将之曝光于X光片(Kodak,NY,USA)上。如有需要,将该膜片以还原缓冲液(Pierce,IL,USA)拆下,并以另一个抗体进行墨点法。
1.5流式细胞仪
从BALB/c小鼠收获脾细胞,并以5-(6)-羧基荧光素二醋酸琥珀酰亚胺酯(CFSE)(Cat.No.C34554,Molecular Probes)标记。以107pfu/mL UV-不活化之EV71 5746或1.4μg/mL纯化之重组E59 3C蛋白以体外方式进行再刺激5天;其中该3C蛋白系以大肠杆菌表现(由庄再成博士提供,本发明之共同作者)。脾细胞之CD4+T细胞之增生,系以流式细胞仪(BD FACSCalibur)及PE-Cy5-标记之抗CD4抗体分析。于CFSE-预染之CD4+T细胞(没有抗原刺激)中没有荧光讯号变化之族群,设定为0%,并计量经抗原刺激后之阴性转变之CD4+T细胞(增殖细胞)之族群。于每组中个别增生CD4+T细胞之相对平均百分比遂被计算。为了侦测CD8+IFN-γ+T细胞之族群,将脾细胞与EV71抗原一起培养两天,接着以布雷菲德菌素A(Cat.No.00-4506-51,eBioscience)处理3小时后再收获。经刺激的脾细胞系以PE-Cy5-标记的抗CD8抗体染色30分钟,接续将之进行固定及通透化。将该等细胞中之一部份进一步以PE-共轭之抗IFN-γ+抗体(BD Bioscience)染色30分钟,以侦测细胞内的IFN-γ。经清洗后,将样本以流式细胞仪分析。
1.6PCR及实时RT-PCR
将pAd-EVVLP质体DNA作为模版,以PCR及相对应之引子对来侦测位于pAd-EVVLP内之P1、3CD、及EF-1α启动子区域。PCR之条件为:95℃3分钟;于95℃1分钟、60℃1分钟、及72℃3分钟进行35个循环;及最终作用于72℃2分钟。
使用TRIZOL试剂(Invitrogen,CA,USA),及遵循制造商之指示,从组织中纯化出总RNA,并将之进行实时RT-PCR。使用随机引子(Genomics BioSci&Tech,Taiwan)及反转录酶(Bionovas,Toronto,Canada)以将总RNA转变成cDNA。将合成之cDNA,以对EV71 P1 RNA之VP1区域的专一引子对,进行定量PCR分析(LightCycler 480SYBR Green Real-Time PCR system)。人类β-肌动蛋白基因表现被用作为内部对照组。PCR条件为95℃3分钟;于95℃10秒钟、65℃20秒钟、及72℃2秒钟进行40个循环;及最终作用于72℃2分钟。如此即可取得扩增转录物所需之循环次数。EV71 P1 RNA之相对表现系以下列方式计算:从实验组或对照组取得之个别Ct值经与其对应Ct(β-肌动蛋白)互减后,以得到常态化之Ct,接着将2常态化Ct(源自未经病毒感染之样本中的P1 RNA的VP1)除以2常态化Ct(源自经病毒感染之样本中的P1 RNA的VP1)。该正向及反向引子,[5_-ACGCGCAAATGCGTAGAAAGGT-3_–正向的(SEQ ID NO:7)及5_-TTAGTGGCAGTTTGCCATGCGA-3_–反向的(SEQ ID NO:8)],用于扩增及侦测VP1 RNA。使用引子对5_-ACCAACTGGGACGACATGGAGAAA-3_–正向的(SEQ ID NO:9)及5_-TAGCACAGCCTGGATAGCAACGTA-3_–反向的(SEQ ID NO:10)以扩增人类β-肌动蛋白mRNA。标靶Ad-EVVLP之P1、3CD、及EF-1α启动子区域的引子对如下所示:P1:5_-ATCG GAATTCATGGGCTCACAGGTGTCCAC-3_–正向的(SEQ ID NO:11)及5_-CTTGTCGACTTAGAGAG TGGTAATTGCTG-3_(SEQ ID NO:12)–反向的、3CD:5_-ATCGGAATTCATGGGGCCGAGCTTGGAC-3_–正向的(SEQ ID NO:13)及5_-ATCGCTCGAGAAACAATTCGAGCC-3_–反向的(SEQ ID NO:14)、EF-1α启动子:5_-ATCGACGCGTGTGAGGCTCCGGTGCCC-3_–正向的(SEQ ID NO:15)及5_-ATCGCCCGGGGTTTTCACGACACCTG-3_–反向的(SEQ ID NO:16)。所有引子对系购自台湾Genomics BioSci&Tech合成者。
1.7 EV71 VLP及Ad之密度梯度纯化
于接种Ad-EVVLP(以MOI=1感染)前一天,将HEK-293A细胞(1x107)种在10孔盘中。经24小时感染后,收获细胞并将之以1%NP-40溶解缓冲液(50mM Tris/HCl,pH 7.5,150mM NaCl,2mM EDTA,及1%NP-40),于冰上作用30分钟进行溶解,并以1000xg离心10分钟以移除细胞碎片。收获上清液并以100,000xg、4℃进行超高速离心1小时而浓缩,接着将之溶解于30μL PBS中。将样本装入自制的碘克沙醇梯度中;该梯度是藉由将0.6mL S溶液(0.25M蔗糖,15mL EDTA,30mM Tris/HCl,pH 8.0)及0.42mL 60%(w/v)碘克沙醇(Cat.No.1114542,Optiprep;Axis Shield,UK)混合以形成一均质之溶液来制备。梯度系透过于4℃、162,000xg进行离心24小时生成。不同片段系以手动方式自顶端收获(称第一片段),每一片段0.1mL,及从每个样本中连续收集10个片段。该等片段遂被以Mab979抗体进行西方墨点法,或以穿透式电子显微镜观察。
1.8穿透式电子显微镜
经Ad-EVVLP感染后24小时,收获HEK-293A细胞,并将细胞碎片以-80℃30分钟及37℃15分钟进行冻融两次。将溶解物于室温、3000rpm离心15分钟,并收获上清液,供JEOL JEM-1400穿透式电子显微镜(transmission electron microscope;TEM)分析腺病毒。透过密度梯度离心将溶解物片段化,且藉由于100,000xg进行超高速离心1小时以浓缩各个片段,并将之重新悬浮于200μL PBS中。接着将各片段以100KDa-cut-off spin-XR UF 20管柱(Corning)进行离心以净化之。样本以醋酸铀酰处理后,以TEM分析。
1.9 ELISA
将96孔盘中以每孔100μL之热不活化的(56℃经1小时)103pfu EV71 5746(C2基因型)或E59(B4基因型)株、200pfu纯化的Ad5、或700ng重组的3C蛋白及碳酸盐包覆缓冲液进行包覆,以侦测血清中之抗EV71、抗Ad、或抗3C抗体。血清样本系自免疫小鼠中收集,并以56℃进行不活化30分钟。从8倍起始稀释阶开始将血清进行两倍序列稀释。将稀释的血清加入孔洞中,并于室温作用2小时。再以PBS-T清洗后,将HRP共轭的驴抗鼠IgG抗体加入孔洞中作用45分钟。接着与100μL TMB受质(3,3’,5,5’-四甲基联苯胺)于黑暗中作用20分钟以开始进行反应,并加入50μL 2N H2SO4以终止反应。使用微盘吸光读值机(SPECTRA,MAX2,M2),于450nm测定光学密度。为了侦测由脾细胞分泌之细胞激素,将源自培养两天之以107pfu/mL UV-不活化EV71 5746进行再刺激之脾细胞之上清液进行分析,系使用一测热能之三明治IFN-γ、IL-4、IL-13、及IL17A ELISA套组(分别为Cat.No.887314、88-7044、88-7137,及88-7371,eBioscience)分析。该分析是根据制造商之指示进行,并使用微盘吸光值读取机于450nm测定光学密度。
1.10中和能力分析
侦测中和活性之方法,即如同吾人先前研究中所述之方法[26],将每一个样本以新鲜细胞培养基进行2倍序列稀释。将E59、5746、或CVA16株加入每一管含有100μL序列稀释血清中以制备总共100μL 100TCID50之病毒悬浮液。于4℃培养18至24小时后,将100μL病毒血清混合物加入96孔盘中,其中种有横纹肌肉瘤细胞(RD),并将之于37℃培养7天,TCID50值系以计算细胞病变效应(CPE)测量。50%中和抑制剂量(ID50)系将血清稀释倍数之倒数与正常血清比较,并以Reed–Muench方法计算[29]。使用小鼠抗EV71Mab979抗体(Chemicon International)做为内部的阳性对照组。
1.11酵素结合免疫吸附分析法
含有5×106无RBC之脾细胞的悬浮液系自个别小鼠制备,并将之种于96孔之过滤盘(Millipore)之个别孔洞中,该盘系预先以捕捉型单株抗体包覆,该单株抗体可辨识鼠IL-4或IFN-γ(0.5μg/well)(分别为Cat.No.16-7041-68或16-7313-68,eBioscience),并以条件培养基(conditioned medium;CM)于室温先阻断1小时。将脾细胞加入溶于CM(100μL)中之106pfu/well UV-不活化的EV71 5746。将脾细胞与Con A(10μg/mL)作用以作为一阳性对照组。将未刺激的脾细胞作为阴性对照组。将为96孔盘置于含有5%CO2之37℃培养箱中作用48小时。ELISPOT盘之个别孔洞系以PBS-T清洗3次,并将相对应之0.2μg生物素化的专一侦测IL-4-或IFN-γ的单株抗体加入,以侦测相对应之细胞激素。于室温经2小时作用后,清洗该等96孔盘,并加入100μL链霉亲和素碱性磷酸酶(1:250稀释倍数)于各别孔洞中。将该等盘置于室温作用45分钟。最后,将该等盘以清洗缓冲液清洗4次,并加入100μL AEC(3-胺-9-乙基咔唑,Sigma-Aldrich)受质于每一个孔洞中,并于室温暗处作用30分钟。将盘以水清洗干净,整夜风干,并使用免疫斑点计算读取机(Immunospot,Cellular Technology Ltd.)计算每一个孔洞的斑点。结果系以每5×105脾细胞(于起始培养时所种之数量)中之细胞激素分泌细胞数量表示。
1.12 Ad-EVVLP免疫hSCARB2转殖基因小鼠,系以EV71及CVA16攻毒
hSCARB2-Tg小鼠系以C57BL/6小鼠为底,系由吾人团队先前生成的,且藉由将hSCARB2-Tg个体交配以维持得到自交小鼠[16]。将1日龄之hSCARB2-Tg小鼠,于第1及7天,以皮下方式注射PBS、3×107pfu Ad-LacZ、或3×106或3×107pfu Ad-EVVLP或1μg FI-EV71疫苗,接着于第14天以3×106pfu EV71 5746或5×105pfu CVA16进行皮下方式攻毒。攻毒后15天,每日观察小鼠之存活情形。
1.13统计分析
对数等级检定系用于分析经药物处理及未处理之转殖基因小鼠的存活率差异。非成对之T检定及Welch’s校对统计系用于分析实验组别中测试基因的表现差异。结果被认为具显著差异者系以p<0.05表示。符号*及**用于分别代表p值<0.05及<0.01。
2.结果
2.1于HEK-293A细胞生产Ad-EVVLP及VLP
吾人使用E1及E3剔除之腺病毒-5基因组,以构筑Ad-EVVLP表现载体,其带有全长之EV71型之P1及3CD基因(图1A)。吾人以聚合酶连锁反应(PCR)及对应之引子,以确认该插入物P1及3CD及延长因子-1α启动子(EF-1p)是否有插入Ad-EVVLP构筑体中。其PCR产物对应之大小为2585bps(P1)、2020bps(3CD)、及1186bps(EF-1p)(图1B)。转染至胜任HEK-293A细胞以持续表现E1蛋白,以生成重组的Ad。吾人使用多株抗体抗Ad5抗体进行西方墨点法,以分析Ad-EVVLP及对照组Ad-LacZ。其表现之每个Ad结构蛋白,包括异己酮蛋白、聚氯醚及蛋白V、VI、及VII(图1C)。先前研究显示VP0(38KDa,VP2+VP4的前躯产物)、VP1(36KDa)、VP2(28KDa)、VP3(25KDa)、及VP4(8KDa)之多重壳体蛋白可于EV71感染之细胞中被测得[26,30]。藉由Ad-EVVLP表现之VLP进一步分析其特性;EV71 VLPs之转译产物,包括VP0(VP4-VP2前躯物)但不包括VP2,可使用VP2专一的单株抗体Mab979[47]于293A细胞中测得。以西方墨点法侦测EV71抗原VP0及VP2(图1C)。吾人藉由使用VP1专一抗体,确认了VP1的表现,其可对应于Ad-EVVLP感染的溶解物及EV71抗原样本中之34至36kDa的条带(图1C)。相较于F颗粒(由VP2、VP4、VP1及VP3组成),由Ad-EVVLP表现之VLPs抗原图谱与源自EV71之E颗粒(由VP0、VP1、及VP3组成)相似,该E颗粒不含有病毒RNA[30]。此外,于缺少EV71遗传的RNA情况下,3C’将P1多蛋白处理以形成VP0、VP1及VP3[30]。吾人使用抗3C蛋白可侦测到一18kDa条带。相对的,于未感染或Ad-LacZ转染之293A细胞中,吾人无法测得该等条带(图1C)。然而,没有可用之VP3专一抗体可用于侦测VP3。于EV71感染小鼠之血清中,吾人藉由墨点法无法测得VP3讯号(图9)。
为了证明EV71 VLP颗粒可于Ad-生成细胞中同时产生,吾人使用密度梯度离心法使其片段化,藉此将病毒颗粒(virions)从Ad-EVVLP转染子之细胞质中纯化出来。吾人将片段化之EV71颗粒作为对照组。吾人将每一个片段化之样本,使用Mab979抗体进行西方墨点分析以分析其特性。主要条带为38kDa,可对应至VP0,另外有较低表现量之28kDa,其对应至VP2(VP0/VP2之强度比率分别为4及6),于片段6及7,这两者可生成EV71之E颗粒。相对的,与VP0/VP2表现相反之图谱(分别为0.8、0.9、及0.8)可对应至F颗粒,其可于片段8、9、及10中观察到。然而,仅有VP0讯号可于Ad-EVVLP感染之溶解物中的片段6至9中侦测到(图2A)。EV71型之相似的抗原图谱,已于先前研究中报告过[31]。
吾人将Ad-EVVLP样本之片段7及8混合,并藉由TEM分析它们。TEM分析结果显示于样本中有部分破碎的VLPs(f)及细胞不纯物,此系因样本制备过程所致。另外,有两个大小之完整颗粒亦存在,直径超过100nm之颗粒对应至Ad颗粒(图2D),以及直径约为30nm之颗粒对应至由Ad-EVVLP所表现之VLPs(图2B)。于EV71样本之片段8及9的混合物中之EV71颗粒亦被检查(图2C)。
2.2于Ad-EVVLP免疫小鼠中EV71 VLP专一的体液性反应
为了分析及比较Ad-EVVLP及FI-EV71疫苗之免疫原性,吾人藉由腹腔(i.p.)、皮下(i.p.)或口服方式,将1×108pfu Ad-EVVLP或Ad-LacZ,于第1及14天投与成年BALB/c小鼠。于不同组别中之动物,以0.1μg或1μg FI-EV71两次皮下注射,以评估及比较该等重组腺病毒之病毒专一性免疫反应。ELISA结果显示(图3A),于Ad-EVVLP-免疫血清样本(于第21天收集者)之抗EV71之平均力价(抗EV71 5746(C2亚基因型))为2240、7040、及130(分别为皮下、腹腔及口服之力价)。吾人于皮下注射Ad-LacZ-免疫小鼠之血清中无法测得力价(图3A)。源自Ad-EVVLP免疫动物之血清抗体,与EV71E59株(B4亚基因型)作用之平均力价为2240、8960及180(分别为皮下、腹腔及口服之力价)。同样的,于Ad-LacZ免疫小鼠血清中无法测得E59之反应(图3B)。源自Ad-EVVLP免疫小鼠血清具有EV71中和活性(表1)。相较于于口服投药之动物的相当低的中和力价,可于腹腔及皮下投药之Ad-EVVLP免疫小鼠中发现有较高之病毒中和力价(1/128)。于Ad-EVVLP免疫小鼠所产生之中和抗体,具有抗EV71型B及C株之有效中和活性。于皮下投药0.1μg FI-EV71疫苗之小鼠中,中和抗体力价(1/256及1/512)具明显之抗体力价。但于免疫Ad-EVVLP、FI-EV71疫苗、或PBS(<1:8;表1)之小鼠血清中无抗CVA16之中和活性。此等结果与先前报告[32]结果吻合,显示FI-EV71疫苗无法诱发交叉保护之中和抗体以对抗CVA16。
表1:以Ad-EVVLP或FI-EV71疫苗诱发之抗EV71E59及5746株及CVA16之中和抗体。
*将七周龄BALB/c小鼠分别以108pfu Ad-EVVLP或Ad-LacZ,以腹腔、皮下或口服方式,进行首免及补强,中间间隔14天。于第21天时收集血清以分析中和活性:先将个别免疫血清进行不同倍数稀释,并与102pfu 5746、E59或CVA16进行作用后,再加入RD细胞。培养后第5天观察CPE。结果系以中和抗体力价表示,系对应至该稀释倍数之免疫血清,以降低50%细胞病变反应来计算TCID50值。
2.3于Ad-EVVLP免疫小鼠诱发VLP专一细胞免疫
近期研究关于对抗EV71之宿主免疫反应,显示T细胞免疫于提供保护以对抗EV71感染及控制疾病中,扮演很重要之脚色[33,34]。因此,吾人探讨是否VLP专一之CD4+及CD8+T细胞反应是否可于Ad-EVVLP免疫小鼠中被诱发。免疫后7天,吾人从脾脏中分离出脾细胞,接着以经UV不活化之EV71(UV-EV71)进行体外再刺激。源自Ad-LacZ免疫小鼠之淋巴球可生产基础量之IFN-γ。相对地,经施予Ad-EVVLP之小鼠,其淋巴球培养物中可测得较高之IFN-γ(图4A)。源自FI-EV71疫苗免疫小鼠之淋巴球,亦仅有分泌出基础量之IFN-γ(图4A)。于Th2细胞激素试验表中,源自Ad-EVVLP免疫小鼠之淋巴球,亦适度地分泌出IL-4(图4B)及IL-13(图4C),意指平衡的Th1/Th2反应亦被活化了。有趣的是,免疫FI-EV71疫苗可产生最高量的IL-4及IL-13,意指偏向Th2反应被诱发了(图4B及图4C)。此结果与吾人之发现相同,即于hSCARB2-Tg小鼠中免疫FI-EV71,可诱发脾细胞IL-4但不会诱发IFN-γ之分泌,如先前研究所示[16]。从IFN-γ及IL-4ELISPOT试验结果可确认,腹腔注射Ad-EVVLP进行免疫,可于Ad-EVVLP免疫小鼠中,诱发明显的脾细胞IFN-γ生成,及少量的IL-4分泌(图10)。源自Ad-EVVLP免疫小鼠之脾细胞为因应EV71抗原,会生成适量之IL-17A。此结果与以Ad-LacZ或FI-EV71疫苗免疫之动物脾细胞所分泌之几乎无法测得之IL-17,明显不同(图4D)。该等结果指出Ad-EVVLP可驱动T细胞活化,使得T细胞之亚群进行分化,其包含可产生Th1、Th2、及IL-17之表现型。
吾人测量于疫苗免疫后之脾细胞中,经以UV-EV71再刺激后,VLP专一之CD4+T细胞增生情形;其中是使用流式细胞仪,并藉由分析5-(6)-羧基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)-预染之CD4+T细胞之荧光讯号之阴性转变情形以分析增生状况。相较于PBS及Ad-LacZ免疫组仅可测得少量或几乎没有阴性转变情形(分别为3%及8.4%),而于Ad-EVVLP免疫组则可测到实质之阴性转变(42%;图5A)。于FI-EV71免疫小鼠中,经UV-EV71处理后,几乎无法测得CD4+T细胞之增生(8%;图5A),意指FI-EV71反应形成之VLP的抗原性已改变,因此免疫后的CD4+T细胞无法藉由接触到EV71颗粒后被完全活化。吾人进一步分析,于Ad-及FI-EV71-免疫动物中,VLP专一的CD8+T细胞活化反应。经UV-EV71再刺激后,吾人以与抗体共轭之荧光染料将脾细胞进行染色,该抗体可与表面之CD8分子及细胞内的IFN-γ作用,再藉由流式细胞仪分析该等细胞。吾人发现于Ad-EVVLP免疫小鼠中,CD8+IFN-γ+T细胞的数量(6.5%)较Ad-LacZ-或FI-EV71免疫小鼠者(分别为0.9%或1.5%;图5B)高。该等结果显示Ad-EVVLP可活化EV71 VLP专一的细胞免疫反应。
2.4于hSCARB2-Tg小鼠中,Ad-EVVLP疫苗提供保护,以对抗EV71感染
吾人进一步藉由使用hSCARB2-Tg小鼠模式,以评估Ad-EVVLP于提供保护对抗EV71感染之效力分析。将1日龄hSCARB2-Tg小鼠,于第1及7天以Ad或FI-EV71疫苗,进行首免及皮下补强,接着以皮下攻毒方式,于出生后14天以3×106pfu EV71 5746株进行攻毒。每日观察小鼠之存活状况。如图6A所示,经以3×107pfu Ad-LacZ或PBS免疫之小鼠,攻毒后8至9天便死亡了。相反的,经施予少量之3×106pfu的Ad-EVVLP后,约有75%小鼠存活,以及经注射10倍剂量之Ad-EVVLP后,100%小鼠皆存活。与接受0.1μg FI-EV71疫苗之EV71攻毒小鼠相比,结果也是100%小鼠皆存活(图6A),意指Ad-EVVLP的对抗EV71感染之保护效力与FI-EV71疫苗相仿。吾人进一步分析经疫苗免疫之动物及攻毒后之不同组织的病毒载量。吾人将感染后第4天之EV71攻毒Tg小鼠之不同器官中萃取RNA,使用VP1区域专一之引子进行实时RT-PCR来定量EV71转录。相较于Ad-LacZ免疫小鼠之较高的VP1表现,Ad-EVVLP免疫可实质地降低脑干、脊髓、及肌肉之VP1表现(图6B),因此确认了Ad-EVVLP可压抑EV71感染及复制。
2.5于Ad-EVVLP免疫小鼠中,可生成3C专一之免疫反应
3C及3D为一保守的蛋白,其于EV71及CVs(A16、A6、A10、及A4)间具有至少90%之氨基酸序列同源性(表2)。
表2:比较不同肠病毒株之3CD蛋白序列
吾人分析藉由Ad-EVVLP免疫,是否可诱发3C专一之免疫反应。吾人收集经以皮下注射Ad-EVVLP、Ad-LacZ、或FI-EV71,首免及补强后第7天之小鼠血清进行分析。以重组3C蛋白包覆之ELISA捕捉型试验法分析,源自Ad-EVVLP免疫小鼠之血清,可诱发抗3C蛋白之活性。于Ad-LacZ-或FI-EV71之免疫小鼠的血清中,无法测得抗3C之结合活性(图7A)。与来自FI-EV71之抗血清相似,源自Ad-EVVLP免疫小鼠之抗血清对于CVA16不具有病毒中和活性(表1)。再者,以弗式完全佐剂(CFA)调制之10μg的重组3C蛋白进行小鼠首免,并以弗式不完全佐剂(IFA)调制之相同剂量的重组3C蛋白进行补强,其间间隔14天,所收集之血清,诱发3C结合活性,但不能中和EV71或CVA16感染(图11)。综上所述,该等结果显示诱发3C专一抗体,无法提供保护力以对抗EV71感染。
吾人进一步于经Ad-EVVLP免疫之小鼠中,分析3C专一的细胞免疫反应。吾人分离经过疫苗补强后第7天且经过重组3C蛋白体外再刺激之脾细胞,并藉由流式细胞仪观察CD4+及CD8+T细胞活化情形(图7)。源自Ad-EVVLP免疫组之CD4+T细胞,因应3C而被活化(平均值为32.6%),但于PBS、Ad-LacZ-、及FI-EV71免疫小鼠中无法或仅有少量活化之脾细胞可被观察到(平均值分别为2.3%、2.2%、及1.9%;图7B)。相较于Ad-LacZ(平均值为0.5%)或FI-EV71(平均值为0.5%)之小量的CD8+IFN-γ+T细胞,及源自经PBS缓冲液免疫小鼠所得之基础量的CD8+IFN-γ+T细胞(平均值为0.6%;图7C),于Ad-EVVLP免疫之脾细胞中,因应3C蛋白所活化之CD8+(CD8+IFN-γ+)T细胞系明显地被活化(平均值为3.8%)。该等结果确认了Ad-EVVLP可诱发CD4+/CD8+T细胞反应,以对抗VLP及3C蛋白。
2.6于hSCARB2-Tg小鼠中,Ad-EVVLP疫苗提供保护以对抗CVA16感染
除了提供保护对抗EV71感染外,吾人亦探讨Ad-EVVLP或FI-EV71是否可帮助hSCARB2-Tg小鼠对抗CVA16致死攻毒。经Ad-EVVLP免疫后,100%的hSCARB2-Tg小鼠皆存活,相对的,接受PBS或Ad-LacZ之hSCARB2-Tg小鼠,经CVA16攻毒后,存活率为0%(图8A及表3)。Ad-EVVLP可完全保护动物,以对抗高于CVA16剂量(3×106pfu)6倍之攻毒(表3)。与吾人先前报告一致[16,35],免疫1μgFI-EV71疫苗无法保护hSCARB2-Tg小鼠,以对抗5x105pfu CVA16攻毒,结果呈现0%之存活率(图8B及表3)。综上所述,该等结果显示Ad-EVVLP疫苗可诱发有效的CD4+/CD8+T细胞免疫反应,以控制EV71及CVA16,然而,FI-EV71疫苗所提供之保护仅可对抗EV71攻毒。表1呈现了该等结果呈一关联性,以及于临床试验第I期的结果中,源自免疫FI-EV71疫苗之个体血清可中和不同EV71基因型,但无法交叉中和CV[32,36]。
表3:Ad-EVVLP保护hSCARB2-Tg小鼠免于CVA16攻毒。
*以PBS、3×107pfu Ad-LacZ、3×107pfu Ad-EVVLP、或1μg FI-EV71疫苗,分别于出生后第1天及第7天(攻毒前)对hSCARB2-Tg小鼠进行皮下预接种两次,攻毒系以5×105或3×106pfu CVA16皮下方式攻毒。*每组全部数量之试验小鼠中存活的小鼠数量,如表所示,并计算其存活率。
3.讨论
于先前研究中,EV71次单位疫苗包括DNA疫苗及重组VP1蛋白,可诱发不完全之免疫反应,且效力较低[19,37]。口服疫苗,像是该等可表现EV71 VP1之抗弱化之肠道沙门氏菌,证明对抗EV71仅具有限之效力,攻毒后仅能提高存活率至50%[38]。可表现VP1之转殖基因西红柿[39]及胜肽疫苗[40]亦被开发出来,但疫苗效力尚未于活体内被评估过。一个含有福尔马林之变性的病毒颗粒作为疫苗(FI-EV71),系于hSCARB2-Tg小鼠模式[16]、及人体临床试验[32]中被测试,其中证实了其之安全及保护效力。于一个发展流感VLP作为疫苗之先前研究显示,破坏流感VLP结构会阻断体液免疫反应及保护免疫力[41]。此外,变性之EV71颗粒具有线性的抗原决定基,可诱发抗EV71抗体;然而,其中大多数可能是不能被中和的,此与脊髓灰质炎病毒之案例相似[42]。丧失诱发有效中和抗体能力,可能与不活化过程中丧失之抗原决定基,像是藉由福尔马林变性之EV71颗粒有关。以昆虫细胞表现之VLP,于猴子中所诱发之中和抗体力价甚至更低,增生更低、及细胞激素生成也减少[35]。此可能是因为于非人类细胞中之VLP蛋白的不同后转译修饰,而导致不同之免疫反应。相对的,从宿主细胞所生成之完整VLP,保留了构型依存之抗原决定基,其可能促使VLPs可与B细胞受体进行直接交互作用,进而活化B细胞及透过抗原呈现细胞进行抗原内化[43]。此可诱发有效之抗体反应[44]并与经刺激之CD4+T细胞合作,交互轮替进行[45]。再者,最近的研究显示中和抗体,特定而言是该等对抗EV71壳体蛋白之中和抗体,无法交叉保护CV感染[36,46],指出该疫苗目前发展仅能提供保护力对抗EV71所诱发之HFMD。
于本研究中,吾人评估可表现EV71 VLP之腺病毒作为疫苗以对抗EV71及CVA16感染之可能性,评估方式藉由比较Ad-EVVLP及经由福尔马林不活化制备之经典的EV71疫苗所诱发之效力及免疫反应。以Ad-LacZ免疫无法诱发EV71专一抗体力价,且仅有少量之T细胞反应,相较于Ad-EVVLP及FI-EV71疫苗,该两者可高效诱发抗EV71抗体力价(图3,表1)。由Ad-EVVLP诱发之抗体存在交叉反应性,以对抗临床分离之EV71C2及B4基因型(图3)。除了抗VLP抗体外,该Ad-EVVLP疫苗可诱发抗3C抗体(图7)。然而,吾人于免疫Ad-EVVLP-及FI-EV71-之小鼠血清中,无法观察到有可对抗CVA16之中和活性(表1)。因为3C蛋白可能没有表现,或表现于EV71或CV之内壳体中,此可能可解释为何抗3C抗体无法结合至3C蛋白。
先前研究显示,已存在之抗腺病毒抗体不会影响接续之体液反应之产生,该体液反应系由一透过黏膜施予之重组的腺病毒载体之抗原所诱发[47-49]。然而,口服免疫Ad-EVVLP所诱发之免疫反应,较以系统性Ad-EVVLP免疫方式(皮下或腹腔;图3及表1)之小鼠的免疫反应为低。吾人之结果显示于疫苗首免动物中之血清中存在着低抗Ad抗体(图12),但不会因为口服、皮下或腹腔施予第二剂之Ad-EVVLP而影响小鼠血清中之二级VLP专一抗体。Ad-EVVLP之实际免疫效力仍需要于临床试验中被评估。
除了体液反应外,源自其它病毒之VLPs已有报告指出可诱发树突细胞(DC)成熟,及细胞激素之分泌[16,17],且可刺激CD4+[18]及CD8+T细胞[19,20]。Ad为一个很强的DC活化子,其可进行酵素反应,并呈现与MHC第I型及第II型分子关连之抗原胜肽于表面上,以及接续地协调及刺激辅助T细胞及细胞毒杀性T细胞反应[50]。Ad-EVVLP免疫可诱发壳体蛋白专一之细胞的免疫反应,此点可由EV71 VLP诱发之CD4+及CD8+T细胞活化(图5),及细胞激素的产生(图4)证实。相较于FI-EV71疫苗免疫,其活化了Th2-调控之反应[16],与IL-4及IL-13之分泌有关(图4),及经由Ad-EVVLP免疫之脾细胞所产生之高量之IFN-·、IL-4及IL-13(图4),此显示混和的Th1/Th2免疫反应可加强活化影响者之细胞反应及抗体生成。该等结果与流感病毒之VLP[21]及人类乳突病毒[51]所诱发之Th1/Th2免疫反应一致。相反地,于FI-EV71免疫小鼠中,无法观察到该VLP所相应之CD4+及CD8+T细胞活化现象(图5),指出FI-EV71疫苗之VLP的抗原决定基之抗原性,可能经福尔马林不活化后,从原本型态之EV71 VLP被改变了。然而,结构分析显示FI-EV71与感染性之EV71病毒颗粒并无不同[13],且免疫原性研究已揭示经福尔马林不活化之EV71之F及E颗粒,可诱发中和抗体,即便于小鼠中F颗粒较E颗粒更具效力[31]。因此,相较于FI-EV71疫苗之VLP,Ad-EVVLP表现之VLP之抗原性,于将来会针对细胞反应之活化进一步研究。
于Ad-EVVLP-,但非FI-EV71疫苗免疫小鼠中,可观察到(图7)对应于重组3C蛋白所产生之CD4+及CD8+T细胞调控之细胞反应。吾人证明Ad-EVVLP免疫,可完全保护hSCARB2-Tg小鼠以对抗EV71(图6)及CVA16攻毒(图8及表3)。该等结果显示透过Ad-EVVLP可提供保护对抗EV71感染,其中系藉由诱发EV71 VLP专一中和抗体,以及VLP及3C专一细胞免疫调控。于儿童及婴儿之较低的中和抗体力价及伴随之高传染率,可见中和抗体对于预防EV71感染是很重要的[52,53]。吾人研究亦证实hSCARB2-Tg小鼠之EV71攻毒,再以VP1专一单株抗体治疗,可预防EV71诱发之病状[46]。然而,自发病第1天起,于80%之含有中和抗体之EV71感染的病患血清中,其抗体力价与疾病严重程度不具关联性[54]。相反的,细胞免疫反应与疾病进展及临床病状有关连[33,55]。于EV71病患中,降低的细胞免疫力与增加的疾病严重度系有关连的,然而中和抗体于该等轻度及重度病例中并无区别[34]。该等研究显示细胞免疫力可能对于提供保护力以对抗肠病毒感染十分重要。吾人结果显示,由Ad-EVVLP诱发之3C专一细胞免疫力,可能足以保护以对抗CVA16感染(图8及表3),即便Ad-EVVLP无法诱发CVA16-VLP专一之中和抗体(表1)。因此,吾人构筑仅可表现3CD基因之Ad-3CD,并将之免疫hSCARB2-Tg小鼠,接着以EV71或CVA16攻毒。该结果显示Ad-3CD可完全保护动物免于EV71及CVA16攻毒(图13)。意即3CD专一细胞免疫力足以提供保护力以对抗EV71及CVA16感染。
总结,透过无法复制之腺病毒于宿主细胞表现VLP,以模拟EV71颗粒之天然的结构,以诱发对抗VLP及3C蛋白之抗体,以及诱发专一于VLP及3C蛋白之细胞免疫力。由于3C蛋白于EV71及CVA间高度保守(表2),吾人证明了Ad-EVVLP可作为一多价疫苗以抑制EV71及CVA16诱发的疾病。吾人于发展一医药所需之肠病毒疫苗上,达到众多突破性结果。首先,与EV71疫苗次单位、不活化EV71疫苗、或蛋白型VLPs仅能保护EV71诱发之HFMD有所不同,Ad-EVVLP可预防EV71及CVA所诱发之HFMD。再者,诱发3C专一之细胞免疫力,可能足以保护对抗CVA感染。
序列信息
EV71 P1(SEQ ID NO:1)
·P1(862 A.A)
·MGSQVSTQRSGSHENSNSATEGSTINYTTINYYKDSYAATAGKQSLKQDPDKFANPVKDIFTEMAAPLKSPSAEACGYSDRVAQLTIGNSTITTQEAANIIVGYGEWPSYCSDSDATAVDKPTRPDVSVNRFYTLDTKLWEKSSKGWYWKFPDVLTETGVFGQNAQFHYLYRSGFCIHVQCNASKFHQGALLVAVLPEYVIGTVAGGTGTEDSHPPYKQTQPGADGFELQHPYVLDAGIPISQLTVCPHQWINLRTNNCATIIVPYINALPFDSALNHCNFGLLVVPISPLDYDQGATPVIPITITLAPMCFEFAGFRQAVTQGFPTELKPGTNQFLTTDDGVSAPILPNFHPTPCIHIPGEVRNLLELCQVETILEVNNVPTNATSLMERLRFPVSAQAGKGELCAVFRADPGRSGPWQSTLLGQLCGYYTQWSGSLEVTFMFTGSFMATGKMLIAYTPPGGPLPKDRATAMLGTDVIWDFGLQSSVTLVIPWISNTHYRAHARDGVFDYYTTGLVSIWYQTNYVVPIGAPNTAYIIALAAAQKNFTMKLCKDASDILQTGTIQGDRVADVIESSIGDSVSRALTRALPAPTGQDTQVSSHRLDTGKGPALQAAEIGASSNASDESMIETRCVLNSHSTAETTLDSFFSRAGLVGEIDLPLEGTTNPNGYANWDIDITGYAQMRRKVELFTYMRFNAEITFVACTPTGEVVPQLLQYMFVPPGAPKPDSRESLAWQTATNPSVFVKLSDPPAQVSVPFMSPASAYQWFYDGYPTFGEHKQEKDLEYGACPNNMMGTFSVRTVGTSKSKCPLVIRIYMRMKHVRAWIPRPMRNQNYLFKANPNYAGNSIKPTGASRTAITTL
EV71 3CD(SEQ ID NO:2)
GPSLDFALSLLRRNIRQVQTDQGHFTMLGVRDHLAVLPRHSQPGKTIWVEHKLVKIVDAVELVDEQGVNLELTLITLDTNEKFRDITRFIPETINPASDATLVINTEHMPSMFVPVGDVVQYGFLNLSGKPTHRTMMYNFPTKAGQCGGVVTAVGKVIGIHIGGNGRQGFCAALKRGYFCSEQGEIQWMKSNKETGRLNINGPTRTKLEPSVFHDVFEGTKEPAVLTSKDPRLEVDFEQALFSKYVGNTLHEPDEFVKEAALHYANQLKQLDIKTTKMSMEDACYGTENLEAIDLHTSAGYPYSALGIKKKDILDPTTRDVSRMKFYMDKYGLDLPYSTYVKDELRAIDKIKKGKSRLIEASSLNDSVYLRMTFGHLYEAFHANPGTVTGSAVGCNPDVFWSKLPILLPGSLFAFDYSGYDASLSPVWFRALEIVLREIGYSEDAVSLIEGINHTHHVYRNKTYCVLGGMPSGCSGTSIFNSMINNIIIRTLLIKTFKGIDLDELNMVAYGDDVLASYPFPIDCLELARTGKEYGLTMTPADKSPCFNEVTWENATFLKRGFLPDHQFPFLIHPTMPMREIHESIRWTKDARNTQDHVRSLCLLAWHNGKEEYEKFVSTIRSVPIGKALAIPNFENLRRNWLELF
EV71 3C(SEQ ID NO:5)
GPSLDFALSLLRRNIRQVQTDQGHFTMLGVRDRLAVLPRHSQPGKTIWVEHKLVKIVDAVELVDEQGVNLELTLVTLDTNEKFRDITRFIPETISPASDATLVINTEHMPSMFVPVGDVVQYGFLNLSGKPTHRTMMYNFPTKAGQCGGVVTAVGKVIGIHIGGNGRQGFCAALKRGYFCSEQ
EV71 3D(SEQ ID NO:6)
GEIQWMKPNKETGRLNINGPTRTKLEPSVFHDVFEGTKEPAVLTSKDPRLEVDFEQALFSKYVGNTLHEPDEFVKEAALHYANQLKQLDIKTTKMSMEDACYGTENLEAIDLHTSAGYPYSALGIKKKDILDPTTRDVSKMKFYMDKYGLDLPYSTYVKDELRAIDKIKKGKSRLIEASSLNDSVYLRMTFGHLYEAFHANPGTITGSAVGCNPDVFWSKLPILLSGSLFAFDYSGYDASLSPVWFRALEIVLREIGYSEDAVSLIEGINHTHHVYRNKTYCVLGGMPSGCSGTSIFNSMINNIIIRTLLIKTFKGIDLNELNMVAYGDDVLASYPFPIDCLELARTGKEYGLTMTPADKSPCFNEVTW
ENATFLKRGFLPDYQFPFLIHPTMPMREIHESIRWTKDARSTQDHVRSLCLLAWLNGKEE YEKFVSAIRSVPIGKALAIPNYENLRRNWLELF
参考文献:
1.Ho M,Chen ER,Hsu KH,Twu SJ,Chen KT,Tsai SF,et al.An epidemic of enterovirus71 infection in Taiwan.Taiwan Enterovirus Epidemic Working Group.N Engl J Med.1999;341:929-935.
2.Wang SM,Liu CC,Tseng HW,Wang JR,Huang CC,Chen YJ,et al.Clinical spectrum of enterovirus 71 infection in children in southern Taiwan,with an emphasis on neurological complications.Clin Infect Dis.1999;29:184-190.
3.Liu CC,Tseng HW,Wang SM,Wang JR,Su IJ.An outbreak of enterovirus 71 infection in Taiwan,1998:epidemiologic and clinical manifestations.J Clin Virol.2000;17:23-30.
4.Perez-Velez CM,Anderson MS,Robinson CC,McFarland EJ,Nix WA,Pallansch MA,et al.Outbreak of neurologic enterovirus type 71 disease:a diagnostic challenge.Clin Infect Dis.2007;45:950-957.
5.Huang CC,Liu CC,Chang YC,Chen CY,Wang ST,Yeh TF.Neurologic complications in children with enterovirus 71 infection.N Engl J Med.1999;341:936-942.
6.AbuBakar S,Chee HY,Al-Kobaisi MF,Xiaoshan J,Chua KB,Lam SK.Identification of enterovirus 71 isolates from an outbreak of hand,foot and mouth disease(HFMD)with fatal cases of encephalomyelitis in Malaysia.Virus Res.1999;61:1-9.
7.Lin KH,Hwang KP,Ke GM,Wang CF,Ke LY,Hsu YT,et al.Evolution of EV71genogroup in Taiwan from 1998 to 2005:an emerging of subgenogroup C4 of EV71.J Med Virol.2006;78:254-262.
8.Lu CH,Huang SW,Lai YL,Lin CP,Shih CH,Huang CC,et al.On the relationship between the protein structure and protein dynamics.Proteins.2008;72:625-634.
9.Melnick JL,Schmidt NJ,Mirkovic RR,Chumakov MP,Lavrova IK,Voroshilova MK.Identification of Bulgarian strain 258 of enterovirus 71.Intervirology.1980;12:297-302.
10.Nagy G,Takatsy S,Kukan E,Mihaly I,Domok I.Virological diagnosis of enterovirus type 71 infections:experiences gained during an epidemic of acute CNS diseases in Hungary in 1978.Arch Virol.1982;71:217-227.
11.Wu TN,Tsai SF,Li SF,Lee TF,Huang TM,Wang ML,et al.Sentinel surveillance for enterovirus 71,Taiwan,1998.Emerg Infect Dis.1999;5:458-460.
12.McMinn PC.An overview of the evolution of enterovirus 71 and its clinical and public health significance.FEMS Microbiol Rev.2002;26:91-107.
13.Wang X,Peng W,Ren J,Hu Z,Xu J,Lou Z,et al.A sensor-adaptor mechanism for enterovirus uncoating from structures of EV71.Nat Struct Mol Biol.2012;19:424-429.
14.Yamayoshi S,Yamashita Y,Li J,Hanagata N,Minowa T,Takemura T,et al.Scavenger receptor B2 is a cellular receptor for enterovirus 71.Nat Med.2009;15:798-801.
15.Nishimura Y,Shimojima M,Tano Y,Miyamura T,Wakita T,Shimizu H.Human P-selectin glycoprotein ligand-1 is a functional receptor for enterovirus 71.Nat Med.2009;15:794-797.
16.Lin YW,Yu SL,Shao HY,Lin HY,Liu CC,Hsiao KN,et al.Human SCARB2 transgenic mice as an infectious animal model for enterovirus 71.PLoS One.2013;8:e57591.
17.Fujii K,Nagata N,Sato Y,Ong KC,Wong KT,Yamayoshi S,et al.Transgenic mouse model for the study of enterovirus 71 neuropathogenesis.Proc Natl Acad Sci U S A.2013;110:14753-14758.
18.Chang JY,Chang CP,Tsai HH,Lee CD,Lian WC,Ih Jen S,et al.Selection and characterization of vaccine strain for Enterovirus 71 vaccine development.Vaccine.30:703-711.
19.Wu CN,Lin YC,Fann C,Liao NS,Shih SR,Ho MS.Protection against lethal enterovirus71 infection in newborn mice by passive immunization with subunit VP1 vaccines and inactivated virus.Vaccine.2001;20:895-904.
20.Chung YC,Ho MS,Wu JC,Chen WJ,Huang JH,Chou ST,et al.Immunization with virus-like particles of enterovirus 71 elicits potent immune responses and protects mice against lethal challenge.Vaccine.2008;26:1855-1862.
21.Wang YF,Chou CT,Lei HY,Liu CC,Wang SM,Yan JJ,et al.A mouse-adapted enterovirus 71 strain causes neurological disease in mice after oral infection.J Virol.2004;78:7916-7924.
22.Khong WX,Yan B,Yeo H,Tan EL,Lee JJ,Ng JK,et al.A non mouse-adapted Enterovirus 71(EV71)strain exhibits neurotropism causing neurological manifestations in a novel mouse model of EV71 infection.J Virol.2012.
23.Wu SC,Liu CC,Lian WC.Optimization of microcarrier cell culture process for the inactivated enterovirus type 71 vaccine development.Vaccine.2004;22:3858-3864.
24.Liu CC,Lian WC,Butler M,Wu SC.High immunogenic enterovirus 71 strain and its production using serum-free microcarrier Vero cell culture.Vaccine.2007;25:19-24.
25.Lin YW,Lin HY,Tsou YL,Chitra E,Hsiao KN,Shao HY,et al.Human SCARB2-mediated entry and endocytosis of EV71.PLoS One.2012;7:e30507.
26.Liu CC,Chou AH,Lien SP,Lin HY,Liu SJ,Chang JY,et al.Identification and characterization of a cross-neutralization epitope of Enterovirus 71.Vaccine.2011;29:4362-4372.
27.Mizuguchi H,Kay MA.Efficient construction of a recombinant adenovirus vector by an improved in vitro ligation method.Hum Gene Ther.1998;9:2577-2583.
28.Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical biochemistry.1976;72:248-254.
29.Reed LJ MH.A simple method of estimating 50 percent end-points.Am J Hyg.1938;27:493-497.
30.Fundamental Virology.Fourth Edition ed.:Lippincott Williams and Wilkins;2001.
31.Liu CC,Guo MS,Lin FH,Hsiao KN,Chang KH,Chou AH,et al.Purification and characterization of enterovirus 71 viral particles produced from vero cells grown in a serum-free microcarrier bioreactor system.PLoS One.2011;6:e20005.
32.Liu CC,Chow YH,Chong P,Klein M.Prospect and challenges for the development of multivalent vaccines against hand,foot and mouth diseases.Vaccine.2014 DOI:10.1016/j.vaccine.2014.08.064.
33.Yang KD,Yang MY,Li CC,Lin SF,Chong MC,Wang CL,et al.Altered cellular but not humoral reactions in children with complicated enterovirus 71 infections in Taiwan.J Infect Dis.2001;183:850-856.
34.Chang LY,Hsiung CA,Lu CY,Lin TY,Huang FY,Lai YH,et al.Status of cellular rather than humoral immunity is correlated with clinical outcome of enterovirus 71.Pediatric research.2006;60:466-471.
35.Lin YL,Yu CI,Hu YC,Tsai TJ,Kuo YC,Chi WK,et al.Enterovirus type 71 neutralizing antibodies in the serum of macaque monkeys immunized with EV71 virus-like particles.Vaccine.2012;30:1305-1312.
36.Chou AH,Liu CC,Chang JY,Jiang R,Hsieh YC,Tsao A,et al.Formalin-Inactivated EV71 Vaccine Candidate Induced Cross-Neutralizing Antibody against Subgenotypes B1,B4,B5 and C4A in Adult Volunteers.PLoS One.2013;8:e79783.
37.Lee MS,Chang LY.Development of enterovirus 71 vaccines.Expert Rev Vaccines.2010;9:149-156.
38.Chiu CH,Chu C,He CC,Lin TY.Protection of neonatal mice from lethal enterovirus 71infection by maternal immunization with attenuated Salmonella enterica serovar Typhimurium expressing VP1 of enterovirus 71.Microbes and infection/Institut Pasteur.2006;8:1671-1678.
39.Chen HF,Chang MH,Chiang BL,Jeng ST.Oral immunization of mice using transgenic tomato fruit expressing VP1 protein from enterovirus 71.Vaccine.2006;24:2944-2951.
40.Foo DG,Alonso S,Phoon MC,Ramachandran NP,Chow VT,Poh CL.Identification of neutralizing linear epitopes from the VP1 capsid protein of Enterovirus 71 using synthetic peptides.Virus Res.2007;125:61-68.
41.Quan FS,Huang C,Compans RW,Kang SM.Virus-like particle vaccine induces protective immunity against homologous and heterologous strains of influenza virus.J Virol.2007;81:3514-3524.
42.Muir P,Kammerer U,Korn K,Mulders MN,Poyry T,Weissbrich B,et al.Molecular typing of enteroviruses:current status and future requirements.The European Union Concerted Action on Virus Meningitis and Encephalitis.Clinical microbiology reviews.1998;11:202-227.
43.Denis J,Majeau N,Acosta-Ramirez E,Savard C,Bedard MC,Simard S,et al.Immunogenicity of papaya mosaic virus-like particles fused to a hepatitis C virus epitope:evidence for the critical function of multimerization.Virology.2007;363:59-68.
44.Zinkernagel RM.On natural and artificial vaccinations.Annual review of immunology.2003;21:515-546.
45.Gamvrellis A,Leong D,Hanley JC,Xiang SD,Mottram P,Plebanski M.Vaccines that facilitate antigen entry into dendritic cells.Immunology and cell biology.2004;82:506-516.
46.Chang HW,Lin YW,Ho HM,Lin MH,Liu CC,Shao HY,et al.Protective efficacy of VP1-specific neutralizing antibody associated with a reduction of viral load and pro-inflammatory cytokines in human SCARB2-transgenic mice.PLoS One.2013;8:e69858.
47.Xiang ZQ,Gao GP,Reyes-Sandoval A,Li Y,Wilson JM,Ertl HC.Oral vaccination of mice with adenoviral vectors is not impaired by preexisting immunity to the vaccine carrier.J Virol.2003;77:10780-10789.
48.McCoy K,Tatsis N,Korioth-Schmitz B,Lasaro MO,Hensley SE,Lin SW,et al.Effect of preexisting immunity to adenovirus human serotype 5 antigens on the immune responses of nonhuman primates to vaccine regimens based on human-or chimpanzee-derived adenovirus vectors.J Virol.2007;81:6594-6604.
49.Shao HY,Yu SL,Sia C,Chen Y,Chitra E,Chen IH,et al.Immunogenic properties of RSV-B1 fusion(F)protein gene-encoding recombinant adenoviruses.Vaccine.2009 DOI:S0264-410X(09)00992-X[pii]
10.1016/j.vaccine.2009.07.004.
50.Barouch DH,Nabel GJ.Adenovirus vector-based vaccines for human immunodeficiency virus type 1.Human gene therapy.2005;16:149-156.
51.Evans TG,Bonnez W,Rose RC,Koenig S,Demeter L,Suzich JA,et al.A Phase 1 study of a recombinant viruslike particle vaccine against human papillomavirus type 11 in healthy adult volunteers.J Infect Dis.2001;183:1485-1493.
52.Chang LY,King CC,Hsu KH,Ning HC,Tsao KC,Li CC,et al.Risk factors of enterovirus 71 infection and associated hand,foot,and mouth disease/herpangina in children during an epidemic in Taiwan.Pediatrics.2002;109:e88.
53.Chang LY,Tsao KC,Hsia SH,Shih SR,Huang CG,Chan WK,et al.Transmission and clinical features of enterovirus 71 infections in household contacts in Taiwan.JAMA.2004;291:222-227.
54.Yang C,Deng C,Wan J,Zhu L,Leng Q.Neutralizing antibody response in the patients with hand,foot and mouth disease to enterovirus 71 and its clinical implications.Virol J.2011;8:306.
55.Chang LY,Chang IS,Chen WJ,Huang YC,Chen GW,Shih SR,et al.HLA-A33 is associated with susceptibility to enterovirus 71 infection.Pediatrics.2008;122:1271-1276.
- 还没有人留言评论。精彩留言会获得点赞!