用于给予抗原肽的组合物、方法和治疗与流程
本申请要求2014年6月23日提交的标题为“Compositions,Methods and Therapies for Administering Antigen Peptide”的美国专利申请系列No.14/312,162的优先权,而该申请要求2011年12月22日提交的标题为“Antigen Peptide and Use Thereof”的美国专利申请系列No.13/380,425、2011年5月23日提交的标题为“Antigen Peptide and Use Thereof”的PCT国际申请系列PCT/JP2011/062305以及2010年5月27日提交的标题为“Antigen Peptide and Use Thereof”的临时申请61/396,574的优先权。这些申请以引用方式并入本文。
技术领域
本发明总体而言涉及抗原肽以及它们对抗粉剌丙酸杆菌(Propionibacterium acne)的用途。本发明进一步包括抗原肽和抗肿瘤坏死因子(抗-TNF)的组合,以及它们对抗粉剌丙酸杆菌的用途。本发明还涉及用于治疗患有粉刺丙酸杆菌的患者的方法和治疗。更具体而言,本发明包括向患者给予治疗有效量的抗原肽和抗-TNF。
背景技术:
粉刺是一种已知的炎性疾病,其通常出现在患者的多个部分上,由人机肌体的颈部延伸至面部。通常,粉刺在青春期是最普遍的,但是已知粉刺也可以在成人期发现。由于是在人类机体上的多个暴露的且可视的部分上形成的炎症,所以粉刺可能对患有该疾病的人产生明显的心理影响。
已经研发出多种用于粉刺的治疗试剂。具体而言,已经研发了多种直接作用于作为粉刺病原体的粉刺丙酸杆菌的药品。
在本领域中,已经测定了粉刺丙酸杆菌的完整基因组序列,由此知晓粉刺丙酸杆菌的许多基因编码毒性因子。基于该信息,关于粉刺丙酸杆菌的唾液酸酶的研究已经在研发疫苗中进行。
肿瘤坏死因子(TNF)是一种在整个机体中循环的细胞因子。TNF对于有效的免疫监视而言是重要的,并且是自然杀伤细胞、T细胞、B细胞、巨噬细胞和树突状细胞的适当增殖和功能所必需的。TNF的主要作用是免疫细胞的调节。已知TNF可以导致系统性炎症,其可以导致多种慢性状况。抗-TNF(也称为TNF阻断剂或抑制剂)干扰TNF的机体生产,由此有效地减少炎症。
研发用于治疗粉刺丙酸杆菌的大部分药品作用于作为粉刺病因的粉刺丙酸杆菌细菌细胞,并发挥抗炎作用。因此,在其中再次感染粉刺丙酸杆菌的情况下,会再次发生炎症。因此,使用此类药品是暂时有效的,但是它们的使用会诱导抗药细菌的出现,这使得治疗更加困难。
本领域需要研发对抗粉刺丙酸杆菌的抗原肽,以及给予抗原肽以消退、减少或消除患者中粉刺丙酸杆菌的治疗和方法,更具体而言,需要能够持续治疗粉刺的治疗和方法。理想的是给予的治疗和方法在合理的时间内是有效的。粉刺的持续治疗包括免疫治疗,即疫苗。不想被任何特定的理论所束缚,相信建立有效的抗粉刺免疫力(特定的粉刺丙酸杆菌的识别和免疫记忆)可以立即消除粉刺丙酸杆菌,至少是被相同的粉刺丙酸杆菌菌株的再次感染。因此,合理地希望免疫治疗可以发挥持续的抗炎作用。
根据本发明,已经发现由氨基酸序列构成的肽和抗-TNF可以高效地抑制粉刺丙酸杆菌在患者中引起的炎症。
发明概述
在一个方面中,本发明通过提供包含肽和抗-TNF的组合物而解决上述需要。所述的肽包含以下一种或多种:(a)由SEQ NO.1所示的氨基酸序列构成的肽;(b)由SEQ NO.1所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽;(c)由SEQ NO.3所示的氨基酸序列构成的肽;以及(d)由SEQ NO.3所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽。
在所述的组合物中存在的肽可以包括:(e)多价抗原肽形式的肽,其中所述的多价抗原肽是通过将上述(a)或(b)中所述的多个肽通过连接子结合而获得的,以及(f)多价抗原肽形式的肽,其中所述的多价抗原肽是通过将上述(c)或(d)中所述的多个肽通过连接子结合而获得的。
在另一个方面中,本发明提供了抑制患者中由粉刺丙酸杆菌感染引起的炎症的方法。所述的方法包括将肽和抗-TNF引入至患者中。所述的肽包括以下中的一种或多种:(a)由SEQ NO.1所示的氨基酸序列构成的肽;(b)由SEQ NO.1所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽;(c)由SEQ NO.3所示的氨基酸序列构成的肽;以及(d)由SEQ NO.3所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽。
在某些实施方案中,所述的肽和抗-TNF同时被引入至患者中。所述的肽和抗-TNF可以结合从而形成组合物,并且该组合物可以被引入至患者中。在其他的实施方案中,所述的肽和抗-TNF可以分别被引入至患者中。所述的肽和抗-TNF可以依次被引入至患者中。所述的肽或抗-TNF的任意一者可以被引入至患者中,然后引入另外一者。
在另一个方面中,本发明提供对抗分泌丙酸杆菌的疫苗,包括上文所述的肽和抗-TNF。
在另一个方面中,本发明提供编码上文所述的肽的多核苷酸。
在另一个方面中,本发明提供上文所述的多核苷酸可操作地连接的表达载体。本发明的表达载体的应用能够提供肽,该肽可以抑制由粉刺丙酸杆菌感染引起的炎症。
在另一个方面中,本发明提供特异性地识别上文所述的肽的抗体。
在另一个方面中,本发明提供了用于测定疫苗对抗粉刺丙酸杆菌的效力的方法。所述的方法包括检测编码上文所述的肽的多核苷酸是否存在于由活机体收集得到的样品中的步骤。本发明的方法的用途能够容易地在将该疫苗给予活机体之前测定对抗粉刺丙酸杆菌的疫苗在活机体中是否有效。
在另一个方面中,本发明提供用于治疗或预防由粉刺丙酸杆菌引起的炎症的方法,其包括将上文所述的疫苗给予个体的步骤,其中所述的疫苗包含治疗有效量的所述的肽和抗-TNF。
在另一个方面中,本发明提供用于治疗或预防由粉刺丙酸杆菌引起的炎症的方法,其包括将上文所述的疫苗给予个体的步骤,其中所述的疫苗包含治疗有效量的多核苷酸和抗-TNF。
附图简述
当与附图相结合进行阅读时,可以由以下优选的实施方案的描述进一步理解本发明,其中:
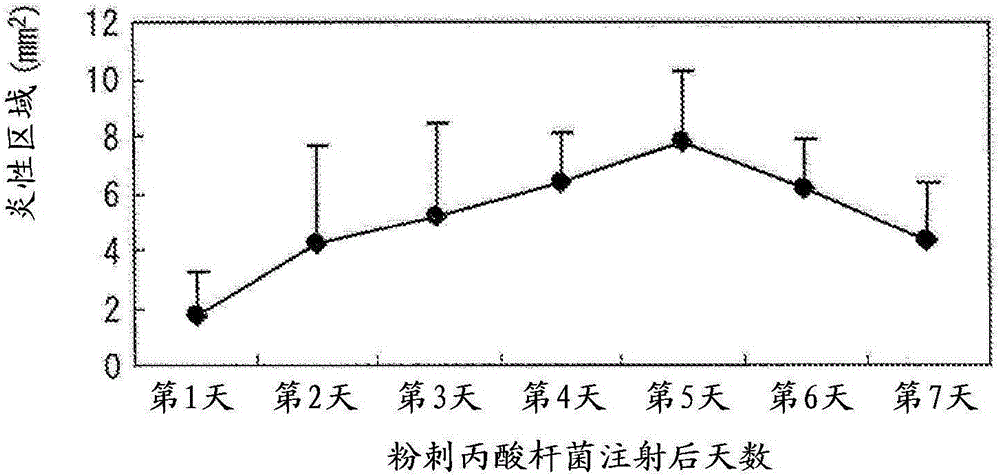
图1为显示测量炎性区域的结果的图,其中所述的炎性区域是通过将粉刺丙酸杆菌注射至各个部分中引起的;
图2为显示在由注射粉刺丙酸杆菌引起的炎性区域与注射后流逝的时间之间的关系的图;
图3为示出检测肽的抗炎作用的步骤的图;
图4为显示检测肽的抗炎作用的结果的图;
图5为显示检测肽的抗炎作用的另一个结果的图;
图6为比较由患者分离的菌株的16S rDNA碱基序列与标准菌株的16S rDNA碱基序列的图;
图7为显示检测肽对抗由患者分离的粉刺丙酸杆菌的注射物的抗炎作用的结果的图;
图8为显示使用根据本发明的某些实施方案的疫苗接种的粉刺患者后续情况的照片的图;
图9为显示使用根据本发明的某些实施方案的疫苗接种的另一位粉刺患者后续情况的照片的图;
图10为显示使用根据本发明的某些实施方案的疫苗接种的另一位粉刺患者后续情况的照片的图;以及
图11为显示使用根据本发明的某些实施方案的疫苗接种的另一位粉刺患者后续情况的照片的图。
序列表
使用标准的字母缩写显示在所附序列表中列出的氨基酸序列,并且该序列表以引用方式并入本文。
发明详述
本发明提供了针对患者的粉刺丙酸杆菌以及由其导致的炎症的组合物、方法和治疗。所述的组合物、方法和治疗包括抗原肽的使用。在某些实施方案中,抗原肽与抗-TNF组合给予。在抗-TNF存在或不存在下,所述的抗原肽能够引起对抗粉刺丙酸杆菌感染的免疫应答,并且减少或预防由粉刺丙酸杆菌引起的炎症。本发明的抗原肽具有极高的抗原性。因此,使用肽、同时具有抗-TNF或不具有抗-TNF都可以提供对抗粉刺丙酸杆菌的疫苗。
在某些实施方案中,使用肽并结合抗-TNF可以产生相对于减少或消除由粉刺丙酸杆菌导致的炎症而言增强的或改善的结果。根据本发明使用的抗-TNF可以是多种形式。例如抗-TNF可以被引入至传递机制中,例如液态载体或媒介物,从而促进引入(例如注射)。
根据本发明使用的抗-TNF可以包括多种合适的材料。非限定性实例包括可以证明抗-TNF作用或结果(例如减少由TNF产生的炎症)的任何材料。此外,根据本发明使用的合适的抗-TNF材料可以选自本领域已知的多种抗-TNF材料。在某些实施方案中,可以使用TNF抑制剂,包括融合蛋白质,包括但不限于依那西普。依那西普是市售可得的,商品名为Enbrel。
根据本发明使用的肽可以为以下肽(a)至(d)中的一种或多种:
(a)由SEQ NO.1所示的氨基酸序列构成的肽;
(b)由SEQ NO.1所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽,所述的肽通过免疫应答而生成抑制粉刺丙酸杆菌增加的抗体;
(c)由SEQ NO.3所示的氨基酸序列构成的肽;以及
(d)由SEQ NO.3所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽,所述的肽通过免疫应答而生成抑制粉刺丙酸杆菌增加的抗体。
在本发明中,“多个氨基酸”可以为例如2个或3个氨基酸,更优选地,为2个氨基酸。
在其中氨基酸被取代的实施方案中,优选的取代为一个氨基酸取代为与所述的一个氨基酸具有相同性质的另一个氨基酸,例如一个氨基酸取代为与所述的一个氨基酸具有相同侧链官能团的另一个氨基酸(例如Arg取代为Lys,Asp取代为Glu);以及一个疏水性氨基酸取代为另一个疏水性氨基酸(例如Val取代为Ile)。
本发明和权利要求书所用的术语“肽”与“多肽”或“蛋白质”可交换使用。
由SEQ NO.1所示的氨基酸序列构成的肽相当于粉刺丙酸杆菌的膜蛋白中从第90个氨基酸残基至第103个氨基酸残基的氨基酸残基,其中所述的粉刺丙酸杆菌的膜蛋白由Genbank/EMBL/DDBJ中以登录号No.AAT84059登记的氨基酸序列构成。由SEQ NO.3所示的氨基酸序列构成的肽相当于粉刺丙酸杆菌的膜蛋白中由第260个氨基酸残基至第272个氨基酸残基的氨基酸残基,其中所述的粉刺丙酸杆菌的膜蛋白由Genbank/EMBL/DDBJ中以登录号No.YP_056445登记的氨基酸序列构成。
通常,在抗体的生产中,作为优异的抗原的氨基酸序列为亲水性氨基酸序列和具有丰富电荷的氨基酸序列,还有预计具有转角结构的氨基酸序列。电荷可以是正电或负电,并且理想的是包括至少5个带电荷的氨基酸。此外,所选的氨基酸的长度优选地相当于10至15个残基。相应地选择SEQ NO.1或3所示的氨基酸序列。
这些肽诱导了对于粉刺丙酸杆菌(其为异型生物质的)的免疫力。推断在免疫力的诱导中,由于诱导了Th2为主的免疫力,因此诱导了特异性抗体的产生。
生产根据本发明的肽的方法可以使用化学合成或表达载体。在其中使用化学合成的实施方案中,本发明的肽可以通过公知的合成方法生产。非限定性实例包括但不限于液相肽合成和固相肽合成。在其中使用表达载体的实施方案中,肽可以由其中已引入表达载体的转化子生产,或者可以使用体外翻译系统生产。例如编码所述的肽的多核苷酸(例如包含SEQ NO.2或4所示的碱基序列的多核苷酸)被插入至表达载体中,并且该表达载体被引入至宿主细胞中。靶肽可以在宿主细胞中生产。本发明和权利要求书中所用的术语“转化子”不仅指细胞、组织和器官,还指活有机体本身。用于制备转化子的方法包括本领域公知的操作,例如通过将重组载体引入至宿主中的转化。待转化的活有机体的非限定性实例包括但不限于微生物、植物和动物。基因引入至宿主细胞中可以通过本领域公知的多种操作来证实,例如但不限于PCR、Southern杂交和Northern杂交。
在其中通过制备转化子来生产本发明的肽的实施方案中,优选的是所述的肽在宿主细胞中稳定地表达。但是,所述的肽可以在宿主细胞中短暂表达。由此生产的肽可以通过已知的方法纯化。用于纯化所述的肽的合适的方法的非限定性实例包括但不限于凝胶过滤层析、离子交换层析和亲和层析。
在另一个方面中,本发明的肽可以为多价抗原肽的形式(其还可以称为MAP:多重抗原肽),其是通过将下文所述的多种肽(a)或(b)通过连接子结合或者通过将下文所述的多种肽(c)或(d)通过连接子结合而获得的:
(a)由SEQ NO.1所示的氨基酸序列构成的肽;
(b)由SEQ NO.1所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽,所述的肽通过免疫应答而生成抑制粉刺丙酸杆菌增加的抗体;
(c)由SEQ NO.3所示的氨基酸序列构成的肽;以及
(d)由SEQ NO.3所示的氨基酸序列通过缺失、取代、插入或添加一个或多个氨基酸而衍生得到的氨基酸序列构成的肽,所述的肽通过免疫应答而生成抑制粉刺丙酸杆菌增加的抗体。
MAP是能够显示较高抗原性的肽,并且是通过以下方式获得的多价肽:将连接子添加至特定肽的C-末端,并通过连接子将该特定的肽与基于Lys构建的MAP结构(基质)结合。MAP可以通过传统的已知方法合成。在一个MAP分子中所包含的特定肽的数量没有特别限定,但是优选为5个或更多。在一个MAP分子中所包含的特定肽的数量的上限没有限定,因为就抗原性而言,这一数量优选为较大。在某些实施方案中,局限可能是由于合成技术,因此,可以生产特定肽的数量为15个分子或更少的MAP。
通常,Cys残基用作构成连接子的氨基酸,其中所述的连接子被添加至特定的肽中。但是,在根据本发明的某些实施方案的MAP形式的肽中,在特定肽与Cys残基之间使用包含Gly残基的连接子。具体而言,-GlyCys或-GlyGlyCys作为连接子被添加至特定肽的C-末端。例如-GlyCys被添加至由SEQ NO.1所示的氨基酸序列构成的肽的C-末端,而-GlyGlyCys被加入至由SEQ NO.3所示的氨基酸序列构成的肽的C-末端。由于在Cys残基与该特定肽的C-末端之间添加了Gly残基,所以该Cys残基具有旋转柔性,这样当该特定肽与MAP结构结合时,所述的肽不会遭受位阻,并且连接子处的Cys残基可以形成角,该角能够使得Cys残基接近于MAP反应性基团。本发明的MAP形式的肽中的连接子不限于所述的连接子,并且可以为由Cys残基构成的一般的连接子。
在另一个方面中,以肽组合物形式提供本发明的肽,其中所述的肽组合物包含肽(e)或(f),如下所示:
(e)多价抗原肽形式的肽,其中所述的多价抗原肽是通过将多个所述的肽(a)或(b)通过连接子结合而获得的;以及
(f)多价抗原肽形式的肽,其中所述的多价抗原肽是通过将多个所述的肽(c)或(d)通过连接子结合而获得的。
本文和权利要求书所用的术语“肽组合物”是指包含多种肽成分的物质。
各个肽成分可以以多种比例组合,从而形成肽组合物。各成分的比例没有特别限定,并且可以是例如1:1(重量比)。此外,为了确保较高的免疫原性,肽组合物优选地包含多价抗原肽形式的肽(其中所述的多价抗原肽是通过将多个由SEQ NO.1所示的氨基酸序列构成的肽通过连接子结合而获得),以及多价抗原肽形式的肽(其中所述的多价抗原肽是通过将多个由SEQ NO.3所示的氨基酸序列构成的肽通过连接子结合而获得)。
此外,本发明提供了编码肽(a)-(d)的多核苷酸。本发明的多核苷酸的非限定性实例包括但不限于由SEQ NO.2或4所示的碱基序列构成的多核苷酸。如本发明所用,术语“碱基序列”与“核酸序列”或“核苷酸序列”可互换使用,并且表示为脱氧核糖核苷酸序列(简写为A、G、C和T)。SEQ NO.2所示的碱基序列编码由SEQ NO.1所示的氨基酸序列构成的肽,SEQ NO.4所示的碱基序列编码由SEQ NO.3所示的氨基酸序列构成的肽。
本发明的多核苷酸可以为DNA或RNA形式。本领域的技术人员可以根据本发明的肽的氨基酸序列信息和编码所述肽的碱基序列信息容易地生成本发明的多核苷酸。具体而言,本发明的多核苷酸可以通过一般的DNA合成或PCR生产。
此外,本发明提供了包含编码所述的肽的多核苷酸的载体。当所述的载体用于所述肽的生产时,优选的是所述的载体为多核苷酸可操作地连接的表达载体。如本文和权利要求书中所用,短语“可操作地连接”是指编码靶肽的多核苷酸处于控制区域(例如启动子)的控制之下,并且能够在宿主细胞中表达所述的肽。用于使编码靶肽的多核苷酸与表达载体“可操作地连接”以便构建所需的载体的操作是本领域公知的。此外,将表达载体引入至宿主细胞中的技术也是本领域公知的。因此,本领域的技术人员可以容易地在宿主细胞中生产所需的肽。
本发明的肽和/或本发明的多核苷酸的使用能够诱导对粉刺丙酸杆菌的免疫力。此外,本发明的肽和/或多核苷酸组合抗-TNF能够诱导对粉刺丙酸杆菌的免疫力。换言之,本发明的肽和/或肽/抗-TNF组合、和/或本发明的多核苷酸和/或多核苷酸/抗-TNF组合可以起到对抗粉刺丙酸杆菌的疫苗的作用。因此,本发明的肽和/或肽/抗-TNF组合、和/或本发明的多核苷酸和/或多核苷酸/抗-TNF组合的使用能够抑制由于粉刺丙酸杆菌引起的真皮内炎症(例如粉刺和丘疹)。
本发明还包括对抗粉刺丙酸杆菌的疫苗,包括上文提及的肽和/或肽/抗-TNF组合、上文提及的肽组合和/或肽组合/抗-TNF组合、或者上文提及的多核苷酸和/或多核苷酸/抗-TNF组合作为有效成分。本发明所用的术语“疫苗”是指可用于免疫治疗(疫苗治疗)并诱导对本发明的肽具有特异性的免疫应答的疫苗。
本发明的疫苗可以以疫苗组合物的形式或疫苗试剂盒的形式提供。在本发明中,“包含有效成分的疫苗组合物”和“包含有效成分的疫苗试剂盒”通常称为“包含有效成分的疫苗”。“试剂盒”是指其中各成分被包含在不同的物质中、使得所述至少一种成分被包含在一种物质中而其余的成分包含在另一种物质中的形式。疫苗组合物和疫苗试剂盒在下文中详细描述。
通常,术语“疫苗组合物”是指“其中两种或多种成分作为整体存在、从而所述成分被认为是一种物质的疫苗物质”。本发明的疫苗的给予可以是例如肽或者肽和抗-NTF的单一给予,其中所述的肽由SEQ NO.1所示的氨基酸序列或者由SEQ NO.3所示的氨基酸序列构成,或者为这两种肽的混合物。在其中使用两种肽的混合物的实施方案中,即使粉刺丙酸杆菌的抗原蛋白质(该抗原蛋白质相当于两种肽中的一种)的氨基酸序列突变,并且所述一种肽的抗炎作用丧失,另一种肽仍可以赋予抗炎作用。此类组合物除了所述的肽和抗-TNF以外,可以包含其他的成分(例如药物可接受的支持物)。
通常,当所述的肽、抗-TNF和任何其他的成分没有组合成疫苗组合物时,各成分的组合不能视为一种组合物,但是可以被术语“试剂盒”所涵盖,并且可以以试剂盒的形式提供。这可以被本领域的普通技术人员容易地理解。
在某些实施方案中,本发明提供包含本发明的肽和/或肽和抗-TNF的疫苗组合物。在其他的实施方案中,疫苗组合物包含本发明的多核苷酸和/或多核苷酸和抗-TNF。所述的多核苷酸优选为能够表达由本发明的多核苷酸编码的肽的形式,并且更优选地以表达载体(其中本发明的多核苷酸与该表达载体可操作地连接)的形式提供。如上文所述,本发明的肽或本发明的多核苷酸在制备对抗粉刺丙酸杆菌的疫苗中被用作有效的疫苗成分。
本发明的疫苗可以用作对抗粉刺丙酸杆菌的预防性疫苗或治疗性疫苗。如本文和权利要求书中所用,术语“预防性疫苗”是指给予未感染的且未治疗的个体以预防该个体免于被疾病感染的疫苗。如本文和权利要求书所用,术语“治疗性疫苗”是指给予已经感染疾病的个体以改善感染或使得感染尽可能小或消除疾病的免疫病理学作用的疫苗。
用于制备包含有效成分的疫苗的多种常规方法是本领域的技术人员公知的,并且可以用于制备根据本发明的疫苗。所述的疫苗可以以溶液或悬液形式制备,使得它们可以注射至患者中。备选地,本发明的疫苗可以以合适的固体形式制备,从而在注射至患者中之前溶解或悬浮在溶液中。此类制备物可以乳化,或者可以为在核糖体中乳化的蛋白质。
本发明的疫苗组合物的有效成分(多种)可以与药物可接受的并且与有效成分相容的稀释剂混合。稀释剂的优选的实例包括水、生理盐水、右旋糖、甘油、乙醇和它们的混合物。此外,如果需要,本发明的疫苗组合物可以包括少量的辅助物质,例如润湿剂或乳化剂、以及pH缓冲剂。
本发明的疫苗组合物可以通过注射(包括真皮内、皮下和肌肉内注射)以多种途径(例如鼻腔、粘膜、口服、阴道内、尿道和眼内)给予,或者可以使用贴剂(皮内给予)或栓剂等非口服给予。
本发明的疫苗组合物可以口服给予。就口服给予而言,本发明的疫苗组合物可以与稀释剂组合使用,例如医药级甘露醇,乳糖,淀粉,硬脂酸镁,糖酸钠,纤维素和碳酸镁。本发明的疫苗组合物在口服给予时,可以为溶液、悬液、片剂、药丸、胶囊、持释配制物或散剂的形式。在其中本发明的疫苗组合物以冻干形式提供的实施方案中,冻干物质在给予之前可以再构建成悬液。再构建优选在缓冲溶液中实施。
本发明的疫苗组合物可以包含用于增强疫苗的效力的佐剂。有效的佐剂的实例包括但不限于氢氧化铝,磷酸铝,硫酸铝钾(明矾),硫酸铍,硅石,高岭土,碳,油包水型乳液,水包油型乳液,胞壁酰二肽,细菌内毒素,脂肪X,百日咳博德特氏菌(Bordetella pertussis),短小棒状杆菌(Corynebacterium parvum),多聚核糖核苷酸,海藻酸钠,羊毛脂,溶血卵磷脂,维生素A,sponin,脂质体,左旋咪唑,DEAE-葡聚糖,嵌段共聚物和其他合成佐剂。这些佐剂可以购自多个供应商。这些佐剂的代表性实例包括水包油类型的佐剂、氢氧化铝佐剂和与这些佐剂混合的佐剂。允许施加至人类的佐剂为氢氧化铝。
在另一个方面中,本发明提供了疫苗试剂盒。疫苗试剂盒相当于上文提及的疫苗组合物,并且可以包含本发明的肽或本发明的多核苷酸作为有效疫苗成分,并且可以包含抗-TNF,而且可以进一步包含一种或多种可任选的成分。
在某些实施方案中,本发明的疫苗试剂盒包含本发明的肽和/或肽和抗-TNF。在另一个实施方案中,本发明的疫苗试剂盒包含本发明的多核苷酸和/或多核苷酸和抗-TNF。本发明的多核苷酸优选为能够表达由本发明的多核苷酸编码的肽的形式,并且更优选为以表达载体的形式提供,其中本发明的多核苷酸与所述的表达载体可操作地连接。
所述的试剂盒通常包含具有一个或多个容器(例如瓶子、板、管和盘)的包装,其中所述的容器中具有特定的材料。所述的试剂盒优选地具有使用包含在构成该试剂盒的各个容器任何一个中的各材料的使用说明。此外,本发明的试剂盒可以为其中包含多种不同的组合物的包装。所述的组合物的形式可以如上文所述,并且如果所述的组合物为溶液形式,则该组合物可以包含在容器中。可以设计本发明的试剂盒,使得材料A和B混合并包含在单一的容器中,或者包含在各个容器中。“使用说明”可以书写于纸上或其他类型的媒介物上,或者可以打印出来。备选地,“使用说明”可以为磁带或电子媒介物的形式,例如计算机可读光盘或带、以及CD-ROM。此外,本发明的试剂盒可以包含装有稀释剂、溶剂、清洗液或其他试剂的容器。此外,所述的试剂盒可以事先包含预防/治疗由于粉刺丙酸杆菌感染引起的粉刺所需的设备。
如上文所述,本发明的疫苗的使用能够高效地预防/治疗由于粉刺丙酸杆菌感染引起的炎症(粉刺)。
换言之,用于治疗或预防由粉刺丙酸杆菌引起的感染的方法包括以下步骤:向个体给药疫苗,该疫苗包含治疗有效量的本发明的肽或治疗有效量的本发明的多核苷酸,以及任选地治疗有效量的抗-TNF。
本发明使用的术语“治疗有效量”是指其量能够使所述的肽或所述的多核苷酸发挥所需的治疗作用或预防作用的肽或多核苷酸的量。在其中存在抗-TNF的多个实施方案中,抗-TNF也可以以治疗有效量存在。治疗有效量可以根据给予疫苗的个体的年龄、体重和其他健康状况,根据待治疗的炎症的状况以及给予的方法而不同。在所有情况下,在最基础的水平下,所需的作用是与使用本发明的治疗方法之前患者肿瘤组织中的肿瘤细胞相比,该患者的肿瘤组织中的肿瘤细胞消退、减少或消除。在皮下给予的某些实施方案中,疫苗的给予可以使得在一次给予中提供5-10μg肽/kg体重或10-50μg多核苷酸/kg体重。为了诱导足以抗炎症的免疫应答,可以将所述的疫苗多次、两次或更多次地给予患者。在某些实施方案中,以预定的间隔进行给予。
另一个实例如下:在疫苗(其包含基于由SEQ NO.1所示的氨基酸序列构成的肽的MAP与基于由SEQ NO.3所示的氨基酸序列构成的肽的MAP的混合物(重量比为1:1))的情况下,可以以下方式通过皮下注射进行给予:以生理盐水溶液的形式5次上下、按3至5天的时间间隔给予100-500μg各种肽/注射。
在通过贴剂给予的情况下,一剂可以较少,剂量的数量可以减少,并且个体可以使用贴剂治疗自己。
本发明使用的术语“患者或个体”是指个人和除了人类以外的哺乳动物(例如大鼠、小鼠、兔、猪、牛和猴)。
本发明提供了特异性识别本发明的任意一种肽的抗体。换言之,本发明的抗体可以特异性地结合任意一种所述的肽。在某些实施方案中,所述的抗体优选为与以下物质结合的抗体:(1)由SEQ NO.1或3所示的氨基酸序列构成的肽;或者(2)通过MAP工艺由SEQ NO.1或3所示的氨基酸序列构成的肽合成的多价抗原肽。
本发明使用的术语“抗体”是指免疫球蛋白(IgA,IgD,IgE,IgG,IgM及其Fab片段,F(ab')2片段和Fc片段)。抗体的实例包括但不限于多克隆抗体、单克隆抗体、单链抗体和抗独特性抗体。
本发明的抗体可以通过本发明所属技术领域的常规方法生产。例如所述的抗体可以通过以下方法获得:将本发明的肽给予哺乳动物的活的机体并导致免疫应答,从而在活的机体中生产抗体。在这种情况下获得的抗体通常为多克隆抗体。可以使用本发明的肽通过常规的已知杂交瘤技术来生产单克隆抗体。备选地,可以利用重组DNA技术或化学合成来生产单克隆抗体。
本发明的抗体的使用能够使人们容易地纯化本发明的肽。例如通过使用本发明的抗体对本发明的肽(使用本发明的载体或本发明的转化子在细胞中表达)进行亲和纯化,可以高效地收集所述的肽。
本发明的抗体可以是任何抗体,只要该抗体特异性地结合本发明的肽即可。就各免疫球蛋白(IgA,IgD,IgE,IgG或IgM)的种类、用于制备嵌合抗体的方法、用于制备肽抗原的方法等而言,所述的抗体没有限定,这在本发明中具体说明。因此,通过除了上文所述的方法以外的方法获得的抗体也涵盖在本发明的范围内。
用于测定疫苗对抗粉刺丙酸杆菌的效力的本发明的方法仅需要包含测定编码上文所述的肽的多核苷酸是否存在于由活机体收集得到的样品中的检测步骤,并且就其他特定的步骤以及待使用的仪器和装置而言没有特别限定。
在其中在检测步骤中检测编码所述肽的多核苷酸的情况下,可以确定对测试受试对象给予本发明的疫苗非常可能高效地抑制由粉刺丙酸杆菌引起的炎症。具体而言,当检测编码上文所述的肽的多核苷酸时,可以确定本发明的疫苗有可能有效地对抗粉刺丙酸杆菌。
用于检测编码所述的肽的多核苷酸的方法没有特别限定。例如所述的方法可以是通过PCR扩增的检测,或者是通过测定PCR产物的碱基序列的检测。通过测定PCR产物的碱基序列,可以更精确地测定接种的作用是否发挥。还可以根据扩增是否产生PCR片段来测定接种的作用是否发挥。例如,在其中使用用于扩增上述多核苷酸的特定引物通过扩增来生成所需长度的片段的情况下(在其中PCR检测结果为阳性的情况下),测试受试对象非常有可能感染了保留有上述多核苷酸的粉刺丙酸杆菌,这样可以确定接种的作用是高度预计的。另一方面,在其中未生成具有所需长度的片段的情况下(在其中PCR检测结果为阴性的情况下),可以确定接种的作用预计很小。在PCR扩增之前,可以通过培养所述的样品使得由测试受试对象收集得到的样品中所包含的粉刺丙酸杆菌生长。
通过检测由活的机体收集得到的样品中是否存在粉刺丙酸杆菌的16S rDNA的部分序列,可以确定是否应用抗粉刺丙酸杆菌的本发明的疫苗的方法。16S rDNA的部分序列是否存在的检测可以是通过PCR扩增的检测以及通过测定PCR产物的碱基序列的检测。该检测可以表明测试受试对象的炎症衍生自粉刺丙酸杆菌。这可以是使用所述疫苗的基础。
模型动物(其为除了人类以外的哺乳动物,例如下文提及的实施例中的小鼠,其腹中线经皮注射具有预定细菌细胞浓度或更高浓度的粉刺丙酸杆菌,从而导致粉刺丙酸杆菌的炎症)和用于制备模型动物的方法也涵盖在本发明的范围内。在模型动物中,以比传统的创建炎症的方法更高效的方式来创建粉刺丙酸杆菌的炎症。用于研发抗粉刺药品的目前已经使用的测定系统是基于所述的药品已经施加的假设。因此,在研发疫苗的过程中,还没有构建好已得到确认的、能够测定疫苗体内效果的测定系统。用于测定疫苗的效力的方法、模型动物和制备模型动物的方法可以优选地用于研发对抗粉刺丙酸杆菌的疫苗。
参照实施例,下文更详细地说明了本发明的实施方案。应该注意本发明不限于以下实施例,并且其细节可以修改。本发明不限于上述实施方案的描述,但是技术人员可以在权利要求书的范围内改变。基于不同实施方案中公开的技术手段的适当组合的实施方案涵盖在本发明的技术范围内。说明书中引用的所有文件均以引用方式并入本文。
实施例
实施例1-粉刺丙酸杆菌的培养
粉剌丙酸杆菌的菌株(下文简称为“P.acnes”(ATCC6919))购自RIKEN BioResource Center(JCM编号No.6425)。将购得的粉剌丙酸杆菌的菌株根据得自上述中心的培养条件信息培养。具体而言,在厌氧的手套式操作箱中,将粉剌丙酸杆菌的菌株悬浮于100ml GAM培养基(由Nippon Suisan Kaisha,Ltd.制造)中,并使用小瓶在37℃下厌氧培养3天。
实施例2-粉剌丙酸杆菌引起小鼠皮肤产生皮内炎症
将粉剌丙酸杆菌的活细菌细胞放置于脱气的生理盐水中,同时保持厌氧状态,由此制备粉剌丙酸杆菌的活细菌细胞的数量为5x107细胞/ml,1x108细胞/ml或5x108细胞/ml的悬液。通过喷射氮气保持厌氧条件。根据以下假设来计算粉剌丙酸杆菌的活细菌细胞的数量:通过分光光度计在550nm下测量的OD测量值0.98-1.02相当于5x108个细胞/ml,参见Ramstad S.et al.,Photochem.Photobiol.Sci.,2006,5,66-72。
将50μl制备的粉剌丙酸杆菌悬液皮内注射至Balb/c雄鼠(9-10周龄)的剃过毛的腹中线、颈部、腰椎背部、尾根背部和耳部。以预定的次数测量各部分上的炎性区域(长轴x短轴:mm2),该区域皮内注射有所述的悬液。各组由5个个体组成。
结果发现,在其中注射粉剌丙酸杆菌(其细菌细胞浓度为5x108细胞/ml)悬液的组中,可显然证明了炎症。图1为显示在注射后5天所观察的各部分处炎性区域结果的图。如图1所示,在皮内注射悬液的各部分中观察到炎症,并且炎性区域在腹中线的皮内部分最大。换言之,当引起小鼠的皮内炎症时,皮内注射至腹中线是最有效的。在所有观察的部分中,耳部的炎症是最轻的。图2为显示在将悬液皮内注射至腹中线后,在各次中在腹中线处的性区域结果的图。如图2所示,在注射粉剌丙酸杆菌后5天,在腹中线处的炎性区域最大。
与此相反,在其中注射粉剌丙酸杆菌(其细菌细胞浓度分别为5x107细胞/ml和1x108细胞/ml)悬液的组中,在任何部分及任何次数均不能引起炎症。
实施例3-肽的制备
将PepA(其为由SEQ NO.1所示的氨基酸序列构成的肽)的粉末或PepD(其为由SEQ NO.3所示的氨基酸序列构成的肽)的粉末溶解于生理盐水(由Otsuka Pharmaceutical Co.,Ltd.生产)中,从而制备800μg/ml肽溶液。
作为比较例,使用PepB(其为相当于粉刺丙酸杆菌膜蛋白中第10-26位氨基酸残基的肽,其中所述的粉刺丙酸杆菌膜蛋白由Genbank/EMBL/DDBJ登记的编号为No.AAT81852的氨基酸序列构成)和PepC(其为相当于粉刺丙酸杆菌膜蛋白中第145-166位氨基酸残基的肽,其中所述的粉刺丙酸杆菌膜蛋白由Genbank/EMBL/DDBJ登记的编号为No.YP_055518的氨基酸序列构成)。表1示出各肽中氨基酸序列的信息。用作比较例的序列为可以是生产抗体过程中用作抗原的强候选物的氨基酸序列,即富含亲水性氨基酸和电荷、并且选自具有转角结构的氨基酸序列的氨基酸序列。此外,根据Bruggemann H.et al.,“The Complete Genome Sequence of Propionibacterium Acnes,a Commensal of Human Skin,”Science,2004,305,671-673中所述的基因组分析,由上述编号No登记的氨基酸序列构成的蛋白质为预计被表达的蛋白质。
表1
实施例4-肽PepA对抗由粉刺丙酸杆菌引起的炎症的抗炎作用
在实施例2中,由将50μl粉刺丙酸杆菌(5x108细胞/ml)皮内注射至腹中线后经过5天,由粉刺丙酸杆菌引起的炎症区域最大。因此,在相同的条件下测定各种肽的抗炎作用,即通过将50μl粉刺丙酸杆菌(5x108细胞/ml)皮内注射至腹中线,并测量注射后5天时的炎性区域(mm2)。图3显示用于检测抗炎作用的操作。
图3为示意性显示用于检测抗炎作用的操作的图。如图3所示,在注射粉刺丙酸杆菌的活细菌细胞之前18天(图3中的第“0”天),在所述的注射之前的11天(图3中的第“7”天),以及在所述的注射之前的4天(图3中的第“14”天),将PepA(40μg/50μl/个体)皮内接种至Balb/c雄鼠的背部(在首次接种PetA时为7周龄),即,总计3次。然后,将粉刺丙酸杆菌皮内注射至小鼠的腹中线,并在注射后5天测量炎性区域(图3中的第“23”天)。各组由10只小鼠构成。作为比较例,准备一组小鼠,对其给予不具有PepA的PBS,并且再准备一组小鼠,对其给予PepB或PepC而非PepA,并且类似地,将粉刺丙酸杆菌注射至这些组的小鼠中。这些结果示于图4中。
图4为示出PepA的抗炎作用的结果的图。如图4所示,给予PepA的组与给予PBS的对照组相比,展示出统计学上显著地减小的炎性区域(P=0.00865(P<0.01))。换言之,PepA具有统计学意义地展示对抗由粉刺丙酸杆菌引起的炎症的抗炎作用。在给予PepB的组中,P=1。在给予PepC的组中,P=0.1655。这些数字不具有统计学意义,因此PepB和PepC被视为不具有对抗由粉刺丙酸杆菌引起的炎症的抗炎作用。
上述结果显示包含肽PepA的组合物作为对抗粉刺丙酸杆菌的疫苗(即,粉刺疫苗)是有效的。
实施例5-肽PepA和PepD对抗由粉刺丙酸杆菌引起的炎症的抗炎作用
在与实施例4相同的条件下,使用致炎症系统来检测各种肽的抗炎作用,不同之处在于在注射粉刺丙酸杆菌之前给予小鼠的肽由PepA,PepB和PepC改为PepA和PepD。结果示于图5中。
图5为示出PepA和PepD的抗炎作用的结果的图。如图5所示,给予PepA的组与给予PBS的对照组相比,展示出统计学上显著减小的炎性区域(P=0.0012(P<0.01)),如实施例4所示的结果。此外,给予PepD的组与给予PBS的对照组相比,展示出统计学上显著减小的炎性区域(P=0.00175(P<0.01))。
上述结果显示包含肽PepA或PepD的组合物作为对抗粉刺丙酸杆菌的疫苗(即,粉刺疫苗)是有效的。
实施例6-粉刺患者具有的菌株的鉴定
16S rDNA的提取
在37℃下,在GAM平板琼脂培养基上厌氧培养由粉刺患者的生病部位收集得到的脓,并收集部分细菌细胞。将所收集的细菌细胞转移至GAM平板琼脂培养基上,并厌氧培养,得以产生单个集落。收集单个集落的细菌细胞,并悬浮于20mM NaOH水溶液中。将悬液在94℃下加热3min,溶解细菌细胞,提取16S rDNA。使用提取的16S rDNA,测定患者所感染的细菌细胞的16S rDNA的碱基序列。相对于分别由3名粉刺患者收集得到的3组细菌细胞的各组,测定碱基序列。
16S rDNA的碱基序列的测定
所提取的16S rDNA用作模板DNA。此外,关于引物,使用引物9F(正向引物):5'-GTTTGATCCTGGCTCA-3'(SEQ NO.5)和引物800R(反向引物):5'-TACCAGGGTATCTAATCC-3'(SEQ NO.6)。在此实施的PCR由30个循环构成,每个循环由以下步骤组成:94℃,30秒;55℃,60秒,以及72℃,60秒。通过AmpliTaq Gold DNA Polymerase(由Applied Biosystems制造)进行PCR。反应后,纯化PCR产物。随后,使用纯化的PCR产物进行循环顺序反应。纯化在循环顺序反应中得到的产物,提供给ABI PRISM 310Genetic Analyzer System(由Applied Biosystems制造),并使用分析软件BioEdit测定碱基序列。在循环序列反应中使用的引物为上述引物9F和引物536R:5'-GTATTACCGCGGCTGCTGG-3'(SEQ NO.7)。循环顺序反应由25个循环构成,每个循环由以下步骤组成:96℃,10秒;50℃,5秒;以及60℃,4分钟。
测定碱基序列的结果
测定碱基序列的结果显示,在所建立的衍生自患者的3个分开的细菌菌株(患者菌株1-3)的每一个中,在扩增部分(SEQ NO.16)的16S rDNA碱基序列具有与粉刺丙酸杆菌ATCC6919菌株的相应碱基序列(SEQ NO.8)相同的序列。图6示出相对于患者菌株1的结果。因此,衍生自患者的3种分开的细菌细胞鉴定为粉刺丙酸杆菌。
实施例7-肽PepA对抗由衍生自患者的粉刺丙酸杆菌引起的炎症的抗炎作用
通过与实施例5相同的操作来检测PepA的抗炎作用,不同之处在于注射至小鼠中的粉刺丙酸杆菌的细菌细胞为在实施例6中分离得到的粉刺患者衍生的粉刺丙酸杆菌细菌细胞。结果示于图7中。
图7为示出在通过PepA免疫后向小鼠的腹中线皮内注射患者菌株1-3(P1-粉刺丙酸杆菌至P3-粉刺丙酸杆菌)并在注射后5天测量小鼠的炎性区域的结果的图。如图7所示,与给予PBS而非PepA的对照组相比,给予PepA的组显示相对于患者菌株1的P=0.0252(P<0.05),相对于患者菌株2的P=0.0476(P<0.05),以及相对于患者菌株3的P=0.0237(P<0.05)。换言之,给予PepA相对于注射每个患者菌株而言,能够统计学上显著地减少炎性区域。这表明PepA作为粉刺疫苗是广泛有效的。
实施例8-在衍生自粉刺患者的粉刺丙酸杆菌中编码PepA或PepD的碱基序列的检测
为了使PepA或PepD能够有效地用作疫苗,理想的是靶粉刺丙酸杆菌具有包含PepA或PepD的蛋白质。因此,通过实施PCR并测定和检查PCR产物的碱基序列来检测靶粉刺丙酸杆菌菌株是否具有包含PepA或PepD的蛋白质。
通过PCR证明PepA
在此用于检测编码PepA氨基酸序列的碱基序列所使用的引物为引物L:5'-GATGAAAGCCATCCAGGAAA-3'(SEQ NO.9)和引物R:5'-GCACACGAAACAACGCTAGA-3'(SEQ NO.10)。在此实施的PCR由35个循环组成,每个循环由以下步骤构成:95℃,15秒;60℃,20秒;72℃,30秒。使用AmpliTaq Gold DNA Polymerase(由Applied Biosystems制造)实施PCR。
结果通过由所检测的患者衍生粉刺丙酸杆菌进行扩增得到了具有所需长度的PCR片段,随后推断存在编码PepA氨基酸序列的碱基序列。这表明相当于PepA的蛋白质具有与PepA相同的氨基酸序列。
此外,针对由21名志愿者收集得到的样本检查它们是否具有编码PepA氨基酸序列的碱基序列,发现21名病例中有19名病例为阳性。在本实施例中使用的术语“阳性”是指使用特定的引物,通过PCR扩增生成了具有所需长度的片段。在本实施例中使用的术语“阴性”是指使用特定的引物,通过PCR扩增不能生成具有所需长度的片段。
类似地,针对由21名志愿者收集得到的样本通过PCR检查它们是否具有粉刺丙酸杆菌的16S rDNA。结果显示,在编码PepA氨基酸序列的碱基序列检测中为阳性的19名病例在16S rDNA的检测中也是阳性,并且在编码PepA氨基酸序列的碱基序列检测中为阴性的2名病例在16S rDNA的检查中也是阴性。在证明编码PepA氨基酸序列的碱基序列的PCR检测中为阴性的2名病例的结果不能表明2名志愿者不携带编码PepA氨基酸序列的碱基序列,但是表明粉刺丙酸杆菌的细菌细胞的数量如此低,以至于不能检测到细菌细胞。由上述结果来看,推测包含PepA氨基酸序列的蛋白质存在于其中证实有粉刺丙酸杆菌的16S rDNA的19名病例中。
表2
此外,与上文类似,针对由另外11名志愿者收集的样本检查它们是否具有粉刺丙酸杆菌的16S rDNA。结果显示,各种样本均为粉刺丙酸杆菌阳性。此外,针对11名病例检查它们是否具有编码PepA氨基酸序列的碱基序列,发现所有11名病例均为阳性。表3示出这11名病例的结果以及19名病例的结果,发现他们均为阳性。
表3
编码PepA和PepD的碱基序列的证明
相对于由5名志愿者收集得到的各个样本以及实施例1中所述的粉刺丙酸杆菌,通过PCR扩增编码PepA氨基酸序列的DNA和编码PepD氨基酸序列的DNA。在扩增编码PepA的DNA过程中,引物L(SEQ NO.9)和引物R(SEQ NO.10)被用作引物。在扩增编码PepD的DNA过程中,引物om1L:5'-GGTGCTGTCGTCAATAACAACTTC-3'(SEQ NO.14)和引物om1R:5'-GGAGTGGCCAGAGACGATCT-3'(SEQ NO.15)被用作引物。在此实施的PCR由以下步骤构成:(i)95℃,5分钟;此后(ii)35个循环,每个循环由以下步骤组成:95℃,15秒;53℃,20秒;以及72℃,30秒;以及此后(iii)72℃,7分钟;以及25℃,10分钟。表4示出PCR的结果。
如表4所示,在所有的样本中,对于PepA,通过扩增生成了具有所需尺寸的PCR产物。其中通过扩增生成了具有所需尺寸的PCR产物的病例显示为“阳性”。对于PepD,通过扩增生成了具有所需尺寸的PCR产物,患者菌株D的样本除外。
随后,测定PCR产物的碱基序列,以测定推断的氨基酸序列。通过使用3130x1Genetic Analyzer,Sequencing Analysis Software ver5.3.1.以及KB BaseCaller(各由Applied Biosystems生产)来进行碱基序列的测定。表4示出结果。如表4所示,在所有的样本中,PepA的序列是保守的。换言之,由此获得的推断的氨基酸序列与SEQ NO.1所示的氨基酸序列相同。另一方面,在患者菌株C和E的样本中,PepD的序列是保守的。换言之,由此获得的推断的氨基酸序列与SEQ NO.3所示的氨基酸序列相同。在患者菌株A和B的样本中,推断的氨基酸序列具有一个氨基酸突变。具体而言,定位于SEQ NO.3所示的氨基酸序列N-末端第11位的氨基酸残基由Gln改变为Lys。在衍生自Riken BioResource Center的菌株中也观察到这种突变,其中所述的菌株用于在多个实施例中测定单一肽的抗炎作用。患者菌株A为衍生自实施例6中粉刺患者的样本。
表4
然而,如实施例5和图5所示,单一给予PepD可以对由衍生自RIKEN BioResource Center的菌株所引起的炎症产生抗炎性作用,其中所述的菌株在PepD的氨基酸序列中包含突变。这显示PepD可以作为甚至对包含具有一个氨基酸突变的PepD的菌株引起的炎症有效的疫苗。
类似的,在如表5所示的由30名志愿者收集得到的样本的粉刺丙酸杆菌中,通过PCR扩增编码PepA氨基酸序列的DNA和编码PepD氨基酸序列的DNA,并测定相应PCR产物的碱基序列,由此测定相应的推断氨基酸序列。表5示出结果。
表5
如表5所示,在此检测的所有样本中,PepA的氨基酸序列完全保守。表4和5的结果显示真实患者衍生的粉刺丙酸杆菌的PepA序列是非常保守的。
另一方面,在所检测的30个病例的20个病例中,PepD的氨基酸序列是完全保守的(66.7%)。在所检测的病例的6个病例中,氨基酸序列是部分突变的(11Gln→Lys)。这是相当于the RIKEN BioResource Center菌株的部分突变,通过使用小鼠的检验发现,对上述菌株给予疫苗是有效的。因此,由疫苗作用的效力来看,认为PepD序列在30个病例中的26个病例中是有效的(86.7%)。换言之,PepD序列是很保守的。
由上文所述来看,认为PepA和PepD具有在患者细菌细胞中很保守的序列,因此作为患者的疫苗是高度有效的。
实施例9-对抗粉刺丙酸杆菌的疫苗应用疫苗的制备
如上文所述,发现在实施例5中使用小鼠的致粉刺炎症测试系统中,两种单链肽(PepA和PepD)都具有抗炎作用。为了使这些肽更高效地工作,通过MAP工艺合成PepA和PepD的MAP肽。如此得到的合成肽由结合于MAP结构的7-13个分子的PepA或PepD单链肽构成。制备MAP肽的混合物溶液(其中混合了PepA和PepD的MAP肽)并用作疫苗。
如下制备混合物溶液的制备物。最初,制备单个MAP肽,然后使用蒸馏水透析,并冻干且制成粉末。随后,将各种粉末溶解于生理盐水(由Otsuka Pharmaceutical Co.,Ltd.生产)中,使得相应MAP肽的浓度为1mg/ml(各种所得的溶液在下文中均称为“PA-MAP溶液”)。PA-MAP溶液经过内毒素检测和细胞毒性检测。内毒素的量满足根据NIH的允许量(5EU或更低/kg体重/1弹丸注射)。此外,在细胞毒性检测中,将10μl测试肽溶液和90μl外周血单个核细胞(2x106细胞/ml,在纯RPMI1640中)在37℃下共培养24小时。细胞生存比例与对照是基本相等的(差异为+/-5%或更低),在所述的对照中,培养其中加入生理盐水的外周血单个核细胞,随后未发现毒性。
病例1
以5天的时间间隔,将100μl制备的PA-MAP溶液5次皮下接种于粉刺患者的上臂中。该粉刺患者为携带实施例8中所示的患者菌株A的患者。图8示出观察结果。
如图8所示,在处理前(在初次给予时),皮肤的整个区域由于粉刺细菌的皮下增殖而凸出和升高(如图中箭头所示),并伴有炎症。在初次接种后1个月,尽管仍观察到粉刺的凸出和升高,但是它们分成2个区域,并且炎症得到改善和局部化。在最后接种后的3个月,炎症逐渐减少,粉刺变成结疤,并且凸出和升高变平。由于处于处理过程,所以观察到色素沉积。未观察到接种引起的恶化现象。
病例2
由携带实施例8所示的患者菌株C的粉刺患者收集样本,并且通过PCR扩增粉刺丙酸杆菌的16S rDNA来证明粉刺患者是否感染粉刺丙酸杆菌。结果显示粉刺患者为粉刺丙酸杆菌阳性。使用(i)引物L1(由与引物9F相同的序列构成)和(ii)引物R2:5'-GCACGTAGTTAGCCGGTGCT-3'(SEQ NO.13)通过PCR进行粉刺丙酸杆菌的16S rDNA的扩增,其中所述的PCR由以下步骤构成:(i)95℃,5分钟;此后(ii)35个循环,每个循环由以下步骤组成:95℃,15秒;55℃,20秒;以及72℃,30秒;以及(iii)72℃,7分钟。
以3天的时间间隔,将300μl制备的PA-MAP溶液5次皮下接种于粉刺患者的上臂中。图9示出观察结果。
如图9所示,在初次接种后1个月和3个月,在处理前(在初次给予时)观察到的脸颊上的炎症整个区域发生改善。未观察到接种引起的恶化现象。
病例3
由携带实施例8所示的患者菌株D的粉刺患者收集样本,通过PCR在与病例2中相同的条件下扩增粉刺丙酸杆菌的16S rDNA来证明粉刺患者是否感染粉刺丙酸杆菌。结果显示粉刺患者为粉刺丙酸杆菌阳性。
以3天的时间间隔,将300μl制备的PA-MAP溶液5次皮下接种于粉刺患者的上臂中。图10示出观察结果。
如图10所示,处理前(在初次给予时)所观察的鼻子周围的整个炎症区域在初次接种后1个月和3个月有所改善。未观察到接种引起的恶化现象。
病例4
由携带实施例8所示的患者菌株E的粉刺患者收集样本,通过PCR在与病例2中相同的条件下扩增粉刺丙酸杆菌的16S rDNA来证明粉刺患者是否感染粉刺丙酸杆菌。结果显示粉刺患者为粉刺丙酸杆菌阳性。
以5天的时间间隔,将300μl制备的PA-MAP溶液5次皮下接种于粉刺患者的上臂中。图11示出观察结果。
如图11所示,处理前(在初次给予时)所观察的脸颊的广泛区域上的整个炎症区域在初次接种后1个月和3个月有所改善。未观察到接种引起的恶化现象。
上述结果显示包含肽PepA和肽PepD的组合物作为对抗粉刺丙酸杆菌的疫苗是有效的,即粉刺疫苗。
本发明的应用使得有可能进行预防和治疗粉刺的免疫治疗。因此,本发明适用于医疗领域、药物领域等,并且是极有用的。
实施例10-包含抗-TNF的粉刺疫苗的制备
根据本发明的疫苗是通过将500μg肽抗原ABF155和500μg肽抗原ABF156与50mg抗-TNF组合而制备的。抗-TNF可以商品名Enbrel商业上获得。对照疫苗是通过将500μg肽抗原ABF155和500μg肽抗原ABF156结合(不具有抗-TNF)组合而制备的。在总计12周内,每周1次将各种疫苗皮下注射给予患者。在总计4个月内,每月1次进行以下血液检验:WBC,RBC,Hb,血像,生化检验,IgM,IgG,IgG亚型。得到Propioni Bacterium Antibody Titer(ELISA测试)和Cytokine Assays。所述的测试包括使用接收疫苗之前和之后由患者得到的外周血液样品测量针对粉刺丙酸杆菌和疫苗肽的抗体效价和T细胞应答。
实施例11-包含抗-TNF的粉刺疫苗的制备和给予
根据本发明制备总计8种疫苗,并将各种疫苗给予患有粉刺丙酸杆菌的不同患者。所述的给予由以下构成:由第0周开始,每周1次将疫苗注射至各个患者的臀部。因此,在初始注射后的每周都向患者的臀部给予另一次注射。在第0周,取得8位患者中每一位的感染区域的照片,此后,每4周取得随后的照片。该照片用于鉴定粉刺斑点的初始数量,以及在一段时间内响应于疫苗的粉刺斑点进展和/或消退。此外,在第0周对8位患者中每一位实施血液检验,此后,每4周进行随后的血液检验。
6种疫苗包含肽和抗-TNF的组合,2种疫苗仅包含肽,即缺乏抗-TNF。在第0周,通过将500μg肽抗原ABF155和500μg肽抗原ABF156与50mg抗-TNF(市售可得,商品名为Enbrel)组合来制备初始疫苗,即6种肽/抗-TNF疫苗。在第0周,通过将500μg肽抗原ABF155和500μg肽抗原ABF156组合(不具有抗-TNF)来制备初始疫苗,即2种对照疫苗。对于在第0周后给予的各种疫苗而言,肽和抗-TNF的量保持相同。但是,应该考虑的是,在第0周后给予的各种疫苗中,抗-TNF的量可以根据患者的整体状况来调节。例如原始疫苗由50mg抗-TNF构成,并且应该考虑的是随后的注射可以包含相同量、更多的或更少的量。在某些实施方案中,其中观察到有所改善(例如粉刺斑点的消退)时,可以使用较少量的抗-TNF,观察到患者的状况恶化(例如粉刺斑点的数量增加)时,可以使用较多量的抗-TNF。
患者#1至#8中每一位的数据分别示于表A至H中。如表A和B所示(对于患者#1和#2),将包含肽和抗-TNF的疫苗给予粉刺患者产生了完全的应答。粉刺斑点的数量显著减少(由第0周的8个斑点减少至第12周的0个斑点)。如表C所示(对于患者#3),向粉刺患者给予仅包含肽的疫苗在第0至第4周得到稳定的疾病应答。粉刺斑点的数量基本保持相同(由第1周的4个斑点至第4周的4个斑点)。然而,对于接下来12周的注射(即,第4周至第16周)使用具有抗-TNF的疫苗。结果粉刺斑点的数量在整个这12周的时间内减少(由第4周的4个斑点减少至第16周的0个斑点)。如表D所示(对于患者#4),向粉刺患者给予包含肽和抗-TNF的疫苗产生了部分应答。粉刺斑点的数量显著减少(由第0周的7个斑点减少至第10周的3个斑点)。如表E所示(对于患者#5),向粉刺患者给予仅包含肽的疫苗产生了部分应答。粉刺斑点的数量减少(由第0周的5个斑点减少至第11周的1个斑点)。如表F和G所示(对于患者#6和#7),向粉刺患者给予包含肽和抗-TNF的疫苗产生了部分应答。患者#6和#7的粉剌斑点的数量减少(对于患者#6由第0周的14个斑点减少至第12周的2个斑点,对于患者#7由第0周的2个斑点减少至第12周的1个斑点)。表H显示了粉刺斑点数(对于患者#8),向粉刺患者给予包含肽和抗-TNF的疫苗产生稳定的疾病应答(第0周斑点的数量和第12周斑点的数量是相同的,即5个斑点)。
根据上述结果,可以认为疫苗中存在的肽作为抗原是有效的,并且抗-TNF有效地抑制由免疫应答(通过给予疫苗而引发)过度诱导的炎症。此外,还表明肽和抗-TNF的组合有效地增强疫苗效力。
本领域的技术人员应该理解,在不脱离本发明的广泛构思的情况下,可以对上述实施方案进行修改。因此,应该理解的是本发明不限于所公开的具体的实施方案,而是涵盖在本发明的精神和范围内的修改,如所附的权利要去书所限定的。
序列表
<110> HASUMI, KENICHIRO
KURAYA, MIKIO
<120> 抗原肽及其应用
<130> 86510(70904)
<140>
<141>
<150> PCT/JP2011/062305
<151> 2011-05-23
<150> 61/396,574
<151> 2010-05-27
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 14
<212> PRT
<213> 粉刺丙酸杆菌(Propionibacterium acnes)
<400> 1
Ala Ile Gln Glu Lys Tyr Gly Asp Asp Arg Glu Arg Ala Gly
1 5 10
<210> 2
<211> 42
<212> DNA
<213> 粉刺丙酸杆菌
<400> 2
gccatccagg aaaagtacgg cgacgacagg gaacgtgccg gc 42
<210> 3
<211> 13
<212> PRT
<213> 粉刺丙酸杆菌
<400> 3
Lys Asp Ala Asp Lys Asp Asn Pro Thr Tyr Gln Lys Val
1 5 10
<210> 4
<211> 39
<212> DNA
<213> 粉刺丙酸杆菌
<400> 4
aaggacgctg acaaagacaa cccgacgtac cagaaggtc 39
<210> 5
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 5
gtttgatcct ggctca 16
<210> 6
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 6
taccagggta tctaatcc 18
<210> 7
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 7
gtattaccgc ggctgctgg 19
<210> 8
<211> 511
<212> DNA
<213> 粉刺丙酸杆菌
<400> 8
agagtttgat cctggctcag gacgaacgct ggcggcgtgc ttaacacatg caagtcgaac 60
ggaaaggccc tgcttttgtg gggtgctcga gtggcgaacg ggtgagtaac acgtgagtaa 120
cctgcccttg actttgggat aacttcagga aactggggct aataccggat aggagctcct 180
gctgcatggt gggggttgga aagtttcggc ggttggggat ggactcgcgg cttatcagct 240
tgttggtggg gtagtggctt accaaggctt tgacgggtag ccggcctgag agggtgaccg 300
gccacattgg gactgagata cggcccagac tcctacggga ggcagcagtg gggaatattg 360
cacaatgggc ggaagcctga tgcagcaacg ccgcgtgcgg gatgacggcc ttcgggttgt 420
aaaccgcttt cgcctgtgac gaagcgtgag tgacggtaat gggtaaagaa gcaccggcta 480
actacgtgcc agcagccgcg gtgatacgta g 511
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 9
gatgaaagcc atccaggaaa 20
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 10
gcacacgaaa caacgctaga 20
<210> 11
<211> 17
<212> PRT
<213> 粉刺丙酸杆菌
<400> 11
Gly Arg Lys Pro Asp Thr Asn Lys Arg Ser Trp His Arg Lys Ala Ser
1 5 10 15
Arg
<210> 12
<211> 22
<212> PRT
<213> 粉刺丙酸杆菌
<400> 12
Ile Asp Gln Val Arg Glu Tyr Arg His Arg Asp Asp Asp Asp Asp Glu
1 5 10 15
Asp Pro Gly Glu Asp Gly
20
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 13
gcacgtagttagccggtgct 20
<210> 14
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 14
ggtgctgtcg tcaataacaa cttc 24
<210> 15
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成引物
<400> 15
ggagtggcca gagacgatct 20
<210> 16
<211> 504
<212> DNA
<213> 粉刺丙酸杆菌
<400> 16
gtttgatcct ggctcaggac gaacgctggc ggcgtgctta acacatgcaa gtcgaacgga 60
aaggccctgc ttttgtgggg tgctcgagtg gcgaacgggt gagtaacacg tgagtaacct 120
gcccttgact ttgggataac ttcaggaaac tggggctaat accggatagg agctcctgct 180
gcatggtggg ggttggaaag tttcggcggt tggggatgga ctcgcggctt atcagcttgt 240
tggtggggta gtggcttacc aaggctttga cgggtagccg gcctgagagg gtgaccggcc 300
acattgggac tgagatacgg cccagactcc tacgggaggc agcagtgggg aatattgcac 360
aatgggcgga agcctgatgc agcaacgccg cgtgcgggat gacggccttc gggttgtaaa 420
ccgctttcgc ctgtgacgaa gcgtgagtga cggtaatggg taaagaagca ccggctaact 480
acgtgccagc agccgcggtg atac 504
- 还没有人留言评论。精彩留言会获得点赞!