含有DPP‑4抑制剂的用于预防或治疗瓣膜钙化的组合物的制作方法
本发明涉及用于预防或治疗瓣膜钙化的药物组合物,其包含二肽基肽酶-4(dpp-4)抑制剂。本发明还涉及用于预防或改善瓣膜钙化的食物组合物,其包含二肽基肽酶-4(dpp-4)抑制剂。
背景技术:
心血管钙化有助于加重高血压、心力衰竭、急性冠状动脉综合征和瓣膜疾病,并且因此导致各种并发症。并且,各种流行病学研究证明血管钙化独立地增加死亡率。在正常产前阶段或骨折后,血管钙化发生在与成骨程序类似的机制中,并且在疾病,诸如衰老、糖尿病、慢性肾功能衰竭和慢性炎性疾病中被激活。骨骼中矿物质的损失通过炎性反应加快,并且游离的矿物质被内吞到异常血管内皮细胞中。
血管内皮功能障碍是血管钙化的重要机制。通常,内皮型一氧化氮合酶(enos)在血管内皮细胞、心内膜心肌细胞、心房细胞、血管平滑肌细胞、呼吸内皮细胞等中以一定水平持续表达,并且通过形成一氧化氮(no)用于调节血管紧张度并保持血管内皮细胞的体内稳态。当enos的功能障碍出现时,与enos具有类似结构和功能的同工酶,诸如神经元型nos(nnos)或诱导型nos(inos),补偿性地增加以替代enos的作用,但是不能轻易地继续维持正常血管内皮细胞功能。因此,在早期发生血管的病理学改变,包括动脉粥样硬化。在研究内皮型一氧化氮合酶(enos)对心血管系统的影响的实验室动物模型,即内皮型一氧化氮合酶敲除(enosko)动物模型中,已知与对照相比,在中风和心肌梗塞后,高血压和动脉粥样硬化的发作增加,并且出现广泛的病变区域和严重的重塑。
与此同时,虽然已经报道了dpp-4在诱导心血管钙化的动物模型中以增加的水平表达,但是这并未表明dpp-4的表达与心血管系统的钙化,具体是心脏瓣膜的钙化有关,或者抑制dpp-4的表达或活性可预防或治疗心脏瓣膜的钙化。
本发明的发明人已经做出广泛的努力以阐明心血管钙化进展,并开发心血管钙化的治疗药物,并且结果是,发现dpp-4抑制剂可有效预防或治疗瓣膜的钙化,具体是心脏瓣膜的钙化,从而完成本发明。
技术实现要素:
本发明提供用于预防或治疗瓣膜钙化的药物组合物,其包含二肽基肽酶-4(dpp-4)抑制剂。
本发明还提供用于预防或改善瓣膜钙化的食物组合物,其包含dpp-4抑制剂。
本发明还提供用于预防或治疗瓣膜钙化的组合物,其包含二肽基肽酶-4(dpp-4)抑制剂。所述组合物包括药物组合物或食物组合物。
附图说明
图1显示cavd患者中的钙化相关基因、纤维化相关基因和炎症相关基因的表达谱。根据图1,上调由红色表示,并且下调由绿色表示。
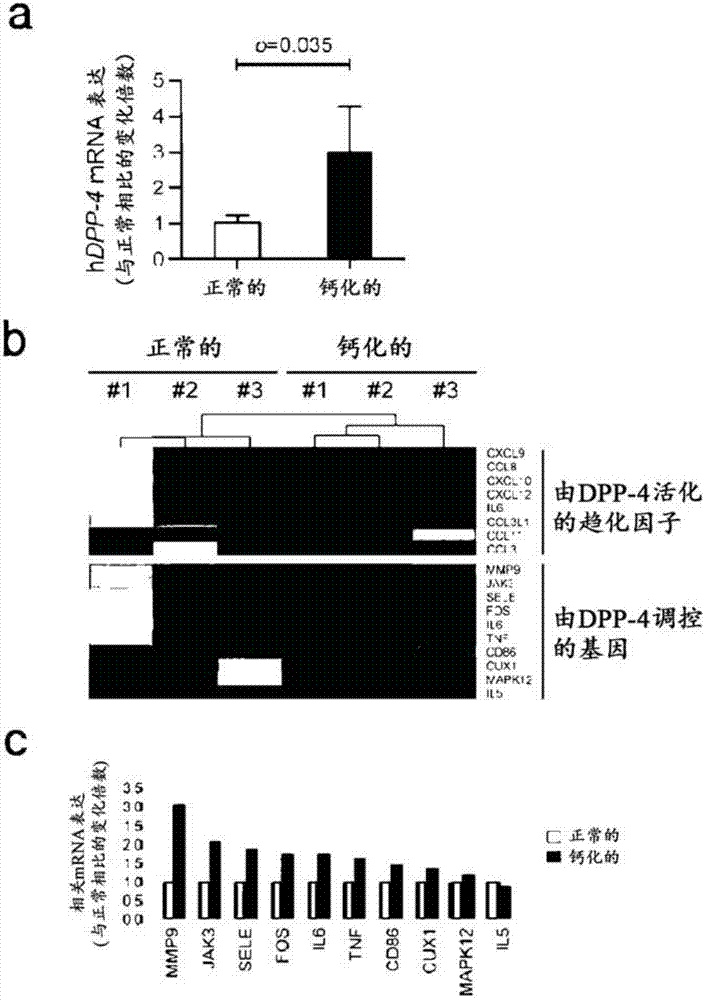
图2a显示cavd患者和正常人中的hdpp-4mrna表达水平,其由qrt-pcr表示;图2b显示由dpp-4激活的趋化因子和由dpp-4调控的基因的表达谱;以及图2c显示进行qrt-pcr以测量微阵列组中由dpp-4调控的基因的mrna水平的结果。
图3显示在cavd患者和正常人中通过vonkossa染色、茜素红(alizarinred)染色,dapi、dpp-4以及dapi和dpp-4的融合进行组织学分析的结果。细胞核用dapi(蓝色)染色。
图4显示来自野生型或enos-/-小鼠主动脉瓣膜的石蜡包埋切片的ar和vk染色的结果。所述切片还用抗鼠科dpp-4染色。
图5显示在成骨基础培养基中培养后野生型或enos-/-小鼠vsmc的alp、ar和vk染色的结果。
图6a显示通过elisa测量培养基中野生型或enos-/-小鼠vsmc的mdpp-4水平的结果;图6b显示通过qrt-pcr分析mdpp-4mrna表达水平的结果;以及图6c显示通过elisa测量血浆mdpp-4水平的结果。
图7a显示在使用deta-no治疗24小时后通过rt-pcr分析野生型或enos-/-小鼠vsmc中dpp-4表达的结果;图7b显示在使用deta-no治疗48小时后通过免疫印记分析(immunoblotanalysis)分析野生型或enos-/-小鼠vsmc中mdpp-4表达的结果;图7c显示测量野生型或enos-/-小鼠vsmc中mdpp-4启动子活性的结果;图7d显示分析野生型或enos-/-小鼠vsmc中nf-κb活性的结果;以及图7e显示通过elisa测量使用nf-κb抑制剂治疗的野生型或enos-/-小鼠vsmc中mdpp-4水平的结果。
图8显示在使用deta-no治疗后,测量使用含有nf-κb结合位点的mdpp-4启动子和含有荧光素酶基因的启动子转化的enos-/-小鼠vsmc中mdpp-4启动子活性的结果。
图9a和9b显示在向enos-/-小鼠施用西格列汀(sitagliptin)后,施用双磷酸盐缀合的显像剂以检测成骨活性的结果。
图10a显示在向enos-/-小鼠施用西格列汀后,enos-/-小鼠全身(上部)和主动脉瓣膜(下部)的vk染色的结果;以及图10b以图形方式显示vk阳性面积。
图12a显示通过使用西格列汀治疗enos-/-小鼠vsmc,培养治疗的vsmc,然后ar染色vsmc以检测骨生成而获得的结果;以及图12b显示测量alp活性以确定enos-/-小鼠vsmc中dpp-4底物治疗对骨生成的影响的结果。各底物在dpp-4存在情况下以50ng/ml的浓度或在dpp-4不存在情况下以200ng/ml的浓度使用。
图11显示人瓣膜间质细胞(hvic)的成骨分化通过使用dpp-4治疗而抑制。
图12显示cavd患者(n=48)和正常人(n=111)中的血浆hdpp-4水平。
图13a显示具有钙化的cavd患者(n=30)和没有钙化的cavd患者(n=18)中的血浆hdpp-4水平,以及图13b显示活性血浆hdpp-4水平。
图14显示使用各种dpp-4抑制剂治疗后,测量enos-/-小鼠vsmc中alp活性的结果。
具体实施方式
除非另有定义,否则本发明使用的所有技术和科学术语具有与本发明属领域普通技术人员通常理解的相同的含义。通常,以下将描述的本发明使用的命名和实验方法是本领域中熟知和通常使用的那些。
本发明涉及用于预防和治疗瓣膜钙化的组合物,其包括二肽基肽酶-4(dpp-4)抑制剂,并且涉及使用用于预防和治疗瓣膜钙化的组合物治疗瓣膜钙化的方法。
在本发明中,dpp-4(二肽基肽酶-4)也被称为分化簇26(cd26),并且已知作为参与免疫调节、凋亡、信号转导等的蛋白质。
在本发明的组合物中,dpp-4抑制剂可以是用于抑制dpp-4核苷酸序列表达的抑制剂或用于抑制dpp-4蛋白质活性的抑制剂。用于抑制dpp-4核苷酸序列表达的抑制剂的实例可包括针对dpp-4的mrna的反义核苷酸序列、适体、小干扰rna(sirna)、短发夹rna(shrna)、微小rna(mirna)或rna干扰(rnai)。
此外,用于抑制dpp-4蛋白质活性的抑制剂的实例可包括抗dpp-4的抗体、西格列汀(sitagliptin)、维格列汀(vildagliptin)、沙格列汀(saxagliptin)、利格列汀(linagliptin)、度格列汀(dutogliptin)、吉格列汀(gemigliptin)、阿格列汀(alogliptin)、阿拉格列汀(anagliptin)、依格列汀(evogliptin)、小檗碱(berberine)、抑二肽素(diprotin)和羽扇豆醇(lupeol)。在本发明中,抗dpp-4的抗体可以是单克隆抗体或多克隆抗体。
在本发明中,当瓣膜被钙化时,dpp-4表达的水平增加,并且当施用dpp-4抑制剂时,钙化显著降低。因此,dpp-4抑制剂可用于瓣膜的治疗或预防。
在本发明中,瓣膜钙化指瓣膜中细胞外基质羟磷灰石(磷酸钙)晶体沉积物的形成、生长或沉积。
钙化包括中膜钙化(medialcalcification)或动脉粥样硬化钙化。钙化的组织被称为钙化的软骨。瓣膜钙化代表性地发生在两个区域。内膜钙化连同动脉粥样硬化一起发生。在动脉粥样硬化的情况下,脂肪富集的巨噬细胞和t淋巴细胞首先在瓣膜中积累以形成脂肪层,然后平滑肌细胞从中膜迁移到脂肪层。刺激这种细胞移动的趋化因子化合物被认为在最接近的内皮细胞、活化的吞噬细胞等中生成。迁移的平滑肌细胞增殖,脂肪在平滑肌细胞中积累,并且形成细胞外基质。钙化发生在粥样斑块的中心区域。不管动脉粥样硬化和内膜钙化如何,都发生中膜钙化。在远端动脉(distalarteries)发生的中膜动脉钙化也被称为门克伯格动脉硬化(monckeberg'ssclerosis),并且经常在老年糖尿病患者中观察到。已知平滑肌细胞和弹性蛋白与中膜动脉钙化的发生有关。
本发明使用的术语“动脉粥样硬化钙化”指沿着内膜以动脉粥样硬化斑块(artheromatousplaque)发生的瓣膜钙化。
在本发明中,中膜钙化、中膜壁钙化或门克伯格动脉硬化指以中膜壁中存在钙为特征的钙化。
并且,本发明的钙化可以由瓣膜疾病、高脂血症、衰老、雌激素缺乏、心绞痛、心力衰竭、肾炎、尿毒症、糖尿病、炎性疾病或心血管疾病引起。肾炎的实例可包括肾小球性肾炎、糖尿病性肾炎、狼疮性肾炎、多发性脓疱性肾炎、肾盂肾炎、肾石病、肾结核、肾肿瘤等。并且,炎性疾病的实例可包括哮喘、过敏性和非过敏性鼻炎、慢性和急性鼻炎、慢性和急性胃炎或肠炎、溃疡性胃炎、急性和慢性肾炎、急性和慢性肝炎、慢性阻塞性肺疾病、肺纤维化、肠易激综合征、炎性疼痛、偏头痛、头痛、背痛、纤维肌痛综合征、肌筋膜病、病毒感染(例如,丙型肝炎)、细菌感染、真菌感染、烧伤、由外科手术或牙科手术引起的损伤、前列腺素e过载综合征、动脉粥样硬化、痛风、关节炎、风湿性关节炎、强直性脊柱炎、霍奇金病、胰腺炎、结膜炎、虹膜炎、巩膜炎、葡萄膜炎、皮炎、湿疹和多发性硬化。此外,心血管疾病的实例可包括心肌病、原发性心搏骤停、缺血性心力衰竭、高血压、缺血性心脏病、冠状动脉疾病、心绞痛、心肌梗塞、动脉粥样硬化和心律失常。
在本发明中,发现dpp-4在主动脉瓣膜钙化中参与主动脉瓣膜钙化(cavd)的进行过程。在缺乏no供应的小鼠中no的缺乏增加dpp-4的表达。这将导致成骨细胞转移并分化,并且造成主动脉瓣膜中钙化的加速。
当向受试者施用dpp-4抑制剂时,vsmc的成骨细胞转移可被抑制以抑制疾病的进展,这支持在cavd治疗中可靶向dpp-4用于潜在治疗的概念。
本发明的一个示例性实施方式的药物组合物可进一步包含药学上可接受的载体。药学上可接受的载体可包括盐水溶液、无菌水、林格氏溶液、缓冲盐水溶液、葡萄糖溶液、麦芽糖糊精溶液、甘油、乙醇,以及它们两种或多种的混合物,其可单独使用或组合使用。当需要时,可向组合物中添加其他常规添加剂,诸如抗氧化剂、缓冲液和抑菌剂。并且,可向组合物中进一步添加稀释剂、分散剂、表面活性剂、粘合剂和润滑剂。在此情况下,组合物可被配制成可注射的制剂,诸如水溶液、悬浮液或乳液、丸剂、胶囊、颗粒或片剂。此外,药物组合物可优选根据个体疾病和组分使用相关领域中已知的适当方法或remington'spharmaceuticalscience(最新版),mackpublishingcompany,eastonpa中披露的方法配制。药学上可接受的载体、药物组合物的制剂和制备制剂的方法的实例是相关领域中已知的。
并且,如上所述,所述药物组合物可用于向受试者施用包含本发明的dpp-4抑制剂作为活性成分的组合物,从而治疗瓣膜钙化。本发明的组合物可以在需要的受试者中以治疗瓣膜钙化的有效量提供。dpp-4抑制剂的剂量可根据患者的体重、年龄、性别、健康状况、饮食、施用时间、施用方法、排泄率和疾病的严重程度在很大程度上变化。在此情况下,dpp-4抑制剂的适当剂量可由相关领域中的技术人员任选地确定。
dpp-4抑制剂的日剂量为约0.0001至500mg/kg,优选为约0.01至5mg/kg,并且可以每日施用一次或以分次剂量施用。
本发明的组合物可根据所需目的口服或肠胃外(例如静脉内、皮下、腹膜内、肌内、血管内或皮下)施用。优选地,组合物可口服施用。对于口服施用,组合物可以胶囊、片剂、粉末、颗粒或悬浮液的形式提供。并且制剂可包括常规添加剂,诸如乳糖、甘露糖醇、玉米淀粉或马铃薯淀粉,并且可用于所述制剂的粘合剂可包括结晶纤维素、纤维素类似物、阿拉伯胶、玉米淀粉或羧甲基纤维素钠。
此外,制剂可与磷酸氢钙或无水羟乙酸淀粉钠一同提供。最终,制剂可与润滑剂,例如滑石或硬脂酸镁,一同提供。
此外,本发明的组合物可单独使用,或与外科手术、激素治疗、药物治疗和使用生物反应调节剂的方法组合使用,以便预防或治疗瓣膜钙化。
本发明的用于预防或改善瓣膜硬化的食物组合物没有特别局限于制剂。可向其中添加组合物的食物可包括肉、肠、面包、巧克力、糖果、点心、甜食、披萨、拉面或其他面条、口香糖、包括冰淇淋的乳制品、各种汤、饮料、茶、酒、酒精饮料和维生素复合物。在此情况下,食物包括常规方面的各种保健食物。
除了可包括在本发明的食物组合物中的dpp-4抑制剂之外,可进一步包括在食物组合物中的其他组分没有特别限制。例如,食物组合物可进一步包含各种草本植物提取物,诸如常规食物、食物补充剂或天然碳水化合物作为附加组分。并且,食物组合物可进一步包括食物补充剂。在此情况下,食物补充剂包括香料、调味剂、着色剂、填充剂、稳定剂等,所有这些在相关领域中被广泛使用。天然碳水化合物的实例可包括典型的糖,诸如单糖,例如葡萄糖、果糖等;二糖,例如麦芽糖、蔗糖等;以及多糖,例如糊精、环糊精等,以及糖醇,诸如木糖醇、山梨糖醇、赤藓糖醇等。除了上述组分之外,天然香料(即,甜菜碱、甜叶菊提取物(例如甜叶菊苷a,甘草甜素等)),以及合成香料(即,糖精、阿斯巴甜等)可理想地用作香料。此外,本发明的食物组合物可含有各种营养物质、维生素、矿物质(电解质)、调味剂(诸如合成调味剂、天然调味剂等)、着色剂、增量剂(奶酪、巧克力等)、果胶酸及其盐、海藻酸及其盐、有机酸、保护胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇、用于碳酸饮料的碳酸化剂等。此外,本发明的食物组合物可包含可用于制备天然果汁、果汁饮料和蔬菜饮料的果肉。所述组分可单独使用或组合使用。
实施例
以下将参考实施例进一步详细地描述本发明。对本领域具有普通技术的人员将显而易见的是,这些实施例仅用作说明的目的,并且不应被解释为限制本发明的范围。
实施例1:分析人钙化性主动脉瓣疾病(cavd)中的dpp-4表达
人主动脉瓣膜样本从首尔峨山医院(seoulasanmedicalcenter)中接受主动脉瓣膜置换的正常患者和从具有严重钙化损伤的患者中获得。将各样本的一半立即存储在rnalater(lifetechnology)中,而剩余一半固定在oct化合物(sakurafinetek,inc.)中。收集人样本的研究方案由首尔峨山医院(seoul,korea)的机构审查委员会(institutionalreviewboard)(irb)批准。
通过微阵列分析人钙化性主动脉瓣膜疾病(cavd)中参与细胞进展的基因表达谱。
在来自非钙化正常患者和钙化患者的主动脉瓣膜样本中基因表达谱的分析使用affymetrix
因此,如图1所示,与正常人相比,与钙化、纤维化和炎症有关的基因在cavd患者的主动脉瓣膜中上调。
此外,进行实时定量pcr(qrt-pcr)以在cavd患者中测量dpp-4表达。在qrt-pcr过程中,全部rna通过使用rneasy脂质组织试剂盒(qiagen,usa)从各样本中分离,并且通过使用cdna合成试剂盒(thermoscientifir,eu)合成cdna。合成的cdna的qrt-pcr分析通过使用powersybr绿色1步法试剂盒和abi7000实时pcr系统(appliedbiosystems)在光学96孔板中进行。使用gapdh作为内部对照。
结果是,如图2a所示,实时pcr的结果表示dpp-4在cavd患者中以高水平表达。
微阵列分析的结果表明dpp-4活性激活炎性趋化因子并且由dpp-4和趋化因子基因调节的下游基因在钙化的主动脉瓣膜组织中被上调(图2b)。此外,基因的上调通过使用实时pcr分析mrna表达来确认(图2c)。
将人主动脉瓣膜样本固定在4%福尔马林溶液中24小时,然后包埋入石蜡中,并且切成4μm的厚度。为了观察石蜡包埋的主动脉瓣膜和心脏基底段中的钙沉积,进行vonkossa(vk)染色和茜素红(ar)染色。对于vonkossa染色,使用蒸馏水洗涤固定在福尔马林中的主动脉瓣膜,然后在室温暴露于5%水溶性agno3和强光60分钟。接着,使用2.5%硫代硫酸钠处理主动脉瓣膜5分钟,并且当其显示黑褐色时,其被认为是阳性。对于茜素红染色,使用蒸馏水洗涤固定在福尔马林中的主动脉瓣膜,然后使用2%茜素红s(水性的,sigma)处理5分钟,并且当主动脉瓣膜显示红色或橙色时,其被认为是阳性的。
进行钙化的主动脉瓣膜组织的免疫荧光染色。结果是,如图3所示,dpp-4在使用vonkossa(vk)和茜素红染色的钙化部分中高度表达,而在正常人的主动脉瓣膜组织中没有观察到dpp-4的表达。
实施例2:分析enos敲除小鼠模型中的dpp-4表达
使用c57bl/6jenos-/-(内皮型一氧化氮合酶敲除)小鼠(8周龄,n=10,thejacksonlaboratory,barharbor,me,usa)和c57bl/6j野生型小鼠(8周龄,野生型,wt,n=10)。在购买后,使用标准啮齿动物饲料喂养小鼠直到3月龄。
小鼠被深麻醉,并且在此情况下,向小鼠施用含有4%多聚甲醛的pbs,并且提取心脏和主动脉。将提取的组织固定过夜并包埋在石蜡中,并且将整个主动脉瓣膜切成5μm的厚度。将小鼠安乐死,并且存储血液和主动脉样本以供分析。
为了观察石蜡包埋的主动脉瓣膜和心脏基底段的钙沉积,进行vonkossa和茜素红染色。
结果是,如图4所示,与对照不同,在vonkossa染色的主动脉瓣膜中观察到指示enosko小鼠的主动脉瓣膜中矿化的黑褐色染色部分,并且在茜素红染色的主动脉瓣膜中也观察到指示钙沉积的红色染色部分。此外,在ar染色和vk染色中,在钙化区域中还观察到表达高水平dpp-4的细胞。
实施例3:观察小鼠血管平滑肌细胞(vsmc)中的钙化
将在实施例2中连同心脏一同从enos-/-小鼠和野生型小鼠提取的主动脉在无血清培养基m199(cellgro)中洗涤,切割成小块,然后在37℃的水浴中在含有20%胎牛血清和3mg/ml胶原酶(sigma)的m199中培养3小时。通过使用抗sm单克隆抗体(sigma)发现分离的细胞是血管平滑肌细胞。分离的血管平滑肌细胞以30%的浓度接种,并且在24小时后,使用成骨基础培养基(osteogenicsinglequots,lonza,usa)替换培养基。在28天培养期间以3天间隔替换培养基。
对于野生型小鼠和enosko小鼠,通过使用alp染色作为初始钙化阶段的染色方法,茜素红(ar)染色作为中间钙化阶段的染色方法,和vonkossa(vk)染色作为最后钙化阶段的染色方法,确定cd26是否促进血管平滑肌细胞的成骨分化。
结果是,如在图5中可见,与对照小鼠相比,在enos敲除的转基因小鼠中促进血管平滑肌细胞(vsmc)的成骨分化。
根据制造商的说明使用商业elisa试剂盒(sigma)测量血管平滑肌细胞的培养物中游离cd26/dpp-4的浓度。结果是,如图6a所示,增加来自enos-/-小鼠的vsmc培养物中的dpp-4浓度。
通过实时pcr测量主动脉瓣膜组织中ddp-4mrna表达水平。结果是,如在图6b中可见,与野生型小鼠相比,enos-/-小鼠的主动脉瓣膜组织中的ddp-4mrna表达增加。
此外,通过elisa测量enos-/-小鼠和野生型小鼠中的血浆dpp-4蛋白质水平。结果是,如在图6c中可见,与野生型小鼠相比,enos-/-小鼠中的血浆dpp-4蛋白质水平增加。
实施例4:观察血管平滑肌细胞(vsmc)中no诱导的dpp-4表达的调控
使用no生物合成抑制剂l-name(nω-硝基-l-精氨酸甲酯)的处理显著增加主动脉中的dpp-4表达。因此,已知no耗尽诱导dpp-4表达。
在此实施例中,使用no供体deta-nonoate(deta-no)处理根据实施例3的方法获得的血管平滑肌细胞。结果是,显示vsmc中dpp-4mrna的表达降低(图7a),并且vsmc中dpp-4蛋白的表达也降低(图7b)。
为了获得更多no调控功能在降低dpp-4表达方面的直接证据,确定dpp-4启动子活性是否将通过no调控。
结果是,显示enos-/-小鼠vsmc的dpp-4启动子活性高于野生型小鼠vsmc,并且此活性以浓度依赖性方式通过使用deta-no处理而抑制(图7c)。
vsmc中的nf-κb活性受no抑制。显示enos-/-小鼠vsmc的nf-κb活性高于野生型小鼠vsmc,并且此活性通过使用deta-no处理而降低(图7d)。因为dpp4启动子具有认定的nf-κb结合位点,所以本发明的发明人确定nf-κb活性是否可直接调控dpp-4启动子活性。
首先,在6孔板中培养vsmc以达到80%的汇合(confluency)。使用lipofectamine2000(lifetechnology),含有正常或突变nf-κb结合位点的dpp-4报告基因被克隆到pgl3基本载体(promega)中,并且使用载体转染细胞。在24小时后,使用dual-glo荧光素酶测定系统(promega)测量细胞中的萤火虫荧光素酶和海肾荧光素酶活性。萤火虫荧光素酶使用海肾荧光素酶活性归一化。
对于nf-κb结合位点的定点突变(site-directedmutagenesis)(sam),使用以下引物进行pcr。
seqidno1:5'-cagccagataacatgccacacccaaccccttc-3;
seqidno2:5'-gaaggggttgggtgtggcatgttatctggctg-3'。
结果是,如图8所示,dpp-4启动子的nf-κb结合位点的突变显著抑制dpp-4启动子活性,并且使用nf-κb抑制剂处理完全抑制dpp-4生成(图7e)。所述结果表明,在血管平滑肌细胞中nf-κb活化诱导dpp-4通过no耗竭发生,并且vsmc的成骨分化可通过控制no供应来调节。
实施例5:评价dpp-4抑制剂西格列汀对主动脉瓣膜钙化的效果
主动脉瓣膜钙化期间dpp-4的显著增加表明dpp-4在主动脉瓣膜钙化中发挥潜在作用。为了证明这一点,使用选择性dpp-4抑制剂西格列汀处理enos-/-小鼠的主动脉钙化,并且检查西格列汀的效果。
使用c57bl/6jenos-/-(内皮型一氧化氮合酶敲除)小鼠(8周龄,n=10,thejacksonlaboratory,barharbor,me,usa)和c57bl/6j野生型小鼠(8周龄,野生型,wt,n=10)。在购买后,使用标准啮齿动物饲料喂养小鼠直到3月龄,并且施用盐水或西格列汀(15mg/kg/天,merck&co.,inc.)12周。
为了检测enos-/-小鼠的成骨活性,经由尾静脉注射双膦酸盐缀合的显像剂(osteosense680,visenmedicalinc.)。osteosense680结合体内的钙化部位(具体是羟磷灰石)并且起显像剂作用,以检测成骨细胞活性。将小鼠安乐死,然后使用optixmx3(artadvancedresearchtechnologies,inc)使整体或分离的主动脉显像。
结果是,显示enos-/-小鼠的严重主动脉钙化(图9),以及口服施用西格列汀减少活体小鼠的主动脉钙化(图9a和9b)。此外,在来自enos-/-小鼠的主动脉瓣膜的vk-染色切片中,发现当抑制dpp-4活性时,可抑制主动脉钙化(图10a和10b)。
实施例6:评价人主动脉瓣膜间质细胞(vic)中西格列汀治疗的效果
人主动脉瓣膜间质细胞(vic)是不同种类细胞的集合,其包括成纤维细胞、成肌细胞和平滑肌细胞,具有与vsmc相似的特征,并且能够分化为成骨细胞。
使用人vic,分析成骨细胞分化中dpp-4的作用。
根据常规细胞分离方法从主动脉瓣膜小叶(aorticvalveleaflet)中分离人vic,并且使用处于第2至10次传代的vic细胞。使用dpp-4(r&d)、西格列汀或deta-nonoate(enzolifesciences)培养vic细胞。
结果是,如图11所示,dpp-4处理增加了vic的成骨能力,并且这种现象通过西格列汀处理来消除。
为了检查dpp-4与疾病活动的关系,分析cavd患者的血浆dpp-4水平。将具有风湿性主动脉瓣疾病患者和施用dpp-4抑制剂的患者从分析中排除。
结果是,cavd患者的dpp-4水平高于正常人的dpp-4水平(图12和表1)。
表1:主动脉瓣膜疾病患者的临床特征
具有钙化的cavd患者中的dpp-4水平比没有钙化的患者高34%(图13a),并且cavd患者中具有降解活化蛋白能力的dpp-4也增加(图13b)。这表明dpp-4循环水平与cavd患者的严重程度相关(表2)。
表2:通过ct钙评分(calciumscore)确定的cavd患者的临床特征
实施例7:评价施用各种dpp-4抑制剂对抑制vsmc的成骨细胞分化的效果
为了检查除西格列汀之外的dpp-4抑制剂对抑制瓣膜钙化的效果,评价使用各种dpp-4抑制剂处理对抑制enos-/-小鼠vsmc(小鼠平滑肌细胞)的成骨细胞分化的效果。
将在48孔板中培养的enos-/-小鼠vsmc各使用10m的阿格列汀(alogliptin)、依格列汀(evogliptin)、利格列汀(linaglipin)、沙格列汀(saxagliptin)、维格列汀(vildagliptin)处理7天,并且测量细胞中的alp活性。结果是,与未使用dpp-4抑制剂处理的阴性对照组的alp活性抑制相比,观察到50%或更低的alp活性抑制。这表明除西格列汀之外的dpp-4抑制剂也展现对主动脉瓣膜硬化的抑制效果。
虽然已经参考具体特征详细描述了本发明,但是对本领域技术人员显而易见的是,本说明书仅针对优选的实施方案,并且不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同物来定义。
工业实用性
当瓣膜钙化时,本发明的dpp-4以增加的水平表达,并且当施用dpp-4抑制剂时,钙化显著降低。因此,dpp-4抑制剂可用于瓣膜的治疗或预防。
序列表
<110>财团法人峨山社会福祉财团
蔚山大学校产学协力团
<120>含有dpp-4抑制剂的用于预防或治疗瓣膜钙化的组合物
<130>pf-b1928
<140>pct/kr2015/001902
<141>2015-02-27
<160>2
<170>patentinversion3.5
<210>1
<211>32
<212>dna
<213>人工序列
<220>
<223>引物
<400>1
cagccagataacatgccacacccaaccccttc32
<210>2
<211>32
<212>dna
<213>人工序列
<220>
<223>引物
<400>2
gaaggggttgggtgtggcatgttatctggctg32
- 还没有人留言评论。精彩留言会获得点赞!