含亚氨基二乙酸的99mTc标记的RGD多肽肿瘤诊断药物及其制备方法与流程
本发明涉及用于肿瘤诊断的放射性药物,特别涉及含新双功能连接剂的用于intergrinαvβ3受体阳性肿瘤诊断的RGD多肽放射性药物及其制备方法。
背景技术:
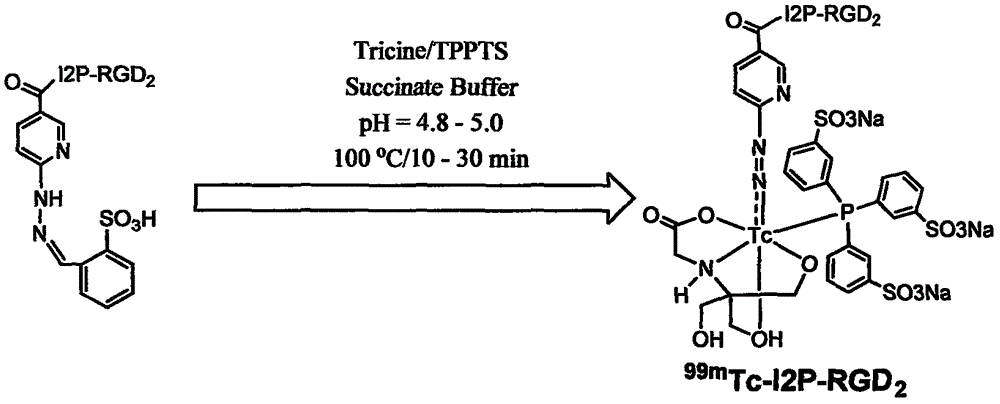
:据世界卫生组织(WHO)统计,全世界恶性肿瘤每年发病1100多万人,病死800多万人。恶性肿瘤发病率在我国也呈明显上升趋势,据国家卫生资料统计,近两年来我国城市居民恶性肿瘤占死亡原因的第1位,每年新增患者约220万人。近年来恶性肿瘤的治疗手段在不断发展,不仅传统的化疗和放疗技术更加规范化和科学化,新的治疗方法,如:分子靶向治疗、免疫治疗和基因治疗等,正在逐步应用于临床。与之相适应,要求恶性肿瘤诊断技术不仅要能够进行准确的诊断,更迫切需要进一步反映恶性肿瘤的生物学行为和病理特点,为治疗方案的科学化决策提供确切的依据。恶性肿瘤的转移潜力直接关系到患者的预后,同时对于临床医师选择治疗方案具有至关重要的意义。但目前临床上还缺乏准确判定恶性肿瘤转移能力的检测方法,而主要依靠经验判断。新生血管和淋巴管的形成在肿瘤发生、发展和转移中发挥着重要的作用,肿瘤新生血管形成促进肿瘤生长和转移,淋巴道形成与肿瘤转移直接相关。整合素(integrin)是一组跨膜糖蛋白,由一个α亚单位和β亚单位通过非共价键组成的异二聚体,也是细胞外基质蛋白的受体,与细胞外基质蛋白(如纤维结合蛋白、玻璃结合蛋白、层粘蛋白和胶原等)的受体识别序列RGD(精氨酸-甘氨酸-天冬氨酸)特异结合。整合素调控新生血管和淋巴道的形成。诸多研究表明,整合素调控金属基质蛋白酶等蛋白水解酶,直接参与细胞外基质的降解,促使肿瘤转移;整合素的丰富表达是促使肿瘤细胞和血管内皮细胞迁移和侵袭的重要分子,它直接介导肿瘤细胞与基质蛋白的粘附和结合;参与调控胞内细胞骨架构成,细胞增殖。αvβ3是目前研究最多的整合素分子,在骨肉瘤、成神经细胞瘤、肺癌、乳腺癌、前列腺癌、膀胱癌、胶质母细胞瘤及浸润性黑色素瘤等多种实体肿瘤细胞表面和肿瘤新生血管均有丰富的表达,在成熟血管内皮细胞和绝大多数正常组织表达缺乏或几乎不表达。αvβ3受体介导肿瘤细胞粘附和移行,在肿瘤新生血管生成和淋巴道转移发挥重要作用。αvβ3的表达水平与恶性肿瘤的浸润转移能力等恶性表型有关,也可以作为评价某些恶性肿瘤预后的的指标。放射性核素标记的RGD序列配体已经被用于肿瘤的放射性核素显像研究,用于检测转移潜力较高的integrinαvβ3表达阳性的肿瘤。已有的研究结果认为:RGD多肽二聚体显像剂与恶性肿瘤表面integrinαvβ3的亲和力更好,要优于RGD多肽四聚体。目前报道的RGD环肽二聚体E[c(RGDxk)]2(E代表谷氨酸,c代表环化,R代表精氨酸,G代表甘氨酸,D代表天冬氨酸,x为f或y,分别代表苯丙氨酸和酪氨酸),其两个RGD模序之间的距离为6个键,由于距离不够长,因此E[c(RGDxk)]2的两个RGD模序很难同时与细胞表面相邻的两个integrinαvβ3受体结合。但目前已有的RGD多肽二聚体显像剂在非靶器官,特别是肠道等器官的摄取较多,腹部本底较高,干扰了腹部肿瘤的成像效果,肝脏和肾脏摄取高。因此,有必要发明新型的RGD多肽二聚体显像剂,通过改变配体的结构,采用新的双功能连接剂进一步降低显像剂在肠等非靶器官的摄取,从而降低放射性本底,提高肿瘤显像的图像质量。技术实现要素:为克服已有技术的缺点,本发明的主要目的在于提供一种具有制备简单、价格低廉、标记率和放射化学纯度高、靶与非靶比值高、肿瘤摄取值高且滞留时间长等优点的以亚氨基二乙酸为双功能连接剂的99mTc标记RGD多肽肿瘤诊断药物。为达到上述目的,本发明的主要技术方案如下:将HYNIC-OSu与亚氨基二乙酸化的RGD肽二聚体I2P-RGD2相连接,制备得到配体HYNIC-I2P-RGD2。再利用配体中HYNIC的螯合作用,实现99mTc标记,制成RGD多肽二聚体显像药物99mTc-I2P-RGD2。在配体结构中引入亚氨基二乙酸以及两个PEG4连接链,减少了药物在肝脏、肾脏和肠道中的摄取,从而降低了放射性本底,提高了肿瘤显像的图像质量。具体技术方案如下:(1).一类含亚氨基二乙酸为双功能连接剂的99mTc配合物99mTc-I2P-RGD2,其结构式如下式(1)所示:(2).一种用于制备如上述(1)所述的含亚氨基二乙酸的99mTc配合物99mTc-I2P-RGD2的方法,其特征在于,主要步骤为:先将HYNIC-OSu与亚氨基二乙酸化的RGD肽二聚体I2P-RGD2反应,使二者相连接,制备得到配体HYNIC-I2P-RGD2;再向反应瓶中加入20-25μgHYNIC-I2P-RGD2、5mg三苯基膦三间磺酸钠(TPPTS)、6.5mgN-三(羟甲基)甲基甘氨酸(Tricine)、40mg甘露醇、38.5mg六水合琥珀酸二钠、12.7mg琥珀酸和1.0-1.5mLNa99mTcO4生理盐水溶液(1,110-1,850MBq),在沸水浴下反应10-15min得到。(3)如(1)所述的含亚氨基二乙酸为双功能连接剂的99mTc配合物99mTc-I2P-RGD2在制备肿瘤诊断药物中的应用。附图说明[图1]是表示标记前体化合物HYNIC-I2P-RGD2的合成路线示意图;[图2]是表示99mTc标记的诊断药物99mTc-I2P-RGD2的合成路线示意图;[图3]是表示99mTc-I2P-RGD2的放射性HPLC图谱;[图4]是表示在过量E[c(RGDfK)]2抑制或未经E[c(RGDfK)]2抑制的条件下,99mTc-I2P-RGD2在荷U87MG人胶质瘤裸鼠中注射后60min的生物分布。[图5]是表示99mTc-I2P-RGD2在荷U87MG人胶质瘤裸鼠模型中的3D和横断面的SPECT-CT图像。具体实施方式一.99mTc标记的RGD多肽肿瘤诊断药物的制备方法1.材料和设备化学试剂均购于美国Sigma/Aldrich公司,无需进一步纯化。I2P-RGD2环肽二聚体(I2P-RGD2)由美国PeptidesInternational公司(Louisville,KY)按照常规工艺制造。HYNIC-Osu根据以往文献中方法进行合成,属于本领域普通技术知识。ESI(电喷射离子化)质谱数据由FinniganLCQ传统质谱仪上采集获得。99mTcO4-从原子高科股份有限公司购得。2.HPLC(高效液相色谱)方法HPLC方法1:使用LabAillance色谱系统,包括紫外-可见光检测仪(波长为254nm)和ZorbaxC18半制备柱(柱宽×柱长为9.4nm×250mm,固定相的孔径大小为美国AgilentTechnologies公司提供)。流速为2.5mL/min,流动相A相为含0.1%TFA的水;B相为含0.1%TFA的甲醇。流动相梯度:0-5min,90%A->80%A;5.01-20min,80%A->70%A。HPLC方法2:使用LabAillance色谱系统,包括-ramIN/US检测仪(Tampa,FL)和ZorbaxC18色谱柱(柱宽×柱长为4.6mm×250mm,固定相的孔径大小为美国AgilentTechnologies公司提供)。流速为1mL/min,流动相A相为25mMNH4OAc;B相为乙腈。流动相梯度为0-5min,90%A;5.01-20min,90%A->60%A;20.01-25min,60%A->40%A。3.标记前体化合物HYNIC-I2P-RGD2的制备方法将HYNIC-Osu(13.5mg,30μmol)和I2P-RGD2(5.9mg,3.2μmol)溶于DMF(2mL)。滴加过量的DIEA(5滴)至上述混合液,室温搅拌24h至反应结束。将2mL水加至反应液中,用三氟乙酸(TFA)调节pH至3~4。产品经HPLC分离纯化(HPLC方法1),收集保留时间12~15min的组分,冷冻干燥后得到5.8mg目标产物HYNIC-I2P-RGD2(合成路线图参见图1)。ESI-MS(C95H141N25O30S):实验值为2145.28([M]+),计算值为2145.00([M]+)。4.99mTc-I2P-RGD2的制备方法将1.0~1.5mL含有1110~1850MBqNa99mTcO4的生理盐水加至含有20-25μgHYNIC-I2P-RGD、5mgTPPTS、6.5mgtricine、40mg甘露醇、38.5mg六水合琥珀酸二钠和12.7mg琥珀酸的冻干瓶中。将上述反应液在沸水浴中反应10~15min,然后在室温中放置5min,采用HPLC对反应产物进行分析(HPLC方法2)(合成路线参见图2)。将上述反应液配制成约30μCi/mL的生理盐水溶液用于生物分布研究,配制成约1mCi/mL的生理盐水溶液用于显像研究。用于上述两个实验的99mTc-I2P-RGD2,其放化纯度>90%。在给动物注射前,溶液均经0.20μmMillex-LG滤膜过滤,每只动物注射0.1mL。从99mTc-I2P-RGD2的放射性HPLC图谱(参见图3)可见,99mTc-I2P-RGD2具有高的放射化学纯度,RCP>95%。二.动物实验生物分布及显像研究依据美国国家卫生研究院动物实验指南进行,并符合动物伦理的要求。U87MG胶质瘤细胞株用含厄尔平衡盐缓冲液的MEM培养基培育,并培养基中添加了10%胎牛血清和1%青霉素和链霉素。肿瘤细胞于37℃,含有5%CO2的培养箱中培养。所有细胞单层生长,待达到90%汇合度时收获。选择雌性4-5周龄裸鼠,将肿瘤细胞悬于生理盐水中,数量调整为5×107个/mL,取0.1mL细胞悬液植于裸鼠肩侧。所有步骤均于超净台内进行。待肿瘤长至0.1~0.5g时进行实验。1.99mTc-I2P-RGD2在荷U87MG人胶质瘤的裸鼠中的生物分布实验随机选择5只荷瘤小鼠(20~25g),均于尾静脉注射约3μCi99mTc-I2P-RGD2。在注射5、30、60和120min后,将动物用过量的戊巴比妥钠(约200mg/kg)麻醉处死。从心脏取血样,再取出肿瘤及正常器官(脑、眼、心、脾、肺、肝、肾、肉和肠),用生理盐水洗涤后擦干称重,并用PerkinElmerWizard1480γ计数器(Shelton,CT)测计数,从而计算出各组织的单位质量注射剂量百分数(%ID/g)和瘤与正常组织的比值。表1列出了99mTc-I2P-RGD2在荷U87MG人胶质瘤的裸鼠中不同时相的生物分布数据;表2对荷U87MG人胶质瘤裸鼠注射后60min后,99mTc-99mTc-I2P-RGD2和99mTc-3P-RGD2的生物分布数据进行了比较。表199mTc-I2P-RGD2在荷U87MG人胶质瘤的裸鼠中的生物分布数据(%ID/g)器官5min30min60min120min血3.62±0.411.02±0.040.51±0.050.27±0.04脑0.34±0.100.30±0.060.16±0.020.18±0.06眼2.48±0.633.46±0.922.25±1.111.96±0.72心4.30±0.913.21±0.801.82±0.391.51±0.43肠23.99±5.7212.32±2.897.36±1.347.11±0.84肾24.80±3.8316.07±1.4312.17±1.169.73±1.37肝5.55±0.492.45±0.191.76±0.211.67±0.40肺6.44±1.214.55±0.482.28±0.452.27±0.27肌肉2.46±0.502.19±0.281.39±0.341.21±0.36脾5.03±0.653.26±0.622.91±0.702.69±0.53肿瘤7.24±1.186.61±0.885.61±1.385.28±1.31肿瘤/血2.04±0.296.48±0.729.31±0.4422.35±4.51肿瘤/肝1.32±0.282.68±0.592.85±0.333.47±0.75肿瘤/肺1.08±0.121.44±0.202.13±0.302.34±0.41肿瘤/肌肉3.13±0.513.10±0.263.33±0.523.82±0.15表2注射后60min,99mTc-I2P-RGD2与99mTc-3P-RGD2在荷U87MG人胶质瘤裸鼠中的生物分布数据比较(%ID/g)器官99mTc-I2P-RGD299mTc-3P-RGD2血0.51±0.050.70±0.11脑0.16±0.020.16±0.02眼2.25±1.112.00±0.28心1.82±0.392.01±0.19肠7.36±1.344.98±0.21肾12.17±1.1620.39±0.90肝1.76±0.214.68±0.40肺2.28±0.453.41±0.57肌肉1.39±0.341.73±0.25脾2.91±0.703.64±0.34肿瘤5.61±1.384.68±0.61肿瘤/血9.31±0.446.68±1.21肿瘤/肝2.85±0.331.01±0.45肿瘤/肺2.13±0.301.37±0.25肿瘤/肌肉3.33±0.522.70±0.89从表1中可以看出,注射后5、30、60和120min,99mTc-I2P-RGD2的肿瘤摄取依次为7.24±1.18、6.61±0.88、5.61±1.38和5.28±1.31%ID/g,注射后60min的肿瘤摄取值明显高于99mTc-3P-RGD2。注射后5、30、60和120min,99mTc-I2P-RGD2在肝中的摄取依次为5.55±0.49、2.45±0.19、1.76±0.21和1.67±0.40%ID/g,肿瘤/肝摄取比值依次为1.32±0.28、2.68±0.59、2.85±0.33和3.47±0.75。注射后60min内,99mTc-I2P-RGD2在肝中的摄取与99mTc-3P-RGD2相比明显降低。99mTc-I2P-RGD2在肾脏中的摄取值为12.17±1.16%ID/g,也明显低于99mTc-3P-RGD2的20.39±0.90%ID/g,p<0.01(表2)。因此,认为99mTc-I2P-RGD2在非靶组织中的摄取更低,性能优于99mTc-3P-RGD2。2.99mTc-I2P-RGD2在荷U87MG人胶质瘤的裸鼠中的抑制实验随机选择4只荷瘤小鼠(20-25g),均于尾静脉共注射约3μCi99mTc-I2P-RGD2和约350μg(约14mg/kg)的经典整合素αvβ3拮抗剂E[c(RGDfK)]2(RGD2)。在注射60min后,将动物用过量的戊巴比妥钠(约200mg/kg)麻醉处死。从心脏取血样,再取出肿瘤及正常器官(脑、眼、心、脾、肺、肝、肾、肉和肠),用生理盐水洗涤后擦干称重,并用PerkinElmerWizard1480γ计数器(Shelton,CT)测计数,从而计算出各组织的单位质量注射剂量百分数(%ID/g)。抑制实验的结果见图4。由图可知,未注射过量RGD2时99mTc-I2P-RGD2的肿瘤摄取为5.61±1.38%ID/g,而共注射过量RGD2后肿瘤摄取降至0.59±0.28%ID/g,可见过量的RGD2显著抑制了99mTc-I2P-RGD2在肿瘤中的摄取。同样地,RGD2也抑制了99mTc-I2P-RGD2在正常组织中的摄取。未经抑制时99mTc-I2P-RGD2在肠、肺和脾的摄取为7.36±1.34,2.28±0.45,2.91±0.71%ID/g,而抑制后它们相应的摄取依次降至0.88±0.26、0.85±0.39和0.51±0.03%ID/g。上述实验清楚地证明,99mTc-I2P-RGD2在肿瘤中的定位是具有integrinαvβ3特异性的。3.99mTc-I2P-RGD2在荷U87MG人胶质瘤的裸鼠中的SPECT-CT显像研究SPECT/CT显像采用配有0.6mm多针孔准直器的u-SPECT-II/CT扫描仪(Milabs,Utrecht,TheNetherlands)。荷胶质瘤的小鼠经尾静脉注射剂量为37.0MBq的99mTc-I2P-RGD2,体积为0.1mL。注射后60min后将其置于连有异氟醚麻醉装置的屏蔽室内(Univentor,Zejtun,Malta),通过流速为350mL/min含有3.0%异氟醚的气流进行麻醉。麻醉完毕后,立即将动物仰卧在扫描床上进行SPECT-CT扫描,并将气流调整为流速250mL/min,含有2.0%异氟醚。显像结束后,SPECT图像采用迭代法(6次迭代,16个子集)进行重建,并进行SPECT图像与CT图像的融合。显像结果见图5,可见肿瘤部位放射性浓聚,显影清晰,肺、肠道等器官放射性本底较低。由上述数据可见,99mTc-I2P-RGD2相比99mTc-3P-RGD2在多个方面均具备明显的优势,可适用于临床中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1