一种复合疫苗佐剂及其应用的制作方法
本发明涉及免疫学技术领域,具体涉及一种复合疫苗佐剂及其在免疫治疗及预防领域的用途。
背景技术:
佐剂是非特异性的免疫调节剂,在疫苗中添加佐剂,可起到提高免疫反应强度、改变免疫反应类型、延长免疫反应持续时间等多种作用。特别是对免疫原性较弱的疫苗(如灭活疫苗、亚单位疫苗、重组蛋白疫苗、多肽疫苗等),合理的应用佐剂可提高疫苗在不同免疫背景人群中接种的阳转率。此外,添加佐剂还可降低疫苗中抗原的用量,减少疫苗针次,有助于降低疫苗成本及解决疫情爆发时的产能问题。
早期的佐剂研究主要基于经验,由于缺乏技术及免疫机制研究的支持,佐剂的研发相对滞后于疫苗研发。自铝佐剂首次应用于人体,有近70年的时间,它是唯一的人用佐剂(o'hagandt等人.expertrevvaccines2013jan;12(1):13-30)。虽然铝佐剂成本低、安全性好,但该类佐剂主要活化th2类免疫反应,对细胞免疫没有强化作用,且在许多人用疫苗(尤其是重组蛋白疫苗和多肽疫苗)中没有明显的强化免疫反应的效果。因此,随着越来越多候选疫苗的涌现及疫苗经济效益的凸显,对临床上可用的新型佐剂的需求正在快速增长。
乳剂型佐剂(包括水包油乳剂、油包水乳剂等)是新型佐剂的一个重要分支,动物实验显示,乳剂可联合多种弱抗原使用(重组蛋白、多肽等),并诱发高滴度的抗原特异性抗体。油相成分、水相成分及乳化剂是乳剂的三大要素,这三个要素的选择和配比决定了乳剂的安全性、稳定性及免疫刺激活性。油包水乳剂以油相成分为主,乳化后黏度大,在体内扩散较慢,对抗原的缓释作用强,但局部刺激性和副反应较大,因此限制了其在人体的应用。而水包油乳剂以水相成分为主,人体耐受性较高,且与多数疫苗抗原的相容性较好。由于矿物油等不可代谢的油类成分可造成局部机体损伤,引起注射部位的毒副反应,因此人用佐剂研发时通常选择可代谢的植物油、动物油等(如花生油、角鲨烯等)。乳剂中常用的乳化剂多为安全性好的非离子型乳化剂。乳化剂的选择通常依据其亲水亲油平衡值(hlb值),一般而言,hlb值越低表示乳化剂亲水性越弱,亲油性越强,倾向于形成w/o型乳状液;反之,hlb值越高,说明乳化剂的亲水性越强,亲油性越弱,倾向于形成o/w型乳状液。值得注意的是,hlb值只能确定所形成的乳状液类型,但由于乳化剂结构、分子大小和用量等其他参数的差异,相同hlb值的乳化剂乳化性能也不尽相同。研究发现,不同hlb值的乳化剂混合使用可以形成稳定的界面,防止颗粒凝集(boydj等人.jcolloidinterafeesci,1972,41:359-370),因此,疫苗佐剂中常使用两种及以上的乳化剂进行配比。不同的油相成分、水相成分及乳化剂混合后,各种成分的相互作用方式复杂多样,因此,采用不同配方制备的乳剂,其佐剂活性是难以预测的。
目前已获批上市的水包油乳剂佐剂有3种,分别是mf59、as03及af03,包含的油相成分均为角鲨烯。其中,mf59获批最早、应用范围最广。mf59的乳化剂为tween-80及span-85,均为人体可降解的表面活性剂,与角鲨烯及缓冲液混合,充分乳化后形成的水包油乳液中包含直径约160nm的液滴(o'hagandt等人.expertrevvaccines2013jan;12(1):13-30)。以mf59为佐剂的流感疫苗
除了乳剂型佐剂之外,具有免疫刺激活性的分子也是新型佐剂的发展方向之一。特别是pam3cys、polyic、mpl、咪喹莫特(imiquimod)、cpgodn等tlr刺激剂,联合多种疫苗使用进入了临床试验(steinhagenf等人.vaccine2011apr12;29(17):3341-55)。这类佐剂通常活化th1主导的免疫反应。其中polyic是人工合成的双链rna,免疫后可同时活化体液免疫及细胞免疫反应,其已知受体为tlr3和mda-5(yoshidai等人.microbiolimmunol2013may;57(5):329-33)。tlr3在mdc、t细胞等免疫细胞以及成纤维细胞等非免疫细胞均有表达,是目前已知的唯一不依赖myd88的tlr,活化后可引起i型ifn分泌,从而介导dc细胞共刺激分子及mhcii分子表达上调(o'neillla等人.natrevimmunol2007may;7(5):353-64)。mda-5可识别细胞质中的dsrna,polyic与mda-5结合后,下游通过ips-1/fadd/tbk1通路也可刺激i型ifn的释放。由于polyic具有很强的促细胞免疫反应作用,它在抗病毒及抗肿瘤治疗领域均有很好的应用前景,目前已作为恶性胶质瘤、皮肤癌、卵巢癌等肿瘤的治疗性疫苗佐剂进入临床试验(ammir等人.pharmacolther2015feb;146:120-31)。在我国,以polyic为主要成分的聚肌胞注射液已在临床上用于治疗带状疱疹等病毒感染相关疾病。此外,含pika佐剂(主要成分为polyic)的狂犬病疫苗已在新加坡进行了i期临床试验,结果显示该佐剂具有很好的安全性,且含pika佐剂的疫苗免疫活性优于无佐剂的对照疫苗(wijayal等人.vaccine2017jan;35:1175–1183)。
由于目前已知的乳剂型佐剂与tlr刺激剂活化免疫反应的机制存在明显差异,活化的免疫反应类型也不相同,将二者联合使用,可望通过协同作用更为全面地活化免疫反应。将安全性好的乳剂与免疫刺激活性强的tlr刺激剂混合使用,亦可望减少后者的用量,将免疫反应的强度控制在一定范围内,兼顾安全性和有效性。但不同机制的佐剂混合应用,是否具有互补性,其安全性和佐剂活性会发生何种变化,各种佐剂组分以何种比例配制可在确保安全性的前提下最大化免疫刺激活性,这些问题均无法预测,需要实验验证。因此,发明人将本发明所述的水包油乳剂与tlr刺激剂,特别是mf59与polyic及各种稳定剂,按一定比例混合后,与不同类型的疫苗联合免疫,发现两种类型的佐剂优势互补,不仅提高了抗原特异性的抗体水平,还有效地活化了特异性的细胞免疫反应,且在动物实验中表现出了很好的耐受性。因此,采用这种策略获得的新佐剂具有很好的应用前景,可望同时应用于预防性疫苗及治疗性疫苗领域。
技术实现要素:
本发明的目的是提供一种新的安全性及免疫刺激活性好、具有人体应用前景的复合佐剂,以及包含该复合佐剂的免疫组合物,并研究该复合佐剂及免疫组合物在免疫治疗及预防领域的用途。
本发明人经研究出人意料地发现,采用恰当的配伍方式将水包油乳剂、tlr刺激剂及稳定剂进行组合,构成的复合佐剂具有良好的安全性及更强的免疫刺激活性,且与hpvvlp疫苗、hpvl2多表位疫苗、hiv嵌合vlp疫苗及灭活狂犬疫苗等不同形式的疫苗联合应用,均可显著提高疫苗的免疫原性。本发明基于以上发现,现已完成,在本文实施例中提供数据。
本发明第一方面提供一种佐剂组合物,其包含水包油乳剂、tlr刺激剂及稳定剂。具体的,水包油乳剂占佐剂组合物总体积的50%-95%,tlr刺激剂的浓度为5μg/ml-1000μg/ml、人体可耐受的稳定剂浓度为1μg/ml-10mg/ml。
具体的,本发明第一方面提供的佐剂组合物中,其水包油乳剂成分主要由水相成分、油相成分及乳化剂构成,所述组分按比例混合后经超声或高压均质等方式恰当乳化,可形成颗粒均一稳定的乳状悬液。
优选的,本发明所述的佐剂组合物中,其水包油乳剂包含的水相成分为人体可耐受的缓冲体系,由ph缓冲剂及离子强度调节剂构成,其ph缓冲剂选自但不限于铵盐、柠檬酸盐、醋酸盐、硼酸、磷酸盐、硫酸盐、tris、琥珀酸、马来酸、各种氨基酸等;其离子强度调节剂选自但不限于氯化钠、氯化钾、磷酸钠、磷酸钾等。特别优选的,本发明所述的佐剂组合物中,其水包油乳剂的水相成分由磷酸盐缓冲液(pbs)构成。水相成分的ph值控制在人体可耐受的范围内,优选的,其范围在ph5.0-8.5,更优选的为ph6.0-8.0,特别优选的为ph6.5-7.5。
优选的,本发明所述的佐剂组合物中,其油相成分为可代谢油,选自但不限于角鲨烯、胆固醇、植物油等;特别优选的,本发明所述的复合佐剂其油相成分为角鲨烯。角鲨烯含量不超过乳剂总体积的10%(v/v),优选的为乳剂总体积的0.25%-10%(v/v),或者0.5%-5%(v/v),或1%-5%(v/v),或3%-5%(v/v),或0.5%-1.5%(v/v),特别优选的,其含量为5%(v/v)。
可选的,本发明所述的水包油乳剂中,还可包含各种脂溶性成分,选自但不限于母育酚(例如α-生育酚及其衍生物)、甾醇类化合物、磷脂(例如卵磷脂、脑磷脂、心磷脂)等。
优选的,本发明所述的佐剂组合物中,所述乳化剂为表面活性剂的组合物,选自但不限于pluronicl121、甘露醇一油酸、聚氧乙烯脱水山梨醇单油酸酯(吐温80/聚山梨酯80/tween-80)、聚氧乙烯失水山梨醇月桂酸酯(吐温20/tween-20)、山梨醇酐三油酸酯(斯盘85/span-85)、失水山梨糖醇脂肪酸酯(斯盘80/span-80)、三甘醇单月桂基醚(布里杰30/brij30)、聚乙二醇十六烷基醚(布里杰56/brij56)、聚乙二醇辛基苯基醚(tritonx-100)等;更优选的,所述乳化剂为tween-80及span-85的组合物,且所述乳化剂含量占乳剂总体积的0.01%-10%(v/v);优选的,所述乳化剂的含量占乳剂总体积的0.3%-3%(v/v);特别优选的,所述乳化剂中tween-80的含量及span-85的含量均为乳剂总体积的0.5%(v/v)。
特别优选的,本发明所述的佐剂组合物中,所述水包油乳剂为mf59佐剂。
制备水包油乳剂的方法是本领域技术人员公知的(例如专利cn101522218b)。具体的,将所述油相成分、水相成分及乳剂混合后,通过多次高压均质,直至获得包含所需直径油滴的均一制剂。本发明所述的水包油乳剂中,包含的油滴具有亚微米级的直径,其平均直径小于1μm;优选的,油滴直径小于500nm;更优选的,小于300nm;特别优选的,其直径范围在140-170nm之间,或在100-140nm之间,或在50-100nm之间。
此外,本发明第一方面所述的佐剂组合物,其中tlr刺激剂选自tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9等tlr的天然或人工合成的刺激剂,具体的,所述tlr刺激剂选自但不限于pam2csk4、聚肌苷酸-聚胞苷酸(polyic)、lps衍生物、鞭毛蛋白及其突变体、咪唑喹啉及其衍生物、cpg等;优选的,所述tlr刺激剂为tlr3刺激剂;更优选的,所述tlr刺激剂为聚核苷酸组合物;特别优选的,所述tlr刺激剂为polyic。本发明所述的polyic为异质性的聚核苷酸混合物,其分子量在66,000至1200,000道尔顿之间,优选的所述polyic的分子量在66,000至990,000道尔顿之间,特别优选的,其分子量在66,000至660,000道尔顿之间,在相关实施例中,使用的polyic均具有该分子量。
本发明第一方面所述的佐剂组合物还包含人体可耐受的稳定剂,所述稳定剂具有与tlr刺激剂结合、降低其毒性并延长其半衰期的作用,因此可进一步增强佐剂的免疫刺激活性。
优选的,所述稳定剂包含选自但不限于带有钙、镉、锂、镁、铈、铯、镉、钴、氘、镓、碘、铁或锌等阳离子的化合物且所述阳离子化合物呈无机盐或有机复合物的形式;更优选的,所述稳定剂选自但不限于氯化钙、碳酸钙、氟化钙、磷酸钙、硫酸钙或葡萄糖酸钙等钙离子化合物;特别优选的,所述稳定剂包含氯化钙。
可选的,本发明所述稳定剂还包含人体可耐受的抗生素,例如但不限于泰百霉素、蒽环霉素、硫酸丁酰苷菌素、庆大霉素、潮霉素、丁胺卡那霉素、双去氧卡那霉素、暗霉素、美它酰胺、新霉素、嘌呤霉素、链霉素或链脲霉素等抗生素;优选的,本发明所述稳定剂包含氨基类抗生素;更优选的,本发明所述稳定剂包含卡那霉素。
特别优选的,本发明第一方面所述的佐剂组合物中,包含的tlr刺激剂及人体可耐受的稳定剂的组合物为pika佐剂,具体的,其成分包含polyic、氯化钙和卡那霉素。
可选的,本发明所述稳定剂还包含非抗生素类多氨基多羟基化合物,这些多氨基多羟基化合物应具有良好的人体耐受性,与疫苗及佐剂联合使用时不会增加不良反应;优选的,本发明所述的多氨基多羟基化合物是人体可代谢的化合物或人体可合成的化合物及其前体,例如但不限于水溶性壳聚糖、低聚壳聚糖、n-乙酰葡萄糖胺、糖胺聚糖(粘多糖)等。
特别优选的,本发明第一方面所述的佐剂组合物中,包含的tlr刺激剂及人体可耐受的稳定剂的组合物成分包含polyic、氯化钙和低聚壳聚糖。
特别优选的,本发明第一方面所述的佐剂组合物中,包含的tlr刺激剂及人体可耐受的稳定剂的组合物成分包含polyic、氯化钙和n-乙酰葡萄糖胺。
特别优选的,本发明第一方面所述的佐剂组合物中,包含的tlr刺激剂及人体可耐受的稳定剂的组合物成分包含polyic、氯化钙和透明质酸。
特别优选的,本发明第一方面所述的佐剂组合物中,包含的多氨基多羟基化合物的含量应当可结合大部分的tlr刺激剂polyic,在佐剂组合物中,polyic与多氨基多羟基化合物的质量比介于1:10到10:1之间;优选的,其质量比介于1:4到4:1之间;特别优选的,其质量比介于1:2到2:1之间。
特别优选的,本发明第一方面所述的佐剂组合物中,氯化钙的浓度介于0.1mmol/l到100mmol/l之间。
本发明第一方面所述的佐剂组合物中,其油相成分与tlr刺激剂具有限定的组成比例,以确保佐剂组合物的安全性及免疫刺激活性。在不同的实施方案中,佐剂组合物中的角鲨烯及polyic的质量比介于1:10至15:之间;优选的,其质量比介于1:5至12:1之间;特别优选的,其质量比介于2:1至5:1之间。优选的,其中polyic的浓度介于5μg/ml至1000μg/ml之间。
在特定实施例中,角鲨烯及polyic的质量比可为0.23:1、0.47:1、2.33:1、4.65:1、5.81:1或11.63:1,不同质量比的佐剂组合物强化体液免疫反应及细胞免疫反应的能力存在一定差异,但均可显著提高疫苗诱发的免疫反应水平。
本发明另一方面提供一种免疫组合物,其成分由本发明第一方面所述的佐剂组合物及不同形式的抗原组成。其中,所述抗原可选自但不限于来源于细菌、病毒、寄生虫、真菌、肿瘤、人体自身抗原和/或变态反应原等的抗原,且所述免疫组合物中抗原的数量可为一种或多种。
优选的,所述免疫组合物的抗原来源于病原微生物的抗原,可选自但不限于腺病毒(adeniviridae)、沙粒病毒(arenaviridae)、星状病毒(astroviridae)、本扬病毒(bunyaviridae)、杯状病毒(cliciviridae)、黄病毒(flaviviridae)、肝炎病毒(hepeviridae)、单分子负链rna病毒(mononegavirales)、巢病毒(nidovirales)、小rna病毒(piconaviridae)、正黏液病毒(orthomyxoviridae)、乳头瘤病毒(papillomaviridae)、细小病毒(parvoviridae)、多瘤病毒(polyomaviridae)、痘病毒(poxviridae)、呼肠孤病毒(reoviridae)、反转录病毒(retroviridae)、披膜病毒(togaviridae)、放线菌(actinobacteria)、衣原体(chlymidae)、硬壁菌(firmicutes)、变形菌(proteobacteria)、螺旋体(spirochaetes)、子囊菌(ascomycota)、担子菌(basidiomycota)、肉足鞭毛门(phylumsarcomastigophora)、顶覆门(phylumapicomplexa)、纤毛门(phylumciliophora)、扁形动物门(phylumplatyhelminthes)、线虫门(phylumnematode)和/或节肢动物门(phylumarthropoda)等的抗原。
更优选的,所述免疫组合物的抗原为病毒抗原,可选自但不限于人乳头瘤病毒(humanpapillomavirus,hpv)、狂犬病毒(rabiesvirus)、乙型肝炎病毒(hepatitisbvirus)、流感病毒(influenzavirus)、脊髓灰质炎病毒(poliovirus)、人类免疫缺陷病毒(humanimmunodeficiencyvirus,hiv)等病毒的不同形式抗原。
特别优选的,所述免疫组合物的抗原为灭活病毒,例如但不限于:灭活狂犬病毒、灭活流感病毒、灭活脊髓灰质炎病毒、甲型肝炎病毒、乙型脑炎病毒等。
特别优选的,所述免疫组合物的抗原为病毒来源的重组蛋白抗原,例如但不限于:人乳头瘤病毒(hpv)、乙型肝炎病毒(hbv)、腺相关病毒(aav)、噬菌体等病毒的病毒样颗粒(vlp)和/或嵌合病毒样颗粒(cvlp),包含人乳头瘤病毒主要外壳蛋白(l1)和/或次要外壳蛋白(l2)中和表位的重组蛋白抗原等。
特别地,如本发明实施方案中所述,聚肌苷酸-聚胞苷酸及稳定剂氯化钙和卡那霉素(pika)联合mf59佐剂构成的复合佐剂,与hpvvlp疫苗或灭活狂犬疫苗联合使用均可有效提高疫苗的免疫活性。
特别地,如本发明实施方案中所述,聚肌苷酸-聚胞苷酸及稳定剂氯化钙和卡那霉素(pika)联合mf59佐剂构成的复合佐剂,与hiv/hpv嵌合vlp疫苗联合使用可有效提高疫苗的免疫活性。
特别地,如本发明实施方案中所述,聚肌苷酸-聚胞苷酸、氯化钙、低聚壳聚糖或n-乙酰葡萄糖胺联合mf59佐剂构成的复合佐剂,与hpvvlp疫苗疫苗联合使用均可有效提高疫苗的免疫活性。
本发明还涉及所述佐剂组合物及免疫组合物的用途,可应用于制备免疫治疗及预防等多种用途的制剂,包括但不限于:(1)预防病原微生物感染及感染相关的各种疾病,如流感病毒、狂犬病毒、hiv、hpv等的感染及感染相关疾病;(2)肿瘤的预防及治疗、(3)过敏反应等免疫相关疾病的治疗。
根据本发明,所述的佐剂组合物及免疫组合物可采用多种剂型,其中乳剂成分可采用单独分装或与抗原及tlr刺激剂混合分装的方式制备;乳剂采用单独分装形式时,抗原和/或tlr刺激剂可为溶液形式或冻干形式。
根据本发明,所述的佐剂组合物及免疫组合物可采用人体可接受的形式进行接种,接种部位包括但不限于肠道外注射给药、肌肉注射、腹腔注射、静脉注射、皮下注射、经呼吸道吸入、直肠给药、阴道给药、经鼻给药、经口给药、经眼给药、局部给药、透皮或皮内给药等。
相关术语的说明及解释
根据本发明,术语“佐剂”是指在临床上可应用于人体或具有人体应用前景的具有增强免疫反应功能的物质,包括当前已获得批准的和将来可能获得批准的各种佐剂,例如但不限于铝佐剂、mf59及各种形式的佐剂组合物。
根据本发明,术语“乳剂”是指由水相成分、油相成分及乳化剂按适当比例混合,经乳化后形成的非均相液体分散体系。其中水相成分包括但不限于磷酸盐缓冲液、tris缓冲液、柠檬酸盐缓冲液、hepes缓冲液等缓冲系统;油相成分为可代谢脂类,包括但不限于植物油、鱼油、动物油、合成油及其他脂类成分(例如但不限于角鲨烯、花生油、亚麻油、磷脂等);乳化剂为具有适宜hlb的表面活性剂,例如但不限于山梨醇酐三油酸酯(span-85)、聚山梨酯80(tween-80)、失水山梨糖醇脂肪酸酯(斯盘80/span-80)、三甘醇单月桂基醚(布里杰30/brij30)、聚乙二醇十六烷基醚(布里杰56/brij56)、聚乙二醇辛基苯基醚(tritonx-100)等。
根据本发明,术语“可代谢油”是指能够通过机体代谢被转化的油类物质,所述油可以是任意植物油、动物油或者合成油,它们对接受免疫者是无毒的,可通过代谢被转化。坚果、种子和谷物是常见的植物油来源;合成油也是本发明的一部分,包括可商品化供应的各种油类。本发明特别提出的油相成分是角鲨烯,为胆固醇生物合成的中间体,也是一种可代谢油。
根据本发明,术语“v/v”是指溶液各组分的体积/体积比,可通过下列换算比将v/v表示的浓度换算成w/v(质量/体积比)表示的浓度:5%(v/v)角鲨烯浓度等同于4.3%(w/v)角鲨烯浓度;0.5%(v/v)tween-80浓度等同于0.53%(w/v)tween-80浓度。
根据本发明,术语“道尔顿”为国际通用原子质量单位,可通过下列比例将道尔顿表示的核酸分子量换算成bp表示的核酸分子量:长度为1bp的核酸分子量等同于660道尔顿。
根据本发明,术语“稳定剂”是指可与佐剂成分结合并起到稳定作用的成分,包括但不限于抗生素(例如但不限于卡那霉素、新霉素、庆大霉素)、多氨基多羟基化合物(例如但不限于壳聚糖、粘多糖等)、无机盐(例如但不限于氯化钙、氯化镁、磷酸钙)、阳离子的有机复合物(例如但不限于硬脂酸钙、葡萄糖酸钙)。
根据本发明,术语“抗原”是指在适当情形下被免疫系统所识别的各种物质,可来源于病原体、人体自身、肿瘤等。
附图说明
图1显示本发明实施例复合佐剂中使用的polyic的相对分子量。
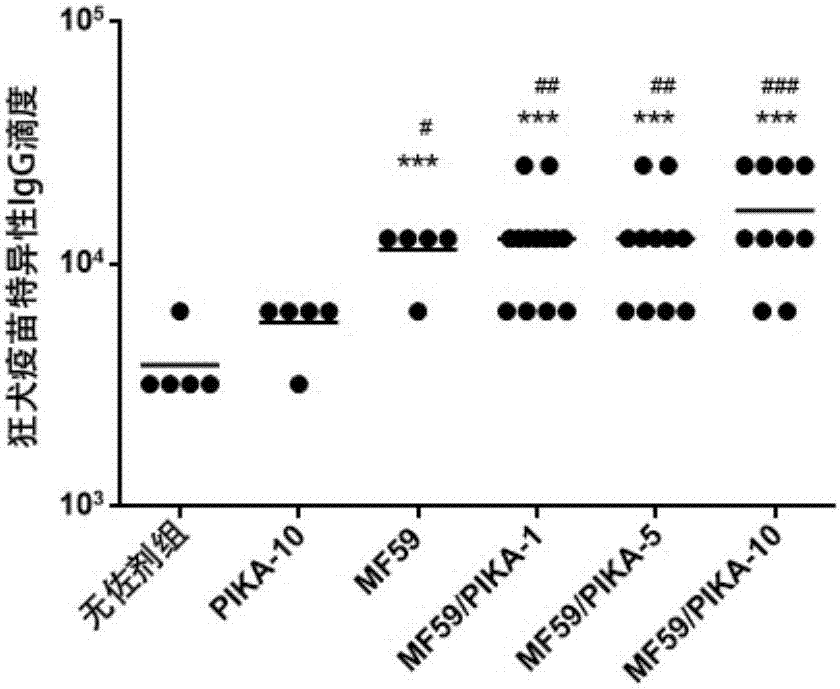
图2显示了本发明实施例2中,复合佐剂联合灭活狂犬疫苗免疫诱发的血清特异性igg水平。结果显示,不同剂量的复合佐剂组均可显著提高疫苗诱发的特异性igg水平。***:与无佐剂组相比,p<0.001;#:与单纯pika组相比,p<0.05;##:与单纯pika组相比,p<0.01;###:与单纯pika组相比,p<0.001。
图3a至图3b显示了本发明实施例3中,采用elispot法检测复合佐剂联合灭活狂犬疫苗免疫诱发的特异性细胞免疫反应水平,结果显示,不同剂量的复合佐剂均可显著提高疫苗诱发细胞免疫反应的水平。*:p<0.05;**:p<0.01;***:p<0.001。
图3a显示各组分泌ifn-γ的脾细胞数;图3b显示各组分泌il-4的脾细胞数。
图4显示了本发明实施例4中,复合佐剂联合hpvvlp疫苗免疫诱发的血清型别特异性中和抗体水平。**:与无佐剂组相比,与p<0.01;***:与无佐剂组相比,与p<0.001;#:与单纯pika组相比,与p<0.05;###:与单纯pika组相比,与p<0.001;&&&:与单纯alum组相比,与p<0.001。
图5显示了本发明实施例5中,复合佐剂联合hpv16l2多表位抗原诱发的血清hpv16型中和抗体水平。***:p<0.001;nd:未检测到中和抗体。
图6显示了本发明实施例6中,复合佐剂联合hpv16l2多表位抗原诱发的血清hpv16型中和抗体水平。*:与无佐剂组相比,p<0.05;**:与无佐剂组相比,p<0.01;***:与无佐剂组相比,p<0.001;###:与单纯polyic组相比,与p<0.001;&&&:与单纯mf59组相比,与p<0.001。
具体实施方式
下面将通过非限制性实施例进一步说明本发明,本领域技术人员公知,在不背离本发明精神的情况下,可以对本发明做出许多修改,这样的修改也落入本发明的范围。下面的实施例仅用于说明本发明,而不应视为限定本发明的范围,因为实施方案必然是多样的。本说明书中使用的用语仅是为了阐述特定的实施方案,而非作为限制,本发明的范围已界定在所附的权利要求中。
除非特别说明,本说明书中所使用的所有技术和科学用语均和本案所属技术领域的技术人员所普遍明了的意义相同。下面就本发明的优选方法和材料加以叙述,但是与本说明书中所述方法和材料类似或等效的任何方法和材料均可用以实施或测试本发明。下述实验方法如无特别说明,均为常规方法或产品说明书所描述的方法,所使用的实验材料如无特别说明,均可容易地从商业公司获取。本说明书中所提到的所有公开文献均被并入于此作为参考,以揭示并说明所述公开文献中的方法和/或材料。
实施例1:polyic与不同稳定剂组合的稳定性实验
按照表1所示的组合方式配制polyic与不同稳定剂的组合物,并采用分光光度法测定polyic的含量,4℃保存一段时间后,测定剩余polyic的含量并计算polyic的保存度(剩余polyic含量/初始polyic含量),结果如下表1所示:
表1:polyic与不同稳定剂的组合
*:计算polyic/稳定剂质量比时,不计氯化钙的质量。
上述结果表明,采用低聚壳聚糖或n-乙酰葡萄糖胺均可有效稳定polyic,减少降解,配置后的佐剂组合物稳定性可维持12-18个月。
实施例2:复合佐剂联合灭活狂犬疫苗免疫小鼠诱发抗原特异性igg检测
取4-6周龄的balb/c小鼠,随机分组,分别用灭活狂犬疫苗(rv,长春卫尔赛生物药业有限公司)、mf59(5%(v/v)角鲨烯,0.5%(v/v)tween-80,0.5%span-85(v/v),溶液为pbs)联合rv、聚肌苷酸-聚胞苷酸注射液(pika,南国药业)联合rv、及mf59/pika联合rv免疫小鼠,具体分组如表2所示。mf59与疫苗其他成分的体积比为1:1。肌肉注射,rv的免疫剂量为0.02iu,于第0,2周免疫,共2次。第2次免疫后2周尾静脉采血,分离血清。
表2:复合佐剂联合rv实验小鼠分组及免疫剂量
(用于血清igg检测)
采用灭活狂犬疫苗原液包被酶标板(100ng/孔),4℃孵育过夜后,使用5%bsa室温封闭2h。用pbs对小鼠免疫血清进行倍比稀释,加入封闭后的酶标板中(100μl/孔),室温孵育2h。使用pbs-t(在pbs中加入0.05%tween20)洗板3次,加入pbs-t稀释的hrp-山羊抗小鼠igg二抗(1:5000),37℃孵育45min。使用pbs-t洗板5次,用opd底物(sigma)显色,37℃孵育5min后,使用2mh2so4终止反应。使用酶标仪读取各个孔的od490,读数大于0.2且大于阴性对照2倍的最高稀释度即为血清rv特异性igg抗体滴度。结果如图2所示,联合使用mf59及pika佐剂的各组血清抗体水平均显著高于无佐剂组和单独使用pika佐剂组,且mf59/pika-10免疫组的特异性igg水平最高。表明当polyic/角鲨烯的质量比在0.47:1至4.65:1之间时,由mf59水包油乳剂及以polyic为主要成分的pika佐剂构成的复合佐剂可显著提高疫苗诱发体液免疫反应的水平(使用spss软件,one-wayanova分析),且在本实施例的剂量下,未观察到佐剂在小鼠体内引起毒性反应。
实施例3:复合佐剂联合灭活狂犬疫苗免疫小鼠诱发抗原特异性细胞免疫反应检测
取4-6周龄的balb/c小鼠,随机分组,每组5只,分别用灭活狂犬疫苗(rv,长春卫尔赛生物药业有限公司)、mf59(5%角鲨烯,0.5%tween-80,0.5%span-85,缓冲液为pbs)联合rv、聚肌苷酸-聚胞苷酸注射液(pika,南国药业)联合rv、及mf59/pika联合rv免疫小鼠,具体分组如表3所示。mf59与疫苗其他成分的体积比为1:1。肌肉注射,rv的免疫剂量为0.02iu,于第0,2周免疫,共2次。
表3:复合佐剂联合rv实验小鼠分组及免疫剂量
(用于elispot检测)
第2次免疫后13天取小鼠脾细胞,采用elispot法分别检测抗原特异性的、分泌ifn-γ和il-4的脾细胞。刺激抗原为灭活的rv疫苗原液,浓度为4μg/ml。结果如图3a和图3b所示,mf59/pika-10组分泌ifn-γ和il-4的细胞数显著高于其他各组,且mf59/pika-5组分泌ifn-γ和il-4的细胞数显著高于无佐剂组、无抗原组和单独mf59佐剂组,但低于mf59/pika-10组。表明当polyic/角鲨烯的质量比在2.33:1至4.65:1之间时,由mf59水包油乳剂及以polyic为主要成分的pika佐剂构成的复合佐剂可显著提高疫苗诱发细胞免疫反应的水平(使用spss软件,one-wayanova分析),且在本实施例的剂量下,未观察到佐剂在小鼠体内引起毒性反应。elispot检测的方法是公开的,例如专利cn101166559b。
实施例4:复合佐剂联合hpvvlp疫苗免疫小鼠诱发中和抗体水平的检测
取4-6周龄的balb/c小鼠,随机分组,分别用hpv16l1δn5c31vlp(获自中国医学科学院基础医学研究所许雪梅实验室)联合聚肌苷酸-聚胞苷酸注射液(pika,南国药业)及氢氧化铝佐剂(alum)或mf59佐剂(5%角鲨烯,0.5%tween-80,0.5%span-85,缓冲液为pbs)免疫小鼠,具体分组及免疫剂量如表4所示。mf59与疫苗其他成分的体积比为1:1。皮下注射,于第0,2周免疫,共2次。第2次免疫后2周尾静脉采血,分离血清。
表4:复合佐剂联合hpvvlp疫苗免疫实验小鼠分组及剂量
使用hpv16假病毒对免疫血清的hpv16中和抗体滴度进行检测,结果如图4所示,单独使用氢氧化铝佐剂或pika佐剂对hpv16l1vlp诱发的中和抗体水平无明显增强效果,但使用mf59联合pika佐剂可显著提高vlp诱发的中和抗体水平,且与单独使用氢氧化铝或单独使用pika佐剂相比,中和抗体水平亦有明显提高。表明当polyic/角鲨烯的质量比在0.23:1至11.63:1之间时,由mf59水包油乳剂及以polyic为主要成分的pika佐剂构成的复合佐剂可显著提高疫苗的免疫活性(使用spss软件,one-wayanova分析),且在本实施例的剂量下,未观察到佐剂在小鼠体内引起毒性反应,具有应用前景。假病毒制备及假病毒中和实验的方法均是公开的,例如专利cn104418942a。
实施例5:复合佐剂联合hpv16l2多表位疫苗免疫小鼠诱发中和抗体水平的检测
取4-6周龄的hfcγri转基因小鼠(c57bl/6背景),随机分组,分别用hpv16l2多表位抗原(含3个拷贝的l2aa.17-36表位及hfcγri靶向结构域)(获自中国医学科学院基础医学研究所许雪梅实验室)联合聚肌苷酸-聚胞苷酸注射液(pika,南国药业)、mf59佐剂(5%角鲨烯,0.5%tween-80,0.5%span-85)免疫小鼠,具体分组及免疫剂量如表5所示。mf59与疫苗其他成分的体积比为1:1。皮下注射,于第0,2,4,6周免疫,共4次。第4次免疫后2周尾静脉采血,分离血清。
表5:复合佐剂联合hpv16l2多表位抗原免疫实验小鼠分组及剂量
使用hpv16假病毒对免疫血清的hpv16中和抗体滴度进行检测,结果如图5所示,使用mf59联合pika佐剂可显著提高hpv16l2多表位抗原诱发的中和抗体水平,且与单独使用mf59或单独使用pika佐剂相比,中和抗体水平亦有明显提高。表明当polyic/角鲨烯的质量比为11.63:1时,由mf59水包油乳剂及以polyic为主要成分的pika佐剂构成的复合佐剂可显著提高疫苗的免疫活性(使用spss软件,one-wayanova分析),且在本实施例的剂量下,未观察到佐剂在小鼠体内引起毒性反应,具有应用前景。假病毒制备及假病毒中和实验的方法均是公开的,例如专利cn104418942a。
实施例6:含不同稳定剂的复合佐剂联合hpv16l2多表位疫苗免疫小鼠诱发中和抗体水平的检测
取4-6周龄的hfcγri转基因小鼠(c57bl/6背景),随机分组,分别用hpv16l2多表位抗原(获自中国医学科学院基础医学研究所许雪梅实验室)(含3个拷贝的l2aa.17-36表位及hfcγri靶向结构域)联合含不同稳定剂的复合佐剂免疫小鼠,具体分组及免疫剂量如表6所示。mf59与疫苗其他成分的体积比为1:1。皮下注射,于第0,2,4,6周免疫,共4次。第4次免疫后2周尾静脉采血,分离血清。
表6:复合佐剂联合hpv16l2多表位抗原免疫实验小鼠分组及剂量
使用hpv16假病毒对免疫血清的hpv16中和抗体滴度进行检测,结果如图6所示,使用4种配方的复合佐剂均可显著提高hpv16l2多表位抗原诱发的中和抗体水平,且与单独使用mf59或单独使用polyic佐剂相比,中和抗体水平亦有明显提高。表明由mf59水包油乳剂、polyic及多氨基多羟基稳定剂构成的复合佐剂可显著提高疫苗的免疫活性(使用spss软件,one-wayanova分析),且在本实施例的剂量下,未观察到佐剂在小鼠体内引起毒性反应,具有应用前景。假病毒制备及假病毒中和实验的方法均是公开的,例如专利cn104418942a。
实施例7:复合佐剂联合hpv/hiv嵌合vlp疫苗免疫小鼠诱发抗hiv中和抗体水平的检测
取4-6周龄的balb/c小鼠,随机分组,分别用2种以hpv16vlp为骨架嵌合hiv中和表位(2f5中和抗体表位)的嵌合vlp(获自中国医学科学院基础医学研究所许雪梅实验室)联合复合佐剂免疫小鼠,具体分组及免疫剂量如表7所示。mf59与疫苗其他成分的体积比为1:1。皮下注射,于第0,2,4,8周免疫,共4次。第4次免疫后2周尾静脉采血,分离血清。
表7:复合佐剂联合hpv/hiv嵌合vlp免疫实验小鼠分组及剂量
使用hiv敏感株sf162假病毒对免疫血清的hiv中和抗体进行检测,结果如表8所示,复合佐剂可显著提高嵌合vlp疫苗诱发的针对hiv表位的中和抗体。
表8:复合佐剂联合hpv/hiv嵌合vlp免疫诱发的hiv中和抗体水平检测
- 还没有人留言评论。精彩留言会获得点赞!