一种儿茶素类化合物的应用的制作方法
本发明属于医药化学领域,具体地,涉及一种儿茶素类化合物的应用。
背景技术:
断裂点簇集区-艾贝尔森蛋白(bcr-abl)是一种非受体的酪氨酸蛋白激酶。正常的abl基因位于9号染色体上,bcr基因位于22号染色体上。9号染色体和22号染色体相互易位形成费城染色体(philadelphiachromosome,ph),费城染色体中abl基因n端的抑制区域被消除,因此编码产生处于持续激活状态的bcr-abl激酶,引起细胞增殖、黏附和生存性质的改变,导致产生慢性粒细胞白血病(cml)和急性粒细胞白血病(all)。
伊马替尼(gleevec,novartis)是第一个被批准上市的bcr-abl激酶抑制剂,同时也是第一个小分子激酶抑制剂。伊马替尼虽然取得了巨大的成功,但是存在耐药性问题,因此新一代bcr-abl激酶抑制剂被开发出来,目前已批准上市的有达沙替尼(sprycel,bristol-myerssquibb),尼洛替尼(tasigna,novartis),伯舒替尼(bosulif,wyeth)和帕纳替尼(iclusig,ariadpharmaceuticals)。然而这些药物仅对部分伊马替尼耐药患者有效,并且可能产生新的耐药性,因此寻找新的bcr-abl激酶抑制剂非常必要。
技术实现要素:
本发明所要解决的技术问题是为了克服现有的已用于肿瘤治疗的bcr-abl抑制剂具有耐药性问题,并提供了一种儿茶素类化合物在制备bcr-abl激酶抑制剂中的应用。本发明的儿茶素类化合物能够有效抑制bcr-abl激酶催化活性,因此在制备用于治疗由bcr-abl激酶活化介导的病症的药物中具有较好的应用前景。
本发明是通过以下技术方案来解决上述技术问题的。
本发明第一方面提供了一种如式i所示的儿茶素类化合物或其立体异构体、互变异构体、药学上可接受的盐、溶剂化物、代谢物或前药在制备bcr-abl激酶抑制剂中的应用:
其中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14和r15各自独立地选自:氢、卤素、羟基、氰基、取代或未取代的c1~c6烷基、取代或未取代的c1~c6烷氧基、取代或未取代的c3~c8环烷基、取代或未取代的c2~c6杂环烷基、取代或未取代的c6-c10芳基、或取代或未取代的c2~c8杂芳基;
所述取代或未取代的c1~c6烷基、取代或未取代的c1~c6烷氧基、取代或未取代的c3~c8环烷基、取代或未取代的c2~c6杂环烷基、取代或未取代的c6-c10芳基、取代或未取代的c2~c8杂芳基中的取代基各自独立地选自卤素、氰基、c1-c4烷基、c1-c4烷氧基、c6-c10芳基和c2-c6杂芳基中的一个或多个;当取代基为多个时,所述的取代基相同或不同;
所述取代或未取代的c2~c6杂环烷基或取代或未取代的c2~c8杂芳基中的杂原子各自独立地选自o、n和s中的一个或多个,杂原子的个数为1-3个,当杂原子为多个时,所述的杂原子相同或不同。
较佳地,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14和r15各自独立地选自:氢、卤素、羟基、取代或未取代的c1~c6烷基、或取代或未取代的c1~c6烷氧基;
所述取代或未取代的c1~c6烷基、取代或未取代的c1~c6烷氧基中的取代基各自独立地选自卤素、氰基、c1-c4烷基和c6-c10芳基中的一个或多个;当取代基为多个时,所述的取代基相同或不同。
更佳地,所述取代或未取代的c1~c6烷基、取代或未取代的c6-c10芳基、或取代或未取代的c2~c8杂芳基中的取代基各自独立地选自氰基、f、cl、br、i、甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基和苯基中的一个或多个;当取代基为多个时,所述的取代基相同或不同。
在本发明中的一优选例中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14和r15各自独立地为:氢、卤素或羟基。
在本发明中的一优选例中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14和r15各自独立地为:氢或羟基。
在本发明中的一优选例中,式i化合物为具有如下结构的化合物:
本发明第二方面提供了一种如本发明第一方面所述的如式i所示的儿茶素类化合物或其立体异构体、互变异构体、药学上可接受的盐、溶剂化物、代谢物或前药在制备用于治疗由bcr-abl激酶活化介导的病症的药物中的用途。
本发明中,所述的由bcr-abl激酶活化介导的病症较佳地为增殖性病症。
本发明中,所述的增殖性病症选自:实体瘤、肉瘤、慢性髓性白血病、慢性粒细胞白血病(cml)、胃肠道间质瘤(gist)、急性粒细胞白血病(all)、甲状腺癌、胃癌、直肠癌、多发性骨髓瘤和瘤形中的一种或多种。
本发明中,所述增殖性病症较佳地选自:慢性粒细胞白血病(cml)、胃肠道间质瘤(gist)、急性粒细胞白血病(all)和甲状腺癌中的一种或多种。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
本发明提供了一种儿茶素类化合物或其立体异构体、互变异构体、药学上可接受的盐、溶剂化物、代谢物或前药在制备bcr-abl激酶抑制剂中的应用。本发明的儿茶素类化合物能够有效抑制bcr-abl激酶的催化活性,因此在制备用于治疗由bcr-abl激酶活化介导的病症的药物中具有较好的应用前景。
附图说明
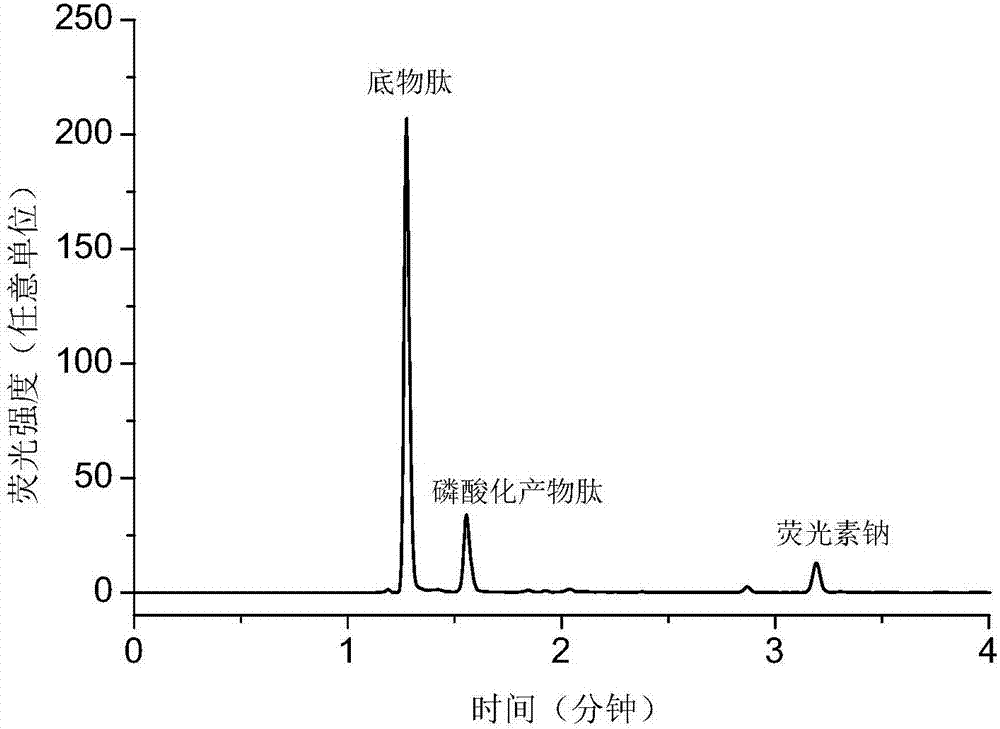
图1a为本发明实施例1中,10μmol/lbcr-abl底物肽体系的激光诱导荧光吸收色谱图。
图1b为本发明实施例1中,10μmol/lbcr-abl底物肽体系中加入2μg/mlbcr-abl蛋白,37℃反应4分钟后所得的激酶反应溶液的激光诱导荧光吸收色谱图。
图1c为本发明实施例1中,在bcr-abl催化底物肽磷酸化反应体系中加入25μmol/l表儿茶素没食子酸酯,37℃反应4分钟后所得的激酶反应溶液的激光诱导荧光吸收色谱图。
图2a为本发明实施例1中,bcr-abl底物肽和bcr-abl催化底物肽磷酸化反应的产物的质谱图。
图2b为本发明实施例1中,bcr-abl底物肽的二级质谱图。
图2c为本发明实施例1中,bcr-abl催化底物肽磷酸化反应的产物的二级质谱图。
图3a为本发明实施例1中,表儿茶素没食子酸酯对bcr-abl催化底物肽磷酸化反应活性的抑制曲线。
图3b为本发明实施例1中,表儿茶素没食子酸酯对bcr-abl催化底物肽磷酸化反应活性的linewearver–burk曲线。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
本发明实施例中,底物肽eaiyaapfakkk(所述底物肽的序列如序列表中seqidno:1所示),由吉尔生化(上海)有限公司合成,并对其n端进行5-羧基荧光素(5-fam)标记;
bcr-abl由北京义翘神州生物技术有限公司提供,产品货号:11199-h09b-20。
表儿茶素没食子酸酯由上海纯优生物科技有限公司提供(纯度≥98%)。
本发明对比例中的六种对照物黄芩苷(纯度≥98%)、金丝桃苷(纯度≥97%)、黄芩素(纯度≥98%)、汉黄芩素(纯度≥98%)、汉黄芩苷(纯度=98%)和千层纸素a(纯度=95%)由上海纯优生物科技有限公司提供(纯度≥98%)。
其余试剂和材料均为市售可得。
实施例1
(1)溶液的配制
①酶反应缓冲液为25mmol/ltris,其中含1mmol/ldtt,100mmol/lnacl,10mmol/lmgcl2,并用h3po4调节ph为7.5。
②使用2μl酶反应缓冲液溶解底物肽(含有1×10-7mol/l荧光素钠作为内标,提高定量的准确性)与bcr-abl,其中,底物肽的浓度为10μmol/l,bcr-abl的浓度为2μg/ml。
(2)实验过程
本实施例中,将bcr-abl与底物肽反应,并考察表儿茶素没食子酸酯对此反应的抑制活性。
本实施例中,利用毛细管电泳仪(ce)分离2μg/mlbcr-abl与10μmol/lbcr-abl底物肽的反应体系,并分别考察不存在儿茶素类化合物(即加入0.25%二甲基亚砜作为对照)与加入儿茶素类化合物(表儿茶素没食子酸酯,25μmol/l,用0.25%二甲基亚砜溶解)后该反应体系的差异。
本实验所用毛细管电泳仪为p/acemdq毛细管电泳仪(beckmancoulter,ca,usa),配有激光诱导荧光检测器,氩离子激光源,激发波长488nm,发射波长520nm;数据通过装有32karatsoftware的计算机采集;弹性石英毛细管柱规格为50μmi.d.(370μmo.d.)×40cm(有效柱长10.5cm,polymicrotechnologies,az,usa)。如无特殊注明,所有分析的电泳条件都为:柱温25℃,反端压力进样。
结果如图1a~1c所示,其中图1a为10μmol/lbcr-abl底物肽体系的激光诱导荧光吸收色谱图。图1b为10μmol/lbcr-abl底物肽体系中加入2μg/mlbcr-abl蛋白,37℃反应4分钟后所得的激酶反应溶液的激光诱导荧光吸收色谱图。图1c为在bcr-abl催化底物肽磷酸化反应体系中加入25μmol/l表儿茶素没食子酸酯,37℃反应4分钟后所得的激酶反应溶液的激光诱导荧光吸收色谱图。
结果表明,在包含2μg/mlbcr-abl与10μmol/lbcr-abl底物肽的反应体系中分别加入表儿茶素没食子酸酯,可以有效抑制bcr-abl对底物肽的磷酸化反应。
bcr-abl催化5-fam修饰的底物肽磷酸化反应如下所示:
为了进一步证明磷酸化产物的生成,利用电喷雾离子阱质谱(esi/ms)的技术对bcr-abl催化底物肽磷酸化反应进行了测试,进一步确证了磷酸化产物肽的存在。
检测条件为:lcq-fleet离子阱质谱(thermoscientific,ca),所有质谱均在正离子模式下获得;喷雾电压为4.5kv;毛细管电压为30v;毛细管温度为320℃。
检测结果如图2a~2c所示,图2a为bcr-abl底物肽和bcr-abl催化底物肽磷酸化反应的产物的质谱图。图2b为bcr-abl底物肽的二级质谱图。图2c为bcr-abl催化底物肽磷酸化反应的产物的二级质谱图。
图2a中底物肽的理论分子量为1694.92,测得的m/z值为565.91([m+3h]3+),其磷酸化产物的理论分子量为1774.88,测得的m/z值为592.56([m+3h]3+),上述结果表明bcr-abl能够有效催化其底物肽的磷酸化反应。对比底物肽(图2b)和磷酸化产物(图2c)二级质谱的碎片离子,发现它们具有相同的b2和b3离子,但是从b4离子开始(b4,b5,b6,b11)分子量相差一个磷酸根,因此确证磷酸化位点为第四位的酪氨酸(tyrosine,缩写为tyr)。其中,b离子和y离子指的是多肽离子在质谱碰撞室内经惰性气体碰撞解离时,在肽链酰胺键处断裂产生的离子,经过这样的过程形成的n端离子为b离子,c端离子为y离子。
(3)表儿茶素没食子酸酯对bcr-abl激酶活性抑制百分比研究
对bcr-abl激酶的催化活性进行抑制作用研究时,需要在反应体系中分别加入不同浓度的表儿茶素没食子酸酯进行磷酸化反应,表儿茶素没食子酸酯在反应体系中的浓度如表1所示:
表1表儿茶素没食子酸酯的添加浓度
实验方法:将新毛细管柱在30psi压力条件下用0.1mol/lnaoh溶液处理30分钟,再分别用超纯水、背景电解质分别冲洗10分钟。每次运行间隔在30psi压力条件下以1mol/lnaoh、超纯水、背景电解质各冲洗3分钟。样品在0.2psi条件下进样5s;分离电压为-15kv;柱温维持在25℃。分离缓冲液为100mmol/lhepes,含40mmol/lnacl,ph值由naoh调节至8.0,荧光素钠为内标以校正进样量。
bcr-abl激酶的活性通过检测磷酸化产物肽的生成来确定,即通过磷酸化产物肽校正峰面积的测定(校正峰面积即磷酸化产物肽和内标的峰面积比),可以定量测定bcr-abl的活性。对于抑制活性研究或抑制剂筛选,将纳摩尔至毫摩尔浓度的表儿茶素没食子酸酯分别加入到反应溶液中,上述化合物的抑制活性可以通过与空白对照(即不加表儿茶素没食子酸酯)相比,根据磷酸化产物肽峰面积的减少来确定,上述化合物的抑制百分比可以通过以下公式计算:
其中,i%是抑制百分数;ax和ao分别是加入抑制剂和不加任何抑制剂时的磷酸化产物肽的峰面积,取抑制作用百分比为50%时所对应的抑制剂浓度得到的半数抑制浓度即抑制剂的ic50值。
经检验确定,当bcr-abl的底物肽浓度为10μmol/l时,bcr-abl浓度为2μg/ml时,孵育时间在0-10分钟内,产物生成量与孵育时间成正比关系;当bcr-abl浓度为2μg/ml,孵育时间为4分钟时,底物转化率不超过10%,符合酶促反应动力学的初速度条件。同时还检验确定bcr-abl催化底物肽磷酸化反应在37℃下反应效率最高。最终选定反应体系为:bcr-abl激酶的底物肽的浓度为10μmol/l,bcr-abl的浓度为2μg/ml,孵育时间为4分钟,在底物的转化率不超过10%条件进行以下的酶抑制剂筛选工作。
按照表1所示,将不同浓度的表儿茶素没食子酸酯分别加入到上述反应体系中进行酶促反应(反应体系中bcr-abl的底物肽的浓度为10μmol/l,bcr-abl的浓度为2μg/ml,孵育时间为4分钟),按照上述毛细管电泳法检测表儿茶素没食子酸酯对bcr-abl活性的抑制百分比,检测结果如表2所示。
表2不同浓度的表儿茶素没食子酸酯对bcr-abl活性抑制百分比
将所得表儿茶素没食子酸酯的抑制百分比结果,利用通用型数据处理软件origin8.0非线性拟合方法进行处理,得到了表儿茶素没食子酸酯对bcr-abl的抑制曲线,其中表儿茶素没食子酸酯对bcr-abl催化底物肽去磷酸化反应活性的抑制曲线如图3a所示。
根据上述检测结果和抑制曲线,计算出表儿茶素没食子酸酯的半数抑制浓度ic50值为5.4μmol/l。该实验结果说明表儿茶素没食子酸酯可以有效地抑制bcr-abl激酶对底物肽的磷酸化反应。
对比实施例
对比实施例的目的是考察其他物质对bcr-abl激酶的抑制活性。
按照与实施例1完全相同的方法,将不同浓度的黄芩苷、金丝桃苷、黄芩素、汉黄芩素、汉黄芩苷和千层纸素a分别加入到相同的反应体系中进行酶促反应(反应体系中bcr-abl的底物肽的浓度为10μmol/l,bcr-abl的浓度为2μg/ml,孵育时间为4分钟),并用毛细管电泳法检测黄芩苷、金丝桃苷、黄芩素、汉黄芩素、汉黄芩苷和千层纸素a对bcr-abl活性的抑制百分比。
实验结果表明这6种化合物在浓度为25μmol/l时,对bcr-abl的酶的催化活性没有任何抑制作用。
<110>中国科学院上海有机化学研究所
<120>一种儿茶素类化合物的应用
<130>p1710791c
<160>1
<170>patentinversion3.5
<210>1
<211>12
<212>prt
<213>artificialsequence
<220>
<223>多肽序列
<400>1
glualailetyralaalaprophealalyslyslys
112
- 还没有人留言评论。精彩留言会获得点赞!