MiR‑214拮抗剂在制备用于减轻蛋白尿引起的肾小管损伤相关病症的药物中的用途的制作方法
本发明涉及mir-214拮抗剂的新用途,具体地涉及mir-214拮抗剂在制备用于减轻蛋白尿引起的肾损伤的药物中的用途。
背景技术:
蛋白尿作为众多肾脏疾病的共同特点,目前认为,蛋白尿首先导致肾小管间质的损害,进而损害肾小球功能,促进肾脏疾病的进展。越来越多的研究表明24小时尿蛋白排泄量与肾脏疾病的病情进展和预后显著相关。在不同的肾脏疾病中,控制饮食蛋白摄入或使用药物(acei等)降低蛋白尿均可延缓肾功能的恶化;而输注过多外源性蛋白则可加重蛋白尿,加重肾功能的损害。众多的临床观察和实验研究表明,不管肾脏疾病类型,蛋白尿都是影响其病情进展和预后的重要因素。因此,研究尿蛋白致肾脏损害的作用机理对延缓肾小球疾病的进展、保护肾功能有重要意义。蛋白尿致肾损害的机理目前尚未完全清楚。以往的观点认为蛋白尿可能直接损害肾小球而促进疾病的进展,但长期的临床和实验研究发现,在不同的肾小球疾病中,长期大量蛋白尿总是与肾间质损害伴随出现。使用大剂量牛血清白蛋白构造大鼠白蛋白超载实验发现,在蛋白尿出现后很短时间内即出现了肾间质炎症,进而出现肾间质纤维化和肾功能损害。因此,目前较一致的观点认为,蛋白尿是通过引起肾小管间质损害而影响肾小球疾病的进展。在各种肾脏疾病中,蛋白尿蛋白程度和肾间质损害程度是判断肾脏病预后最有力的指标。
白蛋白是尿蛋白中最主要的成分,近年来研究发现,大量的白蛋白对肾小管上皮细胞具有直接的损害作用。白蛋白超载肾小管上皮细胞,即给体外培养的肾小管细胞的培养液中加入大量白蛋白,可诱导肾小管上皮细胞增殖或凋亡。在体外,白蛋白超载肾小管上皮细胞可激活许多细胞内信号途径和转录因子,如:mapk(erkl/erk2,jnk,p38),akt,ap1和nf-kb,白蛋白超载还可诱导肾小管上皮细胞表达一系列生长因子和促炎症因子,包括tgf-β,mcp-1,il-8和ros等。这些细胞因子必须进入到肾间质才能诱导肾间质损害和纤维化。正常情况下,肾小管与肾间质之间有肾小管基底膜(tubularbasementmenmbrane,tbm)间隔,肾小管上皮细胞分泌的这些因子是不能进入到肾间质的。因此,tbm完整性的破坏是这些细胞因子进入到间质诱发肾间质炎症和纤维化的前提。白蛋白通过损伤肾小管,破坏tbm,诱发炎症,从而进一步损伤肾脏。所以如何阻止白蛋白诱导的肾小管细胞损伤是治疗蛋白尿引起肾脏疾病的关键。
线粒体是细胞内氧化磷酸化和合成三磷酸腺苷(atp)的主要场所,为细胞的活动提供了能量,细胞生命活动所需的能量95%来自线粒体,所以线粒体有“细胞动力工厂”之称。除此之外,线粒体还参与细胞分化、细胞信息传递和细胞死亡等过程。线粒体发生损伤后导致线粒体功能障碍,包括三个方面:线粒体呼吸链氧化磷酸化(oxphos)功能障碍而致产能减少、线粒体活性氧(ros)生成增加以及线粒体dna(mtdna)受损(拷贝数降低和突变)。已有研究发现,线粒体功能障碍通过损伤足细胞、肾小管上皮细胞及内皮细胞介导肾脏疾病。
microrna拮抗剂(antagomir)(购自exiqon公司,产品货号:199900,批号:182615。序列:5’-3’ctgtctgtgcctgctg)是根据microrna成熟体序列设计,经过mircurylnatm技术特殊标记与化学修饰的单链小rna,是专门用于抑制内源性microrna的高效阻断剂。我们前期实验发现mir-214在线粒体内高表达,其在多种肾脏疾病中通过调控线粒体功能发挥着重要的作用。有文献报道,抑制mir-214可以保护uuo引起的肾脏纤维化,具体涉及的机制不明确,研究只是表明独立于smad信号通路。
目前,尚未有mir-214拮抗剂可以对抗白蛋白引起的肾小管损伤的报道。
技术实现要素:
本发明的发明目的在于提供一种mir-214拮抗剂的新用途,具体地,提出了mir-214拮抗剂在制备用于减轻蛋白尿引起的肾功能疾病的药物中的用途。
更具体地,上述肾脏功能疾病为肾小管损伤相关病症。
进一步地,所述肾小管损伤相关病症为肾小管细胞凋亡。
本发明还提出了mir-214拮抗剂在制备用于制备肾脏炎症的药物中的用途。
另一方面,本发明还提出了mir-214拮抗剂在制备用于肾脏线粒体功能障碍的药物中的用途。
附图说明
图1为用白蛋白(albumin)造模以及用mir-214拮抗剂(anti-mir-214)治疗后的糖原染色(pas)结果;
图2为mir-214拮抗剂对白蛋白诱导的小管细胞凋亡的影响图;
图3为pcr、westernblot和elisa法研究mir-214拮抗剂对白蛋白诱导的肾脏炎症的影响;
图4为mir-214拮抗剂对白蛋白诱导的肾小管细胞线粒体功能的影响;
图5为流式检测mir-214拮抗剂在体外对白蛋白诱导的肾小管上皮细胞凋亡的影响结果;
图6为mir-214拮抗剂在体外对白蛋白诱导的肾小管上皮细胞线粒体功能的影响。
实验及检测方法:
本发明中pas、tunel染色、pcr、westernblot、免疫组化、elisa、电镜、线粒体功能的具体操作步骤如下:
pas染色:
肾组织石蜡切片常规脱蜡、水化;然后在1%过碘酸中氧化10min,用双蒸水充分洗涤,接着用schiff氏液染色30min,将染色液弃去,直接使用亚硫酸盐冲洗处理切片。苏木素染细胞核,流水冲洗10min,盐酸酒精分化2s,scott液返蓝,流水冲洗10min,最后常规脱水、二甲苯透明,中性树胶封片。
tunel(tdt-mediateddutpnick-endlabeling)染色:
4%多聚甲醛固定15min,pbs5min×2次,每张片子100μl(20μg/mlproteinasek)常温处理组织15min,pbs洗5min,浸入4%多聚甲醛5min,pbs5min2次,加100μl平衡液,湿盒平衡10min,制备tunel反应混合液:1μlrtdt+1μl生物素标记的dutp+98μl平衡液混匀,加入100μldnase1缓冲液孵育5min,甩掉液体后再加100μldnase1(10u/ml)酶切10min,用去离子水冲洗4次,pbs浸洗5min,加100μltunel反应混合液于标本上,加盖玻片或封口膜在暗湿盒中反应37℃×1h,浸入2×ssc15min,pbs5min3次,浸入0.3%h2o215min,pbs5min3次,加100μlstreptavidin标记hrp(按1:500pbs稀释)30min:pbs5min3次,dab显色(避光),用苏木素复染。annexinv-fitc/propidiumiodide(pi)双染检测细胞凋亡:
取细胞大约1×106个转移到5ml流式细胞仪检测用离心管内,每管加入400μl结合缓冲液,加入5μlfitc-annexinv及5μlpi,震荡混匀,室温(25℃)避光反应15min,立即用流式细胞仪检测。
实时荧光定量pcr(real-timepcr):
采用罗氏sybrgreenpcr方法,反应体系为25μl,见表1。
表1.real-timepcr反应体系(25μl)
混匀,稍离心,在abiprism7500荧光定量pcr仪中进行pcr扩增,反应条件为:95℃,10min;然后95℃,15s和60℃,1min循环35次。采用参照基因δδct法计算目的基因mrna表达水平的相对量:各基因mrna的表达水平使用相对定量法计算。
westernblot:
组织裂解液提取肾脏组织总蛋白,采用bca法测定蛋白质浓度,取50μg蛋白上样,10%或12%聚丙烯酰胺凝胶电泳(sds.page),100ma×2h半干转转至pvdf膜上,封闭液室温封闭1h,tbst洗脱后加入一抗,mcp-1(abcam),gapdh(santacruzbiotechnology),4℃孵育过夜。tbst洗膜3次,每次15min,以相应二抗室温孵育1h,再脱洗3次。抗原-抗体复合物用增强化学发光法(ecl)显示,暗室x线胶片曝光并扫描,蛋白质定量采用对目的条带进行灰度值分析,以目的条带灰度值/gapdh灰度值表示目的蛋白的相对表达量。
elisa:
血清il-1β检测试剂盒购自美国ebioscience公司,按照elisa试剂盒说明书,采用双抗体夹心法测定。主要步骤:分别设空白孔(不加样品及酶标试剂)、标准品孔(倍比稀释)及待测样品孔,加样至酶标板中,封板膜封板后置室温(18-25℃)孵育2h;然后洗涤6次,拍干;除空白孔外每孔加入酶标试剂100μl,封板膜封板后置室温(18-25℃)孵育1h;然后洗涤6次,拍干;加100μl显色剂,轻轻震荡混匀,室温避光显色10min;加入100μl终止液,450nm波长测量各孔的吸光度,根据标准曲线计算il-1β浓度。
免疫组化:
4%多聚甲醛固定组织48h,石蜡包埋切片,脱蜡至水,蒸馏水冲洗,磷酸缓冲盐溶液(phosphatebuffersaline,pbs)冲洗3次。行抗原热修复15min,随后冷却20min。3%h2o2,室温孵育10min,pbs冲洗3次。山羊封闭血清,室温孵育30min,倾去,滴加一抗cox-i(cellsignalingtechnology)4℃孵育过夜,pbs冲洗3次后滴二抗,37℃孵育45min,pbs冲洗。加dab室温显色,苏木素复染,脱水透明,最后封片。
电镜标本制备:
取新鲜肾组织,约1mm×1mm×1mm大小,加入300μl5%戊二醛。戊二醛固定2h后(如不能及时处理,可先放入4℃储存),然后加入1%锇酸固定2h,ph7.4。固定完毕后,用缓冲液洗涤20min后进行丙酮梯度脱水;环氧树脂(epoxyresin)包埋机浸透,然后将组织块放在多孔橡胶包埋模板中包埋,然后放置在烤箱中烘干。切片、染色,透射电镜(jeol,tokyo,japan)观察组织形态及线粒体超微结构。
线粒体功能检测:
(1)线粒体ros产生:体内提取肾皮质线粒体,应用线粒体特异性荧光探针mitosox检测肾组织线粒体中ros的产生;体外对培养的肾小管上皮细胞,使用dcfda荧光探针和线粒体特异性荧光探针mitosox染色,流式细胞仪检测ros。
(2)线粒体膜电位检测:体外培养的细胞,采用线粒体特异性的荧光探针(jc-1)染色,检测细胞膜电位的变化。
(3)mtdna拷贝数:采用北京天根公司组织dna提取试剂盒抽提肾皮质或细胞总dna,应用rt-pcr检测mtdna表达,基因组18srrna作为内参照校正mtdna拷贝数。
(4)线粒体呼吸链氧化酶complexi活性:提取肾皮质线粒体,采用上海杰美基因检测试剂盒检测线粒体呼吸链酶复合体i酶活性。
具体实施方式
下面通过具体的实施例详细说明本发明。
实施例1mir-214拮抗剂对于白蛋白引起的肾功能的影响。
取体重18~22g的雄性c57bl/6小鼠,分为4组,即空白对照组(vehicle+anti-control(anti-contro为一段没有任何功能的寡核苷酸序列序列:5’-3’acgtctatacgccca),mir-214拮抗剂组(vehicle+anti-mir-214),白蛋白模型组(albumin+anti-control)和mir-214拮抗剂+白蛋白组(anti-mir-214+albumin)。
白蛋白模型组:腹腔注射,从2mg/g体重逐渐递增到第5天10mg/g体重,以后6天维持腹腔注射10mg/g体重,共11天,于第12天处死小鼠,留取肾组织。
mir-214拮抗剂治疗组(即mir-214拮抗剂+白蛋白组):将mir-214拮抗剂用去除rnaase的生理盐水配置成浓度为1μg/μl,提前1天给药(腹腔注射,10mg/kg),在白蛋白注射后第5天和第10天再分别给予一次,于第12天处死小鼠,留取肾组织。白蛋白模型组给予同等剂量anti-control。
空白对照组:腹腔注射生理盐水(与白蛋白模型组注射的白蛋白量相等)和anti-control(与mir-214拮抗剂组注射的拮抗剂量相等)。
mir-214拮抗剂组:腹腔注射生理盐水(与白蛋白模型组注射的白蛋白量相等)和mir-214拮抗剂(与mir-214拮抗剂治疗组注射的拮抗剂量相等)。
图1为用白蛋白造模以及用mir-214拮抗剂治疗后的糖原染色(pas)结果,从结果中可以看出,白蛋白造模组肾小管结构破坏,刷状缘脱落,小管扩张,蛋白管型形成,证明mir-214拮抗剂能够显著改善白蛋白诱导的肾脏的组织损伤。
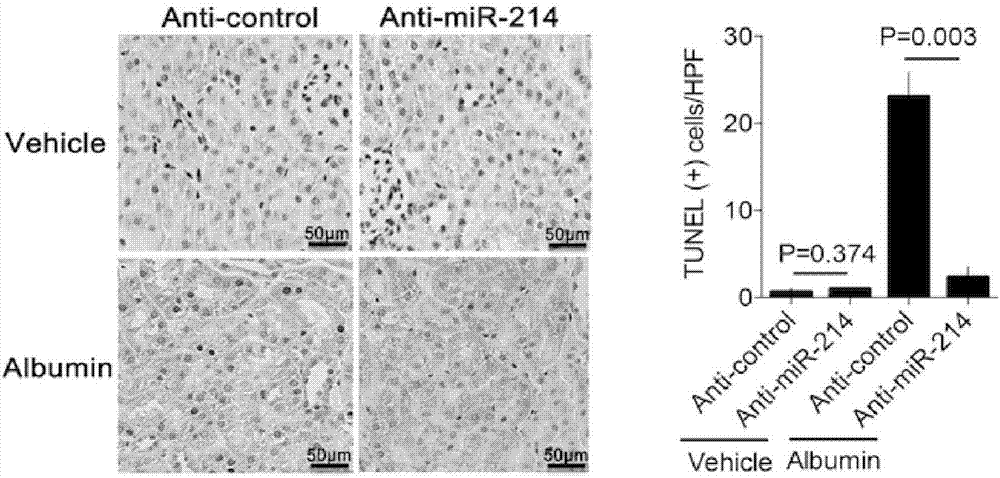
实施例2mir-214拮抗剂对白蛋白诱导的小管细胞凋亡的影响。
利用组织免疫组化的方法检测白蛋白诱导肾损伤中tunel(tdt-mediateddutpnick-endlabeling)阳性的肾小管细胞。
如图2所示,在白蛋白诱导肾损伤模型中,空白对照组(vehicle+anti-control),mir-214拮抗剂组(vehicle+anti-mir-214)显微镜下未见明显tunel阳性细胞,白蛋白模型组(albumin+anti-control)每个高倍视野下有21.4±3.2个阳性细胞,mir-214拮抗剂治疗组(anti-mir-214+albumin)每个高倍视野下有3.5±0.82个阳性细胞(n=6)。
结果表明,单独给予mir-214拮抗剂,对小管细胞没有影响。白蛋白能够大量诱导小管细胞的凋亡,与空白对照组相比,p<0.05。而mir-214拮抗剂能够显著减少凋亡的小管细胞,与白蛋白组相比,p<0.05。
实施例3mir-214拮抗剂对白蛋白诱导的肾脏炎症的影响。
利用pcr检测肾脏炎症因子il-1β、tnf-α和mcp-1的表达,western检测mcp-1和elisa检测血清中il-1β的分泌。
与空白对照组相比,单独给予mir-214拮抗剂并未增加炎症因子的表达,白蛋白模型组炎症因子表达显著增加,p<0.05。而mir-214拮抗剂能够显著减少炎症因子的表达,与白蛋白组相比,p<0.05。
结果表明,白蛋白可以诱导肾脏炎症因子表达增加,而mir-214拮抗剂可以抑制炎症因子表达。
实施例4mir-214拮抗剂对白蛋白诱导的肾脏线粒体功能的影响。
利用pcr检测线粒体mtdna拷贝数,试剂盒检测线粒体复合物i(complexi)和线粒体ros,免疫组化检测线粒体coxi基因的表达,电镜观察线粒体形态。
结果发现,与空白对照组相比,单独给予mir-214拮抗剂对线粒体功能没有影响,白蛋白可以诱导线粒体功能障碍,表现为:mtdna拷贝数下降,complexi活性降低,线粒体ros产生增加,coxi基因表达降低,电镜下线粒体形态紊乱,p<0.05。而mir-214拮抗剂可以阻断白蛋白诱导的线粒体功能障碍,与白蛋白组相比,p<0.05。
实施例5mir-214拮抗剂在体外对白蛋白诱导的小管细胞凋亡的影响。
体外培养mptc细胞(小鼠肾小管细胞系),融合至30%左右时转染对照和mir-214拮抗剂(40nmol/l),孵育24h,再加白蛋白刺激24h诱导凋亡。收取细胞大约1×106个转移到5ml流式细胞仪检测用离心管内,每管加入400μl结合缓冲液,加入5μlfitc-annexinv及5μlpi,震荡混匀,室温(25℃)避光反应15min,立即用流式细胞仪检测。
结果表明,白蛋白刺激mptc细胞24小时,可以诱导细胞凋亡的发生,和未处理组相比,p<0.05。mir-214拮抗剂单独处理不能引起细胞凋亡,但可以显著减少白蛋白诱导的细胞凋亡,与白蛋白组相比,p<0.05。
实施例6mir-214拮抗剂在体外对白蛋白诱导的线粒体功能的影响。
体外培养mptc细胞,融合至30%左右时转染对照和mir-214拮抗剂(40nmol/l),孵育24h,再加白蛋白刺激24h诱导线粒体功能障碍。根据线粒体膜电位和ros试剂盒处理细胞,收取大约1×106个转移到5ml流式细胞仪检测用离心管内,每管加入400μlpbs缓冲液,避光用流式细胞仪检测;根据dna提取试剂盒说明,将细胞的dna提取出,应用rt-pcr检测mtdna表达,基因组18srrna作为内参照校正mtdna拷贝数。
结果表明,白蛋白刺激mptc细胞24小时,可以诱导细胞线粒体功能障碍的发生(膜电位jc-1下降、ros生成增加、mtdna拷贝数降低),和未处理组相比,p<0.05。mir-214拮抗剂单独处理对线粒体功能没有影响,但可以显著减少白蛋白诱导的线粒体功能障碍,与白蛋白组相比,p<0.05。
综上所述,本发明意外地发现mir-214拮抗剂可以减轻由蛋白尿引起的肾功能疾病,具体的可以减轻蛋白尿引起的肾小管损伤相关病症、肾小管细胞凋亡以及肾脏线粒体功能障碍,有望于用于制备用于减轻蛋白尿引起的肾功能疾病的药物。
- 还没有人留言评论。精彩留言会获得点赞!