启动子17M11D及其应用的制作方法
本发明涉及启动子17M11D及其应用。
背景技术:
2,4,6-三硝基甲苯(英文名称为2,4,6-Trinitrotoluene,简称2,4,6-TNT或TNT)是一种无色或淡黄色晶体状硝基苯爆炸物,是一种重要的化工原料,在国防工业、矿山开采、基础建设等领域均有重要作用。在炸药生产,使用企业区,以及许多战场遗址、军事训练区,TNT污染一直是主要的环境问题之一。TNT能够渗入到土壤和水系统当中,长期参与生态循环,甚至产生“粉红水”,其清理十分困难和昂贵。已有报道表明TNT对微生物、绿藻类植物和动物均有毒害作用,同时TNT及其降解物可以被引进食物链中,进而对人类健康造成严重的不良影响。短期内接触大量三硝基甲苯后,会引起急性中毒,严重者可引起呼吸衰竭而死亡。长期接触三硝基甲苯后,可引起慢性中毒,其损害的靶器官主要是肝、眼睛、血液系统及神经系统,同时造成免疫功能降低,罹患贫血和癌症的几率也会大大增加。
由于TNT具有明显的毒害作用,目前基于TNT的理化性质,已经开发了许多TNT的检测技术,如高效液相色谱(HPLC)、紫外、气相色谱-质谱(GC-MS)、激光表面增强拉曼光谱(SERS)、核磁共振、离子迁移谱等方法,然而它们都需要昂贵和复杂的仪器或繁复的样品制备方法。生物传感器作为现在工程技术领域的一个研究热点,以生物活性单元(如酶、抗体、核酸、细胞等)作为生物敏感元件与待检测的目标物相互作用后产生响应信号,信号处理元件对响应信号进行接收、加工、转换、输出,从而实现对目标物的定性、定量检测。
目前,基于目标物生物活性的生物传感器技术已被广泛研究以用于一些特殊的化合物、化学基团以及一些可造成环境污染的有毒化合物的检测。常用的感应元件是参与了细胞应答的启动子区域,而在众多可选择的响应元件(通常为报告基因)中,化学发光(如luxCDABE of Photorhabdusluminescens)和荧光蛋白(如green fluorescent protein,GFP)是最为普遍的两种。当前,有大量针对重金属毒害化合物的生物传感元件的报道,例如,DNA酶(脱氧核糖酶)由于对重金属离子如Pb(II)、Cu(II)和Zn(II)具有高的特异性和灵敏性而被应用于重金属离子传感器。使用荧光基团和淬光基团标记的DNA酶与Pb(II)、Hg(II)和Cu(II)络合的功能化的DNA酶生物传感器可以将检出限降低到10nM。Liao等以钙粘蛋白为调控基因,以绿色荧光蛋白为报告基因,成功构建大肠杆菌DH5 α细胞生物传感器用于土壤和沉积物中重金属的测定,可检测到 0.1nmol/L的Sb(III)、Cd(Ⅱ)和10nmol/L的Pb(Ⅱ),灵敏度高且价格便宜,在实际样品中具有应用前景。
技术实现要素:
本发明的目的是提供启动子17M11D及其应用。
本发明提供的启动子,来源于大肠杆菌K-12 MG1655,命名为17M11D,为序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子。
本发明还保护序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子在启动目的基因表达中的应用。所述目的基因可为报告基因,具体可为荧光标记基因,更具体可为GFP基因。GFP基因具体可如序列表的序列2所示。所述启动目的基因表达具体可为在2,4,6-三硝基甲苯和/或2,6-二硝基甲苯和/或甲苯和/或2,4-二硝基甲苯和/或1,4-二硝基苯的诱导作用下启动目的基因表达。
本发明还保护一种DNA分子(融合基因),自上游至下游依次包括序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子和报告基因。所述DNA分子中,由序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子启动所述报告基因的表达。所述报告基因具体可为荧光标记基因,更具体可为GFP基因。GFP基因具体可如序列表的序列2所示。
本发明还保护含有所述融合DNA的重组质粒。所述重组质粒具体可为在pET-24(+)载体的多克隆位点插入序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子和GFP基因得到的重组质粒,所述重组质粒中由序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子启动所述GFP基因的表达。GFP基因具体可如序列表的序列2所示。所述重组质粒具体可为在pET-24(+)载体的BglⅡ和XbaⅠ酶切位点之间插入序列表的序列1自5’末端第7至94位核苷酸所示的DNA分子、BamHI和XhoI酶切位点之间插入GFP基因得到的重组质粒。
本发明还保护将所述重组质粒导入宿主菌得到的重组菌。所述宿主菌具体可为大肠杆菌,更具体可为大肠杆菌BL21(DE3)。所述重组菌即为用于检测2,4,6-三硝基甲苯和/或2,6-二硝基甲苯和/或甲苯和/或2,4-二硝基甲苯和/或1,4-二硝基苯的生物传感器。
本发明还保护所述重组菌在检测2,4,6-三硝基甲苯和/或2,6-二硝基甲苯和/或甲苯和/或2,4-二硝基甲苯和/或1,4-二硝基苯中的应用。
合成生物学是21世纪初提出的一门全新的交叉学科,2005年MIT的Endy发表了“工程生物学的基础”综述论文,明确提出在合成生物学中引入工程中常用的“标准化”、“复杂系统解藕”、“概念抽象化”做法,将合成生物学涉及的生物系统分成DNA、零件、 装置、系统这样4个层次。合成生物学的研究目前主要朝两个方向发展:一是设计、建造具有生物功能的元件如生物分子或反应系统、生物装置和基因网络、多元件组成的功能单位及其更高级复杂系统的组装等。二是开发建立生物制造所需要的技术,包括如大分子基因组合成技术,生物功能元件的分析与测试技术,生物体信息的捕获与处理技术,系统模拟与控制技术等。在此基础上合成生物学界提出了Bio-Brick思想,既构建标准,便于在活细胞体内,使用现有生物元件组合搭建新的基因线路和生命系统。本发明提供了自然界不存在的全新启动元件,利用本发明提供的启动子,按照Bio-brick思想,作为生物传感器中最为核心的检测元件,其他生物学家可以组装出各种装地雷探测的传感线路,并为新功能的基因线路和生命系统的搭建提供必备的贮备元件。
本发明的发明人首先从大肠杆菌中筛选应答较为灵敏的启动元件,然后对启动元件进行随机突变并构建随机启动子文库,获得了一批可响应靶标分子TNT及其衍生物的全新启动子。本发明的发明人采用17M11D,以绿色荧光蛋白为报告基因,构建了以大肠杆菌为底盘的全细胞生物传感器,并在检测中体现出了良好的特异性和灵敏度,为后期生物传感器更深层次的开发提供了良好的元件储备。本发明提供的生物传感器不仅可应用于战时及战后地雷等爆炸物位置的检测鉴定,还为土壤及水环境中的TNT检测提供新的方法。
附图说明
图1为实施例3的结果。
图2为实施例4的结果。
图3为实施例5中17M11D的EC200值。
图4为实施例5中对照片段的EC200值。
图5为实施例6的结果。
图6为实施例7的结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。所有统计学分析均采用SPSS 18.0统计学软件。
pET24-GFP载体:将序列表的序列2所示的GFP基因插入pET-24(+)载体的BamHI和XhoI酶切位点之间,得到pET24-GFP载体。pET-24(+)载体:EMD Biosciences(Novagen),产品目录号为69749-3。大肠杆菌BL21(DE3):博迈德生物公司(北京, 中国)。载体pMD18-T:Takara Biotechnology(Dalian,China)。
2,4,6-Trinitrotoluene(TNT)、2,4-Dinitrotoluene(2,4-DNT)、2,6-Dinitrotoluene(2,6-DNT)、1,3-Dinitrobenzene(1,3-DNB)、1,4-Dinitrobenzene(1,4-DNB)、2-Nitrotoluene(2-NT)、3-Nitrotoluene(3-NT)、4-Nitrotoluene(4-NT)、苯(Benzene)、甲苯(Toluene)、硝基苯(Nitrobenzene)均购自Sigma-Aldrich公司。TNT的溶解采用超声法,将TNT粉末加入蒸馏水中,800W超声15分钟。其它化合物均先溶于甲醇,然后在Tris缓冲液(200mM,pH7.0)中稀释。
实施例1、启动子序列的发现
1、提取大肠杆菌K-12 MG1655的染色体基因组。
2、将步骤1得到的染色体基因组作为模板,采用NEB Q5 MIX高保真PCR体系扩增出启动元件。
3、将步骤2得到的所有扩增产物分别经过Taq酶聚合反应添加dATP,形成polyA,再通过DNA连接操作连入载体pMD18-T,得到重组质粒。
4、用限制性内切酶XbaⅠ和BglⅡ双酶切步骤3得到的重组质粒,回收小片段。
5、用限制性内切酶XbaⅠ和BglⅡ双酶切pET24-GFP载体,回收载体骨架。
6、将步骤4得到的小片段与步骤5得到的载体骨架连接,得到重组质粒。
7、将步骤6得到的重组质粒导入大肠杆菌BL21(DE3),得到重组菌。
8、将步骤7得到的重组菌在不同的TNT浓度下进行考察,发现其中部分启动元件在不同浓度的TNT浓度之下可以不同程度的激发下游报告基因GFP的表达,并且在15mg/L的TNT浓度下应答反应最为明显。
9、在步骤8的基础上,提取各个启动元件在发挥功能中的一致序列,进行随机突变并构建随机启动子文库,将新启动子文库中的各个DNA分子依次进行步骤3、4、5和6,得到库容量为4500的promoter::GFP文库(即重组质粒库)。
10、将步骤9得到的重组质粒分别导入大肠杆菌BL21(DE3),得到各个重组菌。
11、取步骤10得到的重组菌,培养至OD600nm=0.2时加入TNT并使其浓度为15mg/L,然后30℃、200rpm振荡培养8小时,吸取200μl菌液至黑色96孔板,在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm),数值在200000以上的定为阳性克隆,将阳性克隆转接后再次进行荧光值检测,最终在15mg/L TNT浓度下筛选出了1个受到TNT调控应答强烈的克隆,将相应的启动子命名为17M11D。
17M11D的核苷酸序列如序列表的序列1自5’末端第7至94位核苷酸所示。
实施例2、重组菌和对照菌的获得
一、重组菌的获得
1、合成序列表的序列1所示的双链DNA分子。
2、用限制性内切酶BglⅡ和XbaⅠ双酶切步骤1得到的双链DNA分子,回收酶切产物。
3、用限制性内切酶BglⅡ和XbaⅠ双酶切pET24-GFP载体,回收约6000bp的载体骨架。
4、将步骤2的酶切产物和步骤3的载体骨架连接,得到重组质粒。
5、将步骤4得到的重组质粒导入大肠杆菌BL21(DE3),得到重组菌。
二、对照菌的获得
1、将T7启动子(序列表的序列3所示的双链DNA分子)插入pET24-GFP载体的BglⅡ和XbaⅠ酶切位点之间,得到重组质粒。
2、将步骤1得到的重组质粒导入大肠杆菌BL21(DE3),得到对照菌甲。
3、将N1片段(序列表的序列4所示的双链DNA分子)插入pET24-GFP载体的BglⅡ和XbaⅠ酶切位点之间,得到重组质粒。
4、将步骤3得到的重组质粒导入大肠杆菌BL21(DE3),得到对照菌乙。
5、将N2片段(序列表的序列5所示的双链DNA分子)插入pET24-GFP载体的BglⅡ和XbaⅠ酶切位点之间,得到重组质粒。
6、将步骤5得到的重组质粒导入大肠杆菌BL21(DE3),得到对照菌丙。
7、将recA片段(序列表的序列6所示的双链DNA分子)插入pET24-GFP载体的BglⅡ和XbaⅠ酶切位点之间,得到重组质粒。
8、将步骤7得到的重组质粒导入大肠杆菌BL21(DE3),得到对照菌A。
9、将umuDC片段(序列表的序列7所示的双链DNA分子)插入pET24-GFP载体的BglⅡ和XbaⅠ酶切位点之间,得到重组质粒。
10、将步骤9得到的重组质粒导入大肠杆菌BL21(DE3),得到对照菌B。
11、将SulA片段(序列表的序列8所示的双链DNA分子)插入pET24-GFP载体的BglⅡ和XbaⅠ酶切位点之间,得到重组质粒。
12、将步骤11得到的重组质粒导入大肠杆菌BL21(DE3),得到对照菌C。
实施例3、启动子的功能验证
重组菌TNT组的处理方法:将实施例2的步骤一得到的重组菌接种至LB液体培养 基,培养至OD600nm=0.6时加入TNT并使其浓度为15mg/L,然后30℃、200rpm振荡培养12h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
重组菌对照组的处理方法:将实施例2的步骤一得到的重组菌接种至LB液体培养基,培养至OD600nm=0.6,然后30℃、200rpm振荡培养12h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
对照菌TNT组的处理方法:将实施例2的步骤二得到的对照菌甲接种至LB液体培养基,培养至OD600nm=0.6时加入TNT并使其浓度为15mg/L,然后30℃、200rpm振荡培养12h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
对照菌IPTG组的处理方法:将实施例2的步骤二得到的对照菌甲接种至LB液体培养基,培养至OD600nm=0.6时加入IPTG并使其浓度为1mM,然后30℃、200rpm振荡培养12h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
对照菌对照组的处理方法:将实施例2的步骤二得到的对照菌甲接种至LB液体培养基,培养至OD600nm=0.6,然后30℃、200rpm振荡培养12h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
用仪器所指示的荧光强度来指征启动子对靶标化合的感应强度,用在诱导物存在与不存在的情况下的荧光值差(ΔRFU)来体现诱导的强度(ΔRFU=RFUTNT或IPTG-RFU对照)。
结果见图1。在TNT的诱导下,17M11D可以启动GFP基因的表达,IPTG对17M11D没有诱导作用。
实施例4、启动子的进一步功能验证
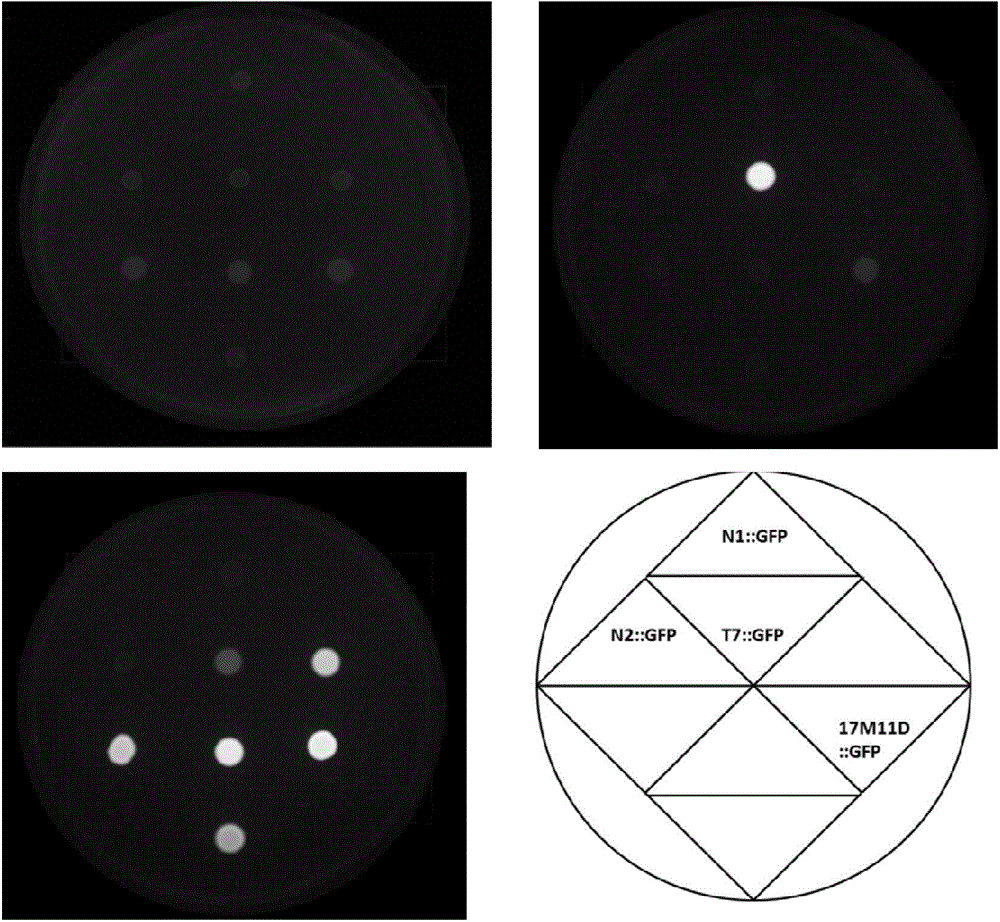
取实施例2的步骤一得到的重组菌、实施例2的步骤二得到的对照菌甲、实施例2的步骤二得到的对照菌乙或实施例2的步骤二得到的对照菌丙,接种至LB液体培养基,培养至OD600nm=2,然后用LB液体培养基稀释至OD600nm=0.6,然后吸取1μl菌液滴加在培养基平板(含有1mM IPTG的LB培养基平板、含有15mg/L TNT的LB培养基平板或LB培养基平板)的孔内(用直径为3mm的打孔器在培养基平板上打孔),30℃静置培养8小时,然后在ClinX荧光呈像系统中进行平板呈像。
照片见图2(左上图:LB培养基平板;右上图:含有1mM IPTG的LB培养基平板; 左下图:含有15mg/L TNT的LB培养基平板;右下图:各个平板中每个孔所对应的菌的启动子)。在无诱导物的条件下,17M11D、T7、N1、N2所对应的菌落没有明显的荧光反应。在TNT诱导的情况下,17M11D、T7对应的菌落均表现出了明显的荧光,17M11D的启动活性高于T7。在IPTG诱导的情况下,只有T7对应的菌落呈现出荧光。结果表明,17M11D对启动诱导物具有一定的选择性,并且其诱导活性可以达到与强启动子T7相当的活性。
实施例5、灵敏度
EC200的值是目前传感器构建领域比较常用的敏感性检测指标,EC200是指可引起两倍指征指标反应时的诱导物的浓度,EC200的值越小,则说明反应的敏感性越强。
一、17M11D的EC200值
取实施例2的步骤一得到的重组菌,接种至LB液体培养基,培养至OD600nm=0.6时加入TNT并使其浓度为梯度浓度(设置不加入TNT的对照处理),然后30℃、200rpm振荡培养8h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
结果见图3(ΔRFU=RFUTNT-RFU对照)。
记录倍数变化达到对照的2倍时TNT的最低浓度。结果表明,17M11D的EC200值达0.01mg/L。
二、对照片段的EC200值
取实施例2的步骤二得到的对照菌A、对照菌B或对照菌C,接种至LB液体培养基,培养至OD600nm=0.6时加入TNT并使其为梯度浓度(设置不加入TNT的对照处理),然后30℃、200rpm振荡培养8h,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
结果见图4(ΔRFU=RFUTNT-RFU对照)。结果表明,在TNT诱导的情况下,各对照片段作为启动子的活性都非常低。
实施例6、时效性
取实施例2的步骤一得到的重组菌,接种至LB液体培养基,培养至OD600nm=0.6时加入TNT并使其浓度为0.10mg/L(设置不加入TNT的对照处理),然后30℃、200rpm 振荡培养一定时间,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
结果见图5(ΔRFU=RFUTNT-RFU对照)。TNT诱导50min左右17M11D开启报告基因的表达,TNT诱导90min左右反应达到一个比较明显的对比强度、达到2倍以上的荧光变化,TNT诱导8小时后荧光反应基本趋于稳定。
实施例7、特异性
取实施例2的步骤一得到的重组菌,接种至LB液体培养基,培养至OD600nm=0.2时加入目标化合物并使其浓度为66.04μm/L,然后30℃、200rpm振荡培养8小时,然后吸取200μl菌液至96孔聚苯乙烯检测板(Bio-rad),在Pekin Elmer 2300 Multilablel Reader进行检测(GFP检测条件为excitation/emission,485/535nm)。
目标化合物为2,4,6-TNT、2,4-DNT、2,6-DNT、1,3-DNB、1,4-DNB、2-NT、3-NT、4-NT、Toluene或硝基苯。
结果见图6(ΔRFU=RFUTNT-RFU对照)。17M11D对TNT、2,6-DNT、Toluene、2,4-DNT、1,4-DNB的反应较其他化合物均有明显差别。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于转录组测序构建的棒状杆菌组成型表达载体启动子的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一株呕吐毒素降解菌及其应用的制造方法与工艺
- 一种具有家蚕血细胞特异性活性的启动子的鉴定方法与流程
- 一种改造的质粒复制子及其应用的制造方法与工艺
- 一种水稻种子特异性启动子Posseed及其应用的制造方法与工艺
- 一种在水稻幼穗特异表达的启动子及其应用的制造方法与工艺
- 一种表达外源基因的启动子及其应用的制造方法与工艺
- 可诱导的CRISPRon或CRISPRi小鼠胚胎干细胞及其应用的制造方法与工艺