体外培养造血干/前驱细胞的方法及其组成物与流程
本发明涉及一种高度纯化并可立即使用的体外放大培养造血干/前驱细胞的制备方法及其组成物。本发明尤其涉及一种将利用梯度离心纯化所得的单核球细胞先经过隔夜培养后,再进行造血干/前驱细胞纯化及体外放大培养的方法。经由本发明方法制得的高纯化造血干/前驱细胞,不仅含有高比例临床上的有效造血干/前驱细胞(CD34+CD38-细胞),且于其纯化及制造过程中并未使用含动物来源成分的试剂,因此所得的造血干/前驱细胞培养物可直接施用于临床应用。
背景技术:
造血干细胞(Hematopoietic stem cells;HSCs)系所有成熟血球的前身,具有自我更新与分化成不同造血细胞系的能力(Blood,Vol.89,No.12,1997:pp4337-4347)。迄今,造血干细胞移植(Hematopoietic stem cells transplantation;HSCT)已为广泛应用于血液疾病与先天性遗传疾病等治疗。一般而言,于临床上较合适的造血干细胞来源包含:骨髓(Bone marrow)、外围血(Peripheral blood)以及脐带血(Umbilical cord blood)。早期的骨髓干细胞抽取方式常伴随极度疼痛不适的步骤,逐渐以外围血作为造血干细胞移植的来源,但因配对不易,故近年来常以脐带血作为造血干细胞移植的来源选择。
CD34是一种表现于人类造血干细胞的表面抗原,通常被作为造血干细胞的指标,临床上已有研究证明:移植细胞表面表现CD34阳性细胞(CD34+细胞)数量的多寡与移植后存活率和成功率成正比(Moore KA,et al.B1ood.1997;89:4337-4347)。随着研究进一步发现,于细胞表面表现CD34而未带有CD38抗原的细胞(CD34+CD38-细胞)才是真正有效用的造血干细胞。
虽说脐带血造血干细胞移植在临床应用上已有良好成效,但在临床上,造血干细胞的数量有核细胞(Total nuclear cells;TNC)至少需达到2x107cells/kg,或者是CD34+细胞需达到2x105cells/kg以上才具有较好的移植成效。而所遇 到的课题为:脐带血所能取得的造血干细胞数量极有限,因此,已有许多致力于造血干细胞体外扩增放大的技术研究。
举例而言,美国专利申请号US11/255,191公开了一种提供造血干细胞体外扩增及其分析方法,利用加入各种有效含量的细胞激素培养造血干细胞,并提供一用于鉴定分离造血干细胞的试剂盒;日本专利申请号JP2012050357为造血干细胞的制造方法,则利用添加一扩增试剂至培养基中以放大造血干细胞数;以及,中国专利申请号CN2012100087227提供一种以血管内皮细胞靶向的Notch配体的可溶性融合蛋白人D111-RGD(hD111-RGD)体外扩增造血干细胞的方法。另,除了于培养阶段促进造血干细胞增生以增其数量外,中国台湾专利申请号第098115726号,公开了用于分离、体外扩增及收获造血干细胞的方法与系统,系可快速分离出造血干细胞并进行体外扩增以提高造血干细胞获取效率。
目前已知的体外扩增造血干细胞的方法,主要于培养基中添加各种不同物质,如细胞激素、化合物及重组蛋白等来促使造血干细胞增生。然而,大部分造血干细胞的培养时间需长达7天甚至于2周以上,并无法在短期间内获取临床上有效的造血干细胞(CD34+CD38-细胞)族群。由于造血干细胞的来源极其珍贵且脆弱,因此如何于有效提升造血干细胞的回收率与产率,以及如何将获取不易的造血干细胞作有效保存,成为体外扩增造血干细胞的核心关键。
技术实现要素:
本发明的发明目的一方面在于提供一种体外培养造血干/前驱细胞的方法。
为达到上述目的,本发明采用以下技术方案:
一种体外培养造血干/前驱细胞的方法,包括:
将含有造血干/前驱细胞的来源血液解冻,以梯度离心进行单核球纯化,获取高纯度单核球细胞;
将前述高纯度单核球细胞进行隔夜培养,之后分离造血干/前驱细胞;
将自前述经隔夜培养的单核球细胞分离所得的高纯度造血干/前驱细胞培养于含有细胞激素、TAT-HOXB4蛋白质及5%人类血清(Human AB serum;HABS)的伊思柯夫改良培养液(Iscove's modified Dulbecco's medium;IMDM)中培养 4-7天;及
收取造血干/前驱细胞培养物。其中该造血干/前驱细胞的来血液为源血液为外围血(Peripheral blood)或脐带血(Umbilical cord blood)。
于本发明的一项具体实施例,系将高纯度造血干/前驱细胞以细胞密度/1x104-5x105cells/mL培养于含有细胞激素、TAT-HOXB4蛋白质及5%人类血清的伊思柯夫改良培养液中培养4-7天,之后收取造血干/前驱细胞培养物。于本发明的另一项具体实施例,所述的细胞激素包含间白素-3(IL-3)、间白素-6(IL-6)、干细胞因子(SCF)、FMS样酪氨酸激酶3配体(FLT-3L)及血小板生成素(TPO)。
另一方面,本发明体外培养造血干/前驱细胞的方法进一步包含:将所得的体外培养造血干/前驱细胞以含有24-80%的人体血清白蛋白25%注射液及20%的二甲基亚砜和右旋糖酐细胞冻存混合液(内含6-20%人类白蛋白)的保存剂进行冷冻保存。
本发明以传统密度梯度离心纯化单核球细胞后,透过隔夜培养使单核球细胞活性恢复,进而于隔日纯化造血干/前驱细胞,藉以大幅提高造血干/前驱细胞的回收率。
又另一方面,本发明的发明目的在于提供一种根据本发明的制备法所制得的组成物。
为达到上述目的,本发明采用以下技术方案:
一种造血干/前驱细胞组成物,包括临床上有效造血干/前驱细胞(CD34+CD38-细胞)的百分比例为15-40%;
于本发明的一具体较佳实施例,其百分比例为25-30%。且所述临床上有效造血干/前驱细胞(CD34+CD38-细胞)的比例与未经体外培养的造血干/前驱细胞族群比较可提高3-5倍。于本发明的另一较佳具体实施例,所制得的组成物中临床上有效造血干/前驱系胞(CD34+CD38-细胞)的百分比可高达27%,且相较于未经体外培养的造血干/前驱细胞族群,可提高3.8倍。
附图说明
图1为利用流式细胞仪分析以不同纯化步骤的造血干/前驱细胞的回收率图。
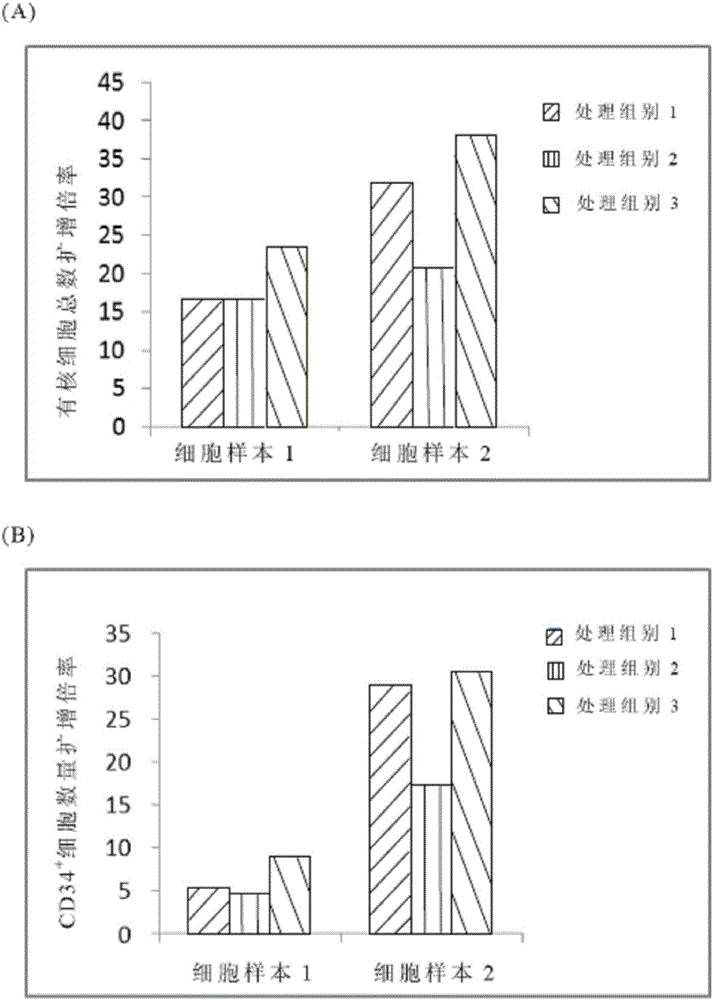
图2(A)为有核细胞总数(Total nuclear cell,TNC)扩增倍率;
图2(B)为CD34+细胞数量扩增倍率图。
图3为利用流式细胞仪分析以不同成分的细胞培养液及不同细胞密度条件培养下所增生的造血干/前驱细胞族群比例的比较图。
图4(A)为有核细胞总数(Total nuclear cell,TNC)扩增倍率图;
图4(B)为CD34+细胞数量扩增倍率图。
图5(A)为细胞存活率分析图;
图5(B)为利用流式细胞仪分析造血干/前驱细胞族群比例图。
具体实施方式
本发明的其他特色及优点将于下列实施例中为进一步举例说明,但该实施例仅为辅助,并非用于限制本发明的范围。
实施例一、造血干/前驱细胞的纯化及回收
本发明的一方面特征点在于,透过纯化及隔夜培养单核球细胞,藉以提高造血干/前驱细胞的回收率。因此于本实施例所进行的实验分为两个处理组,一组为将含有造血干/前驱细胞的来源血液解冻,其来源血液可为脐带血或外围血;先离心移除二甲基亚砜(DMSO)后加入细胞密度梯度分离液以梯度密度离心纯化出单核球细胞,并于当日纯化分离造血干/前驱细胞。纯化分离造血干/前驱细胞方式如下:将前述的纯化单核球细胞收集离心后回溶于300微升的磷酸盐缓冲液(PBS)或含0.5%人类白蛋白的生理食盐水中,而后加入100微升的FcR封闭液及100微升的CD34磁珠混合均匀后,置于4℃以翻转状态作用30分钟;作用完毕后再加入5微升的4℃磷酸盐缓冲液或含0.5%人类白蛋白的生理食盐水稀释,以4-12℃离心转速300g离心10分钟沉淀。再以3微升的磷酸盐缓冲液(PBS)或含0.5%人类白蛋白的生理食盐水回溶细胞,并加入架于磁座的管柱中,再以5微升的磷酸盐缓冲液(PBS)或含0.5%人类白蛋白的生理食盐水清洗管柱三次;最后将其移开磁座,加入5微升的磷酸盐缓冲液或含0.5%人类白蛋 白的生理食盐水并使用活塞将管柱中被CD34磁珠免疫沉淀的细胞压出,即纯化分离出造血干/前驱细胞。
另一组则将如前述的以梯度密度离心方法纯化出单核球细胞,加入或未加入红血球裂解液进行红血球裂解,而获取单核球细胞;并且,以细胞密度5x105-6x106cells/mL回溶于含5%人类血清的伊思柯夫改良培养液当中,并置于培养皿,于37℃5%CO2培养箱中培养16至18小时之后,再进行纯化分离造血干/前驱细胞。
将上述的处理组分别利用流式细胞仪进行分析,可得单核球细胞群落及经过纯化分离的造血干/前驱细胞群落的分析结果。以上结果如图1所示,可观察到上述处理组间的单核球细胞纯化率并无差别,而在将来源血液解冻的当日即直接纯化分离造血干/前驱细胞的处理组,其造血干/前驱细胞纯度为13.5%;相较于自经过隔夜培养的单核球细胞处理组,其造血干/前驱细胞的比例则皆高达76.2%以上,且依本发明的较佳具体实施例,造血干/前驱细胞的比例已可达92%。以上实验可证明,透过本发明隔夜培养单核球细胞的方法,可使单核球细胞因细胞解冻变化的损伤获得恢复活性,而提升了造血干/前驱细胞的回收纯度。
实施例二、造血干/前驱细胞的体外扩增培养
除了改良纯化方法以提高细胞纯化回收率外,特殊的细胞培养液成分亦或是细胞培养的密度皆为影响造血干/前驱细胞的体外扩增培养重要因素,故本发明亦针对以上影响因素进行实验。将如前述的实施例所纯化的高纯度造血干/前驱细胞分别培养于含有不同细胞激素成分的含5%人类血清的伊思柯夫改良培养液中培养4天,并进行细胞增生倍率分析比较。实验中将处理组依其所包含的细胞培养液成分区分为以下3组,
(1)处理组别1:含有5ng/mL间白素-3、10ng/mL间白素-6、50ng/mL干细胞因子、20ng/mL FMS样酪氨酸激酶3配体、15nM TAT-HOXB4;
(2)处理组别2:含有5ng/mL IL-3、10ng/mL IL-6、100ng/mL干细胞因子、20ng/mL FMS样酪氨酸激酶3配体、15nM TAT-HOXB4;
(3)处理组别3:含有5ng/mL IL-3、10ng/mL IL-6、100ng/mL干细胞因 子、20ng/mL FMS样酪氨酸激酶3配体、25ng/mL血小板生成素、15nM TAT-HOXB4。
细胞培养分析结果如图2所示。由图2(A)的有核细胞总数(Total nuclear cell,TNC)扩增倍率结果及图2(B)的CD34+细胞数量扩增倍率结果显示,不论是细胞样本1或样本2,在各处理组培养下皆可具有倍数的成长,其中,又以处理组别3的培养液所培养的扩增率增加最为明显。由上述结果可知,细胞激素的组成及比例含量对于造血干/前驱细胞的扩增影响极大。
除研究培养液成分对于造血干/前驱细胞扩增的影响以外,细胞培养密度亦是对于细胞放大的影响之一。为此,以含有5ng/mL IL-3、10ng/mL IL-6、100ng/mL干细胞因子、20ng/mL FMS样酪氨酸激酶3配体、25ng/mL血小板生成素、0.1%牛血清白蛋白(BSA)的培养液或以上述的处理组别3的培养液,将先前实施例所述的高纯度造血干/前驱细胞分别以细胞密度5x104、1x105及5x105cells/mL培养4天,之后以流式细胞仪进行细胞群落分析,结果如下表1及图3所示。
表1.
由表1及图3的结果显示,在不同成分及不同细胞密度的培养条件下,虽然皆会使细胞增生,但其细胞族群的增生比例却不尽相同。首先,以不同细胞 培养液的部份进行比较,可得到与前一实施例实验相符的结果,不论是何种细胞密度进行培养,以前述的处理组别3细胞培养液成分的培养液培养4天所得的有效造血干/前驱细胞(包含CD34+细胞及CD34+CD38-细胞)比例明显比牛血清白蛋白(BSA)培养液组别高。
再者,以不同细胞密度进行比较,可观察到以细胞密度5x104cells/mL培养4天后,有效造血干/前驱细胞族群的比例可高达72.5-77.2%。综合以上比较,原先有效造血干/前驱细胞族群(CD34+CD38-细胞)仅7%,经由处理组别3的培养液以及特定细胞密度5x104cells/mL培养后,可扩增至高达27.2%,以及,有核细胞总数(Total nuclear cell,TNC)扩增倍率亦高达13.52倍。
再进一步地,以细胞密度5x104cells/mL为基准并下调测试造血干/前驱细胞的最佳培养条件,分为以下4组细胞密度进行培养,并进行细胞数量分析,细胞密度分别为:
(1)细胞密度组别1:以密度1x104cells/mL培养至第7天;
(2)细胞密度组别2:以密度5x104cells/mL培养3天,并于第3天时改以密度1.5x104cells/mL培养至第7天;
(3)细胞密度组别3:以密度5x104cells/mL培养3天,并于第3天时改以密度3x104cells/mL培养至第7天;
(4)细胞密度组别4:以密度5x104cells/mL培养至第7天。
其分析结果如图4所示,可明显观察到,相较于其他组别,在以细胞密度组别1的细胞密度连续培养至第7天的培养条件下,不论是图4(A)所示的有核细胞总数(Total nuclear cell,TNC)扩增倍率或是图4(B)所示的CD34+细胞扩增倍率皆明显扩增,分别高达141.5倍及18.5倍。由本实施例可知细胞密度对于造血干/前驱细胞的体外扩增培养系一重要因子。
实施例三、体外扩增培养的造血干/前驱细胞的冷冻保存
根据以上实施例已可有效扩增体外培养造血干/前驱细胞,然而除此以外,如何对于该细胞进行有效冷冻储存以及确保其在解冻仍可维持其有效造血干/前驱细胞族群的存活比例为一大重点,因此,本实施例以3种保存剂配方作为 试验,其配方分别为:
(1)配方1(内含20%人类白蛋白):80%的人体血清白蛋白注射液(内含25%人体血清白蛋白),20%的二甲基亚砜和右旋糖酐细胞冻存混合液;
(2)配方2(内含12%人类白蛋白):48%的人体血清白蛋白注射液(内含25%人体血清白蛋白),20%的二甲基亚砜和右旋糖酐细胞冻存混合液,生理食盐水;
(3)配方3(内含6%人类白蛋白):24%的人体血清白蛋白注射液(内含25%人体血清白蛋白),20%的二甲基亚砜和右旋糖酐细胞冻存混合液,生理食盐水。
将前述培养4天所得的造血干/前驱细胞分别使用以上3种冷冻保存剂做冷冻保存,并储存于液氮储存系统当中进行为期1个月的冷冻储存,再经解冻测试以比较不同保存剂对细胞族群的影响,其结果如图5所示:由图5(A)的存活率分析(7-AAD染色)可得知,3种不同配方的保存剂所保存的造血干/前驱细胞,在经由解冻后其存活率并没有明显不同;而进一步以流式细胞仪分析出有效造血干/前驱细胞族群(CD34+细胞及CD34+CD38-细胞)的结果如图5(B)所示,则观察到以配方3的保存剂所冷冻解冻的有效造血干/前驱细胞族群比例相较于其他配方为良好。由此证明,以体外扩增培养的有效造血干/前驱细胞亦可被以适当的保存剂进行冷冻保存,并于解冻后保持高比例的细胞族群纯度及良好细胞存活率。
综合以上实施方式的结果,证实本发明的制备方法可有效获取高纯度的造血干/前驱细胞,并可于短期内(4-7天)即获得高比例临床上的有效造血干/前驱细胞的数量,最后,以特殊配方的保存剂进行细胞冷冻保存以维持有效造血干/前驱细胞族群的比例及细胞存活率。
另外本发明的制备法在各个过程中,不论是细胞纯化、体外扩增或者是冷冻保存,皆未使用含有其他动物来源成分的试剂,即代表,由本发明的制备方法所制得的组成物,不需再经过其他加工处理即可直接作为临床的应用。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!