一种重组腺病毒及其构建方法与流程
本发明属于生物技术领域,涉及一种重组腺病毒,尤其是一种能在同一腺病毒中分别表达猪瘟病毒E2基因和蓝耳病病毒GP5基因的重组腺病毒及其构建方法。
背景技术:
猪瘟是危害养猪业的主要传染病之一。目前,免疫接种仍是猪瘟防治的主要措施,而且是根除本病和阻止野毒传向无猪瘟猪群传播的必要手段。猪瘟疫苗无论在过去、现在还是将来,对控制和消灭猪瘟都具有极其重要的作用,各国学者对猪瘟疫苗的研制和开发一直没有放弃。传统的猪瘟疫苗包括灭活疫苗和弱毒疫苗,但灭活苗免疫效力低,保护期短,激发机体产生免疫力的速度慢,且到目前为止,组织培养猪瘟毒的产量和灭活所造成的病毒有效抗原的损失仍是制造灭活疫苗的二大障碍。猪瘟弱毒疫苗的广泛应用,对于控制猪瘟的流行起到了关键作用。但是弱毒疫苗也有其不足的地方,首先近年来猪瘟的流行特点在世界范围内发生了很大的变化,呈现周期性、波浪形的的地区性散发和温和性猪瘟,发病后的临床症状是:无名高热、症状不典型、持续性感染、出生仔猪先天性震颤和母猪繁殖性障碍。用传统疫苗免疫常常造成免疫失败,即使将剂量增加到750个兔体反应(国家规定150个兔体反应)也不能预防其感染,而且有蔓延的趋势。在妊娠早期接种疫苗还会发生疫苗毒通过胎盘感染胎儿,造成死胎或 弱仔并成持续性带毒者,产生新的疫源;其次,弱毒疫苗已经沿用了近40年,猪瘟的流行形式发生了很大变化,说明猪瘟病毒的抗原性可能存在着变异,特别是近年来国内外应用单克隆抗体对C-株检测,发现有不同的反应模式,表明经过多年在不同细胞上的驯化,C-株已经产生变异,这种流行毒株的变化趋势国内外情况基本一致,流行毒往往逃避免疫,导致免疫失败的严重后果。第三,接种弱毒疫苗还会影响到国际贸易,欧盟已禁止使用猪瘟弱毒疫苗,而采用严格的卫生防疫制度、扑杀猪瘟感染猪和血清学阳性猪来控制和消灭猪瘟。采用扑杀政策需要大量的人力、物力和巨额资金,发展中国家是难以承受的,这就促使人们研究和开发新型的猪瘟疫苗来防控本病。近年来,基因工程技术的迅猛发展,为新型猪瘟疫苗的研究和开发提供了工具,目前,猪瘟基因工程疫苗的研制已经成为新的研究方向和热点。
蓝耳病在我国大面积流行近10年了,其灭活疫苗从最初的普通疫苗发展到今天的高效浓缩疫苗,其免疫次数也越来越多,在实际应用中,灭活苗的免疫原性较差,往往接种后抗体效价较低,达不到保护的作用,而且灭活苗注射剂量大、免疫次数多、抗体产生慢。如果抗体与野毒的基因序列比较相似,同样会产生保护;如果基因序列不相似,则保护力比较差。在蓝耳病的灭活苗使用中,如果没有合适的高效的免疫佐剂,其免疫效果更差。弱毒疫苗的优点是:能在体内繁殖,产生抗体快,成本低,免疫期长。但是弱毒疫苗接种后,存在猪场带毒的危险,而且免疫后监测指标又无法与野毒感染相区分。有些学者认为,蓝耳病弱毒疫苗免疫后会对母猪的繁殖性能和公猪的精子 活力造成影响,所以弱毒苗的安全性和效力不可靠,不主张接种弱毒疫苗。
另外,蓝耳病病毒侵害巨噬细胞,影响机体的免疫反应,据临床使用结果表明,蓝耳病弱毒苗和猪瘟弱毒苗同时免疫后会导致猪瘟的免疫效果下降,在猪瘟的控制上造成了很大困难。
人-5型腺病毒载体与其他动物病毒载体相比,具有许多优点。首先是安全,腺病毒毒性低,基本不致病或只引起轻微的症状,腺病毒重组后,毒力进一步降低,并且克服了逆转录病毒载体因随机整合可能导致插入突变的潜在风险;其次是宿主范围广,腺病毒可感染多种细胞包括分裂与非分裂细胞;第三是稳定,腺病毒粒子十分牢固,不易突变,并且容易大量制备并纯化,得到高滴度的病毒,在体外可获得1011pfu/mL;第四就是对于腺病毒基因组的结构和功能目前研究得比较清楚,基因操作方便;第五是插入外源基因容量大。在基因治疗构建重组疫苗中大多采用缺失El和E3区基因的腺病毒载体,通常复制缺陷型腺病毒可容纳约7kb~8kb的外源基因,比逆转录病毒和腺相关病毒的容量大很多;还有免疫途径简便,腺病毒可以在消化道和呼吸道增殖,疫苗接种简便,可口服或气雾吸入而不需注射,并且经口服后能产生局部黏膜免疫应答,在免疫方法上比其它疫苗好,容易于推广使用。
非复制型腺病毒不仅更安全有效,而且以低剂量的方式产生抗原蛋白而不裂解细胞,故表达抗原的时间更持久,有利于激发长期的免疫反应。目前,已经有多种产品已经上市,例如:“安柯瑞——重组 人5型腺病毒注射液”;“重组人γ-干扰素腺病毒注射液(E10B)”;“今又生(重组人p53腺病毒注射液)”;“人禽流感重组腺病毒疫苗临床前安全评价方法的研究”取得阶段性成果;“重组腺病毒-胸苷激酶基因制剂”;另外“猪繁殖与呼吸综合征重组腺病毒和疫苗”已经被南京农业大学申请专利。
技术实现要素:
为解决猪瘟弱毒苗和蓝耳病弱毒苗不能同时免疫,以及弱毒疫苗长期接种导致的病毒返祖、独立增强的现象,和弱毒疫苗株和野毒发生重组等问题,本发明提供一种能在同一腺病毒中分别表达猪瘟病毒E2基因和蓝耳病病毒GP5基因的重组腺病毒及其构建方法。
本发明具体通过以下技术方案实现:
一种重组腺病毒,通过在腺病毒的CMV启动子下游多克隆位点Bgl II和Sal I酶切位点中插入猪瘟病毒E2基因,在腺病毒的CMV启动子下游Kpn I和Not I酶切位点中插入蓝耳病病毒GP5基因。
所述猪瘟病毒为常规的市购病毒,该病毒的E2基因在GenBank中的登录号为:AY775178.2。
所述蓝耳病病毒为常规的市购病毒,该病毒的GP5基因在GenBank中的登录号为:AY740012.1。
所述腺病毒为常规的市购人-5型非复制型腺病毒。
所述在腺病毒中分别表达猪瘟病毒E2基因和蓝耳病病毒GP5基因的重组腺病毒,包括下列构建步骤:
A.从市购的猪瘟病毒和蓝耳病病毒中分别扩增出E2和GP5基 因;
B.将步骤A获得的猪瘟病毒E2基因通过Bgl II和Sal I酶切位点插入至腺病毒穿梭载体pAdTrack中,形成腺病毒穿梭载体pAdTrack-E2;
C.将步骤A获得的蓝耳病病毒GP5基因通过Kpn I和Not I酶切位点插入至腺病毒穿梭载体pAdTrack中,形成腺病毒穿梭载体pAdTrack-GP5;
D.将步骤C的腺病毒穿梭载体pAdTrack-GP5按常规的PCR方法扩增出含有CMV启动子的CMV-GP5基因,通过Xhol I和Xba I酶切位点插入至步骤B的腺病毒穿梭载体pAdTrack-E2中的Xhol I和Xba I酶切位点中,形成重组腺病毒穿梭载体pAdTrack-E2-CMV-GP5;
E.将步骤D的重组腺病毒穿梭载体pAdTrack-E2-CMV-GP5经Pme I酶切线性化后,转化到含有腺病毒骨架载体pAd-easy-1的大肠杆菌BJ5183感受态细胞中,形成重组腺病毒骨架载体pAd-easy-E2-CMV-GP5;
F.将重组腺病毒骨架载体pAd-easy-E2-CMV-GP5经Pac I线性化后,转染人胚胎肾细胞HEK2983中,包装出重组腺病毒rAd-E2-CMV-GP5。
本发明具有下列优点和效果:
采用上述方案获得的重组腺病毒rAd-E2-CMV-GP5,能在同一腺病毒中分别表达猪瘟病毒E2蛋白和蓝耳病病毒GP5蛋白,解决了 E2和GP5基因融合串联表达产量低和保护效果弱的问题,本发明仅通过一次免疫接种就能够使免疫后的猪同时获得对猪瘟病毒和蓝耳病病毒的抗体,对猪瘟和蓝耳病具有较强的抵抗能力,降低了疫苗接种次数和成本,并从根本上解决了猪瘟弱毒苗和蓝耳病弱毒苗不能同时免疫的问题,本发明提供的重组腺病毒rAd-E2-CMV-GP5属于非复制型病毒,在猪体内不繁殖,解决了弱毒疫苗长期接种导致的病毒返祖,毒力增强的现象。本发明提供的重组腺病毒rAd-E2-CMV-GP5仅含有猪瘟病毒和蓝耳病病毒的主要保护基因,不含病毒的其它基因,因此,使弱毒疫苗株和野毒株之间不会发生重组。采用上述方案构建获得的重组腺病毒制成的疫苗,免疫本动物后对猪瘟病毒和蓝耳病病毒联合攻击的保护效果为87.5%。既解决了猪瘟和蓝耳病疫苗不能同时免疫的问题,也解决了弱毒疫苗免疫后毒力返强和同源重组的问题。
附图说明
图1为ELISA检测的猪瘟病毒抗体的水平;
图2为ELISA检测的蓝耳病病毒抗体的水平。
具体实施方式
下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均落在本发明的保 护范围内。
实施例1
A.猪瘟病毒E2基因和蓝耳病病毒GP5基因的扩增
(1)PCR扩增引物的设计
在猪瘟病毒E2基因的上、下游引物中分别加入Kpn I和Bgl II限制性内切酶酶切位点,所述猪瘟病毒E2基因的上、下游引物分别设计为:
上游引物P1:5’-AAAGGTACCATGAGGGGACAGATCGTGC-3’
下游引物P2:5’-CCCAGATCTACCAGCGGCGAGTTGTTCTG-3’
在蓝耳病病毒GP5基因的上、下游引物中分别加入Bgl II和Not I和限制性内切酶酶切位点,所述蓝耳病病毒GP5基因的上、下游引物分别设计为:
上游引物P1:5’-AAAAGATCTATGTTGGGCAAGTGCTTGAC-3’
下游引物P2:5’-CCCGCGGCCGCCTAGAGACGAGCCCATTG-3’
(2)猪瘟病毒E2基因片段的体外扩增及扩增产物的回收与纯化
将含有蓝耳病病毒GP5基因的pMD18-T-GP5质粒用双蒸水稀释100倍,取1μL为模板,用蓝耳病病毒GP5基因的引物扩增编码GP5蛋白的目的片段,其中PCR反应体系如下:
PCR反应条件:95℃预变性5min;94℃1min,54℃1min,72℃1min,共35个循环;最后72℃延伸10min,4℃储存;将PCR产物置于8g/L琼脂糖凝胶,于60V电泳20min后切取目的条带大小的片段,回收蓝耳病病毒GP5基因的扩增产物;
(3)蓝耳病病毒GP5基因片段的体外扩增及扩增产物的回收与纯化
将含有蓝耳病病毒GP5基因的pMD18-T-GP5质粒用双蒸水稀释100倍,取1μL为模板,用蓝耳病病毒GP5基因的引物扩增编码GP5蛋白的目的片段,其中PCR反应体系如下:
PCR反应条件:95℃预变性5min;94℃1min,54℃1min,72℃1min,共35个循环;最后72℃延伸10min,4℃储存;将PCR产物置于8g/L琼脂糖凝胶,于60V电泳20min后切取目的条带大小的片段,回收蓝耳病病毒GP5基因的扩增产物;
B.腺病毒穿梭载体pAdTrack-E2的构建
(1)猪瘟病毒E2基因PCR产物的Bgl II和Sal I双酶切
向1.5mL Eppendorf管中依次加入:
以37℃水浴6h后,用8g/L琼脂糖凝胶电泳,切下含目的条带的凝胶回收;
(2)穿梭载体pAdTrack-CMV的Bgl II和Sal I双酶切
向1.5mL Eppendorf管中依次加入:
以37℃水浴6h后,用8g/L琼脂糖凝胶电泳,切下含目的条带的凝胶回收;
(3)猪瘟病毒E2基因与穿梭质粒载体pAdTrack-CMV的连接
连接反应体系:
16℃水浴连接过夜;
(4)猪瘟病毒E2基因和pAdTrack-CMV载体连接产物的转化和鉴定
①DH5α感受态细胞的制备
将-70℃甘油保种的DH5α接种于不含抗生素的LB琼脂培养基上,37℃培养过夜,挑取长势良好的单菌落,接种于3mL新配置的不含抗生素的LB培养液中,37℃250r/min振荡培养过夜,约14h;取100μL培养物,按1:100比例接种于100mL新鲜LB培养液中,300r/min剧烈振荡培养约3h,至OD600为0.6;无菌条件下转移细菌培养物至两个预冷的50mL离心管中,冰浴10min;4℃下1600r/min离心10min,弃上清,倒置离心管沥干液体,加入预冷的0.1mol/L CaCl2溶液10mL,悬浮菌体沉淀,置冰浴放置30min;4℃下1100r/min离心10min,弃上清,用2mL 0.1mol/L预冷的CaCl2(含150mL/L甘油)重悬菌体,然后分装于预冷的灭菌Eppendorf管中,每管100μL,置-70℃冰箱保存备用;
②重组质粒转化感受态细胞
取一管感受态细胞置于冰水混合物上,待完全融化后,将10μL的连接产物加入管中,轻轻混匀;冰浴30min;42℃水浴中热激90s;冰浴3min;加入800μL LB培养基,37℃下200~250r/min振荡培养1h;8000r/min离心1min,弃部分上清,存留100μL左右的上清重悬沉淀;取100μL混合物均匀涂布于含卡那霉素(50μg/mL)的LB琼脂平板上,待完全吹干后,37℃培养过夜(12~16h);挑取单菌落于3mL含50μg/mL卡那霉素的LB液体培养基中,37℃培养过夜;碱裂解法提取质粒后进行酶切、PCR和测序鉴定;
将猪瘟病毒E2基因插入至穿梭载体pAdTrack-CMV中构建的重组质粒命名为:腺病毒穿梭载体pAdTrack-E2;
C.腺病毒穿梭载体pAdTrack-GP5的构建及CMV-GP5片段的获得
(1)蓝耳病病毒GP5基因PCR产物的Kpn I和Not I双酶切
向1.5mL Eppendorf管中依次加入:
以37℃水浴6h后,用8g/L琼脂糖凝胶电泳,切下含目的条带的凝胶回收;
(2)穿梭载体pAdTrack-CMV的Kpn I和Not I双酶切
向1.5mL Eppendorf管中依次加入:
以37℃水浴6h后,用8g/L琼脂糖凝胶电泳,切下含目的条带的凝胶回收;
(3)蓝耳病病毒GP5基因与穿梭质粒载体pAdTrack-CMV的连接
连接反应体系:
16℃水浴连接过夜;
(4)蓝耳病病毒GP5基因和pAdTrack-CMV载体连接产物的转化和鉴定
①DH5α感受态细胞的制备
同步骤B的(4)①;
②重组质粒转化感受态细胞
同步骤B的(4)②;
将蓝耳病病毒GP5基因插入至穿梭载体pAdTrack-CMV中构建的重组质粒命名为为:腺病毒穿梭载体pAdTrack-GP5;
(5)CMV-GP5基因的获得
根据pAdTrack-GP5载体中CMV启动子的序列设计扩增CMV-GP5基因的引物:
上游引物P1:5’-AAACTCGAGTAGTTATTAATAGTAATCAATTAC-3’
下游引物P2:5’-CCCTCTAGATTACTACTAGAGACGAGCCCATTG-3’
在CMV-GP5基因的上、下游引物中分别加入Xho I、Xba I和限制性内切酶酶切位点,并在下游引物中引入终止密码子;
D.重组腺病毒穿梭载体pAdTrack-E2-CMV-GP5的构建
(1)CMV-GP5基因PCR产物的Xho I和Xba I双酶切
向1.5mL Eppendorf管中依次加入:
以37℃水浴6h后,用8g/L琼脂糖凝胶电泳,切下含目的条带的凝胶回收;
(2)穿梭载体pAdTrack-E2的Xho I和Xba I双酶切
向1.5mL Eppendorf管中依次加入:
以37℃水浴6h后,用8g/L琼脂糖凝胶电泳,切下含目的条带的凝胶回收;
(3)CMV-GP5基因与穿梭质粒载体pAdTrack-E2的连接
连接反应体系:
16℃水浴连接过夜;
(4)CMV-GP5片段和pAdTrack-E2载体连接产物的转化和鉴定
①DH5α感受态细胞的制备
同步骤B的(4)①;
②重组质粒转化感受态细胞
同步骤B的(4)②;
将CMV-GP5片段插入至穿梭载体pAdTrack-E2中构建的重组质粒命名为:重组腺病毒穿梭载体pAdTrack-E2-CMV-GP5;
E.重组腺病毒骨架载体pAdEasy-E2-CMV-GP5的构建
(1)重组腺病毒穿梭载体pAdTrack-E2-CMV-GP5的线性化
用Pme I对穿梭载体pAdTrack-E2-CMV-GP5酶切线性化,按如下所示分别加入各组分:
置37℃水浴中6h后经琼脂糖凝胶电泳回收;
(2)线性化的重组腺病毒穿梭载体pAdTrack-E2-CMV-GP5转化到含有腺病毒骨架载体pAdEasy-1的大肠杆菌BJ5183感受态细胞
同步骤B的(4)②;
将重组后的腺病毒骨架载体命名为:重组腺病毒骨架载体pAdEasy-E2-CMV-GP5;
F.重组腺病毒rAd-E2-CMV-GP5的获得
(1)重组腺病毒骨架载体pAdEasy-E2-CMV-GP5的线性化、回收和纯化
用Pac I酶切使重组腺病毒骨架载体pAdEasy-E2-CMV-GP5线性化,酶切反应体系为:
在酶切后的产物中,加入2.5体积的无水乙醇和1/10体积的3mol/L NaAc,-20℃沉淀1h,在4℃以12000r/min离心15min,弃去上清,加入70%乙醇洗一次,自然干燥后,加入20μL H2O溶解DNA;
(2)重组腺病毒rAd-E2-CMV-GP5的获得
将线性化的重组腺病毒骨架载体pAdEasy-E2-CMV-GP5转染至人胚胎肾细胞HEK 293细胞中,具体操作按LipofectamineTM2000产品说明书进行;收获的病毒液命名为重组腺病毒rAd-E2-CMV-GP5;
(3)重组腺病毒rAd-E2-CMV-GP5的扩增及滴度测定
按照噬斑法测定rAd-E2-CMV-GP5在293细胞中传至10代时的病毒滴度。
实施例2
1.rAd-E2-CMV-GP5免疫保护性试验
(1)实验动物分组
将24头猪随机分为4组,第一组为rAd-E2-CMV-GP5免疫组,8头。第二组为猪瘟脾淋苗和蓝耳病弱毒疫苗免疫组,8头。第三组为非重组腺病毒免疫组,4头。第四组为空白对照组,4头。
(2)免疫和攻毒
重组腺病毒组和非重组腺病毒组的免疫剂量均为1.2×109pfu(约 2mL),于颈部肌肉和腹部皮下多点注射;猪瘟兔化弱毒疫苗和蓝耳病弱毒疫苗的免疫方法和剂量按照疫苗使用说明进行;空白对照用培养重组腺病毒的DMEM培养液免疫,2mL/头。所有试验猪在免疫后的20d时用致死量的猪瘟强毒和蓝耳病强度肌肉注射、点眼、滴鼻和口服攻击。
(3)体温检测和临床观察
所有试验猪从攻毒的第1天开始测量体温,以后每天测量体温,观察临床症状。
(4)血清抗体的检测
从免疫开始和免疫后的每个星期采集血液,收集血清,用于猪瘟和蓝耳抗体的检测,另一份加入抗凝剂,用于血液中猪瘟病毒和蓝耳病病毒的检测。
(5)攻毒后血液中病毒存在的检测
攻毒后隔天采集抗凝全血,用RT-PCR方法检测血液中的猪瘟病毒和蓝耳病病毒。
(6)病理观察
在攻毒后的14天,当所有存活猪的临床症状基本消失后,全部处死并进行剖检,观察下颌淋巴结、肠系膜淋巴结、腹股沟浅淋巴结、肾脏、脾脏、膀胱以及心脏是否有病理变化。
2.结果
(1)体温和临床症状
第一组(rAd-E2-CMV-GP5免疫组)在免疫后没有出现任何临床 症状,在攻毒后第4天,8头免疫猪中3头猪体温达40℃以上,持续48h左右,第7天时1头体温仍持续达40℃以上,精神萎靡,先出现便秘,后拉稀,在第9天死亡。剩余的7头猪全部存活。保护率为87.5%。
第二组(猪瘟脾淋苗和蓝耳病弱毒苗免疫组)在攻毒后的第4天,8头免疫猪中4头猪体温达40℃以上,持续48h左右,食欲稍微下降,其中2头在第6天体温和食欲恢复正常,另1头在第10天死亡。剩余的7头猪全部存活。保护率为87.5%。
第三组(非重组腺病毒免疫组)和第四组(空白对照组)的所有试验猪在攻毒后第2天体温升至40℃以上,病猪便秘;第3天食欲减退,精神沉郁,有些病猪发生呕吐,很少采食,仅少量饮水,精神高度沉郁,四肢软弱无力,行动缓慢,摇摆不稳,普遍拉稀,两眼无神,有多量黏液脓性分泌物,腹下、耳和四肢内侧有出血点;第4天病猪伏卧不起,全身震颤,四肢呈游泳状划动,体温一直稽留在41℃左右。第5天开始陆续死亡,至第7天全部死亡,死前体温下降。死亡率为100%。
体温及死亡情况见表1。
(2)抗猪瘟病毒和抗蓝耳病病毒抗体的检测
用中国兽药监察所提供的猪瘟ELISA抗体检测试剂盒对所有试验猪的抗体水平进行检测。rAd-E2-CMV-GP5免疫组的抗体呈上升趋势,在攻毒前抗体OD630值分别达到0.396,攻毒后所有试验组的抗体水平都呈明显的上升趋势。猪瘟兔化弱毒苗免疫组的抗体水平在攻 毒前的OD630最高值为0.426。非重组腺病毒对照组和空白对照组在攻毒前一直没有检测到抗体水平,但是在攻毒后临死前能检测到猪瘟抗体水平。图1。
表1 不同疫苗免疫组CSFV强毒攻击后体温情况
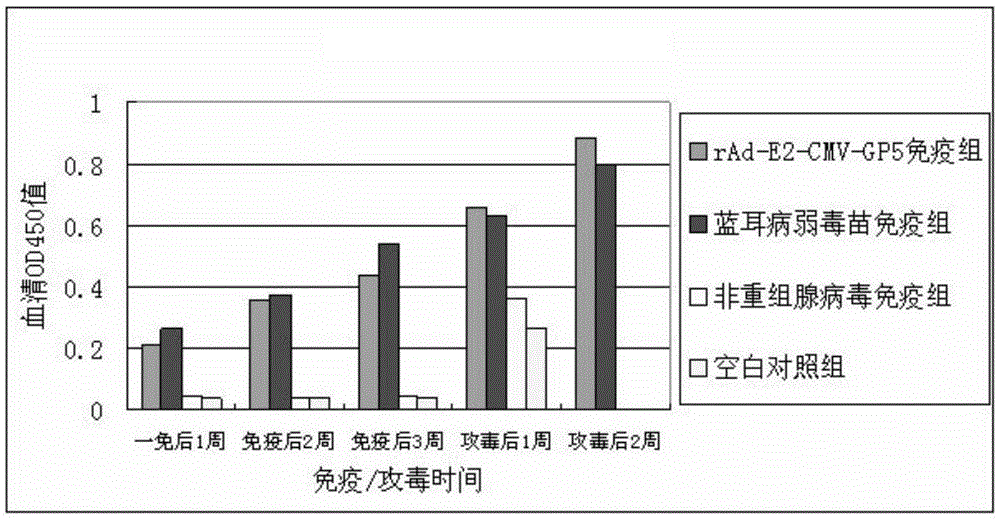
用上海宝特生命科学发展有限公司生产的蓝耳病病毒ELISA抗体检测试剂盒对所有试验猪的抗体水平进行检测。rAd-E2-CMV-GP5免疫组的抗体呈上升趋势,在攻毒前抗体OD450值分别达到0.436,攻毒后所有试验组的抗体水平都呈明显的上升趋势。蓝耳病弱毒苗免疫组的抗体水平在攻毒前的OD450最高值为0.542。非重组腺病毒对照组和空白对照组在攻毒前一直没有检测到抗体水平,但是在攻毒后临死前能检测到蓝耳抗体水平。ELISA检测蓝耳病病毒抗体水平见图2。
(3)攻毒后血液中猪瘟病毒和蓝耳病病毒的检测
攻毒后隔天采集的抗凝血,用RT-PCR方法检测猪瘟病毒,结果发现rAd-E2-CMV-GP5免疫组中有4/8头能检测出猪瘟病毒,猪瘟脾淋苗免疫组也有4/8能检测出猪瘟病毒,而非重组腺病毒对照和空白对照都100%检出,结果见表2。
表2 攻毒后血液中猪瘟病毒的检测
同样用RT-PCR方法检测蓝耳病病毒时,发现rAd-E2-CMV-GP5免疫组中有4/8头能检测出猪瘟病毒,猪瘟脾淋苗免疫组也有4/8能检测出猪瘟病毒,而非重组腺病毒对照和空白对照都100%检出,但持续的时间要长于猪瘟病毒在血液中的存在时间,结果见表3。
表3 攻毒后血液中蓝耳病病毒的检测
(4)攻毒后组织脏器的病理观察
非重组腺病毒和空白对照组死亡猪的剖检结果显示,猪下颌淋巴结、肠系膜淋巴结、腹股沟淋巴结,肾脏、脾脏、膀胱以及心脏均有明显的出血现象。
rAd-E2-CMV-GP5免疫组和常规疫苗免疫组所有存活猪的剖检结果表明,尽管临床症状已经消失,但是某些脏器还存在一些病理变化。rAd-E2-CMV-GP5免疫组7头存活猪中,1头下颌淋巴结、肠系膜淋巴结出血,1头肠系膜淋巴结和肾脏出血。猪瘟脾淋苗免疫组7头存活猪中,1头下颌淋巴结、腹股沟淋巴结和膀胱有出血,1头肾 脏和膀胱有出血。
综上所述,本发明采用ELISA方法检测了免疫猪的体液免疫水平。重组腺病毒rAd-E2-CMV-GP5和常规疫苗免疫猪后都能诱导机体产生特异性体液免疫应答,这表明本试验构建的重组腺病毒接种猪体后,在宿主细胞内所表达的蛋白具有较好的免疫原性。常规疫苗接种猪体后诱导的抗体水平略高于重组腺病毒rAd-E2-CMV-GP5诱导的抗体水平,这可能是因为尽管重组腺病毒rAd-E2-CMV-GP5在机体内仅表达了两种主要的保护性蛋白,其形成的抗原位点较常规全病毒疫苗少的缘故。但是,当用致死量的强毒攻击时,rAd-E2-CMV-GP5免疫组和常规疫苗免疫组都提供了87.5%的保护率,可见抗体水平的高低并不是评价机体能否抵抗强毒攻击的惟一指标,出现这一结果可能是因为接种重组腺病毒激发了机体其他的免疫机制(例如细胞免疫),而抵抗了强毒的攻击。非重组腺病毒免疫组和空白对照组全部死亡。
从攻毒后表现的临床症状来看,rAd-E2-CMV-GP5免疫组和常规疫苗免疫组均有临床症状,rAd-E2-CMV-GP5免疫组有3/8头出现,而常规疫苗免疫组有4/8头出现临床症状,就其原因可能是由于常规的弱毒苗接种猪体后会产生应激的原因。
从攻毒后的血毒检测来看,rAd-E2-CMV-GP5免疫组和常规疫苗免疫组之间没有差别,均有4/8头的检出率。
从上述的结果可以看出,本发明能有效的预防猪瘟和蓝耳病的发生,和常规疫苗相提供相同的保护率,大量节约了人工和成本。
- 还没有人留言评论。精彩留言会获得点赞!