大豆花粉育性的分子标记检测方法及其应用与流程
本发明涉及生物技术领域中大豆花粉育性的分子标记检测方法及其应用。
背景技术:
雄性和雌性生殖器官在植物种子发育中起着非常重要的作用。雄蕊或雌蕊发育过程中相关基因的任何突变均可引起植物育性的改变。根据雌性与雄性配子育性的不同,将相关突变体划分为雌性-雄性不育、雄性不育-雌性可育、雄性可育-雌性不育。目前,大豆中已经鉴定出了多个雄性不育-雌性可育突变体(简称为雄性不育突变体)。
杂种优势利用在玉米、水稻、高粱、油菜、花生、部分蔬菜等育种与生产中已获得巨大的生产效益,而大豆等部分作物仍以常规种生产为主。在最近的作物杂种优势利用国际会议上部分学者就利用雄性不育体系对大豆生产有着积极的杂种优势效应做了相关报告(lietal.2012;sun.2012,yangetal.2012;zongetal.2012)。大豆杂交品种培育在我国已有多年的育种实践,并取得了一定成绩。大豆是一个严格的自花授粉作物,需要在开花之前去除花药,依靠人工杂交手段获得大量大豆杂交种非常困难而且耗费时费力。如果获得一个不依赖于种植环境的雄性不育体系,将会极大地促进大豆杂交品种培育及大豆杂种优势利用。目前急需一种可以快速鉴定大豆花粉粒育性的方法。
技术实现要素:
本发明所要解决的技术问题是如何鉴定大豆花粉粒育性。
为解决上述技术问题,本发明首先提供了利用大豆花粉育性连锁分子标记10-0871及其对应的引物对x1(将用来得到分子标记10-0871的引物对命名为x1)鉴定或辅助鉴定大豆花粉粒育性的方法。
本发明所提供的鉴定或辅助鉴定大豆花粉粒育性的方法,包括如下步骤:
分别以待鉴定大豆、冀豆12和雄性不育突变体(pst1)的基因组dna为模板,用名称为x1的pcr引物对进行pcr扩增,通过非变性聚丙烯酰胺凝胶电泳检测所得到的pcr产物,按照下述方法确定所述待鉴定大豆的花粉粒育性:
将冀豆12的pcr扩增产物的带型命名为a,将雄性不育突变体(pst1)的pcr扩增产物的带型命名为b,如果待鉴定大豆的pcr扩增产物在非变性聚丙烯酰胺凝胶电泳中的带型为所述a,所述待鉴定大豆为或候选为花粉粒可育大豆,如果待鉴定大豆的pcr扩增产物在非变性聚丙烯酰胺凝胶电泳中的带型为所述b,所述待鉴定大豆为或候选为花粉粒败育大豆,如果待鉴定大豆的pcr扩增产物在非变性聚丙烯酰胺凝胶电泳中的带型为h带型,所述h带型为含有所述a带型和所述b带型的带型,所述待 鉴定大豆为或候选为花粉粒部分可育大豆;
所述x1由seqidno.1和seqidno.2所示的两条单链dna组成。
上述方法中,所述非变性聚丙烯酰胺凝胶电泳中,所述非变性聚丙烯酰胺凝胶的浓度为6%,
上述方法中,所述pcr扩增中的引物退火温度为55℃。
上述方法中,所述pcr扩增中的引物退火条件为55℃30s。
上述方法中,所述待鉴定大豆选自雄性不育突变体(pst1)×冀豆12的杂种后代中的f2及其以后世代的家系。
上述方法中,所述花粉粒部分可育大豆是指单株大豆的可育花粉粒占该株花粉粒总数的比例为15-90%。
为解决上述技术问题,本发明还提供了所述的方法在大豆育种中的应用。
为解决上述技术问题,本发明还提供了所述方法在预测大豆花粉粒育性中的应用。
为解决上述技术问题,本发明还提供了鉴定或辅助鉴定大豆花粉粒育性的引物对。
本发明所提供的鉴定或辅助鉴定大豆花粉粒育性的引物对,为所述x1。
为解决上述技术问题,本发明还提供了鉴定或辅助鉴定大豆花粉粒育性的系统。
本发明所提供的鉴定或辅助鉴定大豆花粉粒育性的系统,包括所述引物对、进行pcr扩增所需的试剂和/或仪器、和/或进行非变性聚丙烯酰胺凝胶电泳所需的试剂和/或仪器。
为解决上述技术问题,本发明还提供了所述引物对或所述系统在下述a)、b)、c)或d)中的应用:
a)大豆育种中的应用;
b)预测或辅助预测大豆花粉粒育性;
c)制备鉴定或辅助鉴定大豆花粉粒育性的产品;
d)鉴定或辅助鉴定大豆花粉粒育性。
实验证明,利用分子标记10-0871及其对应的引物对x1对大豆花粉粒育性的鉴定结果与利用常规检测方法的鉴定结果完全一致:将冀豆12(jd12)的带型命名为a,将雄性不育突变体(pst1)的带型命名为b,结果发现,f2中的58个花粉粒败育个体的带型均为b,20个花粉粒可育个体的电泳带型均为a,18个半不育个体的带型均相同,均为h带型,h带型为含有a带型和b带型的带型。表明,可利用分子标记10-0871与其对应的引物对x1对大豆花粉粒育性进行鉴定,也可用于对大豆雄性不育表型的分子标记辅助选择。
附图说明
图1为雄性不育突变体(pst1)和冀豆12的花粉粒育性的检测结果。其中a冀豆12(左),b为雄性不育突变体(pst1,右)。
图2为bsa法育性基因连锁标记筛选结果。其中,a为ssr-10-0810,b为ssr-10-0871,c为ssr-10-0753;1为可育池fj,2为败育池sj,3为突变体(pst1)。
图3为育性基因连锁标记的验证结果。
图4为分子标记10-0871对f2个体的基因型检测结果。pst1表示雄性不育突变体。
具体实施方式
下面结合具体实施方式对本发明做进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的雄性不育突变体(pst1)为大豆(glycinemax(l.)merr.)品种中品661的ems诱变突变体,花粉粒高度败育,统一编号为zdd25365,来源于中国国家种质资源库。公众也可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的大豆(glycinemax(l.)merr.)品种冀豆12:记载于“陈强,闫龙,杨春燕,等.冀豆12遗传背景下3个回交组合高低蛋白含量后代品系ssr标记分析.中国农业科学,2014年02期”,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的花粉粒育性的检测方法如下:取即将开放花蕾,剥出花药后用镊子夹裂,放在载玻片上并滴上10微升碘-碘化钾溶液(m/v,0.1%),后放入光学显微镜下观察花粉粒染色效果。若花粉粒粒形状规则似球形,且呈深黑色则为可育;反之,花粉粒形状不规则,浅染或者不染色则为败育花粉粒。雄性不育突变体(pst1)和冀豆12的花粉粒育性的检测结果如图1所示。雄性不育突变体(pst1)的花粉粒全部败育,冀豆12的花粉粒全部可育。
实施例1、大豆雄性不育位点的鉴定
以冀豆12(jd12,♂)为父本、突变体(pst1,♀)为母本进行杂交,得到其子代f1,子代f1自交获得f2分离群体。根据f2个体花粉粒育性检测结果,选取10株可育(花粉粒败育率为0)个体混和提取dna,构建可育池(fj),同时选取10株败育(花粉粒败育率为100%)个体混和提取dna,构建败育池(sj)。
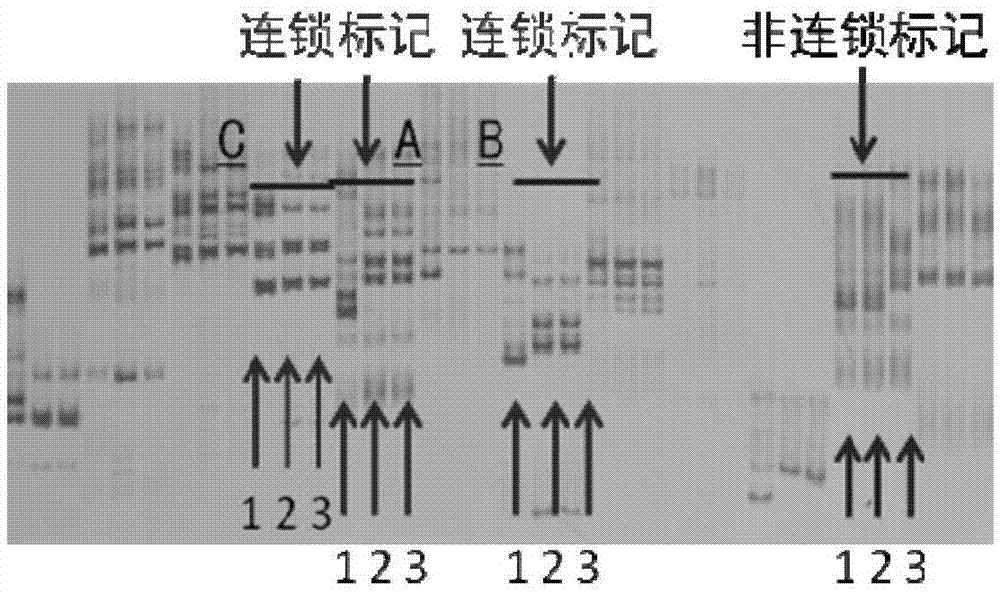
在均匀分布于全基因组的543对ssr中,两亲本间共检测到有多态性标记285对,用这些多态性标记引物对突变体(pst1)、可育池(fj)及败育池(sj)的基因组dna分别进行pcr扩增,部分引物如表1所示,扩增产物用6%非变性聚丙烯酰胺凝胶电泳进行检测(图2)。结果显示,位于gm10上的3对标记扩增产物在可育池(fj)与败育池(sj)间存在差异,这3个标记分别为ssr-10-0753、10-0810、10-0871,这些标记可能与育性位点存在连锁。
用ssr-10-0753、ssr-10-0810和ssr-10-0871等三个标分别记检测f2花粉粒完全败育个体基因型(图3)。结果:28株花粉粒完全败育f2个体中,5株个体的这三个标记扩增结果均为杂合带型(将该带型命名为h),2株个体的带型与jd12的带型相同(将该带型命名为a),其余个体的带型与突变体(pst1)的带型相同(将该带型命名为b)。经对花粉粒育性的重新检测,得知与jd12带型相同的2株个体为花粉粒可育株。因此可知,ssr-10-0753、ssr-10-0810和ssr-10-0871标记与育性基因存在真实连锁关系,ssr-10-0753与ssr-10-0871位点两侧连锁标记相距7.5mb。
标记ssr-10-0753、10-0810两者物理距离为5.2mb,在该区间内新合成17对ssr进行混池筛选。结果:gm10上新检测到标记10-0768、10-0773、10-0790与育性基因存在连锁。选取部分败育个体验证上述结果。49株花粉粒完全败育f2个体中,12株个体的三对标记扩增结果均为杂合带型(h),其余个体基因型均为突变体(pst1)带型(b)。
现有定位群体中,育性基因连锁区间为10-0753~10-0871,物理区间约7.5mb,其中区间内五个标记间未发现交换(ssr-10-0753~10-0810,两者物理距离为5.2mb),同时结合专业网站phytozome大豆基因组染色体结构预测结果,故推测该定位区间可能位于chrome10的着丝粒区。为缩小定位区间,筛选交换单株,进一步扩大定位群体。从现有f2分离群体中,筛选出了败育个体58株与可育个体185株,用现有连锁标记进行了基因型检测,将大豆花粉粒雄性不育基因定位到了标记10-0810~10-0871之间,物理区间长度缩为2.3mb。
上述过程中用到的部分引物的序列如表1所示,反应体系与反应程序如下:
pcr反应体系:dna:2μl(20ng/μl),easytaq酶:0.3μl,10×pcrbuffer:2μl,2.5mmdntps:2μl,引物(f/r):3.0μl(2μm),ddh2o:10.7μl。
pcr反应程序:先94℃5min;然后94℃30s,55℃30s,72℃30s,扩增36个循环;最后72℃延伸5min,4℃forever。
非变性凝胶电泳检测基本流程:制胶、上样、电泳、银染、水洗、显影等,基本步骤类似变性聚丙烯酰胺凝胶电泳。
表1、pst1×jd12组合f2群体基因型检测所用分子标记及其对应引物序列
实施例2、标记10-0871在鉴定大豆雄性不育中的应用
以冀豆12(jd12)为父本、雄性不育突变体(pst1)为母本进行杂交,得到其子代f1,子代f1自交获得f2。共有94个f2单株,利用碘-碘化钾溶液染色方法检测这94个f2单株的花粉粒育性,结果发现f2中共有56个花粉粒败育个体、20个花粉粒可育个体和18个半不育个体,其中半不育个体是指单株大豆的可育花粉粒占该株花粉粒的比例为15-90%的个体。提取得到冀豆12(jd12)、雄性不育突变体(pst1)以及f2各单株的基因组dna。
利用分子标记10-0871的引物对x1分别对冀豆12(jd12)、雄性不育突变体(pst1)以及f2各单株的基因组dna进行pcr扩增。x1为由10-0871f:5’-agactagctcggttccctcc-3’(序列表中序列1)和10-0871r:5’-gtccatgacaaattcctggc-3’(序列表中序列2)组成的引物对。反应体系如下:dna:2μl(20ng/μl),easytaq酶:0.3μl,10×pcrbuffer:2μl,2.5mmdntps:2μl,引物(f/r):3.0μl(2μm),ddh2o:10.7μl。pcr反应程序:先94℃5min;然后94℃30s,55℃30s,72℃30s,扩增36个循环;最后72℃延伸5min,4℃forever。pcr反应结束后,用6%的非变性凝胶电泳对pcr产物进行检测。
将冀豆12(jd12)的带型命名为a,将雄性不育突变体(pst1)的带型命名为b,结果发现,f2中的58个花粉粒败育个体的带型均为b,20个花粉粒可育个体的电泳带型均为a,18个半不育个体的带型均相同,均含有a和b的带型,将该种带型命名 为h,结果如图4所示。利用分子标记10-0871及其引物对x1对大豆花粉粒育性的鉴定结果与利用碘-碘化钾溶液的鉴定结果一致,表明分子标记10-0871是与大豆花粉育性连锁的分子标记,可利用分子标记10-0871及其引物对x1对大豆花粉粒育性进行辅助鉴定。
- 还没有人留言评论。精彩留言会获得点赞!