抗CD127的抗体的制作方法
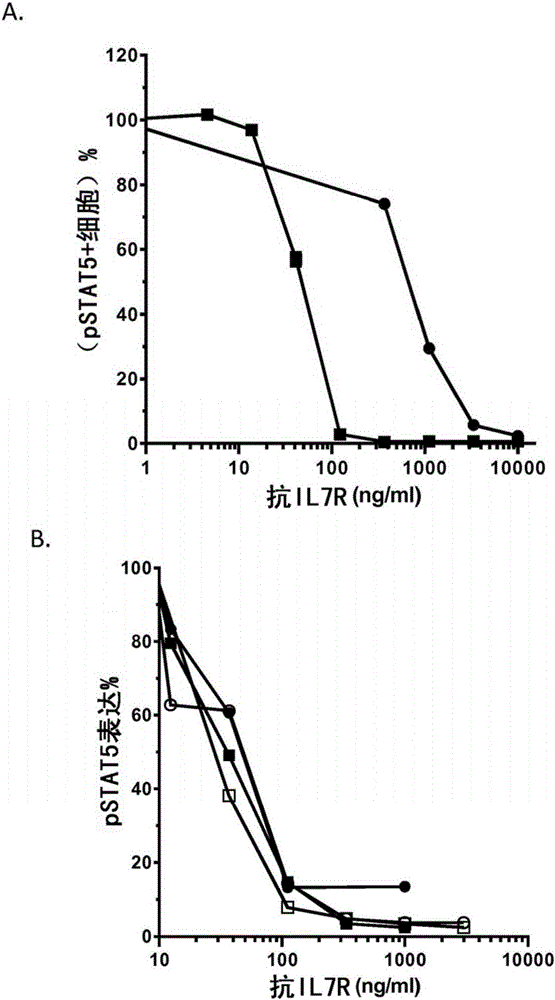
抗CD127的抗体本发明关注的是针对以下的抗体的领域:被命名为CD127或p90IL-7R或IL-7Rα,有时也被称为IL-7Ra的白介素7(IL-7)受体的α亚单位,特别是人细胞上表达的人IL-7的受体的α链。这些抗体具有针对IL-7-IL-7R相互作用的拮抗剂性质,可能呈现针对CD127阳性细胞的细胞毒性活性但是不会增加TSLP诱导的树突细胞(DCs)的成熟,所述TSLP是使用CD127作为其受体一部分的细胞因子。可选地或另外地,这些抗体不诱导CD127的内化和/或抑制IL7-诱导的CD127的内化。根据本发明的另一方面,提供识别以下表位的抗体:含有源自CD127的2b位点的序列的人CD127表位,特别是含有CD127的D1结构域和2b位点的人CD127序列的表位,特别是含有源自D1的至少一个序列和源自2b位点的序列的表位,所述源自D1的序列包括SEQIDNo:115(特别是含有SEQIDNo:110),所述源自2b位点的序列包括SEQIDNo:116序列和可选地也包括SEQIDNo:117(特别是包括SEQIDNo:111)。相应地,当IL-7信号通路对所述发病机理有贡献时,特别是当树突细胞的成熟、更确切地说是树突细胞的共刺激分子的上调中的增加是不期望时,本发明的抗体适用于救治病人中诊断的病症,所述病症是由与淋巴细胞生成相关的发病机理导致的。
背景技术:
:生物化学CD127对于IL-7受体(IL-7R)和TSLP受体(TSLPR)是常见的。IL-7R是由CD127和白介素受体的共用γ链(γc)的异质二聚体构成的。共用γ链γc在本文中和文献中有时也被称为CD132。白介素7结合IL-7R。TSLP受体是CD127和细胞因子受体样因子2(CRLF2)的异质二聚体。TSLP结合TSLP受体。在文献中,TSLPR有时也被用于指受体的CRLF2链和CD127/CRLF2复合物。为了避免误解,下文中TSLPR通常指该复合物。CD127(SwissProt登录号:P16871)可能存在四种同工型。经典(canonical)同工型,也称为H20(SwissProtP16871.1)是单通道跨膜蛋白并具有459个氨基酸,所述氨基酸从N端至C端由20个氨基酸信号肽、219个氨基酸胞外结构域、25个氨基酸跨膜结构域和195个氨基酸胞内结构域构成。其它同工型共享H20的全部(或大部分)胞外结构域的序列并显示出不同的C端序列。同工型2和4被分泌(SwissProtP16871-4和P16871-3),而同工型3(SwissProtP16871-2)也是跨膜蛋白。CD127的没有信号肽的序列,在本文中作为SEQIDNo:57提供。当提及本申请中CD127的编号氨基酸时,所述序列将用作编号的参考。CD127据报道具有SEQIDNo:113序列和它的胞外结构域,当去除信号肽时,其具有SEQIDNo:114序列。除非另有说明,本文中用于CD127的氨基酸的编号是来自SEQIDNo:114的编号。CD127是I型细胞因子受体同源(CRHI)受体。本领域熟知,这些受体的胞外结构域由两个被称为D1和D2的纤连蛋白3结构域构成。CD127精确的结晶结构已经在例如McElroy等,2009;McElroy等,2012和Walsh,2012中发布和讨论,以及特别是在结构生物信息学研究合作组织蛋白质数据库(RCSBPDB)中已经以蛋白质结构数据公开,其登录号为3UP1。通常认为D1涉及与IL-7的结合,而D2涉及与γc链的结合(以及与IL7的结合)。重要的是,D2结构域的2b位点,其基本由SEQIDNo:114的第109至127氨基酸组成(参见Walsh,2012),对于CD127-γc的相互作用,特别是在IL7存在的情况下允许或增加CD127与γc的结合是很关键的。特别地,在患有重症联合免疫缺陷病(SCID)的患者中识别的P112和L115处的突变被认为会动摇D2结构域的疏水内芯,这可能导致它们的病原特征。如上所述,2b位点基本由氨基酸109至127构成,本领域技术人员理解这种结构域的末端没有必要以单个碱基的精确度进行毫无疑问的定义,而且也可以理解2b位点在上述序列的任一端或两端包括1个、2个或3个以上或以下氨基酸。因此,当本文提及CD127的2b位点时,应当理解其指CD127中起始于第106、107、108、109、110、111或112位并终止于第124、125、126或127位的序列;特别是这样的序列,其被认为或显示为与IL7-R的γc链构成必要的结合位点,特别是在IL-7存在的情况下。IL-7R信号传导(signaling)。IL-7与IL-7R的结合触发几种信号通路的活化,所述信号通路包括Janus激酶(JAK)-1和Janus激酶(JAK)-3、信号传导与转录激活因子5(STAT5)和磷脂酰肌醇-3激酶(PI3-k)。据报道STAT1和STAT3通路被激活,尽管它们似乎不是主要通路。STAT5通路的活化对于诱导抗-凋亡蛋白Bcl-2和防止促凋亡蛋白Bax进入线粒体以及胸腺中发育的T细胞前体的存活是必需的。PI3-k通路的活化导致促凋亡蛋白Bad的磷酸化和细胞质滞留。TSLPR信号传导。胸腺基质淋巴细胞生成素(TSLP)是上皮细胞因子,其在淋巴细胞生成中是活化的,并且特别涉及免疫系统细胞的发育的调节,所述调节特别影响所述细胞的成熟。人TSLP(基因库登录号AF338732)是对树突细胞产生极化和促进T细胞和B细胞增殖和分化的因子。TSLP也抑制Treg细胞的产生(Lei等,2011)。已经显示,TSLP诱导的信号通路在分子水平上与IL-7诱导的通路不同。特别地,尽管TSLP结合它的受体也可以活化Jak-1,但是它不活化Jak-3而可以活化Jak-2。这些区别与Jak-1结合CD127的观察是一致的,所述观察在两种受体中相同,而Jak-2结合CRLF2以及Jak-3结合γc(Rochman等,2010)。STAT5通路的活化也被报道为TSLP诱导的信号传导(Zhong等,2014)。TSLP的一个主要效应是导致树突细胞的活化,诱导共刺激分子例如CD80的过表达,从而促进TH-2介导的炎症反应(Reche等,2001)。细胞生物学“CD127-阳性细胞是指在细胞表面表达CD127的细胞。在大多数情况中,CD127阳性细胞在形成IL-7R(IL-7R-阳性细胞)的复合物中和/或在形成TSLPR(TSLPR-阳性细胞)的复合物中表达CD127。CD127由不同的细胞表达,其包括记忆性T细胞和初始T细胞。特别地,CD127由包括静息(resting)和记忆性T细胞的效应T细胞(Teff)表达,以及通过未成熟的B细胞表达,但特别地不是由静息(resting)天然调控节T细胞(天然Treg)表达。IL-7Rα对于促进胸腺细胞分化和淋巴细胞的克隆扩增是必需的。近来的一些研究强调了IL7-CD127通路对初始T细胞稳态的重要性,所述研究表明在健康个体和HIV感染患者以及带有MS的患者中,在传统的CD4+T细胞中膜结合的IL-7Rα的表达水平与新近胸腺迁出细胞(RTE)-CD4+T细胞的频率相关(Albuquerque等,2007)(Broux等,2010)。IL-7Rα也是TSLP受体的元件。已经证明通过哈塞可氏小体的TSLP的分泌,调节CD11C+髓样树突细胞(MDCs)以诱导胸腺细胞分化成Treg,所述哈塞可氏小体的结构由胸腺髓质的上皮细胞构成(Watanabe等,2005a)。相应地,来自IL-7受体的信号对于Treg发育是必需的,如IL-7Rα敲除小鼠所示(Mazzucchelli等,2008)。在Haas等,2011中,作者显示在传统T细胞上IL-7Rα表达降低,和IL-7血浆水平升高以及MS中新近胸腺迁出细胞-Treg频率和Treg功能的降低,而没有明显的遗传影响(Haas等,2011)。分析IL-7如何调节它的同源受体膜运输(trafficking)对于深度理解IL-7/IL-7R在淋巴细胞功能中的作用是很关键的。之前的研究表明IL-7对T细胞的刺激导致在30分钟内CD127的表面下调,可能是因为受体内化。在稍后时间点(2-6小时),显示IL-7诱导CD127的转录下调。然而,CD127内化的实际动力学和通过IL-7对运输(trafficking)机制的调控,仍然有待阐明(Henriques等,2010)。还提示IL-7诱导的信号传导取决于CD127内化,并且随后的受体降解依赖于JAK3活性并由蛋白酶体和溶酶体介导。病理生理学树突细胞在成熟之后表达高水平共刺激分子例如CD80,其可以促进T细胞介导的免疫应答。它们也可以产生细胞因子TARC(CCL17),其可以诱导T细胞中的趋药性。因此,成熟的树突细胞对于若干种免疫介导的疾病的病理生理学是有贡献的,其中T细胞应答例如在哮喘、类风湿性关节炎、结肠炎、多发性硬化和葡萄膜炎中起作用。成熟的树突细胞也在细胞、组织或器官移植的排斥过程中起关键作用。因此,很多治疗策略目的在于防止树突细胞成熟。共刺激分子在抗原呈递细胞(APCs)例如树突细胞中的存在与否可以显著影响免疫应答的定性性质和定量特征。CD80通过树突细胞的过表达引起DC成熟,并增加记忆性T细胞活化(Bour-Jordan等,2011)。机理上,CD28和CD80的相互作用占据了免疫突触的中心簇(cluster),并且与结合的(engaged)TCR共定位,从而稳定免疫突触(Dustin和Shaw,1999)(Grakoui等,1999)。CD28和CD80之间的相互作用实际上为TCR产生适当的间隙以有效地与HLA分子相互作用(Shaw和Dustin,1997)。多发性硬化(MS)是中枢神经系统(CNS)的炎性脱髓鞘疾病。MS患者的CNS中脱髓鞘斑(patches)的出现与主要由巨噬细胞和T淋巴细胞构成的炎性细胞浸润相关。在机理水平上,MS被认为是自身免疫性疾病。MS通常被认为是主要由CD4+T细胞介导的疾病。CD4+的特定亚群:Th1和最近的Th17,与疾病的病理生理学有关。目前,仍然难以为每个亚群Th1和Th17分配特定的作用。而且,通过α4-整合素的拮抗抑制白细胞的运输已经被证实为是治疗炎症疾病例如MS和炎症性肠病(IBD)以及治疗动脉粥样硬化的治疗方法(Zhi等,2014)。α4β7在更窄范围的白细胞组中表达,所述更窄范围的白细胞包括活化的巨噬细胞、淋巴细胞亚群、NK细胞、肥大细胞和嗜酸性粒细胞。人IL-7诱导α4和β7整合素在人T淋巴细胞上的体外强表达,并显著地增加表达α4、β7和α4/β7整合素的人T淋巴细胞的频率(图19),其对于T淋巴细胞归巢和滞留在非淋巴组织例如肠、脑和皮肤中是必需的(Denucci等,2009;Gorfu等,2009)。初始T细胞部分地负责移植器官和组织的急性排斥。可以通过当前的免疫抑制药物(钙调神经磷酸酶抑制剂)和通过阻止共刺激的单克隆抗体(抗-粘附、CD80/86抑制剂)控制这些细胞。记忆性T细胞也负责移植排斥。由于获得性免疫历史,主要是抵抗病毒的在先反应,记忆性T细胞在人体中累积。已经表明,作为“异源免疫”的结果,记忆性T细胞可以被异体抗原重新活化,这是机体抗病毒防御和异体抗原的交叉反应(Adams等,2003)。异源免疫代表对耐受诱导的强有力的屏障,因为与初始T细胞相比,记忆性T细胞被设定为可以快速激活且对共刺激信号的需求降低。记忆性T细胞也涉及慢性排斥。除了它们在器官和组织移植中的作用之外,自然和记忆性T细胞也对很多自身免疫疾病共同负责。溃疡性结肠炎(Shinohara等,2011)、类风湿性关节炎、牛皮癣或移植物抗宿主病都是这种情况。而且,已经证实几种恶性细胞显示IL-7R。Sezary皮肤淋巴瘤(他们中的60%)、或儿童急性淋巴细胞性白血病都是这种情况,其中约15%的病例在CD127中发展成功能获得型突变,使得这些肿瘤是IL-7部分依赖的(Shochat等,2011)。T淋巴细胞的消耗是一种显而易见的免疫抑制方法,以抵消同种异体移植物排斥或对抗自身免疫。然而,T细胞完全耗尽可能不利于诱导免疫耐受。靶向T细胞亚群或选择性激活的T细胞,而不修饰Treg细胞,可构成促-耐受方式(Haudebourg等,2009)。因此,CD127可以被认为是单克隆抗体(Mabs)的潜在有吸引力的治疗目标,目的在于调节免疫应答,因为这种单克隆抗体可以具有消耗效应物(effector)而不是调节性淋巴细胞的潜力。因此,已经假设,它们可能通过拮抗IL-7对IL-7-R的接近从而限制T细胞和B细胞功能和生长,而在移植、自身免疫(Michel等,2008)和恶性肿瘤中显示功效。使用抗CD127+细胞的单克隆抗体的干扰IL-7通路的治疗,可以通过消除/中和初始T细胞和记忆性T细胞和/或降低它们的数量的同时保存Treg细胞或通过消除或降低CD127-阳性恶性肿瘤细胞的数量来实现该目标。然而,如果它导致树突细胞的活化,那么使用抗CD127+细胞的单克隆抗体的治疗可能起双刃剑作用。事实上,CD127也由树突细胞结合CRLF2表达,形成TSLP受体。在TSLP存在的情况下,树突细胞被活化并促进T细胞介导的免疫应答。一些抗CD127的单克隆抗体可能通过修饰TSLP与TSLP受体相互作用的方式,具有增加TSLP诱导的树突细胞成熟的性质(如图7所示,在培养基条件下)。结果,使用不会增加TSLP诱导的树突细胞的成熟的抗CD127的单克隆抗体的治疗将呈现治疗优点。在含有TSLP的炎症环境中,这将会呈现IL7R阻断的优点而没有活化树突细胞的缺点。在一份出版物中(Racapé等,2009),作者分析了IL-7受体α(IL7Rα)在移植中作为潜在的治疗靶标的兴趣(interest)。在评估了IL-7Rα在不同T细胞和IL-7反应细胞上的表达之后,作者确定了靶向表达IL-7Rα的记忆性T细胞是否可以延长同种异体移植物在小鼠中的存活,并得出结论,靶向IL-7或IL-7Rα会有力地排除Treg细胞。在这些观点中,作者指出在治疗性处理中靶向IL-7或IL-7Rα可能对表达CD127的细胞存活有不同的结果,并可能导致不同类型的淋巴细胞减少。从概念的观点来看,还提出了抗IL-7Rα的抗体的效果的问题取决于它们是否是阻断或中和细胞毒性抗体。然而,作者没有显示已经获得和测试这种抗体,而是表示需要进行进一步研究以评估该假设的相关性。鉴于涉及IL-7/IL-7Rα的免疫相关疾病或其它疾病例如包括一些乳腺癌的不同类型癌症中的可用治疗方式的缺点,仍然需要其它候选药物,特别是针对更多选择性靶标具有活性的候选药物,用于控制目的例如调节人类患者的免疫活化。在这种情况下,为了治疗自身免疫性疾病例如多发性硬化,WO2010/017468已经公开了具有抗IL-7Rα的拮抗剂性质的抗IL-7Rα的单克隆抗体,以及WO2011/094259已经公开了它们的人源化形式。所述抗体被认为是IL-7结合其受体的拮抗剂,以及对TH17和TH1细胞的扩增和存活具有活性(据称其需要IL-7与其CD127受体的相互作用)。还没有考虑这些抗体对免疫细胞以及特别是树突细胞的成熟的影响。此外,据说这些抗体不会抑制TSLP诱导的TARC的产生(WO2011/094259的第107页)。类似地,考虑用于治疗糖尿病、狼疮、类风湿性关节炎和其它自身免疫性疾病的WO2011/104687或WO2013/056984中报道的抗-CD127的抗体,尚未就它们对树突细胞成熟的可能影响进行讨论,以及它们与TSLP诱导的信号传导的相互作用尚未见报道。此外,如Kern等(Kern等,2013;Kern等,2015)所公布的以及本文所公布的,现有技术中的抗-CD127的抗体可以诱导受体的内化。由于也诱导CD127内化的拮抗剂抗-CD127的抗体不能控制皮肤IV型超敏反应(图10),而不诱导内化的拮抗剂抗-CD127的抗体可能是内化过程活化信号通路,从而减轻抗体的拮抗效应。最后,现有技术中的抗体可以识别下述表位,其不包括源自CD127的2b位点的任何序列(即,特别是源自SEQIDNo:114的第109-127位氨基酸),以及未显示会破坏CD127与IL7R的γc链的结合。尽管最近研发CD127抗体上热门,但是精力都集中在抑制IL-7诱导的IL-7R信号传导。然而,TSLP和TSLPR涉及许多病理学。已经显示,TSLP在皮肤和肺部疾病中起到重要作用(He和Geha,2010),并且关联到各种不同的病理学,其包括人和小鼠中的气道炎症疾病和过敏性皮肤炎(Ying等,2008)(Jariwala等,2011)。此外,已经显示TSLP与肠道免疫和炎症的调节相关(Taylor等,2009)。涉及TSLP和TSLPR的其它病理学包括儿科B细胞白血病(vanBodegom等,2012)、肺部和皮肤特异性过敏性疾病、自身免疫相关疾病(Roan等,2012)和癌症,其包括乳腺癌(Olkhanud等,2011)。因此,尽管现有技术中已经充分地认识到抗-CD127的抗体是通过下述机制治疗免疫相关疾病的大有希望的候选药物:IL-7诱导的和/或IL-7-R介导的机制的拮抗作用,以及该抗体可以在TSLP受体存在的情况下结合CD127,以及干扰TSLP诱导的和/或TSLP受体介导的机制;但是现有技术中没有提出它们可能参与树突细胞的成熟,也没有暗示改进在于获得如下抗体:其不显示增加树突细胞的成熟的作用和/或也没有诱导CD127的内化和/或抑制IL-7诱导的内化。技术实现要素:伴随他们下述令人惊讶的发现:在TSLP诱导的树突细胞的成熟中由现有抗CD127的抗体诱导的意外升高(虽然抗体抑制TSLP诱导的TARC产生),本申请发明人已经研发出了不显示这种升高的抗体,以及因此更适于治疗疾病,特别是自身免疫性疾病。而且,与现有技术中的抗体例如MD707-13相比,本申请发明人已经发现不诱导CD127的内化和/或抑制IL7诱导的CD127的内化的抗体具有更高效率,特别是在体内。本发明提供了适于这种情况的方法,其涉及仅负面地干扰TSLP通路的抗IL-7Rα的单克隆抗体。相应地,与本申请发明人通过传统的抗-CD127的抗体观察到的相反,本发明的单克隆抗体(Mabs)不增加TSLP诱导的树突细胞成熟。此外或者另外地,本发明的抗体不诱导CD127的内化和/或抑制IL7诱导的CD127的内化。在一个具体实施方式中,本发明提供的抗体结合了这些DC成熟和/或内化相关的特性以及针对IL-7/IL-7-R信号传导的拮抗剂活性。在具体的实施方式中,本发明的抗体抑制T细胞中IL7诱导的α4,β7和α4/β7整合素表达,特别是在体内。这些具有新型作用机理的Mabs因此构成了评估CD127靶向的治疗益处的新产物。而且,本申请发明人公开了本发明的优选抗体识别的表位,因此允许直接研发替代抗体和/或它们的片段或抗原结合结构域或源自其它类型多肽的结构相关的抗原结合结构域,其结合相关表位并保护期望的特征。由N13B2识别的源自CD127的表位通过基于阵列的寡肽扫描(有时也被称为重叠肽扫描或pepscan分析)鉴别,并且包括由ep1(SEQIDNo:110)、ep2(SEQIDNo:111)和ep3(SEQIDNo:86)构成的人CD127的氨基酸序列。该技术使用源自靶蛋白的重叠和未重叠片段的寡肽序列库,并测试它们结合目标抗体的能力。通过结合源自靶蛋白不同部分的不相邻的肽序列并对该结合肽施加构象刚性(例如通过使用CLIPS支架)(Timmerman等,2007),可以以极高的可靠性和精确度绘制不连续的表位(Cragg,2011)(Gaseitsiwe等,2010)。此外,使用蛋白水解的保护程序确定表位,允许确定该构象表位包括人CD127的氨基酸序列,所述人CD127的氨基酸序列具有SEQIDNo:115、SEQIDNo:116和SEQIDNo:117。因此,该表位包括源自CD127的2b位点的序列。而且,该表位包括CD127的D1和D2结构域中的序列,以及更具体地,源自D1结构域的序列和源自2b位点的序列。在下文中,将更细致地描述根据本发明的表位。特别地,所述表位由SEQIDNo:115(或SEQIDNo:110)、SEQIDNo:116(或SEQIDNo:86)和SEQIDNo:117(或SEQIDNo:111)以它们在天然CD127中的构象排列构成。在一个具体实施方式中,该单克隆抗体也展现出靶向CD127+细胞的细胞毒性作用,这也生理上地降低了它们的数量(亚群收缩)。本发明因此涉及大分子,例如抗体、抗体的抗原结合片段或含有抗体或其片段的嵌合分子,其(i)通过抗体-抗原相互作用,将受体的α链特异性结合至IL-7(命名为CD127),特别是由人CD127阳性细胞表达的IL-7受体的α链,和(ii)不增加TSLP诱导的树突细胞的成熟(其特征在于例如增加细胞表面抗原CD80和/或CD40的表达)和/或(iii)不诱导CD127内化和/或抑制IL7诱导的CD127内化。在本发明的一个具体实施方式中,所述大分子包括VH链,其含有下述氨基酸序列中的至少一个:·VHCDR1SEQIDNo:10;·VHCDR2SEQIDNo:12;·VHCDR3SEQIDNo:14或SEQIDNo:48;·VHSEQIDNo:22和/或VL链,其含有下述氨基酸序列中的至少一个:·VLCDR1SEQIDNo:16或SEQIDNo:50;·VLCDR2SEQIDNo:18或SEQIDNo:52;·VLCDR3SEQIDNo:20;·VLSEQIDNo:24。在具体实施方式中,大分子展现出针对表达CD127的人T细胞(CD127+细胞)的细胞毒性活性。在其他实施方式中,该大分子不展现针对表达CD127的人T细胞(CD127+细胞)的细胞毒性活性。本发明也涉及含有所述大分子的组合物、获得所述大分子的方法、和所述大分子和组合物的应用。在本文中,大分子代表分子量大于500Da的任何分子,特别是生物来源的分子或含有生物来源的片段的分子。大分子包括但不限于多肽和改性多肽,例如糖基化多肽和其缀合物。在本文中,“通过抗体-抗原相互作用特异性结合CD127”的大分子是指所述大分子与CD127之间的相互作用基本上在于与如下相同的相互作用:CD127与CD127特异性抗体之间的这些相互作用。特别地,所述大分子可包括参与所述相互作用的抗体的残基,其空间构象允许与CD127蛋白质形成相同的化学结合。在一个具体实施方式中,大分子包括抗体的VH链和/或VL链的至少一个CDR序列。在一个优选的实施方式中,大分子包括抗体的VH链和/或VL链的全部CDR序列。在一个优选的实施方式中,大分子包括抗体的整个VH链和/或整个VL链。在具体实施方式中,生产、设计或选择大分子以识别如下所述的表位(由下述特征的至少一个限定):(a)表位包括序列,特别是源自CD127的2b位点,特别是源自SEQIDNo:114的第109-127位氨基酸,更特别是源自SEQIDNo:114的第110-125、110-120、112-120位氨基酸,更特别是源自SEQIDNo:114的第114-119位氨基酸(对应SEQIDNo:116)的至少3个、4个、5个、6个或7个连续的氨基酸;特别地,表位包括SEQIDNo:116;特别地,包括SEQIDNo:86;特别地,表位包括CD127的P112或L115;(b)除了上述特征(a),表位包括序列,特别是源自CD127的D1结构域,特别是源自SEQIDNo:114的第1-98位氨基酸的至少3个、4个、5个、6个或7个连续的氨基酸;特别地,该表位包括SEQIDNo:115的氨基酸序列(特别地包括ep1(SEQIDNo:110)的氨基酸序列);(c)除了上述特征(a),和可选地上述(b)之外,表位包括序列,特别是源自SEQIDNo:114的第180-220位氨基酸,特别是源自第190-200位氨基酸的至少3个、4个、5个、6个或7个连续的氨基酸;特别地,该表位包括SEQIDNo:117的氨基酸序列;特别地,包括ep2的氨基酸序列(SEQIDNo:111);(d)表位包括SEQIDNo:115的序列和SEQIDNo:116的序列,或者表位包括SEQIDNo:117的序列和SEQIDNo:116的序列,特别地,表位包SEQIDNo:115、SEQIDNo:116和SEQIDNo:117的序列;(e)表位包括如上述(a)、(b)、(c)和/或(d)中定义的CD127的序列,并且除了上述明确提到的序列,不含其它CD127的氨基酸序列(超过3个、4个或5个连续的氨基酸),即,特别地,该表位仅包括源自CD127的下述序列:-源自2b位点的一个序列,特别地,由SEQIDNo:114的第109-127位氨基酸,或SEQIDNo:114的第110-125位、110-120位、或112-120位氨基酸,或SEQIDNo:114的第114-119位氨基酸(对应SEQIDNo:116)构成的序列,或对应SEQIDNo:86的序列,和/或由源自2b位点的3个氨基酸或超过3个、4个、5个、6个、7个氨基酸,和19个氨基酸或少于19个、18个、15个、11个氨基酸的序列构成的序列,特别地,含有CD127的P112或L115的序列;-可选地,除了2b位点的序列之外,源自CD127的D1结构域的一个序列,特别是源自SEQIDNo:114的第98位氨基酸的序列,特别是由SEQIDNo:110或SEQIDNo:115构成的序列,和/或由含有SEQIDNo:115的3个氨基酸或超过3个、4个、5个、6个、7个氨基酸和20个氨基酸或少于20个、18个、16个、11个氨基酸的序列构成的序列,或由SEQIDNo:115的序列中含有的3个氨基酸或超过3个、4个、5个、6个、7个氨基酸和20个氨基酸或少于20个、18个、16个、11个氨基酸的序列构成序列;-可选地,除了2b位点的序列和源自D1结构域的可选序列(如果存在)之外,源自SEQIDNo:114的第180-220位氨基酸的一个序列;特别地,由SEQIDNo:111构成或由SEQIDNo:117构成的一个序列,和/或由含有SEQIDNo:117的3个氨基酸或超过3个、4个、5个、6个、7个氨基酸和20个氨基酸或少于20个、18个、16个、11个氨基酸的序列构成的序列,或由SEQIDNo:117的序列中含有的3个氨基酸或超过3个、4个、5个、6个、7个氨基酸和20个氨基酸或少于20个、18个、16个、11个氨基酸的序列构成的序列;-所述表位可能含有其它氨基酸,只要这些额外的氨基酸不是源自CD127的序列即可(即假定除了如上所述的源自2b位点的序列和可能源自D1结构域的可选序列和源自SEQIDNo:114的第180-220位氨基酸以外,该表位不包括源自CD127序列的超过3个、4个或5个连续的氨基酸);(f)除了上述(a)(b)、(c)或(d)中所述的特征之外,表位不包括源自SEQIDNo:114的第99-108区域的超过3个、4个或5个连续的氨基酸,不包括源自SEQIDNo:114的第128-179区域的超过3个、4个或5个连续的氨基酸和/或不包括源自SEQIDNo:114的第220-239区域的超过3个、4个或5个连续的氨基酸,特别是不包括源自SEQIDNo:114的第99-108、128-179和220-239区域中的任一个的超过3个、4个或5个连续的氨基酸;(g)表位包括如上述(a)、(b)、(c)、(d)、(e)和/或(f)中定义的CD127序列的组合,其中一些氨基酸已经被突变、特别地被删除和/或被取代,特别地,被具有类似特性的氨基酸取代(保守取代);特别地,表位由与上述(a)、(b)、(c)、(d)、(e)和/或(f)中定义的CD127序列具有至少80%、85%、90%、或95%序列相似性的序列构成,或含有与上述(a)、(b)、(c)、(d)、(e)和/或(f)中定义的,以及相关(b)、(c)或(d)中定义的CD127序列具有至少80%、85%、90%、或95%序列相似性的序列,(h)表位是具有上述(a)、(b)、(c)、(d)、(e)、(f)和/或(g)中定义的特征的构象表位,即包括上述(a)、(b)、(c)、(d)、(e)、(f)和/或(g)中定义的序列或由上述(a)、(b)、(c)、(d)、(e)、(f)和/或(g)中定义的序列构成,其构象模拟所述序列在天然CD127中的构象(作为单体或作为具有γc和/或与IL7相关的二聚体);(i)表位含有具有上述(a)、(b)、(c)、(d)、(g)和/或(h)中定义的特征的CD127片段(即一段连续氨基酸);(j)表位具有上述(g)中定义的特征,并且是通过技术例如CLIPS技术得到的,其允许带有预测结构的肽组件的合成。在具有(b)和(c)的特征的表位的具体实施方式中,表位包括插入在两个序列ep1和ep2之间的CD127的氨基酸序列,并且可选地不延伸至包括任何或超过1个在这些序列的上游(即ep1序列的N端)和/或下游(即ep2序列的C端)的人CD127序列中的所述序列的氨基酸。在其他具体实施方式中,表位是这样的,即ep1或ep2序列没有一个延伸至包括任何在人CD127序列中的相邻氨基酸,或者包括人CD127序列(插入两个序列ep1和ep2之间)中与它们相邻的氨基酸中的超过7个、5个或1个连续的氨基酸;在这种情况中,ep1和ep2序列的延伸也可以限定为如上所述的上游(ep1的)或下游(ep2的)。在具体实施方式中,包括上述表位序列的CD127序列没有被延伸至包括源自人CD127序列的与ep1相邻的超过1个N端氨基酸或超过7个C端氨基酸的相邻氨基酸,或与ep2相邻的超过30个N端氨基酸或30个C端氨基酸的相邻氨基酸。在生产、设计或选择大分子以识别含有几个CD127的不连续氨基酸序列的表位(即,CD127的基本序列中不连续的序列)的实施方式中,生产或选择可以识别含有上述CD127序列之一的表位的抗体是可能的,以及然后从这些抗体中选择那些能够识别其它CD127序列的抗体(如果有超过两个不相邻的CD127序列待识别,所述后期选择也可以通过连续选择来执行)。本发明还包括被本发明的拮抗剂抗体(antagnositantibodies)识别的构象表位。本发明也包括结合该构象表位的抗体。实施方式包括CD127构象表位,其包括(i)与SEQIDNO.115具有至少80%、85%、90%、或95%序列相似性的结构域和/或与SEQIDNO.117具有至少80%、85%、90%、或95%序列相似性的结构域,和(ii)与SEQIDNO.116具有至少80%、85%、90%、或95%序列相似性的结构域。更特别地,CD127构象表位包括SEQIDNo:114的第73-79位氨基酸残基和/或第114-119位氨基酸残基和第193-196位氨基酸残基。本发明包括结合该构象表位的抗体。在具体的实施方式中,生产、设计或选择大分子以识别构象表位,所述构象表位含有CD127的氨基酸序列,其具有SEQIDNo:115、SEQIDNo:116和SEQIDNo:117的序列。特别地,在上述实施方式中,抗体针对免疫原产生,所述免疫原由上述表位构成或包括上述表位,即最初通过用抗原免疫非人类的动物特别是哺乳动物生产,该抗原含有所述表位或由所述表位构成。相应地,本发明还涉及其表位如上所述的抗原,特别是它作为免疫原在生产抗体中的应用和/或它在选择和/或测试方法中的应用,用以生产抗体或抗原结合片段或其它大分子。本发明也涉及使用所述抗原的方法。由于除了肽(peptidic)成分之外,抗原可包括非肽(peptidic)成分和/或可含有不形成表位的一部分的肽成分,故应当理解在本文中,除非另有说明或根据上下文显而易见,否则当提及抗原序列和/或所述序列的特征时,所述序列或特征应该理解为代表抗原的表位部分的序列(或其特征)。如果抗原包括不形成表位的一部分的氨基酸,所述氨基酸优选不包括CD127的超过3个、4个或5个连续的氨基酸。相应地,除非它在技术上不相关,否则本文中公开的关于抗体或其片段的定义和特征类似地适用于本发明的任何大分子。结合CD127根据本发明,“结合”IL-7Rα蛋白质是指抗原抗体类型的相互作用并且具有抗体或其抗原结合片段的“特异性结合”性质,其中“特异性结合”是指抗体或抗原结合片段结合IL-7Rα蛋白质并且它们与其它蛋白质(例如常见的细胞因子受体γ-链)不结合或以显著较弱的亲和力结合。优选在生理条件下,特别是从测试溶液的pH和盐浓度的角度而言,定义和/或确定特异性结合。可以根据实施例中公开的测试来检测结合和结合特异性,特别地,可以通过Biacore、酶联免疫吸附测定(ELISA)、或蛋白质免疫印迹(WesternBlot)分析来检测结合和结合特异性。在本发明的具体实施方式中,当抗体或其抗原结合片段在TSLP-受体中复合时,抗体或其抗原结合片段靶向并结合IL-7-Rα链(具有CCRF2;Genbank登录号:AF338733;Rache等,2001)。在一个具体实施方式中,本发明的抗体或其片段或嵌合分子结合作为分离的蛋白质的CD127,其解离常数(Kd)低于5E-10M。在一个优选的实施方式中,解离常数(Kd)小于1E-10M或小于9E-11M,或低于5E-11M。在具体实施方式中,本发明的抗体或其片段或嵌合分子或其它大分子结合人CD127的抗原,所述人CD127包括ep1序列(SEQIDNo:110)和/或ep2序列(SEQIDNo:111)。在具体的实施方式中,抗原包括人CD127的片段,其包括ep1和ep2(即抗原包括ep1和ep2序列和人CD127的插入(intercalated)序列)。在其它实施方式中,可能除了源自与人CD127序列不同的其它来源(origin)的其它序列以外,抗原仅包括来自人CD127的ep1和ep2序列。在其它实施方式中,ep1和/或ep2序列被延伸至包括源自人CD127的一些其它氨基酸,特别地,ep1延伸至包括至多1个N端氨基酸,ep1延伸至包括至多7个C端氨基酸,ep2延伸至包括至多1个、10个、20个或30个N端氨基酸;ep2延伸至包括至多7个、10个、20个或30个C端氨基酸。特定的抗原包括:一种如上所述的抗原,优选同时包括ep1和ep2,其中含有ep1的CD127序列没有延伸至包括与人CD127的序列中的所述序列相邻的氨基酸,或在人CD127的序列中没有延伸至包括ep1中的超过1个N端氨基酸或超过7个C端氨基酸;以及一种上述抗原,其中,含有ep2的CD127序列不延伸至包括与人CD127的序列中的所述序列相邻的氨基酸,或在人CD127的序列中没有延伸至包括ep2中的超过30个N端氨基酸或超过30个C端氨基酸;以及具有这些特征的抗原。在具体实施方式中,本发明的抗体或其片段或嵌合分子或其它大分子结合含有SEQIDNo:115、SEQIDNo:116和SEQIDNo:117的序列的人CD127的抗原。在一些实施方式中,抗原不与IL-7R的表位重叠或不包括IL-7R的表位,所述IL-7R的表位通过选自由C1GM、C2M3、P3A9、P4B3、P2D2、P2E11、HAL403a和HAL403b构成的组的单克隆抗体来识别(如WO2011104687A1所述)。在一些实施方式中,抗体针对抗原产生或结合表位,所述表位不包括任何或一些白介素-7受体α的残基I82、K84、K100、T105、和Y192,特别是不包括K100和/或不包括T105。在一些实施方式中,抗原或表位不包括K194,或不包括任何或全部选自由人IL-7R的残基D190、H191、和K194构成的组的残基。在具体的实施方式中,抗原或表位不包括I82和K84,或不包括K100和T105,或不包括Y192,或不包括D190、H191、Y192和K194。尽管对于IL-7R和TSLPR而言CD127是共同的,但应当注意到在这两种情况中,抗-CD127的抗体并不必然会识别(即在适当的条件下结合)CD127。而且,即使在IL-7R和TSLPR两种情况下抗体均结合CD127,但它对IL-7-IL-7R相互作用和TSLP-TSLPR相互作用也不必然具有相同的作用。例如,它可以阻止IL-7结合IL-7R,但不能阻止TSLP结合TSLPR。而且,除了配体-受体相互作用上的不同效应以外,抗体与任一种受体的结合可能具有不同的效应。事实上,与配体无关或结合配体,抗体的结合可能修饰受体的构象,从而活化受体或使受体失活。任一种受体的效应可能是不同的,并且事实上可能会颠倒:失活IL-7R的抗体可能会活化TSLPR,反之亦然。在本文中,活化受体意味着引发至少一些在配体结合它的受体时发生的生物化学变化。这些变化可包括受体结构(例如二聚化)的修饰;受体和聚集体(recruitment)的磷酸化和/或受体-结合蛋白质(例如Janus激酶、STAT转录因子等)的磷酸化和/或受体的细胞定位的改变(例如受体内化)。在本文中,使受体失活意味着防止、或恢复(revert)至少一些与它的配体和受体结合相关的生物化学改变。例如,在试剂例如本发明的抗体存在的情况下,受体可能被结构性活化(即甚至在缺失配体的情况下被活化)和失活。作为另外一种选择,或额外地,配体诱导的活化可通过使受体失活被完全地、或部分地抑制。因此,除了其它机理,失活可通过以下发生:防止配体的结合(和随后的“活化”事件)、和/或防止与配体的结合相关的结构变化(例如二聚化)和/或受体的细胞定位的变化(例如失活试剂可引发受体内化和/或退化以及从而防止通过配体的活化)。没有增加TSLP-诱导的树突细胞成熟本发明的抗体可结合TSLP受体中的CD127(即,当它在CRLF2的复合物中时,可结合CD127,形成TSLP受体)。因此,本发明的抗体可干扰TSLP-诱导的和/或TSLP受体-介导的信号传导。本申请发明人已经惊讶地发现,现有抗体增加了TSLP诱导的树突细胞的成熟,所述现有抗体抵抗(或识别)TSLP受体中的CD127并显示出与TSLP-TSLPR相互作用的一些拮抗作用:所述成熟在用TSLP和抗体处理过的细胞中高于仅用TSLP处理过的细胞。这些传统抗体增加了TSLP-依赖性树突细胞成熟。在优选的实施方式中,对于免疫细胞的成熟,特别是树突细胞的成熟,本发明的抗体或片段与TSLP没有协同作用。换句话说,本发明的抗体不增加TSLP诱导的免疫细胞的成熟。这种效应对树突细胞的成熟是特别需要的。应当强调的是,抗-CD127抗体抑制TSLP-诱导的TARC的产生的能力不能被认为是抗体对TSLP-诱导的信号传导和其后续结果(特别是树突细胞的成熟)的负(或至少非正)作用的有效的预测物。事实上,如本申请发明人已经发现的,通过使用TSLPR表达CD40或CD80所测量的,甚至有效抑制TSLP诱导的TARC的产生的抗体也可以增加树突细胞的TSLP依赖性成熟。可以通过作为标志物的细胞标志物CD40和/或CD80的表达测量TSLP诱导的树突细胞的成熟(Inaba等,1995;Watanabe等,2005b),所述细胞标志物CD40和/或CD80是一些免疫细胞的成熟的决定因素,特别是一些自身免疫性疾病、哮喘和移植中观察到的所谓的TH-2分化的决定因素。在具体的实施方式中,通过测定使用TSLP和本发明的大分子处理过的TSLPR阳性细胞的细胞表面标志物CD40和/或CD80的表达相比单独用TSLP处理过的TSLPR阳性细胞的增加,可以评估TSLP诱导的树突细胞成熟的增加。在一个具体实施方式中,与单独用TSLP(没有大分子)刺激相比时,不增加TSLP诱导的树突细胞成熟的大分子,特别是抗体或其片段对CD80的表达的增加没有超过25%。优选地,CD80的表达的增加没有超过20%,优选没有超过10%和甚至更优选没有超过5%。在一个特定优选的实施方式中,与单独使用TSLP刺激的细胞相比,使用TSLP和大分子刺激的细胞中的CD80的表达没有增加或降低。在一个具体实施方式中,与单独使用TSLP(没有大分子)刺激相比时,不增加TSLP诱导的树突细胞的成熟的大分子对CD40的表达的增加没有超过50%。优选地,CD40表达的增加没有超过25%,优选没有超过10%和甚至更优选没有超过5%。在一个具体的优选实施方式中,与单独使用TSLP刺激的细胞相比,使用TSLP和大分子刺激的细胞中的CD40的表达没有增加或降低。树突细胞成熟的测量如实施例(参见特别是实施例9)所示,并可以根据本领域技术人员已知的任何标准方法进行,特别是根据任何适于测定树突细胞上作为树突细胞成熟的标志物的CD80和/或CD40的表达的方法来进行。为了在不存在不需要的TSLP信号传导的增强作用的情况下测定CD127抗体的性质,可以使用表达TESLPR的细胞,例如哺乳动物原B细胞(例如本文所述的BA/F3细胞)。IL7-诱导的α4,β7和α4/β7整合素的表达的抑制在具体的实施方式中,本发明的抗体(或大分子)抑制IL7-诱导的α4,β7和α4/β7整合素的体外表达。本文所述的IL7-诱导的α4,β7和α4/β7整合素的表达,是指α4和β7整合素表达水平的增加和表达α4,β7和/或α4/β7整合素的T淋巴细胞的数量或比例的增加中的一种或两者。该抑制可能是部分的,即在抗体存在的情况下,IL7的存在使得α4,β7和α4/β7整合素的表达水平增加超过基线水平(即没有抗体和IL7的水平),但是低于没有抗体的情况;或者该抑制可能是完全的,即在IL7和抗体存在的情况下,α4,β7和α4/β7整合素的表达水平不高于基线水平。在具体的实施方式中,本发明的抗体抑制α4,β7和/或α4/β7整合素的体外表达,即α4,β7和/或α4/β7整合素在使用抗体(和IL7和/或无IL7)处理过的细胞中的表达水平低于未处理的细胞(即没有抗体或IL7)。抑制程度可能是剂量依赖的。如实施例部分所述测量表达的抑制,根据需要本领域技术人员可使之适应于特定抗体、抗体片段或抗原结合结构域或本文公开的其它大分子和/或使之适应于特定疾病模型。在优选的实施方式中,本发明的抗体(或大分子)抑制α4,β7和/或α4/β7整合素的体内表达。在本文中,该表达意味着,相对于未处理过的动物,源自使用抗体处理过的动物的样品中的(i)α4,β7和/或α4/β7整合素的表达,(ii)α4,β7和/或α4/β7-阳性T-淋巴细胞的数量和/或比例,和/或(iii)α4,β7和/或α4/β7-阳性T淋巴细胞的移植(engraftment)降低。在本文中,移植是指将移植组织或细胞并入宿主体内,其为通常在几小时至几天的时间段内发生的过程。在具体的实施方式中,动物是哺乳动物,特别是非人哺乳动物,特别是小鼠。在具体的实施方式中,动物是人。在具体的实施方式中,在注射到受体动物,优选免疫缺陷小鼠中的人淋巴细胞中观察到该效应。在具体的实施方式中,在免疫缺陷小鼠中注射人PBMC两周之后,相对于未处理过的小鼠,抗体处理过的小鼠中的整合素β7-阳性T细胞的平均百分比下降了至少25%,优选至少50%。在具体的实施方式中,在免疫缺陷小鼠中注射人PBMC两周之后,相对于未处理过的小鼠,抗体处理过的小鼠中的整合素β7-阳性植入T细胞的平均百分比下降了至少25%,优选至少50%,以及更优选至少70%。可以通过以下方法测定本发明的抗体或大分子的效应:实施例部分,特别是实施例16中关于α4/β7-整合素和移植物表达中所述的方法,其中,本领域技术人员可以根据需要使之适应于例如特定抗体、片段或其抗原结合结构域或其它大分子和/或使之适应于特定疾病模型。CD127内化的抑制剂(inhibitor)内化是一种细胞过程,细胞表面的受体例如CD127通过其被运输到细胞胞质区(可能在胞内隔室或膜的表面内或表面上),因此不再能从胞外区接近,即胞外区的配体不能直接接触内化的受体。配体,不论是受体的天然配体或任何人工配体或其它结合受体的分子,可和受体一起被内化。大部分受体都经历恒定的内化,并且它们的细胞表面表达通过用新合成/成熟的受体取代内化和降解的受体或通过直接回收,即将内化的受体运送回细胞表面而保持恒定。一些刺激物可导致内化速率增加和/或取代/循环速率下降,因此导致受体的细胞表面表达的净下降。在本文中,IL7诱导的CD127的内化表示,在细胞外基质中由IL7的存在(或在IL-7存在下观察到的)诱导的CD127的细胞表面表达的下降,如同在有限时间孵育后在体外观察到的一样,以排除长期效应如转录下调。所述限制时间通常为几十分钟,优选小于2小时,更优选小于1小时,甚至更优选45分钟或更短,30分钟或更短或15分钟或更短的数量级。在优选的实施方式中,本发明的抗体抑制IL7-诱导的CD127的内化。因此,当与本发明的抗体一起孵育时,IL7的存在诱导CD127的细胞表面表达没有降低,或诱导CD127的细胞表面表达比没有抗体孵育的细胞更低的强度降低。在具体实施方式中,当与本发明的抗体一起孵育时,当细胞与5ng/mLIL7在37℃下孵育15分钟时,CD127细胞表面表达的水平是不用IL7孵育的细胞的细胞表面表达水平的至少80%,优选至少90%。在体外,优选在如上所述的有限时间后测量细胞表面表达。此外,由于大多数细胞内化过程在低温下被抑制,通常最好在生理温度,特别是37℃下观察到该效应。然而,还预期在低温,特别是4℃下孵育细胞。已知针对受体的抗体可以诱导受体的内化,这意味着在抗体存在下受体的细胞表面表达降低。这可能特别是通过诱导受体的构象变化而产生,其模拟由天然的、内化诱导的配体所诱导的,并且该效应可取决于由抗体识别的表位。如本文所用,“抗体诱导CD127的内化”是指,与抗体不存在下孵育的细胞相比,在抗体存在下孵育的细胞显示CD127的细胞表面表达降低。优选在有限的孵育时间段之后和在如上所述的温度条件下,在体外测量细胞表面表达。在优选的实施方式中,本发明的抗体不诱导CD127的内化。因此,相对于在其它条件相同但是不存在抗体的情况下孵育的细胞中的细胞表面表达,在抗体存在的情况下孵育的细胞中CD127在细胞表面表达没有降低或没有显著降低。在具体实施方式中,当在50ng/mL抗体存在下在37℃孵育30至45分钟时,CD127细胞表面表达水平为其在不存在抗体的情况下孵育的细胞中的水平的至少80%,优选至少90%。这种效应可以在不存在IL7情况下(在抗体处理和未处理的细胞中)观察到,在IL7存在情况下观察到,和/或两种情况下均可以观察到。上述两种CD127内化相关特征(即抑制IL7诱导的内化或非诱导内化)可以有助于提高抗体的效率,而两种特征的组合可能甚至更有效。本文公开了代表优选实施方式的抗体,其中在IL7和所述抗体这二者的存在下,CD127的细胞表面表达没有显着降低。在这样的优选实施方式中,在50ng/mL抗体存在下在37℃下孵育45分钟(包括在5ng/mLIL7存在下15分钟)后,CD127细胞表面表达水平是对照细胞中水平的至少80%,优选至少90%,所述对照细胞在不含抗体或IL7的培养基中孵育。CD127-γc链相互作用的破坏根据具体实施方式,本发明的大分子,特别是抗体或其抗原结合片段可以破坏CD127与IL7-R的γc链的结合。这意味着,在CD127和γc链在无抗体存在下,特别是在IL7存在下可以结合在一起的条件(特别是化学和物理条件)下,抗体的存在显著降低所述结合。在具体实施方式中,在抗体和IL7的存在下,CD127不结合γc。特别地,在抗体和IL7的存在下,发现与CD127相关(或结合CD127)的γc链的量小于不存在抗体(或在另一抗CD-127抗体如MD707-13的存在下)但其它条件相同情况下,特别是在IL7存在下的结合量的80%,优选小于50%,甚至更优选小于25%或10%。可以特别通过本领域技术人员熟知的用于测试蛋白质相互作用并且如本文实施例21所示的共免疫沉淀方法来评估抗体的这种特征。特别地,细胞可以在存在或不存在测试抗体的情况下孵育,然后在允许保存蛋白质复合物的条件下溶解,并且可以对所得裂解物进行抗CD127免疫沉淀,并且通过使用抗-γc抗体的蛋白质印迹评估γc在含有CD127的免疫沉淀复合物中的存在(相反地,可以使用抗-γc抗体进行免疫沉淀,以及使用抗-CD127抗体评估CD127的存在)。获得这种抗体的一种方法是产生针对包括来自CD127的2b位点的序列的表位的所述抗体,或选择识别这种表位的抗体。实际上,抗体与对与γc相互作用关键的位点的结合可能会例如通过竞争或空间位阻、γc与CD127的相互作用而被破坏。特别地,还可以从抗-CD127抗体中,例如从抗体库(包括当该文库不是通过使用包括2b位点的序列的免疫原获得时)中,通过本领域技术人员已知的并且容易适应于这种目的常规筛选方法,选择具有这种所需特征的抗体。具体地,例如,CD127(或其单独的细胞外结构域)可以与通常用于这种筛选的96孔板或类似基底结合。构成文库的抗体可以单独添加,一个孔中一个抗体,并且将γc链添加到每个孔中。在洗涤平板(plates)后,例如通过基于荧光的方法可以测试每个孔中γc的存在。在含有具有所需特征的抗体的孔中,将不能检测到γc(或将检测到少量的γc)。显然可以修改这个过程,例如在单个斑点(individualspot)中在固体基底上更确切地识别抗体,允许CD127结合点状(spotted)抗体,并允许γc链结合于如此固定的CD127链。针对IL-7-IL-7R相互作用的拮抗剂根据具体实施方式,本发明的大分子,特别是抗体或其抗原结合片段还具有针对白介素7(IL-7)的拮抗剂性质,从而拮抗IL-7与CD127阳性细胞上CD127结合的途径。“针对IL-7-IL-7R相互作用的拮抗剂性质”是指本发明的靶向IL-7Rα的抗体或其抗原结合片段具有阻止CD127细胞、特别是人效应T细胞、特别是人记忆性T细胞上表达的IL-7受体接近其结合配偶体IL-7,特别是人IL-7的效应。作为拮抗IL-7的结合的结果,本发明的抗体或其功能片段通过阻止IL-7-依赖性胸腺T细胞的产生导致淋巴细胞减少。特别地,拮抗剂性质可以是针对IL-7诱导的IL-7R信号传导的拮抗作用。由IL-7诱导的IL-7R信号传导的拮抗剂可以通过如实施例中所述测量STAT5磷酸化的抑制来鉴定。IL7诱导的STAT5的磷酸化是IL7R活化的标志物,并且预期拮抗IL7-IL7R相互作用的抗体可以降低IL7诱导的STAT5的磷酸化。在具体实施方式中,本发明的大分子是由IL-7诱导的IL-7R信号传导的拮抗剂。在一个具体的实施方式中,本发明的大分子抑制IL7诱导的STAT5的磷酸化。在优选的实施方式中,在低至50ng/ml的抗体浓度下STAT5磷酸化的抑制大于50%,和/或在低至100ng/ml的抗体浓度下STAT5磷酸化的抑制大于80%。STAT5磷酸化的抑制可以通过本领域技术人员已知的方法,特别是通过在实施例部分(特别是实施例3)中所述的方法来评估。“结合TSLP的拮抗剂”由于本发明的抗体结合IL-7R中的CD127,故它们还可以结合TSLPR中的CD127,并且特别是通过空间位阻和/或通过在共同结合位点上的竞争,它们可以抑制TSLP与TSLPR的结合。换句话说,本发明的抗体可以对TSLP的结合呈现拮抗剂活性。“TSLP诱导的TARC生成的抑制剂”在一个具体的实施方式中,本发明的抗体可以抑制CD127阳性细胞中TSLP诱导的TARC生成。如上所述,TSLP刺激的树突细胞产生升高水平的TARC。这可能是由于它们与TSLPR的结合及其作为TSLP结合的拮抗剂的潜在作用。在一个具体实施方式中,选择本发明的抗体及其抗原结合片段是因为它们具有不增加其成熟的能力(例如CD40和/或CD80细胞表面标志物的表达的增加确定成熟)。在使用TSLP连同本文所述的抗CD127的抗体或其片段或嵌合分子处理过的细胞中,TSLP诱导的TARC产生水平低于单独使用TSLP处理过的细胞。换句话说,本发明的大分子可以是TSLP诱导的TARC生成的抑制剂。在本发明的一个实施方式中,如本文所述的抗体或其片段或嵌合分子降低TARC生成的水平。在本发明的一个具体实施方式中,当抗体浓度低至1μg/ml时,与单独用TSLP处理的细胞中的水平相比,用TSLP和抗体、片段或嵌合分子处理的细胞中TARC生成水平降低超过10%,优选超过20%。TARC生成的测量如实施例(特别是实施例9)中所述,并且可以使用本领域技术人员已知的任何标准方法对来自血液样品的CD127阳性免疫细胞、特别是树突细胞进行。“细胞毒性活性”在本发明的一个具体实施方式中,本发明的针对存在于IL-7受体中的CD127分子的抗体或其抗原结合片段还具有对人细胞、特别是表达所述受体的人T细胞的细胞毒性的性质。表达CD127作为IL-7受体链的人细胞(其是本发明的抗体及其片段的靶标)主要是T淋巴细胞,更确切地是效应T淋巴细胞亚群,包括初始和记忆性T细胞,但不是调节性的T细胞(Treg),特别是不是静息的天然Treg。记忆性T细胞作为抗原引发的结果产生,并且主要由它们的功能特性限定,所述功能特性包括在重新活化和分化为次级效应细胞和记忆细胞时经历回忆(recall)增殖的能力。类似地,靶向的TSLP受体(作为包括IL-7-Rα链的复合物)调节T辅助淋巴细胞,B细胞和树突细胞分化。根据本发明的一个实施方式,当给药时,具有“针对T细胞的细胞毒性活性”或细胞毒性性质(细胞毒性抗体)的抗体及其抗原结合片段通过杀死这些细胞导致效应T细胞群的耗竭,并相应地减少这些细胞的数量。相反,这些抗体不改变调节性T细胞亚群或不显著改变它以允许Treg细胞执行其功能。在该上下文中,在具体实施方式中,已经观察到,在施用本发明的抗体后,调节性T(Treg)相对效应T(Teff)细胞的比率升高。在一个具体实施方式中,本发明的抗体能够提高所述比率约10%或更高。在一个具体实施方式中,Treg与Teff的比率的增加为约20%。根据本发明的具体实施方式,细胞毒性抗体显示抗体依赖性细胞毒性(ADCC)。根据另一个实施方式,本发明的抗体没有ADCC性质。当特异性细胞毒性高于10%时,抗体ADCC电位被认为是阳性的。可以在ADCC测定例如实施例中描述的测试(特别是实施例10)中,评价ADCC性质。当抗体是大鼠抗体时,ADCC测定中使用的效应细胞是大鼠的LAK(淋巴因子激活的杀伤)细胞。当抗体被人源化时,ADCC测定可以在人NK细胞上进行。对于CD127阳性细胞具有细胞毒性和拮抗剂性质的本发明的抗体使得这些性质对于效应T细胞,特别是记忆性T细胞的消耗具有累积效应,从而使得能够实现更强烈地消耗(耗尽CD127+细胞池)以及目标T细胞数量的相应减少。以上段落以及实施例描述了如何测试这些功能特征。以下部分将详述抗体或片段或嵌合分子的各种结构特征和可能的修饰。鉴于这些指导,本领域技术人员将能够获得具有以下结构特征以及所需功能特征的抗体或片段,特别是从具有所需功能特性的抗体例如N13B2开始,因为在一些情况下可以采用一些不会修改功能特征的结构特征和/或通过在引入新的结构特征之后测试功能特性的损失进行预测。此外,由于本文公开的由抗体识别的表位,共享相同功能特征的其他抗体的开发是常规程序,因为可以根据在结合CD127时引发相似作用的能力,选择针对相同或相似表位产生的抗体。再次,本文公开了直接测试程序,技术人员可以使用这些测试来选择合适的抗体。在本发明的一个优选实施方式中,大分子是N13B2或具有N13B2的至少一个CDR的抗体,或片段是N13B2的片段。因此,本发明涉及抗体或其片段,其中VH包括以下氨基酸序列中的至少一个,或下述它们优选的人源化变体之一:·VHCDR1SEQIDNo:10;·VHCDR2SEQIDNo:12;·VHCDR3SEQIDNo:14;和/或,其VL包括以下氨基酸序列中的至少一个,或下述它们优选的人源化变体之一:·VLCDR1SEQIDNo:16;·VLCDR2SEQIDNo:18;·VLCDR3SEQIDNo:20。在一个具体的实施方式中,大分子包括N13B2的CDR序列(即VHCDR1SEQIDNo:10,VHCDR2SEQIDNo:12,VHCDR3SEQIDNo:14,VLCDR1SEQIDNo:16,VLCDR2SEQIDNo:18和VLCDR3SEQIDNo:20)的至少2个、3个、4个或5个,其任何数目可被下文所述的它们的优选人源化变体之一替代。在一个具体实施方式中,大分子包括N13B2的所有六个CDR序列,其任何数目可被下述其优选的人源化变体之一替代。在具体实施方式中,大分子包括具有SEQIDNo:22的氨基酸序列的VH链和/或具有SEQIDNo:24的氨基酸序列的VL链。在具体实施方式中,大分子包括具有SEQIDNo:2和/或SEQIDNo:6的氨基酸序列的重链和/或具有SEQIDNo:4的氨基酸序列的轻链。关于VH和VL链的其它具体实施方式是下文公开的人源化变体。在一个具体的实施方式中,恒定链具有如图12的大鼠IgG1Fc链所示的序列(UniprotP20759)和/或SEQIDNo:34的序列。片段本发明的抗体的“抗原结合片段”是抗体的一部分,即对应于本发明的抗体的结构的一部分的分子,其显示对人IL-7的IL-7受体的α链的抗原结合能力,可能以其天然形式;与相应的四链抗体的抗原结合特异性相比,这种片段对所述抗原特别表现出相同或基本上相同的抗原结合特异性。有利地,该抗原结合片段具有与相应的4链抗体相似的结合亲和力。然而,相对于相应的4链抗体具有降低的抗原结合亲和力的抗原结合片段也包括在本发明内。可以通过测量抗体和所考虑的片段的亲和力来确定抗原结合能力。这些抗原结合片段也可以被称为抗体的功能片段。抗体的抗原结合片段是包括其含有抗原识别位点即人IL-7的IL-7Rα的称为CDR(互补决定区)或其部分的超变区的片段,从而限定抗原识别特异性。四链免疫球蛋白的每条轻链和重链(分别是VL和VH)具有三个CDR,分别称为VL-CDR1、VL-CDR2、VL-CDR3和VH-CDR1、VH-CDR2、VH-CDR3。因此,本发明特别涉及本发明的抗体的片段,其包括以下所有或选择的CDR,或由以下所有或选择的CDR构成:VL-CDR1(SEQIDNo:16)、VL-CDR2(SEQIDNo:18)、VL-CDR3(SEQIDNo:20)和VH-CDR1(SEQIDNo:10)、VH-CDR2(SEQIDNo:12)和VH-CDR3(SEQIDNo:14)、如下所述的它们的人源化变体、或其功能部分,即显示期望的结合特异性的部分,优选对人IL-7的IL-7Rα具有高亲和力的部分。本发明的特定抗原结合片段是组合其CDR1、CDR2和CDR3结构域的本发明抗体的VH链的片段,特别是具有本文公开的氨基酸序列的那些VH链的片段,包括下文公开的人源化变体的那些VH链的片段。本发明的其它片段是组合了其CDR1、CDR2和CDR3结构域的本发明抗体的VL链的片段,特别是具有本文公开的氨基酸序列的那些VL链的片段,包括下文公开的人源化变体的VL链的片段。当CDR3区在抗原识别特异性中表现为决定簇时,特别优选包括或由以下构成的片段:VH-CDR3和/或VL-CDR3,特别是具有本文所公开的氨基酸序列(包括下文所公开的人源化变体)或其功能部分的片段。技术人员将能够通过参考在这方面提出的标准定义,包括参考编号系统(Martin,2001)或通过参考Kabat的编号系统(Kabat等,1992)或通过应用IMGT“collierdeperle”算法(http://www.imgt.org/IMGTindex/Colliers.html,Lefranc等,1999)来确定抗体的各个区域/结构域的位置。在这方面,对于本发明的序列的定义,注意,区域/结构域的定界可以从一个参考系统到另一个参考系统而变化。因此,如本发明中所定义的区域/结构域包括在抗体的可变结构域的全长序列内显示约+/-10%的相关序列的长度或定位的变化的序列。此外,去免疫残基可以存在于抗体或其抗原结合片段的可变CDR结构域中。在具体实施方式中,抗体或其片段被去免疫。因此,基于四链免疫球蛋白的结构,可以通过与可获得数据库和现有技术中的抗体序列进行比较(Martin,2001),以及特别是通过比较功能结构域在这些序列中的位置来定义抗原结合片段,注意到对于各种类型的抗体,尤其是对于IgG,特别是对于哺乳动物IgG,框架和恒定结构域的位置有良好的定义。这种比较还涉及与抗体的3维结构相关的数据。为了说明本发明的具体实施方式的目的,含有包括所述抗体的CDR的可变结构域的抗体的抗原结合片段包括根据(Kabat等,1992)、(Martin,2001)和(Delves等,2011)明确定义的Fv、dsFv、scFv、Fab、Fab'、F(ab')2,Fv片段由通过疏水相互作用连接在一起的抗体的VL和VH结构域组成;在dsFv片段中,VH:VL异源二聚体通过二硫键稳定;在scFv片段中,VL和VH结构域通过柔性肽接头彼此连接,从而形成单链蛋白。Fab片段是可通过木瓜蛋白酶消化抗体获得的单体片段;它们包括整个L链和H链的VH-CH1片段,其通过二硫键结合在一起。F(ab')2片段可以通过胃蛋白酶消化铰链区二硫键以下的抗体(pepsindigestionofanantibodybelowthehingedisulfide)产生;其包括两个Fab'片段,以及另外的免疫球蛋白分子的铰链区的一部分。通过切割铰链区中的二硫键,可从F(ab')2片段获得Fab'片段。F(ab')2片段是二价的,即它们包括两个抗原结合位点,如天然免疫球蛋白分子;另一方面,Fv(构成Fab的可变部分的VH-VL二聚体)、dsFv、scFv、Fab和Fab'片段是单价的,即它们包括单个抗原结合位点。嵌合抗体根据本发明的另一个实施方式,所述抗体是被修饰的,并且因此是嵌合抗体,其包括,在功能抗体中结合在一起的不同抗体的氨基酸残基的结构域或链,特别是从不同动物物种获得的抗体。在一个具体实施方式中,本发明的大分子是嵌合抗体,其包括来自至少两种不同物种的抗体片段的组合。在一个具体实施方式中,嵌合抗体包括人抗体的恒定区。这些恒定区在实施例中由Fc片段G1(SEQIDNo:26)或Fc片段G4(SEQIDNo:28)或CLκ片段(SEQIDNo:30)举例说明。或者,可以使用图12(UniprotP01857、UniprotP01859、UniprotP01861)和/或SEQIDNo:31、SEQIDNo:32、SEQIDNo:33或SEQIDNo:112的序列描述的人Fc片段。在一个具体的实施方式中,嵌合抗体包括啮齿动物抗体的可变区和人抗体的恒定区。在一个具体的实施方式中,嵌合抗体包括具有SEQIDNo:2(N13B2-G1m-VH-FcG1m(E333A))或SEQIDNo:6(N13B2-G4m-VH-FcG4m(S228P))序列的VH链和具有SEQIDNo:4(N13B2-G1m-VL-CLκ)序列的VL链。Affitin、Anticalin和其它抗体模拟物本发明的大分子还包括具有结合模拟抗体的抗原(本文也称为结合抗原的抗体模拟物)的能力的人工蛋白。这样的蛋白质包括affitin和anticalin。Affitiin是具有选择性结合抗原的能力的人工蛋白。它们在结构上衍生自在嗜热硫化叶菌中发现的DNA结合蛋白Sac7d,其是属于古细菌域的微生物。通过随机化Sac7d的结合表面上的氨基酸,例如通过产生对应于Sac7d的结合界面的11个残基的随机取代的变体,可以产生affitin文库并将所得蛋白质文库进行多轮核糖体展示,亲和性可以针对各种靶标,例如肽,蛋白质,病毒和细菌。Affitin是抗体模拟物,并且正在被开发为生物技术中的工具。它们也已被用作各种酶的特异性抑制剂(Krehenbrink等,2008)。技术人员可以使用本领域已知的方法,特别是如专利申请WO2008068637和上述引用的出版物中所公开的方法,特别是噬菌体展示和/或核糖体展示文库的产生及其筛选,使用本文公开的抗原容易地开发具有所需结合性质的affitin。Anticalin是能够结合抗原(蛋白质或小分子)的人工蛋白质。它们是衍生自作为天然结合蛋白家族的人载脂蛋白(lipocalin)的抗体模拟物。Anticalin约小8倍,大小约180个氨基酸,质量约20kDa(Skerra,2008)。已经产生了可用于筛选和选择,特别是具有特异性结合特性的Anticalin的Anticalin噬菌体展示文库。本领域技术人员可以使用本领域已知的方法,特别是如EP专利EP1270725B1、美国专利US8536307B2(Schlehuber和Skerra,2002)和上述引用的出版物中所公开的方法,特别是噬菌体展示和/或核糖体展示文库的产生及其筛选,使用本文公开的抗原容易地开发具有所需结合性质的affitin。Anticalin和affitin均可以在包括细菌表达系统的多种表达系统中产生。因此,本发明提供了具有本文所述抗体特征的affitin、anticalin和其它类似的抗体模拟物,特别是关于结合CD127,CD127内化的非诱导和/或抑制、DCs的成熟,所有这些都被预期作为本发明的大分子。人源化在具体实施方式中,本发明的大分子是人源化抗体或其抗原结合片段。因此,最初在动物中,特别是在啮齿类动物中,特别是在大鼠中获得,接着进行动物免疫和从杂交瘤产生单克隆抗体后,本发明的抗体在其VH和/或VL序列中通过在框架中和任选地在CDR序列中用氨基酸残基取代进行修饰。人源化可以通过根据已知技术的表面重建或通过CDR移植来进行。尤其通过用啮齿类残基取代人氨基酸残基来实现表面重建。以保持原始抗体的框架结构以及CDR呈递的方式进行取代,由此使得表面重建的抗体中的框架和CDR相互作用保持接触抗原的表面的天然构象,使得其保留抗原结合亲和力。本发明抗体的优选实施方式由包括以下轻链和重链的(大鼠)N13B2抗体的人源化形式代表:具有SEQIDNo:36的序列的N13B2-h1的重链,其中大鼠N13B2的CDR序列,以及CDR序列外的几个其它氨基酸是保守的(conserved);并且其中所有其它氨基酸均匹配人抗体的序列。该重链与人抗体重链具有87.8%的同一性。CDR序列外的以下残基是保守的:Kabat位置H24上的V(图23中的位置24;人序列中的A),Kabat位置H37上的V(图23中的位置37;人序列中的I),Kabat位置H49上的A(图23中的位置49;人序列中的S)和Kabat位置H73上的D(图23中的位置74;人序列中的N);具有SEQIDNo:38的序列的N13B2-h2的重链,其中与N13B2-h1的重链相比,在CDR序列外的在Kabat位置H37、H49和H73处的氨基酸已经被修饰为匹配人抗体重链的序列;具有SEQIDNo:40的序列的N13B2-h3的重链,其中与N13B2-h2的重链相比,在CDR3序列中Kabat位置H96(图23中的位置100)处的M,已经突变为L以匹配人抗体重链的序列和/或避免翻译后修饰。该位置的其它可能的残基特别包括A、F和I,更优选F或I。因此,N13B2VH的CDR3序列的可能的人源化变体具有SEQIDNo:48的序列。具有SEQIDNo:42的序列的N13B2-h1的轻链,其中大鼠N13B2的CDR序列以及CDR序列外的几个其它氨基酸是保守的,并且其中所有其它氨基酸均匹配人抗体的序列。该轻链与人抗体轻链具有80%同一性。在CDR序列外的以下残基是保守的:Kabat位置L48的V(图24中的位置48;人序列中的I),Kabat位置L71的Y(图24中的位置71;人序列中的F)和Kabat位置L87的F(图24中的位置87;人序列中的Y);具有SEQIDNo:44的序列的N13B2-h2的轻链,其中与N13B2-h1的轻链相比,CDR序列外的Kabat位置L48、L71和L87处的三个氨基酸已经被修饰以匹配人抗体轻链的序列;具有SEQIDNo:46的序列的N13B2-h3的轻链,其中与N13B2-h2的轻链相比,分别位于CDR1和CDR2序列内的Kabat位置L31(图24中的位置31)和/或L52(图24中的位置53)氨基酸分别从N突变为Q和从S突变为T,以匹配人抗体轻链的序列和/或避免翻译后修饰。L31位置的其它可能的氨基酸包括H和R。CDR3序列的其它可能的突变包括保留L52位置的S和将L51位置(图24中的位置52)上的N突变为Q、H、K或R。因此,N13B2VL的CDR1序列的可能的人源化变体具有SEQIDNo:50的序列,N13B2VL的CDR2序列的可能的人源化变体具有SEQIDNo:52的序列。多功能抗体或片段本发明的这些基本抗原结合片段可以组合在一起以获得多价抗原结合片段,例如二聚体(Diabodies)、三聚体(Tribodies)或四聚体(tetrabodies)。这些多价抗原结合片段也是本发明的一部分。在相关的情况下可以组合上述修饰。在具体实施方式中,大分子是作为嵌合抗体或人源化抗体和/或解除免疫的抗体的抗体。获得本发明的抗体的方法本发明的抗体或其抗原结合片段特别有利地针对是由人T细胞表达的CD127的分子而产生,其可能由天然多肽或重组分子形式的免疫产生。免疫可根据以下实施例中公开的方案进行:使用重组CD127Fc嵌合体(10975-H03HSinoBiological,北京,中国)免疫大鼠,例如可从鲁汶大学(比利时)获得的LOU/CIgk1α系的大鼠。或者,包括SEQIDNo:115(特别是包括SEQIDNo:110)和/或SEQIDNo:117(特别是包括SEQIDNo:111)和//或SEQIDNo:116的氨基酸序列的抗原可以用作免疫原,所述抗原另外包括或不包括如上所公开的其它序列、特别是人CD127的其它序列。根据先前所述的方法(Chassoux等,1988),通过将脾单核细胞与LOU大鼠免疫细胞瘤IR983F(非分泌型和氮鸟嘌呤抗性细胞系)融合获得杂交瘤。首先根据分泌的单克隆抗体结合重组CD127分子(CD127Fc嵌合体;10975-H03H,SinoBiological,北京,中国)的能力筛选杂交瘤。然后筛选杂交瘤的单克隆抗体结合人T细胞表达的CD127的能力,以及抑制诱导通过人白细胞上IL-7诱导的STAT-5磷酸化的能力,如图1所示,以及它们不会增加由TSLP诱导的树突细胞的成熟的能力。根据本发明的具体实施方式,本发明的人源化抗体通过其可变重链(VH)和/或其可变轻链(VL)的一个以上CDR区的突变衍生自称为N13B2的抗体,特别是在VH和/或VL任一中的CDR3、CDR2和CDR1区域中保持至少一个或两个原始CDR区的抗体,相对于原始CDR1、CDR2或CDR3区,在单独考虑的CDR区中,所述修饰的抗体具有小于10%的突变氨基酸残基,优选一个或零个突变的氨基酸残基,其中所述原始CDR区是:i.具有氨基酸序列SEQIDNo10的VHCDR1;ii.具有氨基酸序列SEQIDNo12的VHCDR2;iii.具有氨基酸序列SEQIDNo14的VHCDR3;iv.具有氨基酸序列SEQIDNo:16的VLCDR1;v.具有氨基酸序列SEQIDNo:18的VLCDR2;vi.具有氨基酸序列SEQIDNo:20的VLCDR3;因此,VHCDR3可以具有SEQIDNo:48的氨基酸序列;VLCDR1可以具有SEQIDNo:50的氨基酸序列;VLCDR2可以具有SEQIDNo:52的氨基酸序列。在具体实施方式中,本发明的抗原结合片段是如先前段落中所述进行修饰的N13B2抗体的抗原结合片段,相对于原始抗原结合片段,所述经修饰的抗原结合片段具有小于10%的突变氨基酸残基。考虑到本发明提供的教导,为了表达本发明的抗体,本领域技术人员将能够制备杂交瘤或使用替代技术,例如表达文库和表达系统,随后选择具有由杂交瘤分泌的那些的结构和其性质的那些抗体,特别是其结合和中和性质的那些抗体。可以由本发明的杂交瘤中表达的RNA和所选择和表达的适当序列充分地制备cDNA文库。或者,通过合成制备编码本发明的抗体或其片段的cDNA。根据本发明的“杂交瘤细胞”是由抗体产生细胞(B淋巴细胞)(其来自预先用选择的免疫原进行免疫的动物)和融合配偶体的融合产生的细胞,所述融合配偶体是骨髓瘤细胞,能为得到的融合细胞提供永生性。骨髓瘤细胞和抗体产生细胞(B细胞如脾细胞)可以是相同的来源,并且是真核细胞,特别是同一动物的哺乳动物细胞。它们可以可选地具有不同的来源,因此产生异种杂交瘤。从不能产生免疫球蛋白的细胞中选择骨髓瘤细胞例如LOU大鼠免疫细胞瘤IR983F(一种非分泌型和氮鸟嘌呤抗性细胞系),以使所制备的杂交瘤只分泌具有所需特异性的单克隆抗体。可以使用适合于促进ADCC的其它细胞,例如在以下各页中描述的用于通过在重组细胞中表达制备抗体的细胞,来代替大鼠免疫细胞瘤。这样的细胞有利地是具有低岩藻糖基化能力或没有岩藻糖基化能力的细胞。适合于实施本发明的杂交瘤的制备根据常规技术进行。在本申请的实施例中详细描述了实施方式,其中具体公开的特征可以适用于用作融合配偶体的其它细胞。抗体的抗原结合片段可以从抗体开始获得,特别是通过使用根据包括木瓜蛋白酶或胃蛋白酶消化的已知技术的酶消化或使用任何适当的剪切技术来获得。它们可以可选地在通过与编码所述片段的氨基酸序列的核酸序列重组而修饰的宿主细胞中表达,或者可以合成,特别是化学合成。因此,本发明的抗体,包括修饰的抗体和抗体的抗原结合片段也可以通过经典的遗传工程技术制备,例如Sambrook等,(Deininger,1990)和更新版本所述的那些技术。因此,本发明涉及包括信号肽或不包括信号肽的VH和VL多肽版本。在细胞中制备多肽期间信号肽可能是必需的。为了使用本发明的抗体或其功能片段用于对人类患者施用,从本发明的抗体(其将是非灵长类动物抗体,例如实施例中所示的那些)衍生人源化单克隆抗体或嵌合单克隆抗体和/或去免疫抗体可能是有益的,特别是降低接受宿主或患者对所述抗体的免疫反应。这些变体抗体的功能片段也可以作为人源化、嵌合或去免疫的变体获得。也可以通过将本发明的非人抗体的可变链(VH和/或VL)的恒定区中存在的氨基酸残基取代根据标准定义和编号具有人抗体中相应位置的人类氨基酸残基而衍生成作为人源化抗体的抗体或其抗原结合片段,其中取代水平为所述框架区中残基的1%至20%,特别是1%至18%。所述恒定区包括在特别通过参考Kabat编号鉴定的四链抗体中定义的框架区(FwR)的那些。根据本发明的修饰抗体的具体实例包括嵌合抗体、人源化抗体和/或去免疫抗体。特定的修饰抗体在CDR区中具有修饰的氨基酸残基,所述修饰是通过缺失非人抗体的可变区中的T细胞表位导致的去免疫。去免疫可以在确定抗体可变结构域中的T细胞表位后进行,特别是通过计算机(insilico)预测,然后在消除功能性T细胞表位的抗体可变链序列中进行点突变。在本发明的一个优选实施方式中,CDR区、特别是CDR3区的修饰限于出于对人体施用的目的而进行去免疫所必需的程度,例如降低T细胞受体对HLA-II类/肽复合物的结合亲和力。在一个具体的实施方式中,VH和/或VL的CDR3区不被修饰。在另一个实施方式中,FR区和/或CH区也被修饰,特别是被人源化。因此,本发明范围内的抗体包括基于上述特征的相应抗体,其是人源化抗体,特别是通过将存在于本发明抗体的框架区中的氨基酸残基取代根据标准定义和编号在人抗体中具有相应位置的人类氨基酸残基而获得的人源化抗体。在用于人源化(包括去免疫)的框架区和/或CDR中的氨基酸残基的取代水平是所述框架区和/或CDR区中残基的1%至20%,特别是1%至18%。如上所述,人源化主要靶向原始抗体的框架区。在一些情况下,人源化可以可选地或也涉及CDR区,特别是CDR1和/或CDR2区,并且更具体地称为去免疫。在具体实施方式中,在每个CDR区中不超过一个氨基酸被修饰。本文公开了源自大鼠抗体N13B2的人源化抗体和/或去免疫化抗体的实例。因此,通过考虑显示与非人抗体或片段的序列具有最高序列同一性的人种系轻链或重链框架,以及选择所述非人抗体或其片段中要被取代的氨基酸残基、特别是暴露于抗体表面的残基以符合相应的人残基,可以实现人源化。在一个具体实施方式中,一些或所有FRL和/或一些或所有FRH区是完全人类的,即是人框架序列的特征。在另一个实施方式中,在一些或所有FR区中选择的残基被取代。用于人源化抗体的方法也是本领域公知的,并且例如由Routledege等(EdwardG.Rotledge,1993)所述。这些方法也可以应用于抗原结合片段,例如scFvs。例如,称为“表面重修”的方法在于用一组人表面残基替代非人抗体可变区的框架中的一组表面残基,而称为CDR移植的方法包括将CDR从非人抗体转入人抗体的框架区。CDR移植通常通过框架优化完成,包括人框架的一些残基的置换,以优化结合亲和力。框架优化的步骤最近已通过使用组合库(Rosok等,1996)(Baca等,1997)来简化。本发明特别涉及通过CDR移植从大鼠N13B2抗体衍生的人源化抗体。在数据库中选择具有分别与大鼠N13B2的VH和VL序列具有强同源性的序列的人VH和VL序列。将N13E5的CDR序列移植到这些人序列上。CDR序列外的一些残基,特别是紧邻CDR的残基和称为Vernier残基的残基,可能对抗原识别或亲和力具有显著影响。如上文和实施例部分,特别是实施例12中详述的,测试了几种版本的人源化抗体:最保守的版本(其中所有大鼠序列对CDR和上述结构重要的残基是保守的)、为结构重要的残基选择人序列的版本和最接近人序列的版本,其中除了CDR外的结构重要的残基以外,CDR内部的几个残基从初始大鼠序列开始被顺序修饰,以便特别地防止翻译后修饰例如氧化或脱酰胺。另一种可用于抗体人源化的最新策略仅保留轻链和重链的原始非人CDR3序列,而剩余序列选自天然人V基因文库(Rader等,1998)。本发明的嵌合的、人源化的和/或去免疫化的抗体可以属于任何类别的免疫球蛋白,如非修饰的抗体。优选地,它们属于IgG类的亚类,例如IgG1、IgG2、IgG3或IgG4。通过将抗体的可变区与合适的接头或与另一抗体的恒定区组合来制备重组抗原结合片段或嵌合抗体的方法是本领域熟知的。本发明的抗体被称为单克隆抗体,这意味着就抗原结合特异性和因此就可变区组成而言,这些抗体的组合物是同质的,特别是相同的。因此,即使抗体是通过杂交瘤技术的替代技术获得的,抗体也可以称为单克隆抗体。根据另一个实施方式,本发明还涉及嵌合分子,其包括根据本文提供的任何定义的抗体或其抗原结合片段,其中所述抗体或其功能片段与功能不同的分子结合。本发明的嵌合分子可以是融合嵌合蛋白或由任何合适形式的连接产生的缀合物,所述连接包括与化学或生物基团或与分子例如PEG聚合物或适合于保护免于体内蛋白酶切的另一种保护性基团或分子的共价连接、接枝、化学键合,用于改善抗体或功能片段的稳定性和/或半衰期。使用类似的技术,特别是通过化学偶联或接枝,可以用生物活性分子制备嵌合分子,所述活性分子例如选自毒素,特别是假单胞菌外毒素A(Risberg等,2011)、植物毒素蓖麻毒素的A链(vanOosterhout等,2001)或皂草毒素(flaporll等,2006),特别是治疗活性成分,适合于将抗体或功能片段靶向人体的特定细胞或组织的载体(特别包括蛋白质载体),或者其可以与标记物或与接头相连,特别是当使用抗体的片段时。抗体或其功能片段的聚乙二醇化(PEG化)是特别感兴趣的实施方式,因为其改善活性物质向宿主的递送条件,特别是用于治疗应用。PEG化可以是位点特异性的,以防止干扰抗体或功能片段的识别位点,并且可以用高分子量PEG进行。PEG化可通过存在于抗体或功能片段的序列中的游离半胱氨酸残基或通过在抗体或功能片段的氨基酸序列中添加游离半胱氨酸残基来实现。本发明还涉及包括如本文所定义的抗体或其功能片段的组合物,其中所述抗体或其功能片段是抗体或其功能片段的同质群或是单克隆抗体或其功能片段。在一些情况下,可以使用产品的组合物以获得期望的效果,其中组合物中的每种产品产生至少一种所需效果。在这种情况下,例如,可以组合对IL-7-IL-7R相互作用具有抑制作用的分子和对CD127阳性细胞具有细胞毒性作用的分子。这样的组合包括在本发明中。重要的是,在本发明中,产物的组合物不应与TSLP协同作用用于树突细胞的成熟。通常,这涉及将单独地不与TSLP协同作用用于树突细胞的成熟的产物进行组合。在具体实施方式中,本发明涉及包括本文所述的抗体、片段或嵌合分子的化合物的组合物或组合体(assembly),所述组合物包括(i)对CD127阳性细胞、特别是CD127+T细胞具有细胞毒性活性的一组抗体或其抗原结合片段或嵌合分子,和(ii)具有针对人IL-7的拮抗剂性质的一组抗体或其功能片段或嵌合分子,这些组的抗体以混合物组合或分开,并且在后一种选择中,配制用于组合或顺序给药。抗体和/或功能片段和/或嵌合分子不与TSLP协同作用用于树突细胞的成熟。本文特别通过参考本发明的抗体提供的定义类似地适用于其抗原结合片段,除非其在技术上显然不相关。这些定义也适用于本申请中公开的大分子(特别是嵌合抗体或嵌合分子)或包括这些抗体或其抗原结合片段的组合物或衍生自这些抗体的组合物。进一步说明,本发明的抗体的抗原结合片段从概念上或设计的角度来源于抗体,但是可以通过各种技术制备,不一定要求抗体作为产物。本发明还涉及编码根据本文提供的任何定义的大分子的核酸分子。在具体的实施方式中,本发明的核酸编码选自由以下构成的组的氨基酸:SEQIDNo:2、SEQIDNo:4、SEQIDNo:6、SEQIDNo:8、SEQIDNo:10、SEQIDNo:12、SEQIDNo:14、SEQIDNo:16、SEQIDNo:18、SEQIDNo:20、SEQIDNo:22、SEQIDNo:24、SEQIDNo:36、SEQIDNo:38、SEQIDNo:40、SEQIDNo:42、SEQIDNo:44、SEQIDNo:46、SEQIDNo:48、SEQIDNo:50、SEQIDNo:52、SEQIDNo:54、SEQIDNo:56、SEQIDNo:110、SEQIDNo:111、SEQIDNo:86、SEQIDNo:115、SEQIDNo:116和SEQIDNo:117。在具体实施方式中,本发明的核酸包括或由以下序列构成:SEQIDNo:1、3、5、7、9、11、13、15、17、19、21、23、35、37、39、41、43、45、47、49、51、53或55的序列。适合于制备本发明的大分子的这样的核酸特别选自由以下构成的组:i.编码VH区且具有SEQIDNo:1或SEQIDNo:5或SEQIDNo:54的序列或编码VH区的可变区且具有SEQIDNo:21或SEQIDNo:35或SEQIDNo:37或SEQIDNo:39的序列的多核苷酸;ii.编码VL区且具有SEQIDNo:3或SEQIDNo:7或SEQIDNo:56的序列或编码VL区的可变区且具有SEQIDNo:23或SEQIDNo:41或SEQIDNo:43或SEQIDNo:45的序列的多核苷酸;iii.编码具有SEQIDNo:9的序列的VHCDR1区的多核苷酸,iv.编码具有SEQIDNo:11的序列的VHCDR2区的多核苷酸,v.编码具有SEQIDNo:13或SEQIDNo:47的序列的VHCDR3区的多核苷酸,vi.编码具有SEQIDNo:15或SEQIDNo:49的序列的VLCDR1区的多核苷酸,vii.编码具有SEQIDNo:17或SEQIDNo:51的序列的VLCDR2区的多核苷酸,viii.编码具有SEQIDNo:19的序列的VLCDR3区的多核苷酸。本发明还涉及关于SEQIDNo:1、3、5、7、9、11、13、15、17、19、21、23、35、37、39、41、43、45、47、49、51、53或55的序列的经修饰的核苷酸的多核苷酸,以及:(a)所述多核苷酸编码具有分别为SEQIDNo:2、4、6、8、10、12、14、16、18、20、22、24、36、38、40、42、44、46、48、50、52、54或56的氨基酸序列的多肽,和/或(b)所述多核苷酸在其全长上与分别具有SEQIDNo:1、3、5、7、9、11、13、15、17、19、21、23、35、37、39、41、43、45、47、49、51、53或55的序列的多核苷酸中的一个具有至少85%、优选至少90%、更优选至少95%、最优选至少98%或至少99%的同一性,和/或,(c)所述多核苷酸是具有序列SEQIDNo:1、3、5、7、21、23、35、37、39、41、43、45、53或55的序列的多核苷酸的片段,并且编码包括或由以下组成的多肽:抗原结合片段。本发明的多核苷酸也可以是优化的序列,特别是用于在宿主细胞中表达。该领域中的优化技术是常规技术。本发明的多核苷酸片段有利地具有至少9个核苷酸,特别是至少18个核苷酸的序列,并且短于它们的起始序列,特别是分别短于全长所示的VH或VL序列。根据具体实施方式,除了编码根据本发明的大分子的序列之外,本发明的多核苷酸可以有利地包括在编码抗体链的序列的上游的编码信号肽的序列,所述信号肽允许在生产细胞中表达时分泌所述蛋白。它们还可以包括一个或多个编码一个或多个标记肽的序列,用于检测和/或促进所述蛋白质的纯化。本发明还涉及用于克隆和/或表达本文所公开的多核苷酸的载体。在具体实施方式中,本发明的载体是适于在哺乳动物细胞中克隆和/或表达的质粒,其包括用于转录和表达的调节序列。本发明还涉及与本发明的多核苷酸重组的细胞或细胞系,特别是哺乳动物或禽细胞或细胞系。例如中国仓鼠卵巢细胞,进行基因修饰以减少整体(global)岩藻糖基化。事实上,缺乏核心岩藻糖基化的抗体显示出显著增强的抗体依赖性细胞介导的细胞毒性(ADCC)(vonHorsten等,2010)。另一个实例是天然具有低岩藻糖基化性质的EB66细胞系(Olivier等,2010)。因此,本发明还涉及制备抗体或其抗原结合片段的方法,其包括:(a)在用人IL-7受体的人α链、优选用包含人CD127序列的其抗原使动物,特别是哺乳动物免疫后获得杂交瘤,人CD127的序列具有SEQIDNo:115(和/或SEQIDNO:110)和/或SEQIDNo:117(和/或SEQIDNo:111)和/或SEQIDNo:116(和/或SEQIDNo:86)的序列,如上所述,所述抗原含有或不含人CD127的其它序列,并且需要时用相同的免疫原加强所述动物,从响应免疫的动物中回收脾或淋巴结细胞,并将所述细胞与骨髓瘤细胞融合以分离单克隆抗体,和/或(b)在能够回收抗体的条件下,在细胞中表达编码此类抗体的多核苷酸,例如本文公开的具有其重组形式的核苷酸序列的多核苷酸,以及(c)回收识别如本文所定义的表位的抗体,所述表位特别地包括来自CD127的2b位点的序列,特别地包括这种序列以及额外的来自CD127的D1结构域的序列,特别是回收具有所需的与人IL-7受体的α链的结合亲和力的抗体。在本发明的一个具体实施方式中,在呈现低岩藻糖基化性质的细胞如EB66禽类细胞中制备抗体或其片段。本发明还涉及选择抗体的方法,包括以下步骤:可能通过本文所述的方法之一获得特异性结合CD127、特别是其上述公开的抗原的抗体或其片段,并从这些抗体中选择不增加TSLP诱导的免疫细胞特别是树突细胞成熟的那些抗体、不诱导CD127内化的那些抗体、和/或抑制IL-7诱导的CD127的内化的那些抗体、和/或体外和/或体内抑制α4,β7和/或α4/β7整合素表达的那些抗体。可以使用实施例部分中描述的测试TSLP诱导的细胞表面标志物CD40和/或CD80的表达的增加或降低,或测试对CD127内化的作用或测试对α4,β7和α4/β7整合素的表达的作用的任何方法进行选择。这样的测试可以方便地在例如96孔板中进行以允许快速和有效地筛选大量的候选抗体,并且可以通过经典的免疫染色和流式细胞术分析进行读出。因此,本发明涉及选择抗体、其抗原结合片段或其它大分子的方法,其包括或由以下步骤中的至少一个组成:a.测试(例如如实施例1、实施例2、实施例6和/或实施例7中所述)具有大分子与CD127、特别是本文公开的其抗原结合能力的大分子;b.测试(例如如图16和/或实施例5所述)由大分子的存在诱导的CD127在CD127表达细胞中的内化;c.测试(例如如图16和/或实施例5所述)大分子对CD127表达细胞中IL7诱导的CD127内化的抑制;d.测试(例如如图5、图6和/或实施例9中所述)在大分子存在下由TSLP诱导的树突细胞的成熟的增加;并且任选地包括以下步骤中的至少一个:e.测试(例如如图1、图2和/或实施例3中所述)大分子对IL-7诱导的信号传导、特别是STAT5磷酸化的抑制;f.测试(例如如实施例9、图5和/或图6中所述)大分子对TSLP诱导的TARC产生的抑制;g.测试(例如如实施例16、图19和/或图20中所述)大分子对α4,β7和/或α4/β7整合素表达、特别是T淋巴细胞上的细胞表面表达的的抑制;h.测试(例如如实施例21、图28所述)抗体对CD127与γc链的结合的破坏,特别是在IL7的存在下。在这些测试步骤中的每一个之后,选择具有如本文所公开的所需的功能特征的一种或多种大分子。如上所述,当希望抗体识别包括在CD127序列中为不连续的序列的表位时,可以连续地测试由CD127的单一连续序列组成(或基本上由其组成)的表位的片段的识别(或结合)。例如,如果需要获得识别包括序列SEQIDNo:115、SEQIDNo:116和SEQIDNo:117的表位的抗体,可以首先选择识别基本上由SEQIDNo:116组成的表位的抗体,然后在这些第一选择的抗体中选择识别基本上由SEQIDNo:115组成的表位的抗体,然后在这些第二选择的抗体中选择识别基本上由SEQIDNo:117组成的表位的抗体。显然地,可以相对该顺序修改选择顺序,以上仅仅作为一个例子而提供。本发明的另一个目的是包括根据本发明的大分子与药物载体的药物组合物,其中所述药物组合物任选地还包括不同的活性成分。本发明还涉及一种包括本发明的大分子或如上定义的药物组合物作为活性成分的组合物,其在施用于患者时为适于控制人CD127阳性细胞存活或扩增、特别是人CD127阳性效应细胞、特别是CD127+记忆性T细胞存活或扩增、特别是CD127+和CD8+的记忆性T细胞或是CD127+和CD4+细胞的记忆性T细胞的制剂。在一个具体的实施方式中,包括本发明的大分子作为活性成分的组合物在施用于患者时是适于控制树突细胞的分化和/或成熟的制剂。本发明的组合物还可以包括具有治疗性免疫调节剂作用的另外的化合物,特别是涉及过敏或自身免疫的细胞。为了说明的目的,感兴趣的示例性免疫调节剂是靶向T细胞的其他单克隆抗体,例如抗CD3、抗ICOS或抗CD28的抗体或靶向辅助细胞例如CTLA4Ig的重组蛋白或抗体或抗CD40的抗体。本发明还涉及如本文定义或说明的抗体或其抗原结合片段或嵌合分子在有需要的患者中作为组合或附加治疗方案中的活性成分的使用。还考虑本发明的大分子、核酸、细胞或细胞系在有需要的患者中作为组合或附加治疗方案中的治疗活性成分的用途。特别提出如本文所定义的根据本发明的大分子、核酸、载体、细胞、细胞系、药物组合物或组合物在人类患者中用于治疗受免疫应答、特别是受记忆性T细胞应答影响的病理状况。因此,本发明人提出本文定义的抗体或其抗原结合片段、根据本发明的嵌合分子、药物组合物或组合物用于治疗自身免疫性或过敏性疾病,特别是过敏性皮肤疾病,肠疾病或用于治疗移植排斥或用于治疗白血病如急性淋巴细胞白血病(例如T-ALL)或淋巴瘤如霍奇金淋巴瘤,或用于治疗癌症如与CD127+细胞相关的乳腺癌、肾癌、膀胱癌、肺癌、胰腺癌,或用于治疗T细胞皮肤淋巴瘤如Sezary淋巴瘤,或用于治疗具有IL-7-R/TSLP途径的功能获得性突变的急性淋巴细胞白血病。在各种实施方式中,本发明涉及本文定义的大分子的用途,以消耗CD127阳性细胞,同时保留CD127阴性细胞。在各种实施方式中,本发明涉及本文定义的大分子的用途,以防止CD127阳性细胞的分化和/或扩增和/或成熟,特别是由IL-7和/或TSLP诱导的分化、扩增、或成熟,而对CD127阴性细胞几乎没有或没有直接作用。在具体实施方式中,本发明涉及本文定义的大分子的用途,以通过干扰IL-7诱导的信号传导而保留Treg细胞来消除/中和初始和记忆性T细胞。在一个具体实施方式中,本发明还涉及本文定义的大分子的用途,可能但非排他地通过ADCC(抗体依赖性细胞毒性)和任选地通过CDC(补体依赖性细胞毒性),从而作为抗体的细胞毒性作用的结果,消耗淋巴细胞亚群或表达CD127(包括正常或病理性T和B淋巴细胞,NK细胞,树突细胞和包括上皮细胞的其他细胞类型)的其他细胞群。在上述实施方式中,预期用途也适用于本发明的核酸、载体、细胞、细胞系和组合物。“治疗”或“治疗性处理”是指所进行的施用步骤导致改善有需要的动物或人类患者的临床病症,所述动物或人类患者患有与IL-7途径相关的病症,即涉及CD127阳性细胞的活化或增殖。这种治疗目的在于通过消除或减轻与IL-7途径相关的病症相关的症状(即涉及CD127阳性细胞的活化或增殖)来改善动物或人类患者的临床状态。在优选的实施方式中,根据本发明的治疗使恢复健康。在优选的实施方式中,由于免疫细胞、特别是树突细胞的成熟增加,所述治疗没有不期望的负面效应。本发明包括大分子在治疗涉及改变人类患者免疫应答的病理状态中的用途,导致显性致耐受状态或相反缺乏耐受性,其中需要控制免疫应答的水平以及恶性CD127阳性细胞的破坏。本发明提供适用于下述病理学的手段:例如由移植排斥、自身免疫性疾病、过敏性疾病、呼吸道疾病、慢性病毒感染、淋巴瘤、白血病或包括源自实体瘤(例如乳腺癌)的其它癌症诱发的那些病理学,此时这些病理学与CD127阳性细胞以及IL-7信号传导途径相关并且其中必须避免树突细胞的成熟的增加。在一个具体的实施方式中,本发明涉及本发明的大分子、核酸、细胞、细胞系或组合物在人类患者中的用途,用于治疗自身免疫性疾病或过敏性疾病或用于治疗白血病,例如急性淋巴细胞白血病或用于治疗淋巴瘤,或用于治疗癌症,或用于治疗慢性病毒感染,或用于治疗炎性疾病,或用于治疗呼吸系统疾病,或用于治疗与移植相关的症状。在一个具体的实施方式中,本发明涉及一种治疗方法,包括在人类患者中施用本发明的大分子、核酸、细胞、细胞系或组合物,用于治疗自身免疫性疾病或过敏性疾病或治疗白血病如急性淋巴细胞白血病或用于治疗淋巴瘤,或用于治疗癌症,或用于治疗慢性病毒感染,或用于治疗炎性疾病,或用于治疗呼吸系统疾病,或用于治疗与移植相关的症状。本发明的其它特征和性质根据从下面的实施例和附图是明显的。附图说明图1.IL-7R信号传导的抑制。在对于抗人IL-7Rα单克隆抗体(N13B2(正方形),N13E5(圆形)和N13K12(三角形))的剂量-应答中抑制IL-7诱导的pSTAT5+T淋巴细胞。pSTAT5(%):通过FACS测量的磷酸-STAT5阳性细胞的比例(%)。STAT5磷酸化的剂量依赖性抑制对于三种克隆是相似的,全部三种在50ng/ml下有效地抑制磷酸化(约50%抑制),并且在100至500ng/ml完全抑制磷酸化(>95%抑制)。图2.通过N13B2mAb对IL-7R信号传导的抑制。轴如图1所示。(A)与MD707-3mAb(圆形)相比,在对N13B2mAb(正方形)的剂量-应答中抑制IL-7诱导的pSTAT5+T淋巴细胞,两者均为啮齿类。(B)在0.1(空心符号)或5ng/ml(实心符号)重组人IL-7存在下,使用人IgG1(正方形)和人IgG4(圆形)嵌合形式的N13B2进行与(A)相同的实验。N13B2在抑制STAT5方面比MD707-13更有效(N13B2在100ng/ml下的约50%抑制,对于MD707-13而言需要1000ng/mL),而N13B2的不同IgG同种型显示相当的抑制效率。图3.(A)大鼠N13B2与抗CD127的抗体的结合研究。将N13B2抗体或MD707-1以不同浓度注射到固定有CD127的抗原上。Resp.diff:应答差异。时间:以秒计的时间(总持续时间:20分钟)。Blk:空白(无抗体)。在BIAeval4软件上用“二价分析物”模型分析结合和解离曲线。结果示于下表1中。表1.结合研究的结果Ka(1/Ms)Kd(1/s)KA(1/M)KD(M)MD707-12.66E+051.21E-042.19E+094.56E-10N13B22.01E+051.60E-051.26E+107.96E-11表2.在单独实验中,(A)中所述N13B2及其嵌合体的Kd图4.使用重组hCD127抗原通过ELISA测定来测量新抗体N13B2的抗CD127活性。OD450nm:在450nm下的光密度。A.将N13B2(实心圆形)的CD127结合活性与先前抗体代(MD707-1(空心菱形)、3(空心三角形)和6(实心正方形))进行比较。在测定中N13B2表现为最有效的结合物。B.比较不同N13B2形式(大鼠、IgG1(圆形)或IgG4(正方形))之间的CD127活性。没有观察到结合活性的显著差异。表3.所选抗体的ED50图5.通过髓样树突细胞,TSLP诱导的TARC(胸腺和活化调节的趋化因子,CCL17)的产生和CD80细胞表面标志物的表达。无:无刺激。LPS:用脂多糖刺激。TSLP:用TSLP刺激。A)通过ELISA定量上清液中的TARC产生,和B)使用单独的培养基、1μg/mlLPS或15ng/mlTSLP培养24小时的人血CD1C+树突细胞,通过其流式细胞术定量CD80细胞表面表达。数据是3次独立实验的平均值±标准误差或平均值(SEM)浓度。图6.通过抗人CD127的抗体抑制TSLP诱导的TARC生成。通过ELISA对如下条件培养的人血CD1C+树突细胞的上清液中TARC的生成进行定量:用15ng/mlTSLP和不同浓度的抗人CD127的抗体:N13B2抗体(圆形)、MD707-6(三角形)和作为对照(X)的抗TSLP培养24小时。数据是来自三个不同献血者的三个独立实验的代表值。N13B2仅仅非常温和地抑制TARC分泌的诱导(在6μg/mL下约20%抑制),而MD707-13和抗TSLPR则是更有效的抑制剂(分别为约50%和约70%的抑制)。图7.抗CD127的抗体对TSLP诱导的树突细胞成熟的CD80和CD40表达标志物的效应。细胞通过15ng/ml的TSLP活化24小时。将6μg/ml的N13B2、MD707-3和MD707-6抗CD127的抗体添加到上清液。通过FACS分析细胞表面的CD80(A)和CD40(B)表达。数据是3个独立实验的代表值,并以对照细胞(培养基=无抗体,使用TSLP)中的表达的百分比表示。被测试的抗体中仅N13B2不增加TSLP处理过的细胞中CD40和CD80的细胞表面表达。图8.嵌合N13B2(IgG1或igG4)抗人CD127抗体的抗体依赖性细胞毒性(ADCC)。将用作效应物(E)的人NK细胞与作为靶细胞的人CD127转染的BAF/3细胞系(10效应物对1靶细胞比率)以及与不同浓度的嵌合N13B2IgG1(实心正方形)、N13B-IgG4(空心正方形)或嵌合MD707-3(X)孵育4小时。通过51Cr释放测定特异性细胞毒性的百分比。图9.大鼠N13B2抗CD127mAbs改善在人源化免疫缺陷小鼠中化学诱导的结肠炎的功效。从第0天开始每天监测存活(A)和重量变化(B),在第0天用2,4,6-三硝基苯磺酸(TNBS)开始化学处理,在注射PBS(实线/实心三角形)或N13B2抗-IL7Rα抗体(虚线、空心三角形)之后,当直肠给药时诱导严重的结肠炎症。在(B)中,每个点表示平均重量数据(+/-SEM);对于Hu-TNBS+PBS组,n=6,对于TNBS组+抗IL-7Rα,n=6。在治疗组中存活增加并且体重减轻减少。图10.N13B2_G1M嵌合体VH和VL链的核苷酸和氨基酸序列。Fc链以小写字母印刷,每个序列中的三个CDR用下划线表示。星号(*)表示氨基酸序列中的终止密码子。图11.N13B2_G4M嵌合体的核苷酸和氨基酸序列。Fc链以小写字母印刷,每个序列中的三个CDR用下划线表示。星号(*)表示氨基酸序列中终止密码子的位置。图12.三种可选的人Fc链(IgG1、IgG2和IgG4)和大鼠N13B2抗体(IgG1)的Fc链的氨基酸序列。图13.抗CD127的ELISA结合测定:包被人CD127Fc并用抗人κ抗体显示。使用重组hCD127抗原通过ELISA实验来测量新抗体N13B2的抗CD127活性。比较不同N13B2抗体形式(wt(X)、IgG4人源化h1(实心正方形)、h2(空心圆形)或h3(实心三角形)抗体之间的CD127活性。OD:光密度。表4.所选抗体的ED50图14.图14:通过抗CD127抗体对P-STAT5抑制:A.在0.1ng/ml重组人IL-7存在下与大鼠N13B2wt(X)抗体相比,通过T淋巴细胞中人源化N13B2mAb以剂量依赖性方式对IL7诱导的P-STAT5的抑制(N13B2h1(黑色正方形)、h2(空心圆形)和h3(黑色三角形)。B.比较来自先前抗体代的不同抗CD127的抗体抑制IL7依赖性P-STAT5的能力:MD7073(圆形)、MD7074(三角形)和MD70713(正方形)。表5.所选抗体的IC50图15.人源化抗CD127的抗体相对大鼠抗CD127的抗体的稳定性测定。在37℃下7天后(大鼠N13B2wt(+)或人源化N13B2h3(正方形))和在-80℃下(大鼠N13B2wt(X)或人源化N13B2h3(三角形))和在四次结霜/除霜事件之后(菱形),通过ELISA测量抗体的浓度。表6.抗体在37℃或-80℃下7天后和4次结霜/除霜事件后的结合活性。表7.人源化抗人CD127的抗体相对大鼠抗人CD127的抗体的稳定性测定:在37℃或-80℃下孵育7天后通过凝胶过滤分析聚集体形成。图16.通过细胞计数的竞争和内化测定。将人外周血单核细胞与几种抗CD127mAb在4℃(斜线柱)或37℃(黑色柱)下孵育30分钟,或在37℃下且不含IL-7的情况下孵育30分钟然后与5ng/ml重组人IL-7(灰色柱)孵育15分钟:(A)10μg的克隆MD707-5、MD707-12或MD707-13或嵌合N13B2-G4;(B)50ng的N13B2、HAL克隆H3L4或1A11或作为对照的培养基。然后将细胞在4℃下用市售的抗人CD127mAb染色,以评估细胞膜水平的IL-7受体α链表达。在37℃下在IL-7存在或缺失的情况下,MD707-5、MD707-12和MD707-13抗体均诱导了受体的内化,而嵌合N13B2-G4没有诱导受体的内化。HAL抗体在任何条件下均诱导了CD127的细胞表面表达的减少。4℃下的结果显示1A11抗体与用于标记的抗体轻微竞争,而HAL显示出强竞争,N13B2无竞争。在37℃下,在HAL存在下没有观察到细胞表面染色,而单独的1A11诱导CD127的细胞表面表达的强烈降低,并且当与IL-7组合时,细胞表面表达降低约90%。相反,N13B2在4℃下没有减少CD127的细胞表面表达,单独使用时它也没有诱导CD127的细胞表面表达的减少,并且它抑制在IL-7存在下观察到的降低。图17.(A)在非人灵长类动物中施用N13B2和MD707-13mAb的药物动力学和药效学研究。用10mg/kg的N13B2-IgG1(n=3,实心正方形)、N13B2-IgG4(n=3,实心圆形)或MD707-13-IgG4(n=3,空心圆形)静脉处理狒狒(东非狒狒)。通过ELISA监测抗CD127mAb的血清浓度。(B)平行地,通过流式细胞术监测CD127在血液T淋巴细胞表面的的表达,并标准化为在注射mAb之前测量的水平(由虚线表示)。*p<0.05。针对所有三种抗体,总血浆水平随时间具有可比性。在用MD707-13处理~8天后,CD127的细胞表面表达降低,而对于任何测试的N13B2克隆,没有观察到这种降低。图18.用10mg/kg的N13B2-IgG1(n=3,实心正方形)、N13B2-IgG4(n=3,实心圆形)或MD707-13-IgG4(n=3,空心圆形)静脉内处理狒狒(东非狒狒)。在施用mAbs后第0天和2周后监测血液和淋巴结中调节性T淋巴细胞(CD3+CD4+CD25高Foxp3+)的频率(表示为CD4阳性T细胞的%)以及调节性T淋巴细胞的绝对计数数目(以细胞/mL表示)。**p<0.01,***p<0.001。所有三种抗体增加调节性T细胞在血液中的总计数和调节性T细胞在血液和淋巴结中的比例。图19.α4,β7和α4/β7整合素表达的体外抑制。A.用或不用5ng/ml的人IL-7培养9天后,通过FACS测定的α4阳性和α4/β7阳性人T淋巴细胞的百分比。B.与上述相同,在第0天向培养基中加入指定浓度的N13B2mAb。虚线表示对照条件(不含IL-7和N13B2mAb)中的基线水平。人源化N13B2mAb体外防止IL-7诱导的α4,β7和α4/β7整合素表达的增加(其在~2μg/mL抗体下完全被抑制)。图20.α4,β7和α4/β7整合素表达的体内抑制。在辐照的免疫缺陷小鼠(NOD/SCID/IL-2受体γ链敲除小鼠)的腹膜内注射40×106个人外周血单核细胞。在用对照缓冲液(n=5)或N13B2mAb(5mg/kg,n=5)治疗两周后,通过FACS评估血液β7-阳性T淋巴细胞(左)和β7-阳性人T淋巴细胞的移植(右)的百分比。**p<0.01。N13B2显著降低β7阳性T细胞的比例和β7阳性T细胞的移植。图21.N13B2抗体对DTH模型(体内牛皮癣模型)的影响。通过皮内注射2000(A)或1000(B)单位的纯化的结核菌素攻击BCG-(卡介苗)接种的狒狒(东非狒狒),以诱导延迟型超敏反应,并且每天记录红斑直径(星号;虚线)。一个月后,用10mg/kg的N13B2-IgG1(n=3,实心正方形)、N13B2-IgG4(n=3,实心圆形)或MD707-13-IgG4(n=3,空心圆形)静脉处理动物。在施用mAbs后4小时,通过皮内注射2000(A)或1000(B)单位的纯化的结核菌素再次攻击动物以诱导延迟型超敏性反应,并且每天记录红斑直径(实线)。根据第二次攻击后红斑直径的测定可知,N13B2而不是MD707-13抗体,可以抑制记忆性淋巴细胞反应。图22.用10mg/kg的N13B2-IgG1(n=3,实心正方形)、N13B2-IgG4(n=3,实心圆形)或MD707-13-IgG4(n=3,空心圆形)或对照缓冲液(n=3,虚线)静脉内处理狒狒(东非狒狒)。4小时后,动物以10%静脉内注射1.5ml绵羊红细胞(SRBC)。在施用SRBC后1周和2周监测特异性抗SRBCIgG滴度,并在第0天标准化为它们的滴度。*p<0.05。根据特异性IgG滴度的测定可知,N13B2而不是MD707-13,可以抑制体液免疫应答。图23.人源化N13B2VHIgG4的蛋白质序列S228P_h3:灰色的序列是CDR,具有下划线和加粗的氨基酸是被突变的(V42I、A54S、D82N、M108L),具有下划线的序列是突变的IgG4序列(S228P)。图24.人源化N13B2VL的蛋白质序列Ckappa_h3:灰色序列是CDR,具有下划线和加粗的氨基酸是被突变的(V54I、Y77F、F93Y+N31Q、S59T),具有下划线的序列是突变的IgG4序列(S228P)。图25.N13B2在炎症小鼠模型中保护其免于死亡:在人源化小鼠中诱导移植物抗宿主病(参见实施例13)。在未接受治疗的第0天注射5千万个人PBMC(白色正方形,n=14)或每周三次通过腹膜内注射5mg/kg嵌合N13B2(黑色圆形,n=19)的NSG小鼠存活的百分比。图26.N13B2特异性地防止炎症小鼠模型中的结肠炎症(参见实施例13)。在安乐死时(即,在25%体重减轻或注射后100天),炎症细胞浸润在第0天注射了5千万个人PBMC、且每周三次用5mg/kg的N13B2处理(黑色)或不处理(白色)的NSG小鼠的每个组织中,通过组织学在用苏木素和伊红染色的10μm载玻片上进行分析。结果如下:A.结肠、B.肠、C.肝脏和D.肺。数据是每组至少n=8的平均值±SEM。图27.被N13B2抗体识别的CD127蛋白(UniprotP16871)上的表位结构域。粗体字形的氨基酸对应于形成被N13B2识别的构象表位的序列;灰色背景上的氨基酸对与IL-7的相互作用是重要的;划删除线的氨基酸构成CD127的信号肽。图28.用抗hCD127的抗体对CD127/IL7/CD132复合物进行免疫共沉淀研究(实施例21)。泳道:单独的1-PBL、2-PBL+IL7、3-PBL+IL7+N13B2、4-PBL+IL7+MD707-13、5-CD132-Fc(72Kda)或CD-127-Fc(80KDa)。在抗hCD127柱(MD707-9)上对样品进行免疫共沉淀。使用(A)通过过氧化物酶标记的山羊抗兔显示的兔抗人CD132抗体或使用(B)通过过氧化物酶标记的驴抗大鼠抗体显示的大鼠抗人CD127抗体,通过蛋白质印迹分析洗脱液。具体实施方式实施例1.新型抗人CD127单克隆抗体(Mabs)的制备和选择根据常规技术,用重组hCD127-Ig(与免疫球蛋白的恒定片段融合的hCD127(SinoBiologicals,北京,中国;编号10975-H03H))免疫大鼠和衍生单克隆抗体。所用的免疫方案如下所示:使用重组CD127Fc嵌合体(10975-H03HSinoBiological,北京,中国)免疫LOU/CIgk1a菌株的大鼠。将50微克蛋白质悬浮于完全弗氏佐剂中并给予皮下注射。20天后,对悬浮在不完全弗氏佐剂中的蛋白质进行回忆(recall)注射。在第60天进行另一个相似的回忆注射,在第90天用100微克蛋白质进行加强注射(在脾细胞收集前4天)。根据先前所述的方法(Chassoux等,1988),通过将脾单核细胞与LOU大鼠免疫细胞瘤IR983F(非分泌型和氮鸟嘌呤抗性细胞系)融合获得杂交瘤。首先根据分泌的单克隆抗体结合重组CD127分子(CD127Fc嵌合体;10975-H03H,北京,中国)的能力筛选杂交瘤。选择后,将杂交瘤在DMEM完全培养基中培养。上清液通过超滤(Centramate,Pall)而浓缩,并通过蛋白G色谱层析(HiTrap,GeHealthcare)上的亲和力而纯化。用0.1M、pH2.8的甘氨酸洗脱缓冲液进行洗脱。在针对CD127人的活性ELISA测定中评估所得纯化的免疫球蛋白。在基于被重组CD127的分泌抗体识别而选出的第一选择的克隆中,通过流式细胞术,基于对人T细胞表达的CD127的识别和它们对TSLP的拮抗剂性质,进一步选出2种(克隆)。产生抗体并使用BIAcore技术通过表面等离子体共振测量来表征它们的同种型以及它们的亲和力。实施例2.通过ELISA评估抗-h-CD127单克隆抗体的rCD127识别将重组hCD127(SinoBiologicals,北京,中国;编号10975-H08H)固定在塑料上,并加入剂量增加的单克隆抗体以测量结合。孵育和洗涤后,加入过氧化物酶标记的小鼠抗大鼠κ链(AbdSerotec),并通过常规方法显示。证实每种抗体的结合。实施例3.IL7信号传导的抑制(pSTAT5)通过ficoll梯度从健康志愿者收获的人外周血单核细胞(PBMC),在室温下在含有不同浓度的感兴趣的抗体的无血清培养基中孵育15分钟,然后与0.1或5ng/ml重组人IL-7(rhIL-7;AbDSerotec编号PHP046)在37℃孵育15分钟。分析未用rhIL-7处理的PBMC作为背景信号,而将不含抗体的且使用IL-7处理的细胞设定为阴性对照。然后将PBMC快速冷却并用FACS缓冲液洗涤以终止反应。然后将细胞与冷的Cytofix/Cytoperm溶液(BDBioscience,编号554722)孵育15分钟,用Perm/Wash缓冲液(BdBioscience)洗涤两次,并用抗人CD3FITC抗体(BdBioscience编号557694)在冰上染色30分钟。然后用Perm/Wash缓冲液洗涤PBMC两次,并在BDPermBufferIII(BdBioscience,编号558050)中透化30分钟。然后将细胞在FACS缓冲液(和/或含有1%BSA和0.1%叠氮化物的PBS)中洗涤两次,并在室温下与抗人pSTAT5Alexa647抗体(BDBioscience,编号612599)孵育30分钟。在BDCANTOIIFACS仪器上分析样品。如图1和图2所示,N13B2和由其衍生的嵌合抗体(N13B2-G1和N13B2-G4)是STAT5磷酸化的强抑制剂;在抗体浓度低至50ng/ml时具有超过50%的抑制,和在抗体浓度低至100ng/ml时具有超过80%(0.1ng/ml的IL-7)或超过90%(5ng/ml的IL-7)的抑制。实施例4.不同的抗人IL-7Rα单克隆抗体的半抑制浓度(IC50)如表1所示。表8.由100pg/mlrhIL7诱导的不同抗CD127抗体对P-STAT5的IC50IC50N13B2N13E5N13K12MD707-3N13B2-G1N13B2-G4pg/ml43506210902837实施例5.通过细胞荧光测定术对IL7R内化的测定内化测定可以使用共焦显微镜进行,如Henriques等(2010)和Luo(2011)等的材料和方法中所详述。为了观察在不存在IL-7的情况下CD127的内化,将最终浓度为50ng/ml的抗体hN13B2、HAL克隆H3L4(美国专利8,637,27)或1A11(国际专利申请WO2011094259),或最终浓度为10μg/ml的抗体MD707-5、MD707-12、MD707-13或N13B2-G4与人PBMC(100000细胞/孔)在无血清培养基(TexMACS,MiltenyiBiotec)中在4℃或37℃温育30分钟。为了观察在不存在IL-7的情况下CD127的内化,在37℃下使用与抗体相同的预温育条件,然后用0.1ng/ml重组IL7(AbDSerotec,编号PHP046)在37℃刺激细胞15分钟。反应在4℃终止,细胞用PBS-1%BSA-0.1%叠氮化物洗涤3次,然后用PE标记的、且以1/10稀释在PBS-1%BSA-0.1%叠氮化物中的抗CD127(克隆hlL7R-M21,BDBioscience,编号557938)染色并在4℃下孵育15分钟。洗涤后,通过用CantoII细胞计数器(BDBiosciences)的细胞荧光测定法分析细胞。图16中呈现的结果是三个独立实验的代表。该方法容易适应于96孔板,以进行筛选并选择可以阻断IL7依赖性或IL7非依赖性CD127内化的抗体。实施例6.抗CD127抗体亲和力研究通过在Biacore3000(GEHealthcare)上的表面等离子体共振测量抗hCD127抗体的亲和力。通过注射NHS/EDC混合物激活CM5芯片(GEhealthcare)7分钟。在pH6.2的5mM马来酸盐缓冲液中稀释CD-127Fc(500μg/mL),并注射琥珀酰亚胺酯残留物直到达到300RU挂钩信号(ahooking300RUsignal)。通过注射1M乙醇胺(pH8.5)使游离的反应性残基失活。将抗体以结果部分中指定的浓度范围注射到固定化的CD127上。注射速率设定为40μL/min,测量结合3分钟并解离10分钟。在每个分析循环之间,通过注射5MMgCl2溶液60秒使得芯片再生。使用BIAeval4软件上的模型“二价分析物”分析所获得的传感图。如图3和表2所示,来自大鼠的N13B2和嵌合的N13B2对CD127显示高亲和力,其KD范围为4.9E-11M-8.E-11M(来自大鼠的N13B2),3.77.E-10(N13B2-G1)和1.70.E-10(N13B2-G4)。来自大鼠的MD707-1抗体显示对CD127的亲和力低于来自大鼠的N13B2。实施例7.抗CD127的抗体的结合活性对于夹心ELISA,将驴抗人IgG(Fc特异性)抗体以1.2μg/ml包被在P96-平板上,加入纯化的抗体以测量标准范围的功能浓度。孵育和洗涤后,添加小鼠抗人轻链κ特异性(Abcam,编号ab79115或Effimune,克隆NaM76-5F3)加上过氧化物酶标记的驴抗小鼠(JacksonImmunoresearch,编号715-036-151)抗体并通过常规方法显示。通过ELISA(酶联免疫吸附测定)评价抗hCD127抗体的结合活性。对于ELISA测定,将重组hCD127(SinoBiologicals,北京,中国;编号10975-H08H)以1μg/ml固定在塑料上,并加入纯化的抗体以测量结合。孵育和洗涤后,加入过氧化物酶标记的小鼠抗大鼠κ链(AbdSerotec),并通过常规方法显示。如图4和表3所示,通过ELISA测量的N13B2抗体的结合活性高,对于大鼠N13B2抗hCD127抗体:ED50=65.6ng/mL(ED50<75ng/ml和ED50<100ng/ml);对于衍生自N13B2(cN13B2-G1和cN13B2-G4)的两种嵌合抗体:ED50为12.0ng/ml和12.6ng/ml(ED50<15ng/ml)。实施例8.稳定性测试将人源化和嵌合纯化的N13B2-G1在37℃或-80℃下孵育7天。使用两种测定来测量抗体的稳定性:通过ELISA测定结合抗CD127,通过凝胶过滤测定聚集体的形成。对于ELISA的活性测定,将重组hCD127(SinoBiologicals,北京,中国;编号10975-H08H)以1μg/ml固定在塑料上,并加入上清液的稀释液以测量结合。孵育和洗涤后,加入小鼠抗人轻链(κ特异性)加上过氧化物酶标记的驴抗小鼠抗体,并通过常规方法显示。为了分析聚集体形成,在凝胶过滤层析柱(Superdex200,10/300GL,GeHealthcare)上分析样品以从样品中分离和评估聚集体和单体。实施例9.TSLP诱导的TARC的生成和树突细胞成熟的标志物CD80和CD40的表达。使用CD1c(BDCA-1)+树突细胞分离试剂盒(MiltenyiBiotec,贝尔吉施格拉德巴赫,德国)从健康志愿者(EtablissementduSang,南特,法国)的血液中分离出骨髓树突细胞(DC)。骨髓树突细胞在含有10%胎牛血清、1%丙酮酸盐、1%Hepes、1%L-谷氨酰胺和1%青霉素-链霉素的RPMI中培养。在TSLP(15ng/ml)、LPS(1μg/ml)或培养基单独存在下,在平板96孔板中以5.104个细胞/孔接种细胞,并加入不同浓度的大鼠抗人CD127抗体。在培养24小时时,通过流式细胞术分析细胞的成熟CD80细胞表面标志物(抗CD80-V450(BD#560442)),收集上清液并通过ELISA测定(R&D系统,明尼阿波利斯,美国)分析TARC生成。在不存在抗体或在N13B2或MD707-6或商业抗TSLPR抗体(R&D系统参考AF981)以1μg/ml或6μg/ml存在下,通过测量如上所述的所述生成来评估TSLP诱导的TARC生成的抑制。如图6所示,N13B2在低至1μg/mL的浓度下抑制TSLP诱导的TARC产生超过25%,即在该浓度下与MD707-6一样有效。在没有抗体(在该条件下将表达标准化为100%)或在N13B2、MD707-3或MD707-6抗体以6μg/ml存在下,TSLP诱导的CD40和CD80细胞表面标志物的表达的抑制通过测量如上所述的所述表达(对于CD40,在与上述用于CD80相似的条件下使用抗体(来自BecktonDickinson编号555588的抗CD40-FITC))来评估。如图7所示,MD707-3和MD707-6均诱导了CD40和CD80表达的增加,而MD707-3是STAT5活化的良好抑制剂,并且是CD127的良好结合剂(binder)(图2和图4);以及MD707-6是TSLP诱导的TARC生成的强抑制剂(图6)。CD80增加至少20%,CD40增加至少50%。相反,本发明的抗体N13B2不增加TSLP诱导的CD40或CD80的表达。相反,在存在TSLP和抗体的情况下,所述表达比仅单独存在TSLP的情况更低。实施例10.抗人CD127的单克隆抗体的抗体依赖性细胞毒性(ADCC)ADCC是指抗体与靶细胞上表达的表位的结合,以及随后的表达Fc受体的效应免疫细胞(基本上是NK细胞和活化的淋巴细胞)的Fc依赖性募集,导致主要通过基于颗粒酶/穿孔素的机制杀死靶细胞。效应细胞是使用磁珠(NK分离试剂盒,MiltenyiBiotec,贝尔吉施格拉德巴赫,德国)和AutoMACS细胞分选仪器通过阴性选择从外周血单核细胞分离的新鲜原代人NK细胞。在补充有10%FBS(生命科技)、100IU/ml青霉素(生命科技)、0.1mg/ml链霉素(生命科技)、2mML-谷氨酰胺(生命科技)和150IU/ml人IL-2(罗氏,巴塞尔,瑞士)的RMPI1640培养基中,在37℃,5%CO2下过夜培养NK细胞。将靶细胞(人CD127转染的BAF/3细胞系(Park等,2000))用100μCi(3.7MBq)的51Cr(PerkinElmer)在37℃标记1小时,并用培养基洗涤5次。将靶细胞与稀释的抗体或与赋形剂(培养基)在室温下孵育15分钟,并将10000个细胞置于96孔U型底板中。在37℃下4小时孵育期间,以10:1细胞比率(最终体积:200μl)加入效应T细胞。然后收集总共25μl的上清液,并在γ计数器(Packard仪器)中计数。大鼠来源的MD707-3和嵌合N13B2-G1(因此具有IgG1型Fc结构域)的单克隆抗体确实引发了ADCC。嵌合N13B2-G4(具有IgG4型Fc结构域)没有显示任何ADCC活性,并用作阴性对照。有趣的是,亲和力、结合和ADCC性质之间没有直接相关性,表明不能从结合分析中预测ADCC性质。实施例11.抗人CD127的单克隆抗体的核苷酸和氨基酸序列使用RACEPCR技术对N13B2克隆的VH和VL区进行测序。简言之,提取总RNA,逆转录,并使用dATP和末端转移酶在分子的3'末端对所得cDNA进行聚腺苷酸化。使用oligodT锚定引物和Herculease酶(Stratagene)进行第一次35-循环PCR反应。使用巢式PCR锚定引物进行第二个35-循环PCR。然后将所得的PCR产物在大肠杆菌中TA-克隆,并且在氨苄青霉素上选择后,通过限制性酶谱和所测序的插入cDNA筛选出所得克隆。实施例12.人源化使用标准CDR-移植技术完成大鼠N13B2单克隆抗体的人源化。该方法的原理是重构人抗体,使其仅含有来自大鼠单克隆抗体的互补决定区(CDR),目的在于不仅降低人的抗体免疫原性,而且改善CDR-移植的分子的生物物理性质。通过CDR移植的人源化要求来自亲本大鼠抗体的抗原结合残基保留在人源化版本中。发现与CDR相邻的称为“微调(Vernier)”残基的残基影响CDR构象并微调抗原识别。Chothia和Lesk,(1987)根据“经典(canonical)”残基分离CDR构象,它们中的一些位于CDR本身内,其他位于框架区中。因此,这些“微调(Vernier)”和“经典(canonical)”残基的鉴定是关键步骤。所使用的方案基于GregWinter及其同事(Paus和Winter,2006)在英国剑桥的医学研究委员会(MedicalResearchCouncil,Cambridge,UK)首创的方法,并使用Kabat定义的CDR残基。输入大鼠N13B2VH和VL序列,通过IgBLAST-在NCBI开发的用于促进免疫球蛋白可变区序列分析的工具(http://www.ncbi.nlm.nih.gov/igblast;Ye等,2013)搜索IMGT大鼠和人V基因数据库来完成大鼠N13B2CDR区移植在其上的人构架受体区的选择。此外,这里应用的策略使用人种系序列,其是不含有在蛋白质和cDNA衍生的序列中发现的体细胞超突变的天然人序列。通常选择与大鼠VL和VH序列最相似的种系基因。通过亲本N13B2VH和VL抗体序列比对并基于以下标准鉴定人种系构架受体(acceptor)VH和VL区:1、通过Kabat定义的框架和CDR的序列同一性,2、相同和兼容的链间界面残基,3、支持具有亲本CDR经典构象和微调残基的环(loops)。针对N13B2,测试了几种不同的人源化序列以选择最佳的一种,其保持结合和生物活性。对于N13B2的人源化变体,通过EcoRV在含有hIgG1的CH1-CH2-CH3结构域的pFuseCHIg-hG1e4表达质粒(Invivogen,图卢兹)中克隆N13B2抗体的人源化重链(VH)的可变序列,其在E333A突变以增加ADCC。通过BsiWI在含有人CLκ的pFuse2CLIg-hk表达质粒(Invivogen,图卢兹)中克隆N13B2抗体的人源化轻链(VL)的可变序列。在COS细胞中,我们通过脂质体(lipofectamine)方法共转染含有VH-hFcG1的质粒与含有VL-CLk的质粒。在温育48-72h后,回收上清液并通过蛋白G色谱层析(HiTrap,GeHealthcare)上的亲和力用0.1MpH为2.8的甘氨酸洗脱缓冲液来纯化。将纯化的抗体在PBS中透析并浓缩。通过夹心ELISA对它们进行定量,并在针对CD127抗原的活性测定中对它们进行测定。实施例13.抗IL7Rα的抗体对IL-7在不同体内炎症疾病模型中的研究为了检查拮抗剂抗体在人源化NSG小鼠中诱导结肠炎的效果,我们在TNBS模型中进行了一系列实验,其显示出可测量的效果。半抗原例如TNBS(2,4,6,三硝基苯磺酸)的使用允许诱导免疫模型模拟(Nancey等,2008)。通过在第0天在四种人源化小鼠中直肠内施用溶解于乙醇中的TNBS(SigmaChemical,L'Isled'AbeauChesne,法国)在小鼠中诱导结肠炎。最初,通过吸入气体混合物使小鼠麻醉。在第7天,在麻醉下通过CO2中毒将动物处死用于几种研究(数据未显示)。一些动物因其临床评分差而在第7天之前处死。因此,从TNBS处理前一天开始,每两天用PBS或用注射的210μL的0.7mg/mL的N13B2抗IL7Rα处理两组新的小鼠。进行与模型开发中的那些类似的分析。然后我们在人源化移植物抗宿主病(GVHD)小鼠模型中测试N13B2抗体功效。此模型模拟全球性炎症性疾病。如先前由Poirier等(2012)所述,将约7至12周龄的NOD/scid/IL-2Rγ-/-(NSG)小鼠(CharlesRiver,L'arbresle,法国)进行辐照(3Gy),并将来自健康供体的5千万人PBMC进行腹膜内(i.p.)输注。然后将动物保持在无菌条件下,并每周监测3次用于体重进展和临床评价。对照组在输注细胞后保持未处理,并且治疗组从第0天开始每周三次接受腹膜内(i.p.)注射5mg/Kg嵌合N13B2mAb。在体重减轻20%后,对小鼠进行GVHD诊断。将发现体重减轻超过25%动物和从第0天开始存活100天的动物安乐死。安乐死后,将结肠、肠、肝和肺组织在液氮和Tissu-tek中冷冻用于组织学分析。将来自这些组织的冷冻切片(10μm)在室温下风干1小时,然后在室温下用丙酮固定10分钟,然后用苏木精和曙红溶液染色。结果如图25和图26所示。实施例14.各种临床参数的分析存活(图9A):我们根据化学处理和抗IL7Rα抗体的使用评估存活率。相比Hu-TNBS+PBS组,存活百分比趋向于对Hu-TNBS+IL7Rα组更重要(图9A)。实际上,我们观察到Hu-TNBS组+IL7Rα的100%的小鼠存活长达5天,而在Hu-TNBS+PBS组中,三只动物在J5之前必须安乐死。重量(图9B):在直肠内注射5%TNBS/乙醇50%的第0天的TNBS处理组中,我们观察到两组的体重减轻高达20%。然而,在Hu-TNBS+IL7Rα组中,动物从J3开始增加体重,而在Hu-TNBS+PBS组中,体重持续减轻(图9B)。重要的是要注意,小鼠必须被处死以收集生物学数据,并且在更长时间的方案将确认重量反弹。存活(图25):我们根据人PBMC的注射(GvHD发展)和抗IL7Rα抗体N13B2的使用评估存活率。相比对照动物,当用抗体处理动物时动物的存活率高30%(对照动物在60天后的死亡率为100%)。这种结果表明N13B2抗体保护动物免受GvHD和死亡。组织浸润(图26):对来自处理或未处理的死亡和存活动物(未安乐死)的结肠、肠、肝和肺进行组织学分析其炎症细胞浸润率(确定组织学评分)。我们观察到用N13B2处理的动物的结肠含有比对照更少的细胞浸润。在两种条件下,在肠、肝和肺中没有观察到差异。用N13B2处理的动物与对照相比显示30%的存活率。表征炎症的细胞浸润在肠、肝和肺组织中的治疗没有改变,表明在该炎症模型中,N13B2不能阻止这些组织中的炎症。然而,N13B2诱导了结肠中细胞浸润减少50%。这种效应可能与N13B2抗体对α4β7整合素表达的活性相关,如图19和20所示。事实上,已知α4β7整合素在将活化的淋巴细胞归巢到肠道中起到重要的作用。因此,由N13B2抗体诱导的整合素表达的降低可能是结肠中观察到的细胞浸润减少的原因(图26)。应当强调的是,在其他组织中明显缺乏的保护可能对本文使用的模型具有特异性,并且不应导致抗体的保护作用限于结肠的结论。特别地,经处理的动物的高得多的存活率显示抗体的保护作用对动物的整体状况具有强烈的积极影响。实施例15.非内化CD127抗体的体内效率动物狒狒(东非狒狒,来自CNRSPrimatologyCenter,鲁塞,法国)对于所有检疫试验都是阴性的,包括结核菌素皮肤试验。根据法国InstitutNationaldelaSantéEtdelaRechercheMédicale的机构伦理指南的建议,将动物饲养在我们实验室的大型动物设施中。所有实验均在使用舒泰(Zoletil)的全身麻醉下进行(Virbac,卡伦,法国)。在接受静脉注射(i.v.)大剂量10mg/kg的N13B2-IgG1或N13B2-IgG4或MD707-13-IgG4的五只狒狒的DTH实验中进行药代动力学和药效学研究。BCG疫苗接种和DTH测定在DTH皮肤试验前4周和2周,根据Poirier等(Poirier等,2011),用卡介苗(BCG)疫苗(0·1ml;2-105UFS;SanofiPasteurMSD,里昂,法国)在腿的上部区域皮内(i.d.)免疫狒狒两次。为了在DTH皮肤测试前研究抗原特异性T细胞免疫,根据制造商的说明书,通过干扰素(IFN)-g酶联免疫斑点(ELISPOT)实验(非人灵长类IFN-gELISPOT试剂盒;R&D系统,明尼阿波利斯,明尼苏达州,美国)针对新鲜分离的PBMC确定成功的免疫。使用两次剂量(1000UI或2000UI)的结核菌素纯化的蛋白衍生物(PPD;SymbioticsCorporation,圣地亚哥,加利福尼亚州,美国)以0.1ml在动物右背部的皮肤中两次皮内注射执行皮内反应(IDR)。盐水(0.1ml)用作阴性对照。使用游标规(calipersquare)测量注射部位处的皮肤反应。每个硬化红斑的直径由两个观察者在第3天至第8天期间测量,并且当直径>4mm时,其被认为是阳性的。记录读数的平均值。在第4天对来自DTH或对照(盐水)位点的皮肤执行活检一次,并置于TissueTek最佳切割温度(OCT)化合物(SakuraFinetek,Villeneuved'Ascq,法国)中用于免疫组织化学分析。在3周的清除期后进行第二次IDR,在用PPD进行第二次攻击前1天,动物接受一次静脉内注射10mg/kg嵌合CD127抗体(N13B2-IgG1或N13B2-IgG4或MD707-13-IgG4)。在另外3-6周的清除期后进行第三次IDR,并且动物保持不处理。在一些情况下,在另一个3个月的清除期后进行第四次IDR,并且动物也保持不处理。实施例16.在小鼠模型体外和体内中T细胞表面的α4β7表达:为了测量IL7诱导的α4β7在T细胞表面的表达,用IL7(AbDSerotec,编号PHP046)以5ng/ml在37℃下刺激人T淋巴细胞9天。在4℃下停止反应,洗涤,然后用PerCP/Cy5标记的抗α4(BDBioscience563644克隆9F10)和PE标记的抗β7(BDBioscience,克隆FIB504)染色。通过流式细胞术测量α4整合素和随后β7阳性细胞的阳性细胞。将N13B2人源化抗体在第0天以0.01至20ug/ml的不同浓度添加至细胞培养物中。在体内,将40×106个人外周血单核细胞腹膜内注射到受照免疫缺陷小鼠(NOD/SCID/IL-2受体γ链敲除小鼠)中。在用对照缓冲液(n=5)或N13B2mAb(5mg/kg,n=5)处理两周后,通过流式细胞术来测量血液中β7-阳性T淋巴细胞的百分比,和通过流式细胞术测量β7-阳性人T细胞的移植。通过流式细胞术,使用特异性抗体(来自BD编号57748的PECy7抗-人CD45和来自BD编号550994的PerCPCy5.5抗小鼠CD45)从小鼠CD45阳性细胞中区分出人CD45阳性细胞来测量这种移植,然后分析人β7阳性细胞(BDBioscience,克隆FIB504)。实施例17.使用肽微阵列的抗体谱肽技术的PepStarTM肽微阵列包括来自化学选择性和共价地固定在玻璃表面上的抗原或其它来源的纯化合成肽。优化的亲水性连接体部分插入在玻璃表面和抗原衍生的肽序列之间,以避免由空间位阻引起的假阴性。由于技术原因,所有肽含有C末端甘氨酸。对由52个肽组成的肽文库进行样品的分析(profiling)实验。肽的完整列表如下所示:表9.肽微阵列测定中使用的肽列表使用Multiwell格式将总共9个样品在微阵列载玻片上孵育。对于N13B2抗体和其他样品,应用4种不同的浓度(10、1、0.1和0.01μg/ml)。平行进行一个阴性对照培养(仅第二抗体)。将人IgG蛋白和小鼠IgG蛋白共同固定在每组肽旁边作为测定对照。使用两个载玻片平行进行所有温育。每个载玻片上的两个肽-微阵列用作对照孵育,通过单独施加荧光标记的检测抗体来评估与肽的假阳性结合。在洗涤和干燥载玻片后,用高分辨率激光扫描仪在635nm下扫描,以获得荧光强度的图像。对图像进行定量以产生每个肽的平均像素值。用1μg/ml的Cy5标记二抗抗大鼠IgG(JIR212-175-082)。缓冲液和溶液。所用的缓冲液是包括0.05%Tween20(JPT)和测定缓冲液T20(Pierce,SuperBlockTBST20,#37536)的TBS缓冲液。采用肽微阵列(JPTPeptideTechnologiesGmbH,柏林,德国;批号2668,Multi-Well温育室,AxonGenepix扫描仪4200AL,Spot-识别软件GenePix和MicrosoftExcel、R)进行获取和分析。实施例18.通过质谱分析进行表位作图(mapping)使用质谱来鉴定构象表位。使用MALDI质谱仪进行表位的测序。该仪器适于在800和4000Da之间的肽序列。目标蛋白质的消化允许将蛋白质切割成小片段(潜在表位)。理想地,消化酶必须尽可能接近表位的边界切割。根据重组蛋白序列中的酶截止(cut-off)频率选择消化酶。认为第二次消化减少了在第一次消化结束时获得的表位的大小。根据所选择的酶,曲线显著不同。对序列具有最佳消化分布的酶是胰凝乳蛋白酶。对感兴趣的序列具有适当截止频率并且良好分布的第二种酶是GluC。由于表位是构象的,因此亲和层析期间优先考虑复合物消化。目的序列的鉴定基于通过形成抗原-抗体复合物保护表位免受酶消化。在通过亲和层析和消化后,洗脱表位的片段并通过质谱法(MALDI-TOF-TOFBruker)测序。感兴趣的蛋白质的3D结构是可获得的并且可与获得的结果进行比较。UniprotP16871[21-239](SeqIDNo:114):对应于智人白介素-7受体亚单位α的拓扑结构域:ESGYAQNGDLEDAELDDYSFSCYSQLEVNGSQHSLTCAFEDPDVNTTNLEFEICGALVEVKCLNFRKLQEIYFIETKKFLLIGKSNICVKVGEKSLTCKKIDLTTIVKPEAPFDLSVIYREGANDFVVTFNTSHLQKKYVKVLMHDVAYRQEKDENKWTHVNLSSTKLTLLQRKLQPAAMYEIKVRSIPDHYFKGFWSEWSPSYYFRTPEINNSSGEMD在计算机中,CD127消化酶选择(参见对应于SeqIDNo:114的序列中上述带下划线的氨基酸):选择胰凝乳蛋白酶作为消化酶。切割位点(粗线),肽编号,切割的频率是合适的。选择Glu-C酶作为第二消化酶。获得的包括在800和4000Da之间的重量的肽的数量是合适的。Glu-C切割的频率和切割位点的位置(细线)是合适的。所用的方法是常规的并且是本领域技术人员公知的,并且描述于Suckau等(1990)和Papac等(1994)中。材料和试剂:质谱MALDI-TOF/TOFIIdeBruker;Hi-trapNHS色谱柱(编号:17-0716-01-GEhealthcare);胰凝乳蛋白酶(编号:11418467001-Roche);GluC(编号:11420399001-Roche);Zip/TIPC18(编号:ZTC18S096-Millipore);碳酸氢铵(编号:09830-Sigma);甘氨酸(编号:G7126-Sigma);NaCl(编号:27800.360-VWR)。阶段1:游离蛋白和抗体在溶液中的消化。通过胰凝乳蛋白酶或GluC在室温或37℃下消化游离抗原和抗体的溶液1小时、2小时、3小时、4小时、5小时和过夜。通过消化的肽的质谱(MS)对消化的肽的进行分析。这些实验允许建立酶消化(时间和温度)的合适条件。目的是充分消化抗原,同时尽可能少地影响抗体的结构。最佳条件确定为:胰凝乳蛋白酶消化:在室温下1小时;Glu-C消化:在37℃过夜。通过质谱MALDI-TOF/TOF分析抗原和抗体的每个消化物。阶段2:整体结合的(wholetied)Ac+全抗原的复合物的总消化。按照标准程序,在Hi-TrapNHS柱上进行抗CD127单克隆抗体N13B2-G1(批次210415)的偶联。柱上的抗原免疫捕获在1小时期间进行,允许抗原-抗体复合物的形成。N13B2-G1抗体在四个Hi-TrapNHS柱上的偶联效率如下:84%、84%、83%和83%。获得了一致和相同的偶联产率。在由上述对照确定的温度和持续时间内,以1/50的比例或1mg酶对50mg抗体进行复合物消化。然后用洗涤缓冲液(碳酸氢铵25mM)洗涤柱子以除去和回收未结合的抗原肽。还进行在缓冲盐水(PBS-2MNaCl)中的洗涤步骤以除去非特异性肽。洗涤后,用洗脱溶剂(50mM甘氨酸pH2)进行洗脱,以特异性提取和回收特异性结合的肽(预测其对应于表位)。MALDI分析:通过疏水色谱在C18基质上浓缩洗涤和洗脱级分。然后通过质谱MALDI-TOF/TOF分析它们。MS分析可以精确测量肽的质量,并将来自游离抗原电脑模拟(insilico)的消化的肽的实验质量与理论质量进行比较从而允许鉴定肽;如果需要,可以进行MS/MS分析以确认肽的序列。胰凝乳蛋白酶消化后的洗脱液的光谱显示了具有下述质量的肽的存在:912.49、1086.47、1843.03、2104.16、1944.97、1564.73、1835.97、2022.05、2424.22和2858.42Da,其可以对应于下表10中的抗原肽。表10.胰凝乳蛋白酶消化后获得的肽(保护免受蛋白水解的序列)Glu-C消化后的洗脱液的谱显示了我们目标蛋白质的消化肽的存在,其具有对应于下表11中的抗原肽的质量:1200.43、1309.68、2108.97、2191.04、2699.43、3170.68、3264.70Da。表11.在Glu-C消化后获得的肽(保护免于蛋白水解的序列)这两种消化使我们能够鉴定参与hN13B2和CD127抗原之间相互作用的三个位点(下表12)。排除来自盐缓冲液洗涤的肽以限定(restrict)感兴趣的序列。表12.由N13B2保护免遭蛋白水解的人CD127肽的序列N13B2抗体对抗原CD127的表位作图显示出对IL7/CD127途径的抗体活性重要的3种不同序列(图27)。通过IL7/CD127相互作用的3D晶体学分析(McElroy等,Structure2009,PDB:3DI2),两个序列(SeqIDN°115和IDN°117)在结构上是封闭的,并且位于涉及IL7与CD127结合的区域中。第三个鉴定的序列(seqIDN°116)位于受体D2结构域的2b位点中,所述结构域是预测与CD132(受体的γ链)相互作用的结构域(Walsh等,2012)。N13B2识别位于抑制IL7-CD127相互作用和CD127-CD132异二聚体形成的2部分蛋白质中的CD127上的构象表位。N13B2的结合必须使WalshST预测的“三元IL7Rα/IL7/g链复合物”的形成不稳定,其阻断复合物的内化。实施例19.结果如先前所述(Henriques等,2010),单独的IL-7诱导在T淋巴细胞表面的IL-7受体α链(CD127)的快速内化(30-40%),这是IL-7介导的信号传导所必需的。在这里我们描述了N13B2mAb阻止IL-7诱导的CD127内化并且自身不诱导这种内化(图16)。相比之下,我们描述了来自GSK(专利申请WO2011094259)的抗人CD1271A11克隆,在37℃下单独施用或与IL-7组合施用时,可以显著降低T淋巴细胞表面的CD127表达(图16)。使用几种商业抗IL7R抗体(eBioRDR5和MB15-18C9,数据未显示)的不同染色观察到该效应。在非人灵长类动物中以10mg/Kg静脉内施用嵌合N13B2mAb(用人IgG1或IgG4Fc结构域格式化)后,我们在随后2周内没有测量到T淋巴细胞表面的CD127表达的减少(图17B)。相比之下,在用10mg/kg的抗人CD127MD707-13克隆(用人IgG4Fc结构域进行格式化;WO2013/056984)平行静脉内处理的其它非人灵长类动物中,我们观察到CD127在T淋巴细胞表面的显著降低(60%)(图17B)。这种在抗-人CD127mAb结合T淋巴细胞后CD127的内化先前也由辉瑞集团发表,其中他们描述了其抗人CD127mAb(克隆HAL-H3L4,美国专利8,637,273)显著诱导CD127在人和非人灵长类动物血细胞上的活体外内化,以及在静脉内施用后显著诱导CD127在非人灵长类动物中的体内内化(Kern等,2013)。在Kern等最近的出版物中,(Kern等,2015),研究了CD127占用(occupancy)并进行竞争测定。来自BD生物科学的抗CD127HIL-7R-M21克隆显示与HAL/Ab1抗体(来自Pfizer组)竞争以结合CD127。如本发明的图16所示,就CD127表达和内化而言,将HAL抗体(克隆H3L4,美国专利8637273)与N13B2和1A11进行比较。这些结果显示了HAL抗体与HIL-7R-M21之间的竞争,证实了Kern等,2015的数据。然而,N13B2不与HIL-7R-M21竞争。Kern等还显示HAL/Ab1自身在注射后4至8天诱导细胞表面CD127表达的体内下调。这些结果与本发明的图17B的具有MD707-13克隆的结果相当。图17B显示在注射抗体后4至10天细胞表面的CD127表达的下调。这种体内效应可以与观察到的CD127体外MD707-13依赖性内化进入到细胞相关。通过肽微阵列和质谱的表位研究鉴定了由CD127上的N13B2识别的构象表位。与识别仅位于D1中的表位的现有技术的抗体(实施例17)相反,该表位位于结构域D1和D2中。此外,图16显示现有技术的抗体诱导CD127的内化,而N13B2不诱导。因此,我们得出结论,N13B2不诱导CD127内化的性质与其识别同时位于结构域D1和D2两者中的表位的性质相关。总之,这些结果和先前的报道显示,描述阻断IL-7与IL-7受体结合的抗人CD127mAb(1A11克隆,HAL/Ab1和H3L4克隆和MD707-13克隆)也诱导IL-7受体α链内化,其与IL-7受体信号传导相关并且被IL-7受体信号传导所需要的。相反并且以令人惊讶的方式,N13B2mAb具有不诱导CD127内化的独特性质,并且其防止由IL-7诱导的这种内化。这些结果必须与如下观察有关:在体外有效预防IL-7受体信号传导(例如STAT5磷酸化,图14B)的CD127-内化诱导剂mAb(例如MD707-13克隆)不能在体内预防记忆细胞(图21)或体液(图22)免疫应答。相比之下,我们描述了N13B2mAb,其有效阻断IL-7受体信号传导(STAT5磷酸化),但不诱导CD127在体外在人T淋巴细胞上内化和不诱导CD127在体内在非人灵长类动物中内化,防止延迟型超敏记忆细胞应答(图21)以及针对异种绵羊红细胞的免疫(图22)。虽然在记忆体液应答的控制上观察到N13B2的同种型之间没有差异,但是我们注意到与IgG1相比,IgG4形式的N13B2更有效地防止记忆细胞应答。在MD707-13处理的动物和N13B2处理的动物之间没有观察到mAb暴露和血清浓度的差异。类似地,我们还观察到用N13B2或MD707-13mAb处理的动物中调节性T淋巴细胞的显着增加(图22)。人IL-7在体外在人T淋巴细胞上诱导α4和β7整合素的强表达,并且显着增加表达α4,β7和α4/β7整合素的人T淋巴细胞的频率(图19A),其是T淋巴细胞归巢和保留在非淋巴组织如肠、脑和皮肤中所必需的(Gorfu等,2009,DeNucci等,2009)。因此,我们观察到N13B2mAb剂量依赖性地体外抑制α4和β7的表达以及降低α4阳性和α4/β7阳性的人T淋巴细胞的频率(图19B)。类似地,在从人外周血单核细胞转移到免疫缺陷小鼠后,我们观察到在一周(数据未显示)和两周的治疗之后,N13B2抗体显著地和快速地降低β7阳性T淋巴细胞的百分比以及这些细胞的数量(皮内注射(i.d.)移植物)(图20)。在两种不同的炎症模型中获得的结果显示,N13B2抗IL7Rα抗体可以是针对炎性疾病,特别是结肠炎的有效治疗。实施例20.产生构象表位CLIPS肽可用于充分模拟抗原的天然二级和三级结构,目的是将这些CLIPS肽翻译成诱导所需抗体的活性和有效免疫原(Boshuizen等,2014)。CLIPS技术包括通过与携带2、3或4个锚点的小刚性实体(化学支架)反应的线性肽的(多重)环化。锚仅与肽的一种类型的官能团(即硫醇)反应并通过多个共价键连接到肽上。肽折叠在支架周围并且失去柔性,同时缓慢适应于确定(well-defined)的三维结构,其中支架实体在中心,如“蛛网中的蜘蛛”。该技术利用完全合成的定制支架。CLIPS支架主要在大小、极性、刚性、溶解度、功能和“SS跨度”距离上变化。这些支架用于固定肽的松散末端。当适当地定位在肽序列内时,与线性序列相比,所得到的CLIPS肽可能与完整蛋白上的相应区域的3D结构更类似。CLIPS环化可以在天然L-半胱氨酸残基上进行,但也可以在序列中几乎任何所需位置处人工引入的D-和L-(同型)半胱氨酸上进行。因此,CLIPS化肽的结构和尺寸可以随意改变。环化反应持续不超过30分钟,在室温下进行,不需要任何催化。此外,它可以在完全水性条件和中性pH(7.5-8.0)下应用,因此与高度敏感的生物系统如细菌噬菌体相容。最后,反应可以在高稀释条件(10-100μM)下进行,这促进了高产率的环状产物并避免了聚合。这种技术是高度通用的,因其易于应用而独特。在尝试重建抗受体抗体的线性和不连续表位的尝试中,将直链多聚体重叠肽直接合成到信用卡大小的聚丙烯板上,其C末端共价偶联到每个3ul孔的底部(每板455个孔),每个孔含有不同的肽。在每个单结构域肽内,形成环化的二半胱氨酸桥以在板连接的肽中插入受限环。Teeling等,2006,解释了如何用感兴趣的肽产生环化肽,以重建由感兴趣的抗体识别的不连续表位。简言之,首先用沿着肽间隔在4和13个氨基酸之间的半胱氨酸(例如CXXXXC-平板,XXXCXXXXCXXXXXX平板或CXXXXC-平板等)合成板结合的含二半胱氨酸的肽。然后通过在水溶液中用α,α-二溴二甲苯处理将肽环化,以提供含有不同数目氨基酸的半胱氨酸环。这种化学修饰提供了比二硫键更稳定的环。(Niederfellner等,2011)实施例21.CD127和γc的共免疫沉淀为了测试N13B2和现有技术抗体对CD127与γc链的结合的影响,在由IL-7刺激的细胞中进行共免疫沉淀实验,并在不存在抗体或在MD707-13或N13B2抗体存在下温育。在不存在抗体的情况下,显示CD127和γC共免疫沉淀。细胞与MD707-13的孵育不防止这种共免疫沉淀,而与N13B2的孵育导致不存在这种共免疫沉淀。因此,我们的抗体能够破坏CD127与γc链的结合,而现有技术的抗体不具有这种特征。为了在抗CD127存在下共免疫沉淀复合物CD127-CD132-IL7,将人PBL与大鼠抗-hCD127抗体(10μg/ml的大鼠N13B2或MD707-13)在37℃孵育30分钟,然后用IL7(AbDSerotec,编号PHP046)以5ng/ml在37℃刺激15分钟。在4℃下停止反应,并在加入来自共免疫沉淀试剂盒(PierceDirectIP试剂盒,编号26148)的裂解缓冲液之前,用冷PBS洗涤两次。使用共免疫沉淀试剂盒(PierceDirectIP试剂盒,编号26148)制备纯化柱抗人CD127。根据制造商推荐的程序,将柱与75μg非竞争性大鼠抗人CD127(Effimune,MD707-9)偶联。裂解物在非偶联柱上预纯化以除去非特异性结合物。然后,将裂解物加入抗CD127柱上,并在滚动搅拌下在4℃温育2小时。用洗涤缓冲液洗涤柱两次,然后用洗脱缓冲液洗脱。通过Western印迹分析回收的样品。对于Western印迹,制备SDS-Page凝胶(10%用于分离,4%用于堆积凝胶,具有1.5mm厚度),并且将50μl变性的洗脱液(用于变性:DTT0.1M和在95℃下10分钟)加入每个孔中。加入作为用于western印迹检测的对照的CD127Fc(SinoBiologicals,北京,中国;编号10975-H08H)和CD132Fc(SinoBiologicals,北京,中国;编号10555-H02H)重组蛋白(5μg/孔)。在200V迁移1小时30分钟后,在20V下在硝酸纤维素膜上转移35分钟,在室温下在5%牛奶中饱和2小时。开始检测,在4℃下以1/50加入兔抗人CD132抗体(anticorps-en-ligne,法国,编号ABIN741840)过夜,然后用过氧化物酶标记的山羊抗兔(JacksonImmunoresearch,编号111-035-144)以1/2000在室温下1小时来显示。去杂交后,将膜与大鼠抗人CD127抗体(Effimune,MD707-9)以1/200在4℃下温育过夜,并用过氧化物酶标记的驴抗大鼠抗体(JacksonImmunoresearch,编号712-035-153)以1/1000在室温下1小时来显示。对于每个显示,使用ECL(ThermoScientific,编号34080)通过化学发光检测过氧化物酶,并且在Fuji4000照相机上读取结果。图28显示CD127/IL7/CD132复合物的共免疫沉淀的结果。我们观察到,除了当细胞与N13B2抗体(28A)温育时,CD132链(60KDa)在任何条件下均与CD127共免疫沉淀。然而,在每个条件下,CD127(70KDa)被deMD707-9抗体良好地免疫沉淀,如图28B所示,表明N13B2和MD707-13不与MD707-9竞争识别CD127。N13B2抗体在IL-7存在下抑制CD127/CD132的复合物形成。这些结果与N13B2抗体对CD127的表位作图是一致的,显示N13B2结合IL7Rα链的结构域D2中的2b位点内的氨基酸序列(Walsh等,Immunolrev.2012)。总之,这些结果表明,在IL-7存在下,N13B2抗体是IL7/CD127相互作用的拮抗剂以及是2b位点处的CD127/CD132相互作用的拮抗剂,这可以解释用来自现有技术的IL7和/或抗CD127抗体观察到的抗体对CD127内化的抑制活性。以下编号的实施方式构成本发明的优选实施方式。1.抗体或抗体的抗原结合片段或结合抗原的抗体模拟物,其特异性结合CD127并且不诱导CD127内化。2.抗体或其抗原结合片段或其模拟物,特别是根据实施方式1的抗体或其抗原结合片段或其模拟物,其抑制IL-7诱导的CD127的内化。3.根据实施方式1或2所述的抗体或其抗原结合片段或其模拟物,其中在抗体或片段存在下,IL-7处理过的细胞中CD127的细胞表面表达是不存在抗体下温育的细胞中的水平的至少80%、优选至少90%。4.抗体或其抗原结合片段,其特异性结合CD127,从而破坏CD127与细胞因子受体的γc共用链的结合。5.根据实施方式1至3中任一项所述的抗体或其抗原结合片段,当与CD127结合时,其破坏CD127与细胞因子受体的γc共用链的结合。6.根据实施方式4或5中任一项所述的抗体或其抗原结合片段,在其存在下,与CD127结合的γc的量小于在除无抗体存在外其它条件相同时测量的所述量的80%,优选小于50%,甚至更优选小于25%或10%,特别是当所述测量针对在存在或不存在所述抗体下温育的细胞裂解物上进行时,所述细胞裂解物包括来自在细胞表面表达IL7受体的完整细胞的包含CD127的分子复合物。7.根据上述实施方式中任一项所述的抗体或其抗原结合片段或其模拟物,其是由IL-7诱导的IL-7R信号传导的拮抗剂。8.抗体或其抗原结合片段或其模拟物,特别是根据任何上述实施方式的抗体或其抗原结合片段或其模拟物,其特异性结合和/或针对根据实施方式53至67中任一项的抗原或所述抗原的表位而产生。9.特异性结合CD127的抗体或其抗原结合片段或其模拟物,特别是根据任何上述实施方式所述的抗体或其抗原结合片段或其模拟物,其不增加由TSLP诱导的树突细胞的成熟。10.根据上述实施方式中任一项所述的抗体或其抗原结合片段或其模拟物,其抑制α4,β7和/或α4/β7整合素的表达。11.根据实施方式10所述的抗体或其抗原结合片段或其模拟物,其抑制体内α4,β7和/或α4/β7整合素的表达,特别是注射在免疫缺陷小鼠中的人T细胞中α4,β7和/或α4/β7整合素的表达。12.特异性结合CD127的抗体或其抗原结合片段或其模拟物,特别是根据上述实施方式中任一项所述的抗体或其抗原结合片段或其模拟物,其包括VH链,其含有以下氨基酸序列中的至少一个:·VHCDR1SEQIDNo:10;·VHCDR2SEQIDNo:12;·VHCDR3SEQIDNo:14或SEQIDNo:48;或·VHSEQIDNo:22和/或VL链,其含有以下氨基酸序列中的至少一个:·VLCDR1SEQIDNo:16或SEQIDNo:50;·VLCDR2SEQIDNo:18或SEQIDNo:52;·VLCDR3SEQIDNo:20;或·VLSEQIDNo:24。13.根据实施方式12所述的抗体或其片段或其模拟物,其包括选自由以下构成的组的至少两个、三个、四个或五个CDR序列:VHCDR1SEQIDNo:10、VHCDR2SEQIDNo:12、VHCDR3SEQIDNo:14或SEQIDNo:48、VLCDR1SEQIDNo:16或SEQIDNo:50、VLCDR2SEQIDNo:18或SEQIDNo:52和VLCDR3SEQIDNo:20。14.根据实施方式13所述的抗体或其片段或其模拟物,其包括全部六个CDR序列:VHCDR1SEQIDNo:10、VHCDR2SEQIDNo:12、VHCDR3SEQIDNo:14或SEQIDNo:48、VLCDR1SEQIDNo:16或SEQIDNo:50、VLCDR2SEQIDNo:18或SEQIDNo:52和VLCDR3SEQIDNo:20。15.根据实施方式14所述的抗体,其中-VH链为具有SEQIDNo:2的序列或SEQIDNo:6的序列或SEQIDNo:54的序列的VH链或包括SEQIDNo:22的序列或SEQIDNo:36的序列或SEQIDNo:38的序列或SEQIDNo:40的序列;和-VL链为具有SEQIDNo:4的序列或SEQIDNo:56的序列的VL链或包括SEQIDNo:24的序列或SEQIDNo:42的序列或SEQIDNo:44的序列或SEQIDNo:46的序列。16.根据上述实施方式中任一项所述的抗体,其是嵌合抗体或人源化抗体或去免疫化抗体。17.根据实施方式13所述的抗体,其是人源化和去免疫化抗体,其中所述重链具有SEQIDNo:52的序列,并且所述轻链具有SEQIDNo:54的序列。18.大分子,其是包括根据上述任一项实施方式的抗体或其抗原结合片段或其模拟物的嵌合分子,其中所述抗体与功能不同的分子关联,所述嵌合分子或者是融合嵌合蛋白、或者是因化学基团或分子(例如PEG聚合物或标记的抗体)的共价连接而得到产生的缀合物。19.根据上述实施方式中任一项所述的大分子,其是affitin或anticalin。20.根据上述实施方式中任一项的大分子,特别是抗体或其抗原结合片段或其模拟物,其结合CD127M的Kd低于5E-10M,特别是低于1E-10M,特别是低于5E-11M。21.根据上述实施方式中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物,其显示对CD127阳性细胞的细胞毒性活性。22.根据上述实施方式中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物,其不增加由TSLP诱导的树突细胞的成熟,其中,通过确定同时使用TSLP和所述大分子处理的TSLP受体阳性细胞中的细胞表面标志物CD40和/或CD80的表达相比单独使用TSLP处理的细胞中的表达的升高,来评估由TSLP诱导的树突细胞成熟的增加。23.根据实施方式22的大分子,特别是抗体或其抗原结合片段或其模拟物,其中与单独使用TSLP处理的细胞相比,同时使用TSLP和所述大分子处理的TSLP受体阳性细胞中CD80的表达升高了不超过25%,优选不超过10%。24.根据实施方式23的大分子,特别是抗体或其抗原结合片段或其模拟物,其中与单独使用TSLP处理的细胞相比,同时使用TSLP和所述大分子处理的TSLP受体阳性细胞中的CD80的表达没有升高或降低。25.根据实施方式22的大分子,特别是抗体或其抗原结合片段或其模拟物,其中与单独使用TSLP处理的细胞相比,同时使用TSLP和所述大分子处理的TSLP受体阳性细胞中CD40的表达升高了不超过50%,优选不超过25%。26.根据实施方式25的大分子,特别是抗体或其抗原结合片段或其模拟物,其中与单独使用TSLP处理的细胞相比,同时使用TSLP和所述大分子处理的TSLP受体阳性细胞中CD40的表达没有升高或降低。27.编码上述实施方式中任一项所述的抗体或其抗原结合片段或大分子的核酸分子。28.根据实施方式27所述的核酸分子,其编码选自由以下构成的组的氨基酸:SEQIDNo:2、SEQIDNo:4、SEQIDNo:6、SEQIDNo:8、SEQIDNo:10、SEQIDNo:12、SEQIDNo:14、SEQIDNo:16、SEQIDNo:18、SEQIDNo:22、SEQIDNo:24、SEQIDNo:36、SEQIDNo:38、SEQIDNo:40、SEQIDNo:42、SEQIDNo:44、SEQIDNo:46、SEQIDNo:48、SEQIDNo:50、SEQIDNo:52、SEQIDNo:54和SEQIDNo:56。29.根据实施方式28所述的核酸分子,其选自由以下构成的组:SEQIDNo:1、SEQIDNo:3、SEQIDNo:5、SEQIDNo:7、SEQIDNo:9、SEQIDNo:11、SEQIDNo:13、SEQIDNo:15、SEQIDNo:17、SEQIDNo:19、SEQIDNo:21、SEQIDNo:23、SEQIDNo:35、SEQIDNo:37、SEQIDNo:39、SEQIDNo:41、SEQIDNo:43、SEQIDNo:45、SEQIDNo:47、SEQIDNo:49、SEQIDNo:51、SEQIDNo:53和SEQIDNo:55。30.用于克隆和/或表达实施方式27至29中任一项所述的多核苷酸的载体,特别是适于在哺乳动物细胞中克隆和/或表达的质粒。31.与根据实施方式27至30中任一项所述的多核苷酸重组的细胞或细胞系,特别是哺乳动物细胞或细胞系。32.一种药物组合物,其包括根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物和药物载体;其中,所述药物组合物任选地包括另外不同的活性成分。33.包括作为治疗活性成分的根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物的药物组合物或实施方式32所述的药物组合物,其为适于在施用于人类患者时控制树突细胞分化/成熟的制剂。34.实施方式32或33所述的药物组合物,其还包括特别对涉及以下疾病的细胞具有治疗性免疫调节剂作用的另外的化合物:自身免疫疾病或过敏性疾病、白血病如急性淋巴细胞白血病、淋巴瘤、癌症、慢性病毒感染、炎性疾病、移植、呼吸道疾病或自身免疫性疾病。35.根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物或根据实施方式27至30中任一项所述的核酸或根据实施方式31所述的细胞或细胞系,其在需要的患者中作为组合或附加治疗方案中的治疗活性成分使用。36.根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物或根据实施方式27至30中任一项所述的核酸或根据实施方式31所述的细胞或细胞系或根据实施方式32至34中任一项所述的药物组合物,其用于治疗患有疾病的患者,特别是人类患者。37.根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物或根据实施方式27至30中任一项所述的核酸或根据实施方式31所述的细胞或细胞系或根据实施方式32至34中任一项所述的药物组合物,其用于治疗具有疾病风险的患者,特别是人类患者。38.根据实施方式36和/或实施方式37所述的大分子、核酸、细胞、细胞系或药物组合物的用途,其中所述疾病是自身免疫性疾病,特别是类风湿性关节炎、多发性硬化、I型糖尿病、自身免疫性甲状腺炎和狼疮。39.根据实施方式36和/或实施方式37所述的大分子、核酸、细胞、细胞系或药物组合物的用途,其中所述疾病是炎性疾病,特别是IBD和脑脊髓炎。40.根据实施方式36和/或实施方式37所述的大分子、核酸、细胞、细胞系或药物组合物的用途,其中所述疾病是过敏性疾病。41.根据实施方式36和/或实施方式37所述的大分子、核酸、细胞、细胞系或药物组合物的用途,其中所述疾病是癌症。42.根据实施方式36和/或实施方式37所述的大分子、核酸、细胞、细胞系或药物组合物的用途,其中所述疾病是呼吸道疾病。43.根据实施方式36和/或实施方式37所述的大分子、核酸、细胞、细胞系或药物组合物的用途,其中所述疾病与移植相关,特别是移植的结果。44.一种治疗方法,包括将根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物或根据实施方式27至30中任一项所述的核酸或根据实施方式31所述的细胞或细胞系或根据实施方式32至34所述的药物组合物施用于患有疾病或处于疾病风险中的患者。45.根据实施方式44所述的治疗方法,其中所述疾病是自身免疫疾病,特别是类风湿性关节炎、多发性硬化、I型糖尿病、自身免疫性甲状腺炎和狼疮。46.根据实施方式44所述的治疗方法,其中所述疾病是炎性疾病,特别是IBD和脑脊髓炎。47.根据实施方式44所述的治疗方法,其中所述疾病是过敏性疾病。48.根据实施方式44所述的治疗方法,其中所述疾病是癌症。49.根据实施方式44所述的治疗方法,其中所述疾病是呼吸道疾病。50.根据实施方式44所述的治疗方法,其中所述疾病与移植相关,特别是移植的结果。51.根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物或根据实施方式27至30中任一项所述的核酸或根据实施方式31所述的细胞或细胞系或根据实施方式32至34中任一项所述的药物组合物,其用于治疗需要移植和/或即将移植的患者,特别是人类患者和/或移植过的患者。52.一种治疗方法,包括将根据实施方式1至26中任一项所述的大分子,特别是抗体或其抗原结合片段或其模拟物或根据实施方式27至30中任一项所述的核酸或根据实施方式31所述的细胞或细胞系或根据实施方式32至34所述的药物组合物施用于需要移植和/或即将移植的患者和/或移植过的患者。53.抗原,其中所述表位包括来自CD127的2b位点的序列或由来自CD127的2b位点的序列组成,特别是包括来自CD127的2b位点的至少3个、4个、5个、6个或7个连续的氨基酸。54.根据实施方式53所述的抗原,其中所述表位包括以下序列或由以下序列构成:来自由SEQIDNo:114的第109至127位氨基酸构成的位点的序列,特别是来自由第110至125位、第112至125位、第112至120位氨基酸构成的位点的序列,特别是来自包括来自所述位点的至少3个、4个、5个、6个或7个连续的氨基酸的位点的序列。55.根据实施方式53或54中任一项所述的抗原,其中所述表位包括CD127的至少3个、4个、5个、6个或7个连续的氨基酸,所述连续的氨基酸包括P112和/或L115。56.根据实施方式53至55中任一项的抗原,其中所述表位由SEQIDNo:116的序列组成或包括SEQIDNo:116的序列,特别是包括SEQIDNo:86的序列。57.根据实施方式53至56中任一项的抗原,其中所述表位还包括来自CD127的D1结构域的序列(特别是至少3个、4个、5个、6个或7个连续的氨基酸),特别是来自SEQIDNo:114的第1至98位氨基酸序列的至少3个、4个、5个、6个或7个连续的氨基酸。58.根据实施方式57所述的抗原,其中所述表位包括人CD127的序列,该人CD127的序列包括或由以下序列构成:SEQIDNo:115的序列,特别是包括或由以下序列构成:SEQIDNo:110。59.根据实施方式53至58中任一项所述的抗原,其中所述表位还包括来自SEQIDNo:114的第180至220位氨基酸的序列,特别是来自SEQIDNo:114的第180至220位氨基酸的至少3个、4个、5个、6个或7个连续的氨基酸;特别是其中来自SEQIDNo:114的第180至220位氨基酸的所述序列包括或由以下序列构成:SEQIDNo:117的序列,特别是包括或由以下序列构成:SEQIDNo:111。60.根据实施方式53至59中任一项所述的抗原,其中所述表位包括或由以下序列构成:由以下组成的人CD127的序列,SEQIDNo:110的序列或SEQIDNo:115的序列;SEQIDNo:111的序列或SEQIDNo:117的序列;和SEQIDNo:86的序列或SEQIDNo:116的序列。61.根据实施方式53至60中任一项所述的抗原,其中所述表位不包括来自SEQIDNo:114的第99-108位氨基酸的序列的超过3个、4个或5个连续的氨基酸和/或不包括来自SEQIDNo:114的第128-179位氨基酸的序列的超过3个、4个或5个连续的氨基酸,和/或不包括来自SEQIDNo:114的第220-239位氨基酸的序列的超过3个、4个或5个连续的氨基酸,特别是不包括来自SEQIDNo:114的任何所述氨基酸序列的超过3个、4个或5个连续的氨基酸。62.根据实施方式53或60中任一项所述的抗原,其中包括SEQIDNo:110的人CD127的表位序列不延伸至包括超过1个N-端氨基酸或超过7个C端氨基酸的与人CD127的序列中的所述序列相邻的氨基酸。63.根据实施方式61的抗原,其中包括SEQIDNo:110的人CD127的表位序列不延伸至包括与人CD127的序列中的所述序列相邻的任何N-端和/或C-端氨基酸。64.根据实施方式53至63中任一项所述的抗原,其中包括SEQIDNo:111的人CD127的表位序列不延伸至包括超过30个N-端氨基酸或超过30个C-端氨基酸的与人CD127的序列中的所述序列相邻的氨基酸。65.根据实施方式64的抗原,其中包括SEQIDNo:111的人CD127的表位序列不延伸至包括与人CD127的序列中的所述序列相邻的任何N-端和/或C-端氨基酸。66.根据实施方式53至65中任一项所述的抗原,其中所述表位是构象表位,特别是其中包括在所述表位中的来自CD127的肽处于一种构象中,其模拟在天然CD127或其胞外结构域中的相应肽的构象,特别是在CD127中没有配体的单体形式的相应肽的构象,结合γc的形式的相应肽的构象和/或结合IL7的形式的相应肽的构象。67.根据实施方式66所述的抗原,其中所述表位是构象表位,其中来自CD127的肽与刚性分子骨架结合,所述刚性分子骨架使它们保持所需的构象,特别是使用CLIPS技术获得的该抗原。68.根据实施方式53至67中任一项所定义的表位。69.核酸,其编码如实施方式53至67中任一项所定义的抗原。70.一种制备抗体的方法,包括针对根据实施方式53至67中任一项所定义的抗原对非人动物进行免疫。71.一种选择抗体,抗体片段或抗体模拟物的方法,特别是选择如实施方式70中获得的抗体,其片段或模拟物的方法,包括测定所述抗体与实施方式53至67中任一项所定义的至少一种抗原的结合能力的步骤,特别是其中所述方法包括几个连续的这种步骤,每个步骤测定与由CD127的单个连续序列构成的不同的肽的结合能力。72.一种选择大分子,特别是抗体,特别是如实施方式70中获得的抗体,或该抗体的抗原结合片段或模拟物的方法,包括或者由以下步骤构成:测试大分子与CD127,特别是如实施方式53至67中任一项所定义的抗原的结合能力的步骤,和任选地选择根据实施方式20所述的大分子的步骤。73.一种选择根据实施方式71或72中任一项所述的大分子的方法,其中所述抗原包含几种CD127的非连续肽,并且其中所述方法包括几个步骤,每个所述步骤由测试所述大分子与所述CD127多个肽中的一个的结合能力组成。74.一种方法,特别是一种根据实施方式71至73中任一项所述的选择大分子,特别是抗体,特别是如实施方式70中获得的抗体,或该抗体的抗原结合片段或模拟物的方法,其包括或由以下步骤构成:测试由存在的大分子诱导的CD127表达细胞中CD127的内化的步骤。75.一种方法,特别是一种根据实施方式71至74中任一项所述的选择大分子,特别是抗体,特别是如实施方式70中获得的抗体,或该抗体的抗原结合片段或模拟物的方法,其包括或由以下步骤构成:在表达CD127细胞中测试大分子对IL-7诱导的CD127内化的抑制的步骤,和任选地选择根据实施方式3的大分子的步骤。76.一种方法,特别是一种根据实施方式71至75中任一项所述的选择大分子,特别是抗体,特别是如实施方式70中获得的抗体,或该抗体的抗原结合片段或模拟物的方法,其包括或由以下步骤构成:测定所述大分子通过其与CD127的结合破坏CD127与γc链的结合能力的步骤。77.一种方法,特别是一种根据实施方式71至76中任一项所述的选择大分子,特别是抗体,特别是如实施方式70中获得的抗体,或该抗体的抗原结合片段或模拟物的方法,其包括或由以下步骤构成:测试在大分子存在下由TSLP诱导的树突细胞(DCs)的成熟的增加,以及任选地选择根据实施方式22至26中任一项的大分子。78.根据实施方式71至77中任一项所述的方法,还包括以下步骤中的一个或多个:A.测试大分子对IL-7诱导的信号传导、特别是STAT5磷酸化的抑制;B.测试大分子对由TSLP诱导的TARC生成的抑制;C.测试大分子对α4,β7和/或α4/β7整合素表达、特别是在T淋巴细胞上的细胞表面表达的抑制。参考文献Adams,A.B.,Pearson,T.C.,andLarsen,C.P.(2003).Heterologousimmunity:anoverlookedbarriertotolerance.Immunol.Rev.196,147–160.Albuquerque,A.S.,C.S.,Foxall,R.B.,Soares,R.S.,Victorino,R.M.M.,andSousa,A.E.(2007).RateofincreaseincirculatingIL-7andlossofIL-7RalphaexpressiondifferinHIV-1andHIV-2infections:twolymphopenicdiseaseswithsimilarhyperimmuneactivationbutdistinctoutcomes.J.Immunol.Baltim.Md1950178,3252–3259.Baca,M.,Presta,L.G.,O’Connor,S.J.,andWells,J.A.(1997).Antibodyhumanizationusingmonovalentphagedisplay.J.Biol.Chem.272,10678–10684.VanBodegom,D.,Zhong,J.,Kopp,N.,Dutta,C.,Kim,M.-S.,Bird,L.,Weigert,O.,Tyner,J.,Pandey,A.,Yoda,A.,etal.(2012).DifferencesinsignalingthroughtheB-cellleukemiaoncoproteinCRLF2inresponsetoTSLPandthroughmutantJAK2.Blood120,2853–2863.Boshuizen,R.S.,Marsden,C.,Turkstra,J.,Rossant,C.J.,Slootstra,J.,Copley,C.,andSchwamborn,K.(2014).AcombinationofinvitrotechniquesforefficientdiscoveryoffunctionalmonoclonalantibodiesagainsthumanCXCchemokinereceptor-2(CXCR2).mAbs6,1415–1424.Bour-Jordan,H.,Esensten,J.H.,Martinez-Llordella,M.,Penaranda,C.,Stumpf,M.,andBluestone,J.A.(2011).IntrinsicandextrinsiccontrolofperipheralT-celltolerancebycostimulatorymoleculesoftheCD28/B7family.Immunol.Rev.241,180–205.Broux,B.,Hellings,N.,Venken,K.,Rummens,J.-L.,Hensen,K.,VanWijmeersch,B.,andStinissen,P.(2010).Haplotype4ofthemultiplesclerosis-associatedinterleukin-7receptoralphageneinfluencesthefrequencyofrecentthymicemigrants.GenesImmun.11,326–333.Chassoux,D.M.,Linares-Cruz,L.G.,Bazin,H.,andStanislawski,M.(1988).K-cell-mediatedcytotoxicityinducedwithratmonoclonalantibodies.I.Antibodiesofvariousisotypesdifferintheirabilitytoinducecytotoxicitymediatedbyratandhumaneffectors.Immunology65,623–628.Chothia,C.,andLesk,A.M.(1987).Canonicalstructuresforthehypervariableregionsofimmunoglobulins.J.Mol.Biol.196,901–917.Deininger,P.(1990).Molecularcloning:Alaboratorymanual:2nded.EditedbyJ.Sambrook,E.F.Fritsch,andT.Maniatis.ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY,1989(in3volumes).Anal.Biochem.186,182–183.Delves,P.J.,Martin,S.J.,Burton,D.R.,andRoitt,I.M.(2011).Roitt’sEssentialImmunology(JohnWiley&Sons).Denucci,C.C.,Mitchell,J.S.,andShimizu,Y.(2009).IntegrinfunctioninT-cellhomingtolymphoidandnonlymphoidsites:gettingthereandstayingthere.Crit.Rev.Immunol.29,87–109.Dustin,M.L.,andShaw,A.S.(1999).Costimulation:buildinganimmunologicalsynapse.Science283,649–650.EdwardG.Routledge,S.D.G.(1993).Reshapingantibodiesfortherapy.13–44.Flavell,D.J.,Warnes,S.L.,Bryson,C.J.,Field,S.A.,Noss,A.L.,Packham,G.,andFlavell,S.U.(2006).Theanti-CD20antibodyrituximabaugmentstheimmunospecifictherapeuticeffectivenessofananti-CD19immunotoxindirectedagainsthumanB-celllymphoma.Br.J.Haematol.134,157–170.Gaseitsiwe,S.,Valentini,D.,Mahdavifar,S.,Reilly,M.,Ehrnst,A.,andMaeurer,M.(2010).Peptidemicroarray-basedidentificationofMycobacteriumtuberculosisepitopebindingtoHLA-DRB1*0101,DRB1*1501,andDRB1*0401.Clin.VaccineImmunol.CVI17,168–175.Gorfu,G.,Rivera-Nieves,J.,andLey,K.(2009).Roleofbeta7integrinsinintestinallymphocytehomingandretention.Curr.Mol.Med.9,836–850.Grakoui,A.,Bromley,S.K.,Sumen,C.,Davis,M.M.,Shaw,A.S.,Allen,P.M.,andDustin,M.L.(1999).Theimmunologicalsynapse:amolecularmachinecontrollingTcellactivation.Science285,221–227.Haas,J.,Korporal,M.,Schwarz,A.,Balint,B.,andWildemann,B.(2011).Theinterleukin-7receptorαchaincontributestoalteredhomeostasisofregulatoryTcellsinmultiplesclerosis.Eur.J.Immunol.41,845–853.Haudebourg,T.,Poirier,N.,andVanhove,B.(2009).DepletingT-cellsubpopulationsinorgantransplantation.Transpl.Int.Off.J.Eur.Soc.OrganTransplant.22,509–518.He,R.,andGeha,R.S.(2010).Thymicstromallymphopoietin.Ann.N.Y.Acad.Sci.1183,13–24.Henriques,C.M.,Rino,J.,Nibbs,R.J.,Graham,G.J.,andBarata,J.T.(2010).IL-7inducesrapidclathrin-mediatedinternalizationandJAK3-dependentdegradationofIL-7RalphainTcells.Blood115,3269–3277.VonHorsten,H.H.,Ogorek,C.,Blanchard,V.,Demmler,C.,Giese,C.,Winkler,K.,Kaup,M.,Berger,M.,Jordan,I.,andSandig,V.(2010).Productionofnon-fucosylatedantibodiesbyco-expressionofheterologousGDP-6-deoxy-D-lyxo-4-hexulosereductase.Glycobiology20,1607–1618.Inaba,K.,Inaba,M.,Witmer-Pack,M.,Hatchcock,K.,Hodes,R.,andSteinman,R.M.(1995).ExpressionofB7costimulatormoleculesonmousedendriticcells.Adv.Exp.Med.Biol.378,65–70.Jariwala,S.P.,Abrams,E.,Benson,A.,Fodeman,J.,andZheng,T.(2011).Theroleofthymicstromallymphopoietinintheimmunopathogenesisofatopicdermatitis.Clin.Exp.AllergyJ.Br.Soc.AllergyClin.Immunol.41,1515–1520.Kabat,E.A.,Wu,T.T.,Reid-Miller,M.,Perry,H.M.andGottesman,K.S.(1992)SequencesofProteinsofImmunologicalInterest(DIANEpublishing,1992).Kern,B.,Kraynov,E.,Lee,L.-F.,Ray,R.(2013).Receptoroccupancyandinternalizationofananti-IL-7receptorantibody.Cytokine63,276-277.Kern,B.,Li,W.,Bono,C.,Lee,L.-F.,andKraynov,E.(2015).ReceptoroccupancyandblockingofSTAT5signalingbyananti-IL-7receptorαantibodyincynomolgusmonkeys.CytometryBClin.Cytom.Krehenbrink,M.,Chami,M.,Guilvout,I.,Alzari,P.M.,PécorariF.,PugsleyA.P.(2008).Artificialbindingproteins(Affitins)asprobesforconformationalchangesinsecretinPulD.JMolBiol.2008Nov28.Lefranc,M.-P.,Giudicelli,V.,Ginestoux,C.,Bodmer,J.,Müller,W.,Bontrop,R.,Lemaitre,M.,Malik,A.,Barbié,V.,andChaume,D.(1999).IMGT,theinternationalImMunoGeneTicsdatabase.NucleicAcidsRes.27,209–212.Lei,L.,Zhang,Y.,Yao,W.,Kaplan,M.H.,andZhou,B.(2011).ThymicStromalLymphopoietinInterfereswithAirwayTolerancebySuppressingtheGenerationofAntigen-SpecificRegulatoryTCells.J.Immunol.186,2254–2261.Luo,H.,Wu,Z.,Qi,S.,Jin,W.,Han,B.,Wu,J.(2011).Ephrinb1andEphrinb2areassociatedwithinterleukin-7receptorαandretarditsinternalizationfromthecellsurface.JBiolChem.2011Dec30;286(52):44976-87.Martin,A.C.R.(2001).ProteinSequenceandStructureAnalysisofAntibodyVariableDomains.InAntibodyEngineering,D.R.Kontermann,andD.S.Dübel,eds.(SpringerBerlinHeidelberg),pp.422–439.Mazzucchelli,R.,Hixon,J.A.,Spolski,R.,Chen,X.,Li,W.Q.,Hall,V.L.,Willette-Brown,J.,Hurwitz,A.A.,Leonard,W.J.,andDurum,S.K.(2008).DevelopmentofregulatoryTcellsrequiresIL-7RalphastimulationbyIL-7orTSLP.Blood112,3283–3292.McElroy,C.A.,Dohm,J.A.,andWalsh,S.T.R.(2009).StructuralandbiophysicalstudiesofthehumanIL-7/IL-7Ralphacomplex.Struct.Lond.Engl.199317,54–65.McElroy,C.A.,Holland,P.J.,Zhao,P.,Lim,J.-M.,Wells,L.,Eisenstein,E.,andWalsh,S.T.R.(2012).Structuralreorganizationoftheinterleukin-7signalingcomplex.Proc.Natl.Acad.Sci.U.S.A.109,2503–2508Michel,L.,Berthelot,L.,Pettré,S.,Wiertlewski,S.,Lefrère,F.,Braudeau,C.,Brouard,S.,Soulillou,J.-P.,andLaplaud,D.-A.(2008).Patientswithrelapsing-remittingmultiplesclerosishavenormalTregfunctionwhencellsexpressingIL-7receptoralpha-chainareexcludedfromtheanalysis.J.Clin.Invest.118,3411–3419.Nancey,S.,Hamzaoui,N.,Moussata,D.,Graber,I.,Bienvenu,J.,andFlourie,B.(2008).Seruminterleukin-6,solubleinterleukin-6receptorandCrohn’sdiseaseactivity.Dig.Dis.Sci.53,242–247.Niederfellner,G.,Lammens,A.,Mundigl,O.,Georges,G.J.,Schaefer,W.,Schwaiger,M.,Franke,A.,Wiechmann,K.,Jenewein,S.,Slootstra,J.W.,etal.(2011).EpitopecharacterizationandcrystalstructureofGA101provideinsightsintothemolecularbasisfortypeI/IIdistinctionofCD20antibodies.Blood118,358–367.Olivier,S.,Jacoby,M.,Brillon,C.,Bouletreau,S.,Mollet,T.,Nerriere,O.,Angel,A.,Danet,S.,Souttou,B.,Guehenneux,F.,etal.(2010).EB66cellline,aduckembryonicstemcell-derivedsubstratefortheindustrialproductionoftherapeuticmonoclonalantibodieswithenhancedADCCactivity.mAbs2,405–415.Olkhanud,P.B.,Rochman,Y.,Bodogai,M.,Malchinkhuu,E.,Wejksza,K.,Xu,M.,Gress,R.E.,Hesdorffer,C.,Leonard,W.J.,andBiragyn,A.(2011).Thymicstromallymphopoietinisakeymediatorofbreastcancerprogression.J.Immunol.Baltim.Md1950186,5656–5662.VanOosterhout,Y.V.,vanEmst,J.L.,Bakker,H.H.,Preijers,F.W.,Schattenberg,A.V.,Ruiter,D.J.,Evers,S.,Koopman,J.P.,anddeWitte,T.(2001).Productionofanti-CD3andanti-CD7ricinA-immunotoxinsforaclinicalpilotstudy.Int.J.Pharm.221,175–186.Papac,D.I.,Hoyes,J.,andTomer,K.B.(1994).Epitopemappingofthegastrin-releasingpeptide/anti-bombesinmonoclonalantibodycomplexbyproteolysisfollowedbymatrix-assistedlaserdesorptionionizationmassspectrometry.ProteinSci.3,1485–1492.Park,L.S.,Martin,U.,Garka,K.,Gliniak,B.,DiSanto,J.P.,Muller,W.,Largaespada,D.A.,Copeland,N.G.,Jenkins,N.A.,Farr,A.G.,etal.(2000).Cloningofthemurinethymicstromallymphopoietin(TSLP)receptor:Formationofafunctionalheteromericcomplexrequiresinterleukin7receptor.J.Exp.Med.192,659–670.Paus,D.,andWinter,G.(2006).Mappingepitopesandantigenicitybysite-directedmasking.Proc.Natl.Acad.Sci.U.S.A.103,9172–9177.Poirier,N.,Haudebourg,T.,Brignone,C.,Dilek,N.,Hervouet,J.,Minault,D.,Coulon,F.,deSilly,R.V.,Triebel,F.,Blancho,G.,etal.(2011).Antibody-mediateddepletionoflymphocyte-activationgene-3(LAG-3(+))-activatedTlymphocytespreventsdelayed-typehypersensitivityinnon-humanprimates.Clin.Exp.Immunol.164,265–274.Racapé,M.,Vanhove,B.,Soulillou,J.-P.,andBrouard,S.(2009).Interleukin7receptoralphaasapotentialtherapeutictargetintransplantation.Arch.Immunol.Ther.Exp.(Warsz.)57,253–261.Rader,C.,Cheresh,D.A.,andBarbas,C.F.(1998).Aphagedisplayapproachforrapidantibodyhumanization:designedcombinatorialVgenelibraries.Proc.Natl.Acad.Sci.U.S.A.95,8910–8915.Reche,P.A.,Soumelis,V.,Gorman,D.M.,Clifford,T.,LiuMr,null,Travis,M.,Zurawski,S.M.,Johnston,J.,Liu,Y.J.,Spits,H.,etal.(2001).Humanthymicstromallymphopoietinpreferentiallystimulatesmyeloidcells.J.Immunol.Baltim.Md1950167,336–343.Risberg,K.,Fodstad,.,andAndersson,Y.(2011).Synergisticanticancereffectsofthe9.2.27PEimmunotoxinandABT-737inmelanoma.PloSOne6,e24012.Roan,F.,Bell,B.D.,Stoklasek,T.A.,Kitajima,M.,Han,H.,andZiegler,S.F.(2012).Themultiplefacetsofthymicstromallymphopoietin(TSLP)duringallergicinflammationandbeyond.J.Leukoc.Biol.91,877–886.Rochman,Y.,Kashyap,M.,Robinson,G.W.,Sakamoto,K.,Gomez-Rodriguez,J.,Wagner,K.-U.,andLeonard,W.J.(2010).Thymicstromallymphopoietin-mediatedSTAT5phosphorylationviakinasesJAK1andJAK2revealsakeydifferencefromIL-7-inducedsignaling.Proc.Natl.Acad.Sci.U.S.A.107,19455–19460.Rosok,M.J.,Yelton,D.E.,Harris,L.J.,Bajorath,J.,K.E.,I.,Cruz,G.A.,Kristensson,K.,Lin,H.,Huse,W.D.,etal.(1996).AcombinatoriallibrarystrategyfortherapidhumanizationofanticarcinomaBR96Fab.J.Biol.Chem.271,22611–22618.Schlehuber,S.,Skerra,A.(2002).Tuningligandaffinity,specificity,andfoldingstabilityofanengineeredlipocalinvariant--aso-called'anticalin'--usingamolecularrandomapproach.BiophysChem.2002May2;96(2-3):213-28Shaw,A.S.,andDustin,M.L.(1997).MakingtheTcellreceptorgothedistance:atopologicalviewofTcellactivation.Immunity6,361–369.Shinohara,T.,Nemoto,Y.,Kanai,T.,Kameyama,K.,Okamoto,R.,Tsuchiya,K.,Nakamura,T.,Totsuka,T.,Ikuta,K.,andWatanabe,M.(2011).UpregulatedIL-7receptorαexpressiononcolitogenicmemoryCD4+Tcellsmayparticipateinthedevelopmentandpersistenceofchroniccolitis.J.Immunol.Baltim.Md1950186,2623–2632.Shochat,C.,Tal,N.,Bandapalli,O.R.,Palmi,C.,Ganmore,I.,teKronnie,G.,Cario,G.,Cazzaniga,G.,Kulozik,A.E.,Stanulla,M.,etal.(2011).Gain-of-functionmutationsininterleukin-7receptor-α(IL7R)inchildhoodacutelymphoblasticleukemias.J.Exp.Med.208,901–908.Skerra,A.(2008).Alternativebindingproteins:anticalins-harnessingthestructuralplasticityofthelipocalinligandpockettoengineernovelbindingactivities.FEBSJ.2008Jun;275(11):2677-83.doi:10.1111/j.1742-4658.2008.06439.x.Epub2008Apr24.Suckau,D.,J.,Karwath,G.,Schneider,K.,Casaretto,M.,Bitter-Suermann,D.,andPrzybylski,M.(1990).Molecularepitopeidentificationbylimitedproteolysisofanimmobilizedantigen-antibodycomplexandmassspectrometricpeptidemapping.Proc.Natl.Acad.Sci.U.S.A.87,9848–9852Taylor,B.C.,Zaph,C.,Troy,A.E.,Du,Y.,Guild,K.J.,Comeau,M.R.,andArtis,D.(2009).TSLPregulatesintestinalimmunityandinflammationinmousemodelsofhelminthinfectionandcolitis.J.Exp.Med.206,655–667.Teeling,J.L.,Mackus,W.J.M.,Wiegman,L.J.J.M.,vandenBrakel,J.H.N.,Beers,S.A.,French,R.R.,vanMeerten,T.,Ebeling,S.,Vink,T.,Slootstra,J.W.,etal.(2006).ThebiologicalactivityofhumanCD20monoclonalantibodiesislinkedtouniqueepitopesonCD20.J.Immunol.Baltim.Md1950177,362–371.Timmerman,P.,Puijk,W.C.,andMeloen,R.H.(2007).FunctionalreconstructionandsyntheticmimicryofaconformationalepitopeusingCLIPStechnology.J.Mol.Recognit.JMR20,283–299.Walsh,S.T.R.(2012).Structuralinsightsintothecommonγ-chainfamilyofcytokinesandreceptorsfromtheinterleukin-7pathway.Immunol.Rev.250,303–316.Watanabe,N.,Wang,Y.-H.,Lee,H.K.,Ito,T.,Wang,Y.-H.,Cao,W.,andLiu,Y.-J.(2005a).Hassall’scorpusclesinstructdendriticcellstoinduceCD4+CD25+regulatoryTcellsinhumanthymus.Nature436,1181–1185.Watanabe,N.,Hanabuchi,S.,Marloie-Provost,M.-A.,Antonenko,S.,Liu,Y.-J.,andSoumelis,V.(2005b).HumanTSLPpromotesCD40ligand-inducedIL-12productionbymyeloiddendriticcellsbutmaintainstheirTh2primingpotential.Blood105,4749–4751.Ye,J.,Ma,N.,Madden,T.L.,andOstell,J.M.(2013).IgBLAST:animmunoglobulinvariabledomainsequenceanalysistool.NucleicAcidsRes.41,W34–W40.Ying,S.,O’Connor,B.,Ratoff,J.,Meng,Q.,Fang,C.,Cousins,D.,Zhang,G.,Gu,S.,Gao,Z.,Shamji,B.,etal.(2008).Expressionandcellularprovenanceofthymicstromallymphopoietinandchemokinesinpatientswithsevereasthmaandchronicobstructivepulmonarydisease.J.Immunol.Baltim.Md1950181,2790–2798.Zhi,K.,Li,M.,Zhang,X.,Gao,Z.,Bai,J.,Wu,Y.,Zhou,S.,Li,M.,andQu,L.(2014).α4β7Integrin(LPAM-1)isupregulatedatatheroscleroticlesionsandisinvolvedinatherosclerosisprogression.Cell.Physiol.Biochem.Int.J.Exp.Cell.Physiol.Biochem.Pharmacol.33,1876–1887.Zhong,J.,Sharma,J.,Raju,R.,Palapetta,S.M.,Prasad,T.S.K.,Huang,T.-C.,Yoda,A.,Tyner,J.W.,vanBodegom,D.,Weinstock,D.M.,etal.(2014).TSLPsignalingpathwaymap:aplatformforanalysisofTSLP-mediatedsignaling.DatabaseJ.Biol.DatabasesCuration2014,bau007.序列表<110>Effimune<120>抗CD127的抗体<130>B10744B<150>US62/010117<151>2014-06-10<150>EP15305078.6<151>2015-01-23<160>132<170>PatentInversion3.5<210>1<211>1359<212>DNA<213>人工序列<220><223>合成序列<400>1gcggtgcagctggtggagtctgggggaggcctagtgcagcctggagggtccctgaaactc60tcctgtgcagtctcaggattcactctcagtgactattacatggcctgggtccgccaggct120ccaaagaagggtctggaatgggtcgcaaccattagtgccagtgggctcagaacttactat180ccagactccgtgaagggccgcttcactatctccagagatgatgcaaaaaggagcctcttc240ctgcaaatgaccagtctgaagtctgaggacacggccacttattactgtgcaagaccgatg300tctgcacactatggttttaactactttgattactggggccaaggagtcatggtcacagtc360tcctcagctagcaccaagggcccatcggtcttccccctggcaccctcctccaagagcacc420tctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacg480gtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacag540tcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacc600cagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagtt660gagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctg720gggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccgg780acccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttc840aactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcag900tacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaat960ggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgcgaaaacc1020atctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgg1080gaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagc1140gacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcct1200cccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagc1260aggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccac1320tacacgcagaagagcctctccctgtctccgggtaaatga1359<210>2<211>452<212>PRT<213>人工序列<220><223>合成序列<400>2AlaValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly151015SerLeuLysLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpValArgGlnAlaProLysLysGlyLeuGluTrpVal354045AlaThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAspAlaLysArgSerLeuPhe65707580LeuGlnMetThrSerLeuLysSerGluAspThrAlaThrTyrTyrCys859095AlaArgProMetSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyValMetValThrValSerSerAlaSerThrLysGlyPro115120125SerValPheProLeuAlaProSerSerLysSerThrSerGlyGlyThr130135140AlaAlaLeuGlyCysLeuValLysAspTyrPheProGluProValThr145150155160ValSerTrpAsnSerGlyAlaLeuThrSerGlyValHisThrPhePro165170175AlaValLeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThr180185190ValProSerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsn195200205HisLysProSerAsnThrLysValAspLysLysValGluProLysSer210215220CysAspLysThrHisThrCysProProCysProAlaProGluLeuLeu225230235240GlyGlyProSerValPheLeuPheProProLysProLysAspThrLeu245250255MetIleSerArgThrProGluValThrCysValValValAspValSer260265270HisGluAspProGluValLysPheAsnTrpTyrValAspGlyValGlu275280285ValHisAsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThr290295300TyrArgValValSerValLeuThrValLeuHisGlnAspTrpLeuAsn305310315320GlyLysGluTyrLysCysLysValSerAsnLysAlaLeuProAlaPro325330335IleAlaLysThrIleSerLysAlaLysGlyGlnProArgGluProGln340345350ValTyrThrLeuProProSerArgGluGluMetThrLysAsnGlnVal355360365SerLeuThrCysLeuValLysGlyPheTyrProSerAspIleAlaVal370375380GluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrPro385390395400ProValLeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThr405410415ValAspLysSerArgTrpGlnGlnGlyAsnValPheSerCysSerVal420425430MetHisGluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeu435440445SerProGlyLys450<210>3<211>645<212>DNA<213>人工序列<220><223>合成序列<400>3gacatccagatgacacagtctccagcttccctgtctgcatctctgggagaaactgtcacc60atcgaatgtcgaacaagtgaggacatttacaatggtttagcatggtatcagcagaagcca120gggaaatctcctcagctcctggtctatagtgcaaatagcttacatattggggtcccatca180cggttcagtggcagtggatctggtacacagtattctctcaagataaacagcctgcaattt240gaagatgtcgcaagttatttctgtcaacagtattacgattatccgctcgcgttcggttct300gggaccaagctggagatcaaacggacggtggctgcaccatctgtcttcatcttcccgcca360tctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctat420cccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccag480gagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacg540ctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggc600ctgagctcgcccgtcacaaagagcttcaacaggggagagtgttag645<210>4<211>214<212>PRT<213>人工序列<220><223>合成序列<400>4AspIleGlnMetThrGlnSerProAlaSerLeuSerAlaSerLeuGly151015GluThrValThrIleGluCysArgThrSerGluAspIleTyrAsnGly202530LeuAlaTrpTyrGlnGlnLysProGlyLysSerProGlnLeuLeuVal354045TyrSerAlaAsnSerLeuHisIleGlyValProSerArgPheSerGly505560SerGlySerGlyThrGlnTyrSerLeuLysIleAsnSerLeuGlnPhe65707580GluAspValAlaSerTyrPheCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlySerGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>5<211>1350<212>DNA<213>人工序列<220><223>合成序列<400>5gcggtgcagctggtggagtctgggggaggcctagtgcagcctggagggtccctgaaactc60tcctgtgcagtctcaggattcactctcagtgactattacatggcctgggtccgccaggct120ccaaagaagggtctggaatgggtcgcaaccattagtgccagtgggctcagaacttactat180ccagactccgtgaagggccgcttcactatctccagagatgatgcaaaaaggagcctcttc240ctgcaaatgaccagtctgaagtctgaggacacggccacttattactgtgcaagaccgatg300tctgcacactatggttttaactactttgattactggggccaaggagtcatggtcacagtc360tcctcagctagcaccaagggcccatcggtcttccccctggcgccctgctccaggagcacc420tccgagagcacagccgccctgggctgcctggtcaaggactacttccccgaaccggtgacg480gtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacag540tcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacg600aagacctacacctgcaacgtagatcacaagcccagcaacaccaaggtggacaagagagtt660gagtccaaatatggtcccccatgcccaccatgcccagcacctgagttcctggggggacca720tcagtcttcctgttccccccaaaacccaaggacactctcatgatctcccggacccctgag780gtcacgtgcgtggtggtggacgtgagccaggaagaccccgaggtccagttcaactggtac840gtggatggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagttcaacagc900acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaacggcaaggag960tacaagtgcaaggtctccaacaaaggcctcccgtcctccatcgagaaaaccatctccaaa1020gccaaagggcagccccgagagccacaggtgtacaccctgcccccatcccaggaggagatg1080accaagaaccaggtcagcctgacctgcctggtcaaaggcttctaccccagcgacatcgcc1140gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1200gactccgacggctccttcttcctctacagcaggctaaccgtggacaagagcaggtggcag1260gaggggaatgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacag1320aagagcctctccctgtctccgggtaaatga1350<210>6<211>449<212>PRT<213>人工序列<220><223>合成序列<400>6AlaValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly151015SerLeuLysLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpValArgGlnAlaProLysLysGlyLeuGluTrpVal354045AlaThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAspAlaLysArgSerLeuPhe65707580LeuGlnMetThrSerLeuLysSerGluAspThrAlaThrTyrTyrCys859095AlaArgProMetSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyValMetValThrValSerSerAlaSerThrLysGlyPro115120125SerValPheProLeuAlaProCysSerArgSerThrSerGluSerThr130135140AlaAlaLeuGlyCysLeuValLysAspTyrPheProGluProValThr145150155160ValSerTrpAsnSerGlyAlaLeuThrSerGlyValHisThrPhePro165170175AlaValLeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThr180185190ValProSerSerSerLeuGlyThrLysThrTyrThrCysAsnValAsp195200205HisLysProSerAsnThrLysValAspLysArgValGluSerLysTyr210215220GlyProProCysProProCysProAlaProGluPheLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerGlnGluAsp260265270ProGluValGlnPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnPheAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysGlyLeuProSerSerIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerGlnGluGluMetThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerArgLeuThrValAspLys405410415SerArgTrpGlnGluGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>7<211>645<212>DNA<213>人工序列<220><223>合成序列<400>7gacatccagatgacacagtctccagcttccctgtctgcatctctgggagaaactgtcacc60atcgaatgtcgaacaagtgaggacatttacaatggtttagcatggtatcagcagaagcca120gggaaatctcctcagctcctggtctatagtgcaaatagcttacatattggggtcccatca180cggttcagtggcagtggatctggtacacagtattctctcaagataaacagcctgcaattt240gaagatgtcgcaagttatttctgtcaacagtattacgattatccgctcgcgttcggttct300gggaccaagctggagatcaaacggacggtggctgcaccatctgtcttcatcttcccgcca360tctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctat420cccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccag480gagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacg540ctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggc600ctgagctcgcccgtcacaaagagcttcaacaggggagagtgttag645<210>8<211>214<212>PRT<213>人工序列<220><223>合成序列<400>8AspIleGlnMetThrGlnSerProAlaSerLeuSerAlaSerLeuGly151015GluThrValThrIleGluCysArgThrSerGluAspIleTyrAsnGly202530LeuAlaTrpTyrGlnGlnLysProGlyLysSerProGlnLeuLeuVal354045TyrSerAlaAsnSerLeuHisIleGlyValProSerArgPheSerGly505560SerGlySerGlyThrGlnTyrSerLeuLysIleAsnSerLeuGlnPhe65707580GluAspValAlaSerTyrPheCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlySerGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>9<211>27<212>DNA<213>人工序列<220><223>合成序列<400>9ttcactctcagtgactattacatggcc27<210>10<211>9<212>PRT<213>人工序列<220><223>合成序列<400>10PheThrLeuSerAspTyrTyrMetAla15<210>11<211>51<212>DNA<213>人工序列<220><223>合成序列<400>11accattagtgccagtgggctcagaacttactatccagactccgtgaagggc51<210>12<211>17<212>PRT<213>人工序列<220><223>合成序列<400>12ThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerValLys151015Gly<210>13<211>39<212>DNA<213>人工序列<220><223>合成序列<400>13ccgatgtctgcacactatggttttaactactttgattac39<210>14<211>13<212>PRT<213>人工序列<220><223>合成序列<400>14ProMetSerAlaHisTyrGlyPheAsnTyrPheAspTyr1510<210>15<211>33<212>DNA<213>人工序列<220><223>合成序列<400>15cgaacaagtgaggacatttacaatggtttagca33<210>16<211>11<212>PRT<213>人工序列<220><223>合成序列<400>16ArgThrSerGluAspIleTyrAsnGlyLeuAla1510<210>17<211>21<212>DNA<213>人工序列<220><223>合成序列<400>17agtgcaaatagcttacatatt21<210>18<211>7<212>PRT<213>人工序列<220><223>合成序列<400>18SerAlaAsnSerLeuHisIle15<210>19<211>27<212>DNA<213>人工序列<220><223>合成序列<400>19caacagtattacgattatccgctcgcg27<210>20<211>9<212>PRT<213>人工序列<220><223>合成序列<400>20GlnGlnTyrTyrAspTyrProLeuAla15<210>21<211>366<212>DNA<213>人工序列<220><223>合成序列<400>21gcggtgcagctggtggagtctgggggaggcctagtgcagcctggagggtccctgaaactc60tcctgtgcagtctcaggattcactctcagtgactattacatggcctgggtccgccaggct120ccaaagaagggtctggaatgggtcgcaaccattagtgccagtgggctcagaacttactat180ccagactccgtgaagggccgcttcactatctccagagatgatgcaaaaaggagcctcttc240ctgcaaatgaccagtctgaagtctgaggacacggccacttattactgtgcaagaccgatg300tctgcacactatggttttaactactttgattactggggccaaggagtcatggtcacagtc360tcctca366<210>22<211>122<212>PRT<213>人工序列<220><223>合成序列<400>22AlaValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly151015SerLeuLysLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpValArgGlnAlaProLysLysGlyLeuGluTrpVal354045AlaThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAspAlaLysArgSerLeuPhe65707580LeuGlnMetThrSerLeuLysSerGluAspThrAlaThrTyrTyrCys859095AlaArgProMetSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyValMetValThrValSerSer115120<210>23<211>324<212>DNA<213>人工序列<220><223>合成序列<400>23gacatccagatgacacagtctccagcttccctgtctgcatctctgggagaaactgtcacc60atcgaatgtcgaacaagtgaggacatttacaatggtttagcatggtatcagcagaagcca120gggaaatctcctcagctcctggtctatagtgcaaatagcttacatattggggtcccatca180cggttcagtggcagtggatctggtacacagtattctctcaagataaacagcctgcaattt240gaagatgtcgcaagttatttctgtcaacagtattacgattatccgctcgcgttcggttct300gggaccaagctggagatcaaacgg324<210>24<211>108<212>PRT<213>人工序列<220><223>合成序列<400>24AspIleGlnMetThrGlnSerProAlaSerLeuSerAlaSerLeuGly151015GluThrValThrIleGluCysArgThrSerGluAspIleTyrAsnGly202530LeuAlaTrpTyrGlnGlnLysProGlyLysSerProGlnLeuLeuVal354045TyrSerAlaAsnSerLeuHisIleGlyValProSerArgPheSerGly505560SerGlySerGlyThrGlnTyrSerLeuLysIleAsnSerLeuGlnPhe65707580GluAspValAlaSerTyrPheCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlySerGlyThrLysLeuGluIleLysArg100105<210>25<211>993<212>DNA<213>人工序列<220><223>合成序列<400>25gctagcaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctggg60ggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcg120tggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctca180ggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacc240tacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagttgagccc300aaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctgggggga360ccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccct420gaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactgg480tacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaac540agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag600gagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgcgaaaaccatctcc660aaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggag720atgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatc780gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg840ctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtgg900cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacg960cagaagagcctctccctgtctccgggtaaatga993<210>26<211>330<212>PRT<213>人工序列<220><223>合成序列<400>26AlaSerThrLysGlyProSerValPheProLeuAlaProSerSerLys151015SerThrSerGlyGlyThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrGlnThr65707580TyrIleCysAsnValAsnHisLysProSerAsnThrLysValAspLys859095LysValGluProLysSerCysAspLysThrHisThrCysProProCys100105110ProAlaProGluLeuLeuGlyGlyProSerValPheLeuPheProPro115120125LysProLysAspThrLeuMetIleSerArgThrProGluValThrCys130135140ValValValAspValSerHisGluAspProGluValLysPheAsnTrp145150155160TyrValAspGlyValGluValHisAsnAlaLysThrLysProArgGlu165170175GluGlnTyrAsnSerThrTyrArgValValSerValLeuThrValLeu180185190HisGlnAspTrpLeuAsnGlyLysGluTyrLysCysLysValSerAsn195200205LysAlaLeuProAlaProIleAlaLysThrIleSerLysAlaLysGly210215220GlnProArgGluProGlnValTyrThrLeuProProSerArgGluGlu225230235240MetThrLysAsnGlnValSerLeuThrCysLeuValLysGlyPheTyr245250255ProSerAspIleAlaValGluTrpGluSerAsnGlyGlnProGluAsn260265270AsnTyrLysThrThrProProValLeuAspSerAspGlySerPhePhe275280285LeuTyrSerLysLeuThrValAspLysSerArgTrpGlnGlnGlyAsn290295300ValPheSerCysSerValMetHisGluAlaLeuHisAsnHisTyrThr305310315320GlnLysSerLeuSerLeuSerProGlyLys325330<210>27<211>984<212>DNA<213>人工序列<220><223>合成序列<400>27gctagcaccaagggcccatcggtcttccccctggcgccctgctccaggagcacctccgag60agcacagccgccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcg120tggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctca180ggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacgaagacc240tacacctgcaacgtagatcacaagcccagcaacaccaaggtggacaagagagttgagtcc300aaatatggtcccccatgcccaccatgcccagcacctgagttcctggggggaccatcagtc360ttcctgttccccccaaaacccaaggacactctcatgatctcccggacccctgaggtcacg420tgcgtggtggtggacgtgagccaggaagaccccgaggtccagttcaactggtacgtggat480ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagttcaacagcacgtac540cgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaacggcaaggagtacaag600tgcaaggtctccaacaaaggcctcccgtcctccatcgagaaaaccatctccaaagccaaa660gggcagccccgagagccacaggtgtacaccctgcccccatcccaggaggagatgaccaag720aaccaggtcagcctgacctgcctggtcaaaggcttctaccccagcgacatcgccgtggag780tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc840gacggctccttcttcctctacagcaggctaaccgtggacaagagcaggtggcaggagggg900aatgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacagaagagc960ctctccctgtctccgggtaaatga984<210>28<211>327<212>PRT<213>人工序列<220><223>合成序列<400>28AlaSerThrLysGlyProSerValPheProLeuAlaProCysSerArg151015SerThrSerGluSerThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrLysThr65707580TyrThrCysAsnValAspHisLysProSerAsnThrLysValAspLys859095ArgValGluSerLysTyrGlyProProCysProProCysProAlaPro100105110GluPheLeuGlyGlyProSerValPheLeuPheProProLysProLys115120125AspThrLeuMetIleSerArgThrProGluValThrCysValValVal130135140AspValSerGlnGluAspProGluValGlnPheAsnTrpTyrValAsp145150155160GlyValGluValHisAsnAlaLysThrLysProArgGluGluGlnPhe165170175AsnSerThrTyrArgValValSerValLeuThrValLeuHisGlnAsp180185190TrpLeuAsnGlyLysGluTyrLysCysLysValSerAsnLysGlyLeu195200205ProSerSerIleGluLysThrIleSerLysAlaLysGlyGlnProArg210215220GluProGlnValTyrThrLeuProProSerGlnGluGluMetThrLys225230235240AsnGlnValSerLeuThrCysLeuValLysGlyPheTyrProSerAsp245250255IleAlaValGluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLys260265270ThrThrProProValLeuAspSerAspGlySerPhePheLeuTyrSer275280285ArgLeuThrValAspLysSerArgTrpGlnGluGlyAsnValPheSer290295300CysSerValMetHisGluAlaLeuHisAsnHisTyrThrGlnLysSer305310315320LeuSerLeuSerProGlyLys325<210>29<211>321<212>DNA<213>人工序列<220><223>合成序列<400>29acggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctgga60actgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtgg120aaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagc180aaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaa240cacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagc300ttcaacaggggagagtgttag321<210>30<211>106<212>PRT<213>人工序列<220><223>合成序列<400>30ThrValAlaAlaProSerValPheIlePheProProSerAspGluGln151015LeuLysSerGlyThrAlaSerValValCysLeuLeuAsnAsnPheTyr202530ProArgGluAlaLysValGlnTrpLysValAspAsnAlaLeuGlnSer354045GlyAsnSerGlnGluSerValThrGluGlnAspSerLysAspSerThr505560TyrSerLeuSerSerThrLeuThrLeuSerLysAlaAspTyrGluLys65707580HisLysValTyrAlaCysGluValThrHisGlnGlyLeuSerSerPro859095ValThrLysSerPheAsnArgGlyGluCys100105<210>31<211>330<212>PRT<213>人工序列<220><223>合成序列<400>31AlaSerThrLysGlyProSerValPheProLeuAlaProSerSerLys151015SerThrSerGlyGlyThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrGlnThr65707580TyrIleCysAsnValAsnHisLysProSerAsnThrLysValAspLys859095LysValGluProLysSerCysAspLysThrHisThrCysProProCys100105110ProAlaProGluLeuLeuGlyGlyProSerValPheLeuPheProPro115120125LysProLysAspThrLeuMetIleSerArgThrProGluValThrCys130135140ValValValAspValSerHisGluAspProGluValLysPheAsnTrp145150155160TyrValAspGlyValGluValHisAsnAlaLysThrLysProArgGlu165170175GluGlnTyrAsnSerThrTyrArgValValSerValLeuThrValLeu180185190HisGlnAspTrpLeuAsnGlyLysGluTyrLysCysLysValSerAsn195200205LysAlaLeuProAlaProIleGluLysThrIleSerLysAlaLysGly210215220GlnProArgGluProGlnValTyrThrLeuProProSerArgAspGlu225230235240LeuThrLysAsnGlnValSerLeuThrCysLeuValLysGlyPheTyr245250255ProSerAspIleAlaValGluTrpGluSerAsnGlyGlnProGluAsn260265270AsnTyrLysThrThrProProValLeuAspSerAspGlySerPhePhe275280285LeuTyrSerLysLeuThrValAspLysSerArgTrpGlnGlnGlyAsn290295300ValPheSerCysSerValMetHisGluAlaLeuHisAsnHisTyrThr305310315320GlnLysSerLeuSerLeuSerProGlyLys325330<210>32<211>326<212>PRT<213>人工序列<220><223>合成序列<400>32AlaSerThrLysGlyProSerValPheProLeuAlaProCysSerArg151015SerThrSerGluSerThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerAsnPheGlyThrGlnThr65707580TyrThrCysAsnValAspHisLysProSerAsnThrLysValAspLys859095ThrValGluArgLysCysCysValGluCysProProCysProAlaPro100105110ProValAlaGlyProSerValPheLeuPheProProLysProLysAsp115120125ThrLeuMetIleSerArgThrProGluValThrCysValValValAsp130135140ValSerHisGluAspProGluValGlnPheAsnTrpTyrValAspGly145150155160ValGluValHisAsnAlaLysThrLysProArgGluGluGlnPheAsn165170175SerThrPheArgValValSerValLeuThrValValHisGlnAspTrp180185190LeuAsnGlyLysGluTyrLysCysLysValSerAsnLysGlyLeuPro195200205AlaProIleGluLysThrIleSerLysThrLysGlyGlnProArgGlu210215220ProGlnValTyrThrLeuProProSerArgGluGluMetThrLysAsn225230235240GlnValSerLeuThrCysLeuValLysGlyPheTyrProSerAspIle245250255SerValGluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLysThr260265270ThrProProMetLeuAspSerAspGlySerPhePheLeuTyrSerLys275280285LeuThrValAspLysSerArgTrpGlnGlnGlyAsnValPheSerCys290295300SerValMetHisGluAlaLeuHisAsnHisTyrThrGlnLysSerLeu305310315320SerLeuSerProGlyLys325<210>33<211>327<212>PRT<213>人工序列<220><223>合成序列<400>33AlaSerThrLysGlyProSerValPheProLeuAlaProCysSerArg151015SerThrSerGluSerThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrLysThr65707580TyrThrCysAsnValAspHisLysProSerAsnThrLysValAspLys859095ArgValGluSerLysTyrGlyProProCysProSerCysProAlaPro100105110GluPheLeuGlyGlyProSerValPheLeuPheProProLysProLys115120125AspThrLeuMetIleSerArgThrProGluValThrCysValValVal130135140AspValSerGlnGluAspProGluValGlnPheAsnTrpTyrValAsp145150155160GlyValGluValHisAsnAlaLysThrLysProArgGluGluGlnPhe165170175AsnSerThrTyrArgValValSerValLeuThrValLeuHisGlnAsp180185190TrpLeuAsnGlyLysGluTyrLysCysLysValSerAsnLysGlyLeu195200205ProSerSerIleGluLysThrIleSerLysAlaLysGlyGlnProArg210215220GluProGlnValTyrThrLeuProProSerGlnGluGluMetThrLys225230235240AsnGlnValSerLeuThrCysLeuValLysGlyPheTyrProSerAsp245250255IleAlaValGluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLys260265270ThrThrProProValLeuAspSerAspGlySerPhePheLeuTyrSer275280285ArgLeuThrValAspLysSerArgTrpGlnGluGlyAsnValPheSer290295300CysSerValMetHisGluAlaLeuHisAsnHisTyrThrGlnLysSer305310315320LeuSerLeuSerLeuGlyLys325<210>34<211>326<212>PRT<213>人工序列<220><223>合成序列<400>34AlaGluThrThrAlaProSerValTyrProLeuAlaProGlyThrAla151015LeuLysSerAsnSerMetValThrLeuGlyCysLeuValLysGlyTyr202530PheProGluProValThrValThrTrpAsnSerGlyAlaLeuSerSer354045GlyValHisThrPheProAlaValLeuGlnSerGlyLeuTyrThrLeu505560ThrSerSerValThrValProSerSerThrTrpProSerGlnThrVal65707580ThrCysAsnValAlaHisProAlaSerSerThrLysValAspLysLys859095IleValProArgAsnCysGlyGlyAspCysLysProCysIleCysThr100105110GlySerGluValSerSerValPheIlePheProProLysProLysAsp115120125ValLeuThrIleThrLeuThrProLysValThrCysValValValAsp130135140IleSerGlnAspAspProGluValHisPheSerTrpPheValAspAsp145150155160ValGluValHisThrAlaGlnThrArgProProGluGluGlnPheAsn165170175SerThrPheArgSerValSerGluLeuProIleLeuHisGlnAspTrp180185190LeuAsnGlyArgThrPheArgCysLysValThrSerAlaAlaPhePro195200205SerProIleGluLysThrIleSerLysProGluGlyArgThrGlnVal210215220ProHisValTyrThrMetSerProThrLysGluGluMetThrGlnAsn225230235240GluValSerIleThrCysMetValLysGlyPheTyrProProAspIle245250255TyrValGluTrpGlnMetAsnGlyGlnProGlnGluAsnTyrLysAsn260265270ThrProProThrMetAspThrAspGlySerTyrPheLeuTyrSerLys275280285LeuAsnValLysLysGluLysTrpGlnGlnGlyAsnThrPheThrCys290295300SerValLeuHisGluGlyLeuHisAsnHisHisThrGluLysSerLeu305310315320SerHisSerProGlyLys325<210>35<211>366<212>DNA<213>人工序列<220><223>合成序列<400>35caggtgcagctggtcgaatctggagggggtctggtcaagcccggagggtcactgcgtctg60tcatgcgccgtctcagggttcacactgtctgactactatatggcttgggtgcgacaggca120ccaggcaagggactggagtgggtcgccactatctctgctagtggcctgaggacctactat180cctgatagtgtgaagggaaggttcacaatttcacgggacgatgcaaaaaactccctgtac240ctgcagatgaatagcctgagagcagaagacaccgccgtctactattgcgcccgcccaatg300agcgctcactatggcttcaactactttgattattgggggcagggtaccctggtgacagtc360tccagc366<210>36<211>122<212>PRT<213>人工序列<220><223>合成序列<400>36GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045AlaThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAspAlaLysAsnSerLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaArgProMetSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyThrLeuValThrValSerSer115120<210>37<211>366<212>DNA<213>人工序列<220><223>合成序列<400>37caggtgcagctggtcgaatctggggggggactggtcaaacccggaggctcactgcgtctg60tcatgtgccgtctcaggctttacactgagcgactactatatggcatggatccgacaggca120ccaggcaagggactggagtgggtgtctactatttctgccagtggcctgaggacctactat180cctgacagtgtcaagggaaggttcacaatctcacgggataacgctaaaaattccctgtac240ctgcagatgaacagcctgagagccgaagacaccgctgtgtactattgcgctcgcccaatg300tccgcacactatggcttcaattactttgattattgggggcagggtaccctggtgacagtc360tccagc366<210>38<211>122<212>PRT<213>人工序列<220><223>合成序列<400>38GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpIleArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAsnAlaLysAsnSerLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaArgProMetSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyThrLeuValThrValSerSer115120<210>39<211>366<212>DNA<213>人工序列<220><223>合成序列<400>39caggtgcagctggtcgaatcaggggggggactggtcaaacccgggggctcactgcgtctg60tcatgtgccgtctcaggcttcacactgagcgactactatatggcatggatccgacaggca120ccaggcaagggactggagtgggtgtctactatttctgccagtggcctgaggacctactat180cctgacagtgtcaagggaaggttcacaatctcacgggataacgctaaaaattccctgtac240ctgcagatgaacagcctgagagccgaagacaccgctgtgtactattgcgctcgcccactg300tccgcacactatggcttcaattactttgattattgggggcagggtaccctggtgacagtc360tccagc366<210>40<211>122<212>PRT<213>人工序列<220><223>合成序列<400>40GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpIleArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAsnAlaLysAsnSerLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaArgProLeuSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyThrLeuValThrValSerSer115120<210>41<211>321<212>DNA<213>人工序列<220><223>合成序列<400>41gaaattgtgatgactcagtctcccgctaccctgtcagtctctcccggcgaacgtgctacc60ctgtcctgccgaacctcagaagatatctacaacgggctggcttggtatcagcagaagccc120ggacaggcccctaggctgctggtgtactccgctaattctctgcacatcggcattccagca180cggttctctggtagtggctcaggaactgagtataccctgacaatctccagcctgcagagc240gaagacttcgcagtgtacttttgccagcagtactatgattatcccctggcctttggcgga300gggaccaaggtcgagatcaag321<210>42<211>107<212>PRT<213>人工序列<220><223>合成序列<400>42GluIleValMetThrGlnSerProAlaThrLeuSerValSerProGly151015GluArgAlaThrLeuSerCysArgThrSerGluAspIleTyrAsnGly202530LeuAlaTrpTyrGlnGlnLysProGlyGlnAlaProArgLeuLeuVal354045TyrSerAlaAsnSerLeuHisIleGlyIleProAlaArgPheSerGly505560SerGlySerGlyThrGluTyrThrLeuThrIleSerSerLeuGlnSer65707580GluAspPheAlaValTyrPheCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlyGlyGlyThrLysValGluIleLys100105<210>43<211>321<212>DNA<213>人工序列<220><223>合成序列<400>43gaaatcgtgatgactcagtctcctgctactctgtccgtgtcccctggtgaacgtgctact60ctgtcctgtcgtacctccgaagatatttacaacgggctggcttggtatcagcagaagccc120ggacaggcccctaggctgctgatctactccgctaattctctgcacatcggcattccagca180cggttctctggtagtggctcaggaactgagtttaccctgacaatttccagcctgcagagc240gaagacttcgcagtgtactattgccagcagtactatgattatcccctggcctttggcgga300gggaccaaggtcgagatcaaa321<210>44<211>107<212>PRT<213>人工序列<220><223>合成序列<400>44GluIleValMetThrGlnSerProAlaThrLeuSerValSerProGly151015GluArgAlaThrLeuSerCysArgThrSerGluAspIleTyrAsnGly202530LeuAlaTrpTyrGlnGlnLysProGlyGlnAlaProArgLeuLeuIle354045TyrSerAlaAsnSerLeuHisIleGlyIleProAlaArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleSerSerLeuGlnSer65707580GluAspPheAlaValTyrTyrCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlyGlyGlyThrLysValGluIleLys100105<210>45<211>321<212>DNA<213>人工序列<220><223>合成序列<400>45gaaattgtgatgactcagagccctgctacactgtccgtcagccctggagaacgtgctaca60ctgtcctgtcgcacctcagaagatatttaccaggggctggcttggtatcagcagaagccc120ggacaggcccctaggctgctgatctactccgctaacactctgcacatcggcattccagca180cggttctctggtagtggctcaggaaccgagtttaccctgacaatttccagcctgcagtct240gaagacttcgcagtgtactattgccagcagtactatgattatcccctggcctttggcgga300gggacaaaggtcgagatcaaa321<210>46<211>107<212>PRT<213>人工序列<220><223>合成序列<400>46GluIleValMetThrGlnSerProAlaThrLeuSerValSerProGly151015GluArgAlaThrLeuSerCysArgThrSerGluAspIleTyrGlnGly202530LeuAlaTrpTyrGlnGlnLysProGlyGlnAlaProArgLeuLeuIle354045TyrSerAlaAsnThrLeuHisIleGlyIleProAlaArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleSerSerLeuGlnSer65707580GluAspPheAlaValTyrTyrCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlyGlyGlyThrLysValGluIleLys100105<210>47<211>39<212>DNA<213>人工序列<220><223>合成序列<400>47ccactgtccgcacactatggcttcaattactttgattat39<210>48<211>13<212>PRT<213>人工序列<220><223>合成序列<400>48ProLeuSerAlaHisTyrGlyPheAsnTyrPheAspTyr1510<210>49<211>36<212>DNA<213>人工序列<220><223>合成序列<400>49tgtcgcacctcagaagatatttaccaggggctggct36<210>50<211>12<212>PRT<213>人工序列<220><223>合成序列<400>50CysArgThrSerGluAspIleTyrGlnGlyLeuAla1510<210>51<211>21<212>DNA<213>人工序列<220><223>合成序列<400>51tccgctaacactctgcacatc21<210>52<211>7<212>PRT<213>人工序列<220><223>合成序列<400>52SerAlaAsnThrLeuHisIle15<210>53<211>1350<212>DNA<213>人工序列<220><223>合成序列<400>53caggtgcagctggtcgaatcaggggggggactggtcaaacccgggggctcactgcgtctg60tcatgtgccgtctcaggcttcacactgagcgactactatatggcatggatccgacaggca120ccaggcaagggactggagtgggtgtctactatttctgccagtggcctgaggacctactat180cctgacagtgtcaagggaaggttcacaatctcacgggataacgctaaaaattccctgtac240ctgcagatgaacagcctgagagccgaagacaccgctgtgtactattgcgctcgcccactg300tccgcacactatggcttcaattactttgattattgggggcagggtaccctggtgacagtc360tccagcgctagcaccaagggcccatcggtcttccccctggcgccctgctccaggagcacc420tccgagagcacagccgccctgggctgcctggtcaaggactacttccccgaaccggtgacg480gtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacag540tcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacg600aagacctacacctgcaacgtagatcacaagcccagcaacaccaaggtggacaagagagtt660gagtccaaatatggtcccccatgcccaccatgcccagcacctgagttcctggggggacca720tcagtcttcctgttccccccaaaacccaaggacactctcatgatctcccggacccctgag780gtcacgtgcgtggtggtggacgtgagccaggaagaccccgaggtccagttcaactggtac840gtggatggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagttcaacagc900acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaacggcaaggag960tacaagtgcaaggtctccaacaaaggcctcccgtcctccatcgagaaaaccatctccaaa1020gccaaagggcagccccgagagccacaggtgtacaccctgcccccatcccaggaggagatg1080accaagaaccaggtcagcctgacctgcctggtcaaaggcttctaccccagcgacatcgcc1140gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1200gactccgacggctccttcttcctctacagcaggctaaccgtggacaagagcaggtggcag1260gaggggaatgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacacag1320aagagcctctccctgtctccgggtaaatga1350<210>54<211>449<212>PRT<213>人工序列<220><223>合成序列<400>54GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaValSerGlyPheThrLeuSerAspTyr202530TyrMetAlaTrpIleArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerThrIleSerAlaSerGlyLeuArgThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAsnAlaLysAsnSerLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaArgProLeuSerAlaHisTyrGlyPheAsnTyrPheAspTyrTrp100105110GlyGlnGlyThrLeuValThrValSerSerAlaSerThrLysGlyPro115120125SerValPheProLeuAlaProCysSerArgSerThrSerGluSerThr130135140AlaAlaLeuGlyCysLeuValLysAspTyrPheProGluProValThr145150155160ValSerTrpAsnSerGlyAlaLeuThrSerGlyValHisThrPhePro165170175AlaValLeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThr180185190ValProSerSerSerLeuGlyThrLysThrTyrThrCysAsnValAsp195200205HisLysProSerAsnThrLysValAspLysArgValGluSerLysTyr210215220GlyProProCysProProCysProAlaProGluPheLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerGlnGluAsp260265270ProGluValGlnPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnPheAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysGlyLeuProSerSerIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerGlnGluGluMetThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerArgLeuThrValAspLys405410415SerArgTrpGlnGluGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>55<211>642<212>DNA<213>人工序列<220><223>合成序列<400>55gaaattgtgatgactcagagccctgctacactgtccgtcagccctggagaacgtgctaca60ctgtcctgtcgcacctcagaagatatttaccaggggctggcttggtatcagcagaagccc120ggacaggcccctaggctgctgatctactccgctaacactctgcacatcggcattccagca180cggttctctggtagtggctcaggaaccgagtttaccctgacaatttccagcctgcagtct240gaagacttcgcagtgtactattgccagcagtactatgattatcccctggcctttggcgga300gggacaaaggtcgagatcaaaacggtggctgcaccatctgtcttcatcttcccgccatct360gatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatccc420agagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggag480agtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctg540agcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctg600agctcgcccgtcacaaagagcttcaacaggggagagtgttag642<210>56<211>213<212>PRT<213>人工序列<220><223>合成序列<400>56GluIleValMetThrGlnSerProAlaThrLeuSerValSerProGly151015GluArgAlaThrLeuSerCysArgThrSerGluAspIleTyrGlnGly202530LeuAlaTrpTyrGlnGlnLysProGlyGlnAlaProArgLeuLeuIle354045TyrSerAlaAsnThrLeuHisIleGlyIleProAlaArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleSerSerLeuGlnSer65707580GluAspPheAlaValTyrTyrCysGlnGlnTyrTyrAspTyrProLeu859095AlaPheGlyGlyGlyThrLysValGluIleLysThrValAlaAlaPro100105110SerValPheIlePheProProSerAspGluGlnLeuLysSerGlyThr115120125AlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAlaLys130135140ValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGlnGlu145150155160SerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSerSer165170175ThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyrAla180185190CysGluValThrHisGlnGlyLeuSerSerProValThrLysSerPhe195200205AsnArgGlyGluCys210<210>57<211>439<212>PRT<213>智人<400>57GluSerGlyTyrAlaGlnAsnGlyAspLeuGluAspAlaGluLeuAsp151015AspTyrSerPheSerCysTyrSerGlnLeuGluValAsnGlySerGln202530HisSerLeuThrCysAlaPheGluAspProAspValAsnThrThrAsn354045LeuGluPheGluIleCysGlyAlaLeuValGluValLysCysLeuAsn505560PheArgLysLeuGlnGluIleTyrPheIleGluThrLysLysPheLeu65707580LeuIleGlyLysSerAsnIleCysValLysValGlyGluLysSerLeu859095ThrCysLysLysIleAspLeuThrThrIleValLysProGluAlaPro100105110PheAspLeuSerValIleTyrArgGluGlyAlaAsnAspPheValVal115120125ThrPheAsnThrSerHisLeuGlnLysLysTyrValLysValLeuMet130135140HisAspValAlaTyrArgGlnGluLysAspGluAsnLysTrpThrHis145150155160ValAsnLeuSerSerThrLysLeuThrLeuLeuGlnArgLysLeuGln165170175ProAlaAlaMetTyrGluIleLysValArgSerIleProAspHisTyr180185190PheLysGlyPheTrpSerGluTrpSerProSerTyrTyrPheArgThr195200205ProGluIleAsnAsnSerSerGlyGluMetAspProIleLeuLeuThr210215220IleSerIleLeuSerPhePheSerValAlaLeuLeuValIleLeuAla225230235240CysValLeuTrpLysLysArgIleLysProIleValTrpProSerLeu245250255ProAspHisLysLysThrLeuGluHisLeuCysLysLysProArgLys260265270AsnLeuAsnValSerPheAsnProGluSerPheLeuAspCysGlnIle275280285HisArgValAspAspIleGlnAlaArgAspGluValGluGlyPheLeu290295300GlnAspThrPheProGlnGlnLeuGluGluSerGluLysGlnArgLeu305310315320GlyGlyAspValGlnSerProAsnCysProSerGluAspValValIle325330335ThrProGluSerPheGlyArgAspSerSerLeuThrCysLeuAlaGly340345350AsnValSerAlaCysAspAlaProIleLeuSerSerSerArgSerLeu355360365AspCysArgGluSerGlyLysAsnGlyProHisValTyrGlnAspLeu370375380LeuLeuSerLeuGlyThrThrAsnSerThrLeuProProProPheSer385390395400LeuGlnSerGlyIleLeuThrLeuAsnProValAlaGlnGlyGlnPro405410415IleLeuThrSerLeuGlySerAsnGlnGluGluAlaTyrValThrMet420425430SerSerPheTyrGlnAsnGln435<210>58<211>15<212>PRT<213>人工序列<220><223>合成序列<400>58GluSerGlyTyrAlaGlnAsnGlyAspLeuGluAspAlaGluLeu151015<210>59<211>15<212>PRT<213>人工序列<220><223>合成序列<400>59AlaGlnAsnGlyAspLeuGluAspAlaGluLeuAspAspTyrSer151015<210>60<211>15<212>PRT<213>人工序列<220><223>合成序列<400>60AspLeuGluAspAlaGluLeuAspAspTyrSerPheSerCysTyr151015<210>61<211>15<212>PRT<213>人工序列<220><223>合成序列<400>61AlaGluLeuAspAspTyrSerPheSerCysTyrSerGlnLeuGlu151015<210>62<211>15<212>PRT<213>人工序列<220><223>合成序列<400>62AspTyrSerPheSerCysTyrSerGlnLeuGluValAsnGlySer151015<210>63<211>15<212>PRT<213>人工序列<220><223>合成序列<400>63SerCysTyrSerGlnLeuGluValAsnGlySerGlnHisSerLeu151015<210>64<211>15<212>PRT<213>人工序列<220><223>合成序列<400>64GlnLeuGluValAsnGlySerGlnHisSerLeuThrCysAlaPhe151015<210>65<211>15<212>PRT<213>人工序列<220><223>合成序列<400>65AsnGlySerGlnHisSerLeuThrCysAlaPheGluAspProAsp151015<210>66<211>15<212>PRT<213>人工序列<220><223>合成序列<400>66HisSerLeuThrCysAlaPheGluAspProAspValAsnThrThr151015<210>67<211>15<212>PRT<213>人工序列<220><223>合成序列<400>67CysAlaPheGluAspProAspValAsnThrThrAsnLeuGluPhe151015<210>68<211>15<212>PRT<213>人工序列<220><223>合成序列<400>68AspProAspValAsnThrThrAsnLeuGluPheGluIleCysGly151015<210>69<211>15<212>PRT<213>人工序列<220><223>合成序列<400>69AsnThrThrAsnLeuGluPheGluIleCysGlyAlaLeuValGlu151015<210>70<211>15<212>PRT<213>人工序列<220><223>合成序列<400>70LeuGluPheGluIleCysGlyAlaLeuValGluValLysCysLeu151015<210>71<211>15<212>PRT<213>人工序列<220><223>合成序列<400>71IleCysGlyAlaLeuValGluValLysCysLeuAsnPheArgLys151015<210>72<211>15<212>PRT<213>人工序列<220><223>合成序列<400>72LeuValGluValLysCysLeuAsnPheArgLysLeuGlnGluIle151015<210>73<211>15<212>PRT<213>人工序列<220><223>合成序列<400>73LysCysLeuAsnPheArgLysLeuGlnGluIleTyrPheIleGlu151015<210>74<211>15<212>PRT<213>人工序列<220><223>合成序列<400>74PheArgLysLeuGlnGluIleTyrPheIleGluThrLysLysPhe151015<210>75<211>15<212>PRT<213>人工序列<220><223>合成序列<400>75GlnGluIleTyrPheIleGluThrLysLysPheLeuLeuIleGly151015<210>76<211>15<212>PRT<213>人工序列<220><223>合成序列<400>76PheIleGluThrLysLysPheLeuLeuIleGlyLysSerAsnIle151015<210>77<211>15<212>PRT<213>人工序列<220><223>合成序列<400>77LysLysPheLeuLeuIleGlyLysSerAsnIleCysValLysVal151015<210>78<211>15<212>PRT<213>人工序列<220><223>合成序列<400>78LeuIleGlyLysSerAsnIleCysValLysValGlyGluLysSer151015<210>79<211>15<212>PRT<213>人工序列<220><223>合成序列<400>79SerAsnIleCysValLysValGlyGluLysSerLeuThrCysLys151015<210>80<211>15<212>PRT<213>人工序列<220><223>合成序列<400>80ValLysValGlyGluLysSerLeuThrCysLysLysIleAspLeu151015<210>81<211>15<212>PRT<213>人工序列<220><223>合成序列<400>81GluLysSerLeuThrCysLysLysIleAspLeuThrThrIleVal151015<210>82<211>15<212>PRT<213>人工序列<220><223>合成序列<400>82ThrCysLysLysIleAspLeuThrThrIleValLysProGluAla151015<210>83<211>15<212>PRT<213>人工序列<220><223>合成序列<400>83IleAspLeuThrThrIleValLysProGluAlaProPheAspLeu151015<210>84<211>15<212>PRT<213>人工序列<220><223>合成序列<400>84ThrIleValLysProGluAlaProPheAspLeuSerValIleTyr151015<210>85<211>15<212>PRT<213>人工序列<220><223>合成序列<400>85ProGluAlaProPheAspLeuSerValIleTyrArgGluGlyAla151015<210>86<211>15<212>PRT<213>人工序列<220><223>合成序列<400>86PheAspLeuSerValIleTyrArgGluGlyAlaAsnAspPheVal151015<210>87<211>15<212>PRT<213>人工序列<220><223>合成序列<400>87ValIleTyrArgGluGlyAlaAsnAspPheValValThrPheAsn151015<210>88<211>15<212>PRT<213>人工序列<220><223>合成序列<400>88GluGlyAlaAsnAspPheValValThrPheAsnThrSerHisLeu151015<210>89<211>15<212>PRT<213>人工序列<220><223>合成序列<400>89AspPheValValThrPheAsnThrSerHisLeuGlnLysLysTyr151015<210>90<211>15<212>PRT<213>人工序列<220><223>合成序列<400>90ThrPheAsnThrSerHisLeuGlnLysLysTyrValLysValLeu151015<210>91<211>15<212>PRT<213>人工序列<220><223>合成序列<400>91SerHisLeuGlnLysLysTyrValLysValLeuMetHisAspVal151015<210>92<211>15<212>PRT<213>人工序列<220><223>合成序列<400>92LysLysTyrValLysValLeuMetHisAspValAlaTyrArgGln151015<210>93<211>15<212>PRT<213>人工序列<220><223>合成序列<400>93LysValLeuMetHisAspValAlaTyrArgGlnGluLysAspGlu151015<210>94<211>15<212>PRT<213>人工序列<220><223>合成序列<400>94HisAspValAlaTyrArgGlnGluLysAspGluAsnLysTrpThr151015<210>95<211>15<212>PRT<213>人工序列<220><223>合成序列<400>95TyrArgGlnGluLysAspGluAsnLysTrpThrHisValAsnLeu151015<210>96<211>15<212>PRT<213>人工序列<220><223>合成序列<400>96LysAspGluAsnLysTrpThrHisValAsnLeuSerSerThrLys151015<210>97<211>15<212>PRT<213>人工序列<220><223>合成序列<400>97LysTrpThrHisValAsnLeuSerSerThrLysLeuThrLeuLeu151015<210>98<211>15<212>PRT<213>人工序列<220><223>合成序列<400>98ValAsnLeuSerSerThrLysLeuThrLeuLeuGlnArgLysLeu151015<210>99<211>15<212>PRT<213>人工序列<220><223>合成序列<400>99SerThrLysLeuThrLeuLeuGlnArgLysLeuGlnProAlaAla151015<210>100<211>15<212>PRT<213>人工序列<220><223>合成序列<400>100ThrLeuLeuGlnArgLysLeuGlnProAlaAlaMetTyrGluIle151015<210>101<211>15<212>PRT<213>人工序列<220><223>合成序列<400>101ArgLysLeuGlnProAlaAlaMetTyrGluIleLysValArgSer151015<210>102<211>15<212>PRT<213>人工序列<220><223>合成序列<400>102ProAlaAlaMetTyrGluIleLysValArgSerIleProAspHis151015<210>103<211>15<212>PRT<213>人工序列<220><223>合成序列<400>103TyrGluIleLysValArgSerIleProAspHisTyrPheLysGly151015<210>104<211>15<212>PRT<213>人工序列<220><223>合成序列<400>104ValArgSerIleProAspHisTyrPheLysGlyPheTrpSerGlu151015<210>105<211>15<212>PRT<213>人工序列<220><223>合成序列<400>105ProAspHisTyrPheLysGlyPheTrpSerGluTrpSerProSer151015<210>106<211>15<212>PRT<213>人工序列<220><223>合成序列<400>106PheLysGlyPheTrpSerGluTrpSerProSerTyrTyrPheArg151015<210>107<211>15<212>PRT<213>人工序列<220><223>合成序列<400>107TrpSerGluTrpSerProSerTyrTyrPheArgThrProGluIle151015<210>108<211>15<212>PRT<213>人工序列<220><223>合成序列<400>108SerProSerTyrTyrPheArgThrProGluIleAsnAsnSerSer151015<210>109<211>15<212>PRT<213>人工序列<220><223>合成序列<400>109TyrPheArgThrProGluIleAsnAsnSerSerGlyGluMetAsp151015<210>110<211>31<212>PRT<213>人工序列<220><223>合成序列<400>110LysCysLeuAsnPheArgLysLeuGlnGluIleTyrPheIleGluThr151015LysLysPheLeuLeuIleGlyLysSerAsnIleCysValLysVal202530<210>111<211>31<212>PRT<213>人工序列<220><223>合成序列<400>111TyrGluIleLysValArgSerIleProAspHisTyrPheLysGlyPhe151015TrpSerGluTrpSerProSerTyrTyrPheArgThrProGluIle202530<210>112<211>327<212>PRT<213>人工序列<220><223>合成序列<400>112AlaSerThrLysGlyProSerValPheProLeuAlaProCysSerArg151015SerThrSerGluSerThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrLysThr65707580TyrThrCysAsnValAspHisLysProSerAsnThrLysValAspLys859095ArgValGluSerLysTyrGlyProProCysProProCysProAlaPro100105110GluPheLeuGlyGlyProSerValPheLeuPheProProLysProLys115120125AspThrLeuMetIleSerArgThrProGluValThrCysValValVal130135140AspValSerGlnGluAspProGluValGlnPheAsnTrpTyrValAsp145150155160GlyValGluValHisAsnAlaLysThrLysProArgGluGluGlnPhe165170175AsnSerThrTyrArgValValSerValLeuThrValLeuHisGlnAsp180185190TrpLeuAsnGlyLysGluTyrLysCysLysValSerAsnLysGlyLeu195200205ProSerSerIleGluLysThrIleSerLysAlaLysGlyGlnProArg210215220GluProGlnValTyrThrLeuProProSerGlnGluGluMetThrLys225230235240AsnGlnValSerLeuThrCysLeuValLysGlyPheTyrProSerAsp245250255IleAlaValGluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLys260265270ThrThrProProValLeuAspSerAspGlySerPhePheLeuTyrSer275280285ArgLeuThrValAspLysSerArgTrpGlnGluGlyAsnValPheSer290295300CysSerValMetHisGluAlaLeuHisAsnHisTyrThrGlnLysSer305310315320LeuSerLeuSerProGlyLys325<210>113<211>459<212>PRT<213>人工序列<220><223>合成序列<400>113MetThrIleLeuGlyThrThrPheGlyMetValPheSerLeuLeuGln151015ValValSerGlyGluSerGlyTyrAlaGlnAsnGlyAspLeuGluAsp202530AlaGluLeuAspAspTyrSerPheSerCysTyrSerGlnLeuGluVal354045AsnGlySerGlnHisSerLeuThrCysAlaPheGluAspProAspVal505560AsnThrThrAsnLeuGluPheGluIleCysGlyAlaLeuValGluVal65707580LysCysLeuAsnPheArgLysLeuGlnGluIleTyrPheIleGluThr859095LysLysPheLeuLeuIleGlyLysSerAsnIleCysValLysValGly100105110GluLysSerLeuThrCysLysLysIleAspLeuThrThrIleValLys115120125ProGluAlaProPheAspLeuSerValIleTyrArgGluGlyAlaAsn130135140AspPheValValThrPheAsnThrSerHisLeuGlnLysLysTyrVal145150155160LysValLeuMetHisAspValAlaTyrArgGlnGluLysAspGluAsn165170175LysTrpThrHisValAsnLeuSerSerThrLysLeuThrLeuLeuGln180185190ArgLysLeuGlnProAlaAlaMetTyrGluIleLysValArgSerIle195200205ProAspHisTyrPheLysGlyPheTrpSerGluTrpSerProSerTyr210215220TyrPheArgThrProGluIleAsnAsnSerSerGlyGluMetAspPro225230235240IleLeuLeuThrIleSerIleLeuSerPhePheSerValAlaLeuLeu245250255ValIleLeuAlaCysValLeuTrpLysLysArgIleLysProIleVal260265270TrpProSerLeuProAspHisLysLysThrLeuGluHisLeuCysLys275280285LysProArgLysAsnLeuAsnValSerPheAsnProGluSerPheLeu290295300AspCysGlnIleHisArgValAspAspIleGlnAlaArgAspGluVal305310315320GluGlyPheLeuGlnAspThrPheProGlnGlnLeuGluGluSerGlu325330335LysGlnArgLeuGlyGlyAspValGlnSerProAsnCysProSerGlu340345350AspValValIleThrProGluSerPheGlyArgAspSerSerLeuThr355360365CysLeuAlaGlyAsnValSerAlaCysAspAlaProIleLeuSerSer370375380SerArgSerLeuAspCysArgGluSerGlyLysAsnGlyProHisVal385390395400TyrGlnAspLeuLeuLeuSerLeuGlyThrThrAsnSerThrLeuPro405410415ProProPheSerLeuGlnSerGlyIleLeuThrLeuAsnProValAla420425430GlnGlyGlnProIleLeuThrSerLeuGlySerAsnGlnGluGluAla435440445TyrValThrMetSerSerPheTyrGlnAsnGln450455<210>114<211>219<212>PRT<213>人工序列<220><223>合成序列<400>114GluSerGlyTyrAlaGlnAsnGlyAspLeuGluAspAlaGluLeuAsp151015AspTyrSerPheSerCysTyrSerGlnLeuGluValAsnGlySerGln202530HisSerLeuThrCysAlaPheGluAspProAspValAsnThrThrAsn354045LeuGluPheGluIleCysGlyAlaLeuValGluValLysCysLeuAsn505560PheArgLysLeuGlnGluIleTyrPheIleGluThrLysLysPheLeu65707580LeuIleGlyLysSerAsnIleCysValLysValGlyGluLysSerLeu859095ThrCysLysLysIleAspLeuThrThrIleValLysProGluAlaPro100105110PheAspLeuSerValIleTyrArgGluGlyAlaAsnAspPheValVal115120125ThrPheAsnThrSerHisLeuGlnLysLysTyrValLysValLeuMet130135140HisAspValAlaTyrArgGlnGluLysAspGluAsnLysTrpThrHis145150155160ValAsnLeuSerSerThrLysLeuThrLeuLeuGlnArgLysLeuGln165170175ProAlaAlaMetTyrGluIleLysValArgSerIleProAspHisTyr180185190PheLysGlyPheTrpSerGluTrpSerProSerTyrTyrPheArgThr195200205ProGluIleAsnAsnSerSerGlyGluMetAsp210215<210>115<211>7<212>PRT<213>人工序列<220><223>合成序列<400>115PheIleGluThrLysLysPhe15<210>116<211>6<212>PRT<213>人工序列<220><223>合成序列<400>116AspLeuSerValIleTyr15<210>117<211>4<212>PRT<213>人工序列<220><223>合成序列<400>117PheLysGlyPhe1<210>118<211>14<212>PRT<213>人工序列<220><223>合成序列<400>118ArgLysLeuGlnGluIleTyrPheIleGluThrLysLysPhe1510<210>119<211>16<212>PRT<213>人工序列<220><223>合成序列<400>119AsnPheArgLysLeuGlnGluIleTyrPheIleGluThrLysLysPhe151015<210>120<211>17<212>PRT<213>人工序列<220><223>合成序列<400>120AspLeuSerValIleTyrArgGluGlyAlaAsnAspPheValValThr151015Phe<210>121<211>13<212>PRT<213>人工序列<220><223>合成序列<400>121ValValThrPheAsnThrSerHisLeuGlnLysLysTyr1510<210>122<211>15<212>PRT<213>人工序列<220><223>合成序列<400>122GluIleLysValArgSerIleProAspHisTyrPheLysGlyPhe151015<210>123<211>16<212>PRT<213>人工序列<220><223>合成序列<400>123GluIleLysValArgSerIleProAspHisTyrPheLysGlyPheTrp151015<210>124<211>19<212>PRT<213>人工序列<220><223>合成序列<400>124GluIleLysValArgSerIleProAspHisTyrPheLysGlyPheTrp151015SerGluTrp<210>125<211>23<212>PRT<213>人工序列<220><223>合成序列<400>125GluIleLysValArgSerIleProAspHisTyrPheLysGlyPheTrp151015SerGluTrpSerProSerTyr20<210>126<211>8<212>PRT<213>人工序列<220><223>合成序列<400>126PheLysGlyPheTrpSerGluTrp15<210>127<211>23<212>PRT<213>人工序列<220><223>合成序列<400>127IleTyrPheIleGluThrLysLysPheLeuLeuIleGlyLysSerAsn151015IleCysValLysValGlyGlu20<210>128<211>28<212>PRT<213>人工序列<220><223>合成序列<400>128LysSerLeuThrCysLysLysIleAspLeuThrThrIleValLysPro151015GluAlaProPheAspLeuSerValIleTyrArgGlu2025<210>129<211>19<212>PRT<213>人工序列<220><223>合成序列<400>129LeuThrThrIleValLysProGluAlaProPheAspLeuSerValIle151015TyrArgGlu<210>130<211>11<212>PRT<213>人工序列<220><223>合成序列<400>130AlaProPheAspLeuSerValIleTyrArgGlu1510<210>131<211>27<212>PRT<213>人工序列<220><223>合成序列<400>131AsnLysTrpThrHisValAsnLeuSerSerThrLysLeuThrLeuLeu151015GlnArgLysLeuGlnProAlaAlaMetTyrGlu2025<210>132<211>17<212>PRT<213>人工序列<220><223>合成序列<400>132IleLysValArgSerIleProAspHisTyrPheLysGlyPheTrpSer151015Glu当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1