绵马次酸类化合物及其药物组合物与应用的制作方法
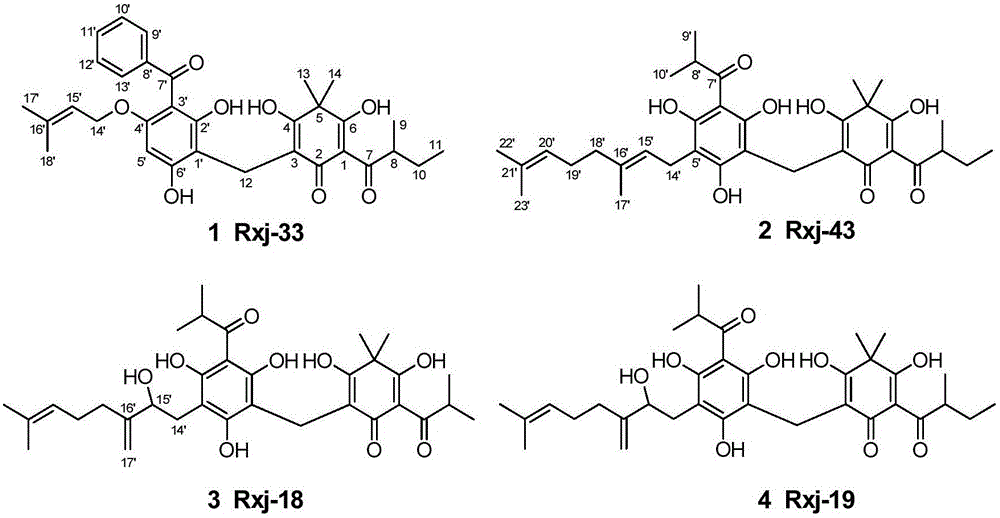
本发明属于药物技术领域,具体地说,涉及具有抑菌活性的绵马次酸类化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)及其制备方法,以该化合物为活性成分的食品、化妆品、药物组合物,以及其在制备预防和治疗细菌感染导致的皮肤问题的化妆品和药物中的应用。
背景技术:
:
金丝桃属(Hypericum)是藤黄科(Guttiferae)的一个大属,全世界约400种,除南北两极地或荒漠地及大部分热带低地外世界广布。我国约有55种8亚种,几产于全国各地,但主要集中在西南地区。除了用于观赏,金丝桃属植物具有抗抑郁、抗病毒、抗菌和抗肿瘤等多种药理活性。
地耳草(Hypericum japonicum Thunb.):《中药大辞典》记载品种,别名田基黄、雀舌草。一年生草本,产于江苏、浙江、四川、云南等地。具有清热利湿,消肿解毒等功效,用于黄疸热淋,肿毒,毒蛇咬伤。文献报道该植物的化学成分有黄酮、xanthone等。现有技术中未见有本发明所涉及的从地耳草中分离所得的绵马次酸类化合物,以及它们的药物活性功能的报道。
技术实现要素:
:
本发明目的在于提供从地耳草(H.japonicum)中分离得到的绵马次酸类化合物,以其为活性成分的食品、化妆品或药物组合物,其制备方法,及其在制备预防和治疗细菌感染疾病的药物中的应用,以及在制备预防细菌感染导致的皮肤问题的化妆品中的应用,能用于预防细纹和/皱纹,皮肤红疹,干性、敏感肌肤,皮肤瘙痒,肤色不均或皮肤黑斑,皮肤发炎和其它与此相关的皮肤不适症。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
下述结构式所示的绵马次酸类化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)或其药用盐,
如所述的绵马次酸类化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)或其药用盐,所述的药用盐为是指药学上可接受的盐,是与有机酸形成的盐,所述的有机酸为酒石酸、甲酸、乙酸、乙二酸、丁酸、马来酸、琥珀酸、己二酸、藻酸、柠檬酸、天冬氨酸、苯磺酸、樟脑酸、樟脑磺酸、二葡糖酸、环戊烷丙酸、十二烷基硫酸、乙磺酸、葡庚糖酸、甘油磷酸、庚酸、己酸、延胡索酸、2‐羟基乙磺酸、乳酸、甲磺酸、烟酸、2‐萘磺酸、扑酸、果胶酯酸、3‐苯基丙酸、新戊酸、丙酸、对‐甲苯磺酸和十一烷酸。
化妆品,由所述的绵马次酸类化合物1-4任一种或任几种的混合物和化妆品常用载体组成。
含有治疗有效量的绵马次酸类化合物1-4任一种或任几种的混合物或其药用盐和药学上可接受的载体的药物组合物。
所述的绵马次酸类化合物1-4任一种或任几种的混合物在制备化妆品或食品中的应用。
所述的绵马次酸类化合物1-4任一种或任几种的混合物在制备预防细菌大肠杆菌、伤寒杆菌、金黄色葡萄球菌、粪肠杆菌感染导致的皮肤不适症的化妆品中的应用。
所述的绵马次酸类化合物1-4任一种或任几种的混合物在制备预防皮肤不适症的化妆品中的应用,所述的皮肤不适症为细纹和/皱纹,皮肤红疹,干性、敏感肌肤,皮肤瘙痒,肤色不均或皮肤黑斑,皮肤发炎。
所述的绵马次酸类化合物1-4任一种或任几种的混合物或其药用盐在制备预防或治疗由细菌感染导致的疾病的药物中的应用,所述的疾病是由大肠杆菌、伤寒杆菌、金黄色葡萄球菌、粪肠杆菌感染所导致的疾病。
制备权利要求1所述的绵马次酸类化合物1-4的方法,取地耳草干燥全草,粉碎,用甲醇室温下冷浸2次,每次24小时,合并提取液,减压蒸馏浓缩,得浸膏,浸膏用100-200目硅胶拌样,硅胶柱层析,用氯仿洗脱得到氯仿段,氯仿段用1.5倍量的聚酰胺拌样,过MCI柱,以7:3-10:0的MeOH-H2O进行梯度洗脱,得到5个大段A-E,B段经硅胶柱层析,以1:0-0:1的石油醚-丙酮进行梯度洗脱,得到4个小段B1-B4,其中B3段经制备HPLC,甲醇-水,95:5分离纯化后得到Rxj-33;同样,B4部分经制备HPLC,甲醇-水,95:5分离纯化后得到Rxj-18和Rxj-19;C段用100-200目硅胶拌样,硅胶柱层析,以1:0-0:1的石油醚-丙酮进行梯度洗脱,得到5个部分C1-C5,其中C2部分经制备HPLC,甲醇-水,95:5分离纯化后得到Rxj-43。
本发明的化合物1-4为新的绵马次酸类(二聚间苯三酚类衍生物)化合物,化学结构新颖,作为抗菌药物有较多优势。化合物1-4具有显著的体外抑制细菌生长的活性,对大肠杆菌、伤寒杆菌、金黄色葡萄球菌、粪肠杆菌都有显著的抑制作用。尤其是化合物1-4对伤寒杆菌抑制浓度低于阳性对照头孢噻肟(cefotaxime),以及化合物1和3对金黄色葡萄球菌的抑制浓度也低于阳性对照。这些化合物可作为活性成分用于制备预防皮肤病的化妆品,或作为抗菌药物制剂,具有较好的药用价值。
本发明中含有化合物以及化妆品常用载体的组合物可用于局部皮肤护理或护发产品。这些组合物可以做成乳化剂(例如水包油、油包水、硅油包水,水包硅油,水包油包水,油包水包油,油包水包硅油等),霜剂,护肤液,液体(例如水剂或水-醇溶液),无水基质(例如唇膏或粉剂等),啫喱,油膏,奶液,软膏,喷雾剂,固体剂,眼霜等。局部施用这些组合物可治疗干性皮肤、敏感皮肤或皮肤搔痒或减小肤色不均的外观。皮肤病包括干性皮肤、皮肤搔痒、皮肤发炎、红斑、皮肤过敏、瘙痒症、蜘蛛血管、雀斑、老年斑、老年性紫癜、角化症、黑斑病、疙瘩、细纹或皱纹、结节、皮肤太阳损伤、皮炎(脂溢性皮炎、钱币状皮炎、接触性皮炎、异位性皮炎、剥脱性皮炎、口周皮炎和淤滞性皮炎等)、牛皮癣、毛囊炎、红斑痤疮、痤疮、脓胞病、丹毒、红癣、湿疹、日光灼伤、皮肤烧伤、开放性伤口、感染性皮肤病等。皮肤病还可由暴露在紫外光下、年龄、辐射、长期暴露在太阳下、环境污染、空气污染、风、冷、热、化学品、病理、吸烟或缺乏营养等引起。
附图说明:
图1为本发明化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)的结构示图。
具体实施方式:
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1:
化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)的制备:
取地耳草干燥全草(14kg),粉碎,用甲醇室温下冷浸2次,每次24小时,合并提取液,减压蒸馏浓缩,得浸膏2.5kg。粗提物用100-200目硅胶拌样,硅胶柱层析,用氯仿洗脱得到氯仿段(164.2g)。氯仿段用1.5倍量的聚酰胺拌样,过MCI柱,以MeOH-H2O(7:3-10:0)进行梯度洗脱,得到5个大段(A-E)。B段(25.5g)经硅胶柱层析,以石油醚-丙酮(1:0-0:1)进行梯度洗脱,得到4个小段(B1-B4)。其中B3段(3.0g)经制备HPLC(甲醇-水,95:5)分离纯化后得到Rxj-33(180mg);同样,B4部分(6.4g)经制备HPLC(甲醇-水,95:5)分离纯化后得到Rxj-18(310mg)和Rxj-19(230mg)。C段(25.5g)用100-200目硅胶拌样,硅胶柱层析,以石油醚-丙酮(1:0-0:1)进行梯度洗脱,得到5个部分(C1-C5),其中C2部分(3.2g)最终经制备HPLC(甲醇-水,95:5)分离纯化后得到Rxj-43(850mg)。
化合物1-4的结构解析:
化合物1(Rxj-33),无色胶状物。ESI-MS谱给出准分子离子峰为m/z 547[M-H]-,结合高分辨负离子HRESI-MS(m/z[M-H]-547.2337,calcd for 547.2332)及13C和DEPT NMR谱图提供的信息,确定其分子式为C32H36O8,计算不饱和度为15。UV光谱在206(4.39),241(4.11),331(3.89)nm处有吸收,说明分子中存在较长的共轭系统。分析1H和13C NMR谱,再结合HSQC谱表明化合物1中含有32个碳信号,包括6个甲基,3个亚甲基,8个次甲基(包括7个烯碳),15个季碳(其中1个饱和季碳)。仔细分析这些数据表明1为绵马次酸类化合物,且与已知化合物sarothralin很相似。最后通详细地分析HMBC和1H-1H COSY谱,确定了化合物sarothralin中的异丙基被1中的仲丁基所取代。至此,化合物1的结构被确定。
同样地,化合物2被确定为sarothralen A的衍生物,sarothralen A中C-7位异丙基被2中的仲丁基取代。化合物3为化合物2的15'氧化产物,并伴随着16',17'双键的形成。化合物4与3的不同之处为,C-7位羰基上携带的是一个仲丁基。化合物1-4的1H和13C NMR谱数据如表1和2所示。
表1.化合物1-4的NMR 13C谱数据(acetone)
表2.化合物1-4的NMR 1H谱数据(acetone)
化合物1-4的结构式如下所示:
实施例2
采用定量稀释法测定化合物1-4的抑菌活性:
1培养基配置:将肉汤蛋白粉配置成浓度为20g/L的肉汤培养液和肉汤固体培养基,经灭菌处理后,待用。
2菌种活化:将大肠杆菌、伤寒杆菌、金黄色葡萄球菌、粪肠杆菌依次用肉汤固体培养接种,37℃培养24h。将活化的细菌用无菌环接种于肉汤固体培养基,置于摇床上,以220r/min,37℃培养18h,离心除去培养液后再用0.9%盐水离心处理3次,以便于准确测定细菌悬浮液的吸光度。调节悬浮液的吸光度在0.10-600nm的范围内,与此相关的悬浮液细菌浓度为108CFU/mL(吸光度为0.1时);使用前用肉汤培养液稀释细菌悬浮液浓度100倍至106CFU/mL,待用。
3待测样品配置:将待测的单体化合物溶解于DMSO溶液中,浓度配置为4μg/mL;阳性对照:以头孢噻肟(cefotaxime)为阳性对照品,用肉汤液体培养基依照成倍稀释的方法将待测化合物样品浓度调整到1.56μg/mL、0.78μg/mL、0.39μg/mL、0.19μg/mL;空白对照:含DMSO 5%体积比的肉汤液体培养基溶液。
4抗菌活性测试:用移液枪吸取待测样品(4μg/mL)100μL转至96孔板中,其中DMSO的含量需低于5%体积比;继续加入100μL的细菌培养液至每一个小孔,采用成倍稀释的方法将待测化合物样品浓度调整到2μg/mL、1μg/mL、0.5μg/mL、0.25μg/mL、0.125μg/mL、0.06μg/mL、0.03μg/mL、0.015μg/mL八个浓度梯度。每孔再加入需测试的浓度为106CFU/mL的细菌悬浮液,置恒温箱(37℃)中培养24h后,用酶标仪进行测定。每个单体化合物均采用上述方法对每个菌种进行最小抑菌浓度(MIC值)的测定,检测结果如表3所示。
表3.化合物1-4对4种细菌的最小抑菌浓度(MIC值)
由表3可见:化合物1-4对大肠杆菌、伤寒杆菌、金黄色葡萄球菌、粪肠杆菌都有显著的抑制作用。尤其是化合物1-4对伤寒杆菌抑制浓度低于阳性对照头孢噻肟(cefotaxime),以及化合物1和3对金黄色葡萄球菌的抑制浓度也低于阳性对照。这些化合物可作为活性成分用于制备抗菌药物制剂,具有较好的药用价值。
实施例3
化合物1-4体外抗氧化活性实验:
将待测药物与DPPH(终浓度为100μM)混合反应,设定3个重复孔,同时设置不含药物的空白对照和Trolox阳性对照,30℃,1h,酶标仪测定OD值,检测波长为515nm。计算得到抗氧化率。
表4样品体外抗氧化活性结果
实施例4
酪氨酸酶抑制活性实验:
将待测药物与L-Dopa(终浓度1.25mM)混合,加入酪氨酸酶(终浓度25U/mL)开始反应,设定3个重复孔,同时设置不含药物的空白对照和KojicAcid阳性对照,室温,5min,酶标仪测定OD值,检测波长为490nm。计算得到酪氨酸酶活性抑制率。
表5样品对酪氨酸酶的抑制作用活性
实施例5
B16细胞黑色素生成抑制活性实验:
96孔细胞培养板上,将B16细胞与不同浓度的待测药物溶液混合,设定8个重复孔,同时设置不含药物的空白照和KojicAcid阳性对照。37℃,5%CO2培养5天,酶标仪测定OD值,检测波长为405nm,加入MTS,采用MTS比色法检测490nm的OD值。计算得到B16细胞黑色素生成抑制率。
表6样品对B16细胞黑色素生成的抑制作用结果
实施例6
促胶原蛋白分泌活性实验:
12孔细胞培养板上,将HDFa细胞与不同浓度的待测药物溶液混合,设置不含药物的空白照和TGF-β阳性对照。37℃,5%CO2培养3天,收取细胞培养上清,存于-80℃;加入MTS,采用MTS比色法检测490nm的OD值;按胶原蛋白ELISA试剂盒中提供的方法检测胶原蛋白的分泌,酶标仪测定OD值,检测波长为450nm。计算得到胶原蛋白分泌增加率。
表7样品对HDFa细胞胶原蛋白分泌的促进作用结果
实施例7
TNF-α分泌抑制活性实验:
12孔细胞培养板上,向HEKa细胞培养液中加入PMA(终浓度为0.01μg/mL),然后将不同浓度的待测药物溶液与上述细胞溶液混合,同时设置不含药物的空白照和PMA对照。37℃,5%CO2培养4-6h,收取细胞培养上清,存于-80℃;加入MTS,采用MTS比色法检测490nm的OD值;按TNF-αELISA试剂盒中提供的方法检测TNF-α的分泌,酶标仪测定OD值,检测波长为450nm,校正波长为540nm。计算得到TNF-α分泌抑制率。
表8样品对HEKa细胞TNF-α分泌的抑制作用结果
实施例8:
含有化合物1-4任一或组合的美白霜配方(W%):
按常规制作化妆品的方法制得本发明上述配方的化妆品。
实施例9:
含有化合物1-4任一或组合的乳剂配方(W%):
按常规制作化妆品的方法制得本发明上述配方的化妆品。
实施例10:
按实施例1制得化合物1-4,按化合物1-4任一种或任几种混合与赋形剂重量比1:1或1:2的比例加入赋形剂,制粒压片。
实施例11:
按实施例1制得化合物1-4,按常规胶囊制剂方法制成胶囊。
实施例12:
先按实施例1制得化合物1-4,再按下述方法制成片剂
制备方法:将化合物1-4任一种或任几种混合与助剂混合,过筛,在合适的容器中均匀混合,把得到的混合物制粒压片。
实施例13:
胶囊剂:化合物1-4任一种或任几种混合 100mg
淀粉 适量
硬脂酸镁 适量
制备方法:将化合物1-4任一种或任几种混合与助剂混合,过筛,在合适的容器中均匀混合,把得到的混合物装入硬明胶胶囊。
实施例14:
片剂:实施例1所得化合物1-4任一种或任几种混合10mg,乳糖180mg,淀粉55mg,硬脂酸镁5mg;
制备方法:将化合物1-4任一种或任几种混合、乳糖和淀粉混合,用水均匀湿润,把湿润后的混合物过筛并干燥,再过筛,加入硬脂酸镁,然后将混合物压片,每片重250mg,化合物含量为10mg。
实施例15:
安瓿剂:实施例1所得化合物1-4任一种或任几种混合2mg,氯化钠10mg;
制备方法:将化合物1-4任一种或任几种混合和氯化钠溶解于适量的注射用水中,过滤所得溶液,在无菌条件下装入安瓿瓶中。
实施例16:
胶囊剂:实施例1所得化合物1-4任一种或任几种混合10mg,乳糖187mg,硬脂酸镁3mg;
制备方法:将化合物1-4任一种或任几种混合与助剂混合,过筛,均匀混合,把得到的混合物装入硬明胶胶囊,每个胶囊重200mg,活性成分含量为10mg。
- 还没有人留言评论。精彩留言会获得点赞!