OsMPK11蛋白及其编码基因在调控植物抗旱性中的应用的制作方法
本发明属于基因工程领域,涉及一种osmpk11蛋白及其编码基因在调控植物抗旱性中的应用。
背景技术:
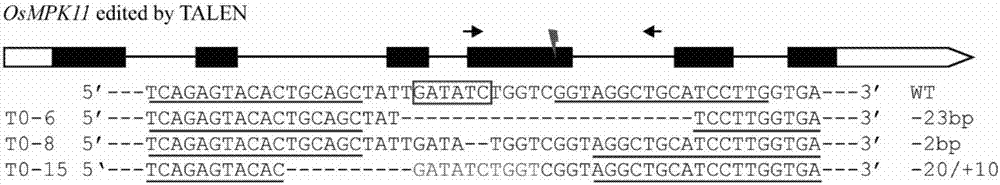
:干旱胁迫是陆生植物经常面对的胁迫类型。植物在干旱胁迫条件下会增加磷脂酶d(phospholipased,pld)介导的磷脂酸(pa)和ros的产生。ros与水分缺失导致的气孔关闭紧密相关,该过程会减少植物的蒸腾失水,使植物增加抗旱能力(zhaoetal.,2013)。干旱胁迫还会导致植物细胞内由wrky和b-zip类转录因子调控的抗逆相关基因表达谱的变化(shenetal.,2012)。真核生物丝裂原蛋白激酶级联(mitogenactivatedproteinkinasecascades,mapkcascades)是真核生物中保守的信号通路。mapk参与了不同植物的干旱胁迫响应,同时mapk级联还参与了wrky和b-zip类转录因子的激活。mapk级联包括三个层级的蛋白激酶,细胞膜表面的受体蛋白接受信号之后通过直接或间接的方式激活mapkinasekinasekinase(mapkkk/map3k)。依次磷酸化下游特定的mapkkinase(mapkk/mkk),之后mkk磷酸化并激活mapkinase(mapk/mpk)。激活的mpk会磷酸化细胞质或细胞核中不同的底物蛋白,这些底物蛋白包括其它激酶、各种催化酶、转录因子和结构蛋白等。干旱诱导的气孔运动主要是由mpk9和mpk12调控。mpk9和mpk12在气孔细胞表达,mpk6是另外一个被干旱激活的mapk,与mpk9和mpk12不同,ros和pa的产生和积累激活mpk6。拟南芥mkk4-oe株系较野生型保水能力强,表明其下游底物mpk3也是水分利用的正调控因子(kimetal.,2011;jammesetal.,2009;smekalovaetal.,2014),而且干旱处理会激活水稻osmpk4/3/7/14/20-4/20-5等成员(shenetal.,2012)。水稻raf类mapkkk突变体droughtsupersensitivemutant1(dsm1)对干旱处理超敏感,突变体株系苗期和成株期失水速率较野生型快,而且dsm1-rnai转基因植株也表现出干旱敏感的表型。dsm1突变体中过氧化物酶基因(pox22.3和pox8.1)表达量显著降低,表明dsml清除ros能力降低,从而对干旱造成的氧化胁迫敏感(ningetal.,2010)。水稻是世界上最重要的粮食作物之一,养活世界上近半数的人口。我国干旱半干旱地区面积巨大,因此利用最新的生物学研究工具筛选、鉴定参与抗旱的植物基因意义重大。研究和培育高产、优质、抗逆的水稻品种对我国粮食安全具有重要意义。技术实现要素:本发明的目的是提供一种osmpk11蛋白及其编码基因在调控植物抗旱性中的应 用。本发明所提供的应用具体为如下a或b:a.osmpk11蛋白在如下(a)或(b)中的应用:(a)调控植物抗旱性;(b)选育抗旱性降低或提高的植物品种;所述osmpk11蛋白为如下a1)或a2)所示的蛋白质:a1)由序列表中序列3所示的氨基酸序列组成的蛋白质;a2)在序列表中序列3所示的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的与植物抗旱相关的由a1)衍生的蛋白质。b.osmpk11蛋白相关生物材料在如下(a)或(b)中的应用:(a)调控植物抗旱性;(b)选育抗旱性降低或提高的植物品种;所述osmpk11蛋白为如下a1)或a2)所示的蛋白质:a1)由序列表中序列3所示的氨基酸序列组成的蛋白质;a2)在序列表中序列3所示的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的与植物抗旱相关的由a1)衍生的蛋白质;所述osmpk11蛋白相关生物材料,为如下b1)-b5)中任一:b1)编码所述osmpk11蛋白的核酸分子;b2)含有步骤b1)所述核酸分子的表达盒、重组载体、重组微生物或转基因细胞系;b3)针对编码所述osmpk11蛋白的基因组dna序列的基因编辑工具;所述基因编辑工具为序列特异核酸酶,所述序列特异核酸酶能够特异性剪切编码所述osmpk11蛋白的基因组dna序列中的靶标序列;所述序列特异核酸酶为转录激活因子样效应因子核酸酶(transcriptionactivator-likeeffectornucleases,talen)、锌指核酸酶(zinc-fingernucleases,zfn)或crispr/cas9核酸酶;b4)编码所述基因编辑工具的核酸分子;b5)含有步骤b4)所述核酸分子的表达盒、重组载体、重组微生物或转基因细胞系。其中,所述“编码所述osmpk11蛋白的核酸分子”为编码所述osmpk11蛋白的dna分子或rna分子;所述dna分子具体可为如下1)至5)中任一所述的dna分子;所述rna分子可为如下1)至5)中任一所述的dna分子转录所得的rna分子:1)序列表中序列1所示的dna分子;2)序列表中序列2所示的dna分子;3)在严格条件下与1)或2)所限定的dna分子杂交且编码所述osmpk11蛋白的dna分子;4)与1)-3)任一限定的dna分子具有90%以上同一性且编码所述osmpk11蛋白的dna分子。所述osmpk11蛋白的基因组dna序列具体为序列表中序列1。所述“编码所述基因编辑工具的核酸分子”既可为编码所述基因编辑工具(所述序列特异核酸酶)的dna分子,也可为编码所述基因编辑工具(所述序列特异核酸酶)的rna分子。在所述应用中,所述“调控植物抗旱性”体现为:所述osmpk11蛋白的表达量和/或活性改变,影响所述植物的抗旱表现;具体可为降低植物抗旱性或提高植物抗逆性。本发明还请求保护一种培育转基因植物的方法。本发明所提供的培育转基因植物的方法,可为如下(a)或(b):(a)培育抗旱性降低的转基因植物的方法,具体可包括如下步骤:抑制受体植物中osmpk11蛋白的表达或降低受体植物中osmpk11蛋白的活性,得到转基因植物;所述转基因植物与所述受体植物相比抗旱性降低;(b)培育抗旱性提高的转基因植物的方法,具体可包括如下步骤:促进受体植物中osmpk11蛋白的表达或提高受体植物中osmpk11蛋白的活性,得到转基因植物;所述转基因植物与所述受体植物相比抗旱性提高;所述osmpk11蛋白为如下(a)或(b)所示的蛋白质:(a)由序列表中序列3所示的氨基酸序列组成的蛋白质;(b)在序列表中序列3所示的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的与植物抗旱相关的由(a)衍生的蛋白质。在所述(a)中,可采用任何基因沉默相关技术抑制所述受体植物中osmpk11蛋白的表达。如采用针对编码所述osmpk11蛋白的基因组dna序列的基因编辑工具对所述受体植物中的所述osmpk11蛋白的基因组dna序列进行基因编辑,使得所述受体植物中的所述osmpk11蛋白的表达受到抑制;所述基因编辑工具为序列特异核酸酶,所述序列特异核酸酶能够特异性剪切所述osmpk11蛋白的基因组dna序列中的靶标片段;所述核酸酶为talen、zfn或crispr/cas9核酸酶。所述序列特异核酸酶对所述靶标片段进行特异性剪切会造成所述靶标片段发生插入突变、缺失突变和/或替换突变,从而使得所述osmpk11蛋白的基因组dna序列发生能够抑制所述osmpk11蛋白表达。其中,所述靶标片段可位于所述osmpk11 蛋白的基因组dna序列的如下区域中的至少一种:增强子区、启动子区、外显子区、内含子区、终止子区。当所核酸酶为转录激活因子样效应因子核酸酶或锌指核酸酶时,对所述osmpk11蛋白的基因组dna序列进行基因编辑,是通过如下实现的:向所述受体植物的细胞或组织中导入表达转录激活因子样效应因子核酸酶或锌指核酸酶的遗传物质,或者直接导入转录激活因子样效应因子核酸酶或锌指核酸酶,再将导入后的细胞或组织培养成完整植株。当所核酸酶为crispr/cas9核酸酶时,对所述osmpk11蛋白的基因组dna序列进行基因编辑,是通过如下实现的:向所述受体植物的细胞或组织中导入表达crispr/cas9核酸酶的遗传物质,或者直接导入cas9蛋白及向导rna,再将导入后的细胞或组织培养成完整植株。所述遗传物质可为dna质粒或dna线性片段或体外转录的rna;即根据所述核酸酶种类的不同,所述遗传物质可为能表达转录激活因子样效应因子核酸酶、锌指核酸酶、cas9蛋白、向导rna、tracrrna、crrna的dna质粒或dna线性片段或体外转录的rna。所述细胞为任何能作为导入受体并能经过组织培养再生为完整植株的细胞(如原生质体细胞或悬浮细胞等);所述组织为任何能作为导入受体并能经过组织培养再生为完整植株的组织(如愈伤组织、幼胚、成熟胚、叶片、茎尖,幼穗或下胚轴等)。所述导入的方法可为基因枪法、农杆菌侵染法、peg诱导原生质体法、电极法、碳化硅纤维介导法、真空渗入法或其他任何导入方法。其中,所述osmpk11蛋白的基因组dna序列具体为序列表中序列1。在本发明的一个实施例中,所述序列特异核酸酶具体为转录激活因子样效应因子核酸酶,所述转录激活因子样效应因子核酸酶对所述osmpk11蛋白的基因组dna序列的两个作用靶点分别为:序列表中序列1的第1535-1551位,以及序列表中序列1的第1570-1587位。进一步,组成所述类转录激活因子效应物核酸酶的两个talen蛋白的氨基酸序列分别如序列表6的第3-950位和第995-1972位。在所述(b)中,所述促进受体植物中osmpk11蛋白的表达可通过如下实现:向所述受体植物中导入编码所述osmpk11蛋白的核酸分子,从而促进所述受体植物中所述osmpk11蛋白的表达。其中,所述“编码所述osmpk11蛋白的核酸分子”可为编码所述osmpk11蛋白的dna分子或rna分子;所述dna分子具体可为如下1)至5)中任一所述的dna分子;所述rna分子具体可为如下1)至5)中任一所述的dna分子转录所得的rna分子:1)序列表中序列1所示的dna分子;2)序列表中序列2所示的dna分子;3)在严格条件下与1)或2)所限定的dna分子杂交且编码所述osmpk11蛋白的dna分子;4)与1)-3)任一限定的dna分子具有90%以上同一性且编码所述osmpk11蛋白的dna分子。当所述“编码所述osmpk11蛋白的核酸分子”为dna分子时,可先进行如下修饰,再导入所述受体植物中,以达到更好的表达效果:(1)根据实际需要进行修饰和优化,以使基因高效表达;例如,可根据所述受体植物所偏爱的密码子,在保持本发明所述osmpk11蛋白的氨基酸序列不改变的同时改变其密码子以符合植物偏爱性;优化过程中,最好能使优化后的编码序列中保持一定的gc含量,以最好地实现植物中导入基因的高水平表达,其中gc含量可为35%、多于45%、多于50%或多于约60%;(2)修饰邻近起始甲硫氨酸的基因序列,以使翻译有效起始;例如,利用在植物中已知的有效的序列进行修饰;(3)与各种植物表达的启动子连接,以利于其在所述受体植物中的表达;所述启动子可包括组成型、诱导型、时序调节、发育调节、化学调节、组织优选和组织特异性启动子;启动子的选择将随着表达时间和空间需要而变化,而且也取决于靶物种;例如组织或器官的特异表达启动子,根据需要受体在发育的什么时期而定;尽管证明了来源于双子叶植物的许多启动子在单子叶植物中是可起作用的,反之亦然,但是理想地,选择双子叶植物启动子用于双子叶植物中的表达,单子叶植物的启动子用于单子叶植物中的表达;(4)与适合的转录终止子连接,也可以提高本发明基因的表达效率,任何已知在植物中起作用的可得到的终止子都可以与本发明基因进行连接;(5)引入增强子序列,如内含子序列(例如来源于adhl和bronzel)和病毒前导序列(例如来源于tmv,mcmv和amv)。在本发明中,所述“同一性”指与天然核酸序列的序列相似性。“同一性”可以直接观察或采用计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。在本发明中,所述“转基因植物”理解为不仅包含将相关遗传物质或非遗传物质转化到所述受体植物中后得到的第一代转基因植物及其无性系,也包括其子代及其无性系。对于所述转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物可为种子、愈伤组织、完整植株或细胞。在上述应用或方法中,所述植物既可以为单子叶植物,也可以为双子叶植物。在本发明的一个实施例中,所述植物为单子叶植物中的禾本科植物,具体为水稻(具体如水稻品种日本晴)。本发明的实验证明,向日本晴水稻中导入针对所述osmpk11蛋白的基因组dna序列的基因编辑工具(talen核酸酶)的编码基因得到的osmpk11突变体转基因水稻(osmpk11基因发生突变,改变了osmpk11基因的阅读框,使其失去功能),突变体表现出干旱敏感表型,说明osmpk11或与osmpk11相关的生物材料可用于调控植物的抗旱,对于培育抗旱植物特别是水稻新品种具有重要意义。附图说明图1为pgw3-t-osmpk11在水稻原生质体的活性检测。其中,marker中各条带由大到小依次为1000bp、750bp、500bp、250bp和100bp。图2为t0代osmpk11基因的talen敲除纯合突变体基因型。图3为t2代osmpk11纯合突变体在干旱处理5天时的抗旱表型。图4为t2代osmpk11纯合突变体在田间正常种植灌溉条件下的表型。其中,a为野生水稻(wt);b为t2代osmpk11纯合突变体。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。农杆菌菌株agl1(agrobacteriumstrainagl1):文献:hellens,r.,mullineaux,p.,andklee,h.(2000).technicalfocus:aguidetoagrobacteriumbinarytivectors.trendsinplantscience5:446-451.公众可从中国科学院遗传与发育生物学研究所获得。水稻日本晴(oryzasatival.ssp.japonicacv.nipponbare):文献:stephena.goffetal.adraftsequenceofthericegenome(oryzasatival.ssp.japonica).science.2002,(296):92,公众可从中国科学院遗传与发育生物学研究所获得。实施例1、osmpk11的生物信息学分析osmpk11是水稻osmpk家族中的b组成员,该基因位于第8号染色体上。其在日本水稻注释计划riceannotationprojectdatabase(rap-db)美国水稻基因组注释计划themsuricegenomeannotationprojectdatabase(rgap7)的登录号分别是os08g0157000和loc_os08g06060。osmpk11基因在水稻基因组中的序列如序列表中序列1所示;cdna序列如序列表中序列2所示;编码的osmpk11蛋白的氨基酸序列如序列表中序列3所示。该基因共有6个外显子。本发明在基因的第四外显子上设计了转录激活子样效应因子核酸酶(talens)的靶序列。以期对osmpk11基因进行敲除。实施例2、osmpk11靶位点的设计及相关敲除载体的构建在水稻基因组中osmpk11基因的第四外显子处设计一对talen,靶位点序列如下:5’-tcagagtacactgcagctattgatatctggtcggtaggctgcatccttggtga-3’;其中的小写字母为间隔序列,两侧大写字母为talen模块识别序列(分别命名为l-arm和r-arm);下划线为ecorv酶切识别序列;将识别l-arm的talen命名为t-osmpk11-l;识别r-arm模块talen命名为t-osmpk11-r。其左侧识别模块l-arm的rvd序列为:hdninnninnngnihdnihdngnnhdninnhd;右侧识别模块r-arm的rvd序列为:hdnihdhdnininnnnningnnhdninnhdhdng。将编码t-osmpk11-l/t-osmpk11-r的dna片段分别与核酸内切酶foki的dna编码片段融合后得到dna片段t-osmpk11。t-osmpk11-l和t-osmpk11-r构建在同一表达盒中并被18个氨基酸组成t2a连接,可以在表达时断开形成两个蛋白。结合到靶位点处形成foki二聚体,行驶对osmpk11靶位点的编辑。dna片段t-osmpk11的序列如序列4所示,其中7-2850位编码l-arm的编辑蛋白t-osmpk11-l:7-27位编码核定位信号nls;第463-2052位编码l-arm的talen识别模块蛋白;第2248-2850位编码核酸内切酶foki(603bp);第2851-2904位编码由18个氨基酸残基组成的t2a序列;序列4中2983-5916位编码r-arm的编辑蛋白t-osmpk11-r,第2983-3003位编码核定位信号nls;3439-5130位编码r-arm的talen识别模块蛋白;第5326-5916位编码foki核酸内切酶(591bp)。将序列4所示的dna片段通过gateway克隆(invitrogengatewaylrclonaseiimix克隆酶)方法插入pgw3载体的玉米ubiquitin启动子下游,获得重组载体pgw3-t-osmpk1。所述载体pgw3是将载体pmdc32(arabidopsisbiologicalresourcecenter,网址:http://abrc.osu.edu/,stock#cd3-738)中hindiii和acc65ⅰ位点间的35s启动子替换为序列表序列5的第7-1993位所示的玉米ubiquitin启动子后得到的重组质粒(shan,q.,wang,y.,chen,k.,liang,z.,li,j.,zhang,y.,zhang,k.,liu,j.,voytas,d.f.,zheng,x.,zhang,y.andgao,c.(2013)rapidandefficientgenemodificationinriceandbrachypodiumusingtalens.mol.plant6,1365–1368.)。实施例3、osmpk11靶位点talen的活性筛选将实施例2构建完成的重组载体pgw3-t-osmpk11大量提取之后通过peg介导的方式转入水稻品种日本晴的原生质体,25℃避光培养48小时,然后提取原生质体的 基因组dna,用特异引物通过pcr扩增包含靶位点的osmpk11基因,然后将含有靶位点osmpk11的pcr扩增产物用ecorv酶切(如果pcr扩增产物有部分条带不能被切开,说明实施例1中设计的靶位点有活性),将不能被限制性内切酶ecorv切开的pcr扩增产物进行测序。用于扩增含有靶位点osmpk11的引物序列如下:上游引物osmpk11-iden-f:accagccactaacagatgatcac(序列1的第1164-1186位);下游引物osmpk11-iden-r:cccatgaacagatgattgactg(序列1的第1700-1721位的反向互补序列)。原生质体中检测重组载体活性的酶切结果见图1,泳道3为转化后的原生质体,其中含有不能被ecorv切开的pcr条带(大小约为558bp,与设计预期一致),同时也含有能被ecorv切开的两个dna条带(大小分别约为395bp和163bp,与设计预期一致),说明靶位点t-osmpk11有活性;泳道2为野生型对照pcr产物ecorv酶切结果,含有ecorv酶切产生的两个dna条带(大小分别为395bp和163bp,与设计预期一致);泳道1为野生型对照pcr产物未经ecorv酶切(大小为558bp)。进一步将泳道3中未被酶切开的条带切胶回收后测序,结果表明靶位点处产生了少量碱基的插入与缺失,证实重组载体pgw3-t-osmpk11在靶位点处进行了基因定点编辑。将重组载体pgw3-t-osmpk11热击转化农杆菌菌株agl1,获得含有重组载体pgw3-t-osmpk11的重组农杆菌,命名agl1/pgw3-t-osmpk11;同时将空载体pgw3热击转化农杆菌菌株agl1,获得含有重组载体pgw3的重组农杆菌,命名为agl1/pgw3。实施例4、定点敲除水稻基因组中的osmpk11基因一、农杆菌介导法转基因水稻的构建用实施例3中获得的重组农杆菌agl1/pgw3-t-osmpk11和agl1/pgw3分别侵染水稻品种日本晴(oryzasatival.ssp.japonicacv.nipponbare)成熟胚诱导的愈伤组织,将获得抗性愈伤组织分别命名为抗性愈伤t-osmpk11和抗性愈伤ck1。其中,重组农杆菌侵染愈伤组织的具体方法如下:(1)将25%次氯酸钠消毒后的日本晴水稻种子接种于愈伤组织诱导培养基上,28℃黑暗培养7天,去除芽和残留胚乳后再置于愈伤组织继代培养基上继代培养4-6周,得到成熟胚愈伤组织。(2)将重组农杆菌接种于yeb液体培养基(含50μg/ml卡那霉素和25μg/ml利福平)中,28℃振荡培养至od600为1.0-1.5;以10000rpm室温离心1min,用aam液体培养基(其中,葡萄糖浓度为100g/l,乙酰丁香酮浓度为100μm,ph5.2)重悬 菌体并稀释至od600为0.1,得到菌悬液。(3)将步骤(1)得到的成熟胚愈伤组织浸于步骤(2)得到的菌悬液中25-30min后,于含有两层滤纸的共培养培养基上,25℃黑暗下共培养3天。(4)将经过步骤(3)共培养的愈伤组织;用无菌水清洗6次,再用含500mg/l羧苄青霉素(car)的无菌水浸泡45min之后置于无菌滤纸上风干。将愈伤组织接种于含有50mg/l潮霉素的筛选培养基中28℃黑暗下筛选培养2周,转入新配置的筛选培养基中进行再次筛选培养,获得存活的淡黄色抗性愈伤组织。(5)从经两轮筛选后长出的抗性愈伤组织中,挑选乳黄色致密的抗性愈伤组织转至含有50mg/l潮霉素的分化培养基上,先暗培养3天,然后转至15h/d光照条件下培养,一般经过15-25天左右,有绿点出现。30-40天后进一步分化出小苗。(6)当抗性愈伤组织分化的芽长至约2cm时,得到分别转入pgw3-t-osmpk11和pgw3空载体的t0代转基因植物。将小苗移到生根培养基上,培养两周左右。选择高约10cm、根系发达的小苗,洗去培养基,移栽至田间。其中,所用的培养基如下:1、培养基母液配方:1)20×n6培养基母液:注:配制时按表中所列顺序逐一添加。2)100×b5微量母液(每升含量):3)b5有机母液:4)100×铁盐注:配制顺序如下:①称取2.78gfeso4·7h2o溶解于200ml去离子水中(a)。②称取3.73gna2-edta·2h2o溶解于200ml去离子水中(b)。③将b置于70℃水浴锅中直至溶质完全溶解(c)。④将a倒入c中混合,置于70℃水浴锅中保温2h。⑤定容至1l。5)aa大量元素母液(每升含量):2、培养基配方1)愈伤组织诱导培养基(每升含量):(ch:caseinhydrolysate,水解酪蛋白)2)愈伤组织继代培养基(每升含量):3)共培养培养基(每升含量):4)筛选培养基(每升含量):5)分化培养基配方(每升含量):6)生根培养基配方(每升含量):7)悬浮农杆菌感染愈伤组织团的培养基配方(aam)每升含量:二、talens诱导的转基因t0代植物突变筛选1、在步骤一获得t0代转基因植物之后,利用pcr/re对所有获得的转基因植物进行突变筛选。涉及到引物为实施例3中描述,涉及的内切酶和检测标准在实施例3中描述。结果显示:经pcr/re检测后,t0代共获得126株转入重组载体pgw3-t-osmpk11的转基因植株。其中共有9株植物中osmpk11基因talen结合位点处有突变;9株突变体中有2株为纯合突变体带型,7株为杂合突变体带型,突变效率为7.1%(携带突变的植株数目/t0代获得的转基因植物总数)。2.osmpk11突变体基因型测序确定将上述t0代植物中的pcr/re筛选出的转入重组载体pgw3-t-osmpk11的突变体植株的pcr产物连接peasyblunt克隆载体(transgenbiotech)。转化大肠杆菌后37℃培养过夜,在蓝白斑筛选培养基上挑取白色单克隆测序,确定各株系基因型。选取其中移码突变株系osmpk11-t0-6,osmpk11-t0-8和osmpk11-t0-15。进行后续试验。对其中3个t0代osmpk11talen位点纯合突变体植株(t0-6、t0-8和t0-15)的测序结果见图2,其中t0-6在设计的靶位点处含有23bp的碱基删除;t0-8在设计的靶位点处含有2bp碱基的删除;t0-15在设计的靶位点处含有20bp碱基的删除同时有10bp新序列的插入。这些突变都最终改变osmpk11基因的阅读框,使其失去功能,获得osmpk11纯合突变体。实施例5、水稻基因osmpk11敲除突变体的干旱处理敏感表型将实施例4获得的t0代osmpk11talen位点突变体植株(t0-6、t0-8和t0-15)自交后代鉴定纯合突变体,获得t2代osmpk11纯合突变体后进行干旱处理。具体如下:首先将种子在75%乙醇中洗涤1min,然后将种子转移到25%次氯酸钠溶液中消毒30min;然后将种子用无菌水洗5遍后置于37℃催芽48小时。催芽两天后,将萌芽的种子置于水培皿中培养10天。将10天的幼苗转移至无菌土中,每3天浇水一次,期间浇1/2ms营养液三次,培养30天。在第30天时,水饱和之后断水干旱处理,干旱处理5天左右拍照记录表型。处理7天之后复水,5天后统计存活率。实验同时设置未转基因的日本晴水稻作为野生型对照,同时以转入pgw3空载体的转基因水稻作为空载体对照。实验设置3次重复,定量结果取均值。每次重复中保证供试的各水稻材料均不少于30株。结果显示,在干旱处理过程中t2代osmpk11纯合突变体水稻失水速率比野生型水稻和空载体对照水稻要快。干旱处理5天时t2代osmpk11纯合突变体水稻和野生型水稻的表型见图3。而osmpk11纯合突变体在正常栽培条件下与野生水稻无明显表型差异(图4)。各水稻干旱处理7天后复水5天时统计的存活率情况如表1所示,可见与野生水稻相比,t2代osmpk11纯合突变体水稻的存活率显著降低(p<0.05)。另外,空载体对照水稻的存活率与野生水稻的存活率基本一致,无统计学差异。表1osmpk11纯合突变体水稻和野生水稻在干旱处理7天后复水5天时的存活率重复1重复2重复3均值(%)osmpk11纯合突变体203026.725.5野生水稻53.363.36058.9以上结果表明:与野生水稻相比,osmpk11纯合突变体水稻表现出干旱处理敏感表型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺