一种联合Tlr4和Tlr7激动剂共刺激扩增人NK细胞的方法与流程
本发明属于生物医药领域、细胞免疫学及肿瘤免疫治疗领域,涉及一种联合Tlr4和Tlr7激动剂共刺激扩增人NK细胞的方法和抗肿瘤过继免疫治疗应用。
背景技术:
由于肿瘤具有较高的损害性和病死率,肿瘤疗法的研究和应用一直是人们关注的焦点,肿瘤免疫治疗是现今用于研究肿瘤治疗的热点,而且免疫细胞疗法在临床得到广泛的应用,目前国内开展最多的就是免疫细胞过继性回输疗法。
NK细胞即自然杀伤细胞主要表达CD3-CD56+表型,是天然免疫系统的重要组成部分,是机体抗肿瘤、抗感染免疫的第一道防线。与T淋巴细胞不同的是,NK细胞不需要肿瘤特异性抗原识别就可以直接杀伤肿瘤细胞和病毒感染的细胞。在临床上,NK细胞对黑素瘤、乳腺癌、肝癌、肺癌、结肠癌、肾癌、膀胱癌和白血病等肿瘤治疗有明显疗效。
目前有关免疫细胞在肿瘤免疫治疗领域的研究主要集中在自体NK细胞过继免疫治疗,并取得了一定的成效。但如何在保证临床安全性的前提下同时提高NK细胞体外增殖效率和杀伤活性,增强适用于临床应用的免疫细胞的离体增殖和活化的改进,简化并具有成本低廉的方法仍存有很大需求。
技术实现要素:
本发明的目的是克服现有细胞技术的不足,通过Tlr4a和Tlr7a优化刺激NK细胞培养方案的基础上,提供了一种更新的人NK细胞的制备方法及其应用,解决了现有技术NK细胞培养后,异质性细胞群体增值力不高、细胞毒活性提高不一种联合Tlr4和Tlr7激动剂共刺激扩增人NK细胞的方法,包括步骤:
1)采集人的外周静脉血,获得单个核细胞;
2)加入一系列细胞因子、Tlr4a和Tlr7a刺激进行NK细胞的诱导培养;
3)NK细胞培养扩增及收集。
所述步骤1)具体包括:从人静脉穿刺采集患者外周血,转移至含有肝素钠的抗凝管中,混合均匀,将外周血样本移至离心管进行离心,获得血清和全血细胞,上层血浆灭活备用,全血细胞用生理盐水稀释,淋巴分离液密度梯度离心分离单个核细胞,生理盐水重悬单个核细胞,离心收集单个核细胞。
所述步骤2)具体包括:将步骤1)中收集的单个核细胞重悬于含5~20%自体灭活血浆的培养基等无血清培养基中,调整细胞密度(1~2)×106/ml左右,加入Tlr4a和Tlr7a各0.05ug/ml~50ug/ml,并加入IFN-γ至终浓度500~1000IU/ml,最后转移入培养瓶内进行培养;培养20~28小时后同时加入抗CD3单抗、IL-1α、IL-2,继续放置于CO2恒温培养装置中培养。
所述步骤3)具体包括:将步骤2)的细胞每2-3天补加含有IL-2的新鲜培养基,调整细胞密度到在(0.5~2)×106/ml,连续培养11~15天;培养11~15天后收集NK细胞。
所述加入抗CD3单抗浓度为50~500ng/ml,IL-1α浓度为0.5~5ng/ml,IL-2浓度为50~1000IU/ml。
本发明所提供的人NK细胞,是指以NK细胞为主效应细胞,与K562细胞共培养18小时对肿瘤细胞杀伤活性可达95%左右。
本文中的“CD3-CD56+细胞”表示CD3阴性和CD56阳性的NK细胞。
细胞组成:CD3阳性表达率在90%以上,CD3-CD56+细胞约在30~50%。
本发明的目的是得到一种可以用于临床的高效抗肿瘤过继免疫活性细胞。
上述方法培养的NK细胞与常规培养制备的NK细胞相比,其对K562细胞的杀伤活性都明显增加,体外实验时杀瘤活性达到90%以上,明显高于常规方法培养的NK细胞。本方法可在体外培养条件下获得大量的、应用安全的以及杀伤活性强的NK细胞,同时也具有制备成本低廉、工序简单、条件易控、对设 备的要求较低、易于规模化生产等优势。本发明还提供了NK细胞体外制备的诱导培养体系。通过本发明所制备的NK细胞应用可用于癌症病人的治疗或者癌症高危人群的预防及抗病毒的治疗等。
Toll样受体(TLRs)是存在于不同类型细胞上的模式识别受体,这种受体的模式识别机制是机体抵抗病原菌的第一道“特异性”屏障,在TLRs家族中,TLR配体能特异性激活TLR,其中Tlr4a和Tlr7a有很强的免疫佐剂作用,Tlr4a单磷酰脂质A(Monophosphoryl lipid A,MPLA)是一种低毒性的LPS衍生物,而Tlr7a是本发明自主研发的一类腺嘌呤类似物(化学式如下图所示),均具有良好的免疫刺激活性,可以作为免疫佐剂使用,可以通过诱导前细胞因子产生抗病毒和抗肿瘤作用。
1H NMR(400MHz,DMSO-d6)δ12.084(brs,1H),9.954(s,1H),6.486(s,2H),4.249(t,J=3.60Hz,2H),3.693(t,J=5.20Hz,2H),3.584(t,J=3.60Hz,2H),3.266(s,3H),2.205(t,J=6.00Hz,2H),1.844(t,J=5.60Hz,2H).13C NMR(100MHz,DMSO-d6)δ174.15,160.09,152.67,149.75,147.88,98.61,70.62,65.65,58.45,38.86,31.14,23.80.MS(ESI)calculated for C12H17N5O5,m/z[M+1]312.1230;found 334.1120(M+Na)+.
本发明是在肿瘤免疫治疗中使用的一种联合Tlr4和Tlr7激动剂共刺激扩增人NK细胞的方法,使得主要表达CD3-CD56+表型的异质性细胞增加,制备出更有效的肿瘤杀伤性细胞,称之为Tlr4a-Tlr7a-NK。经过Tlr4a和Tlr7a刺激的NK细胞活化,并且产生共协同杀伤作用,具有更好的杀瘤活性。
附图说明
图1:培养第0、3、5、7、9、11、13、15天细胞倍增图。
图2:培养第15天流式细胞术进行NK成熟度检测。
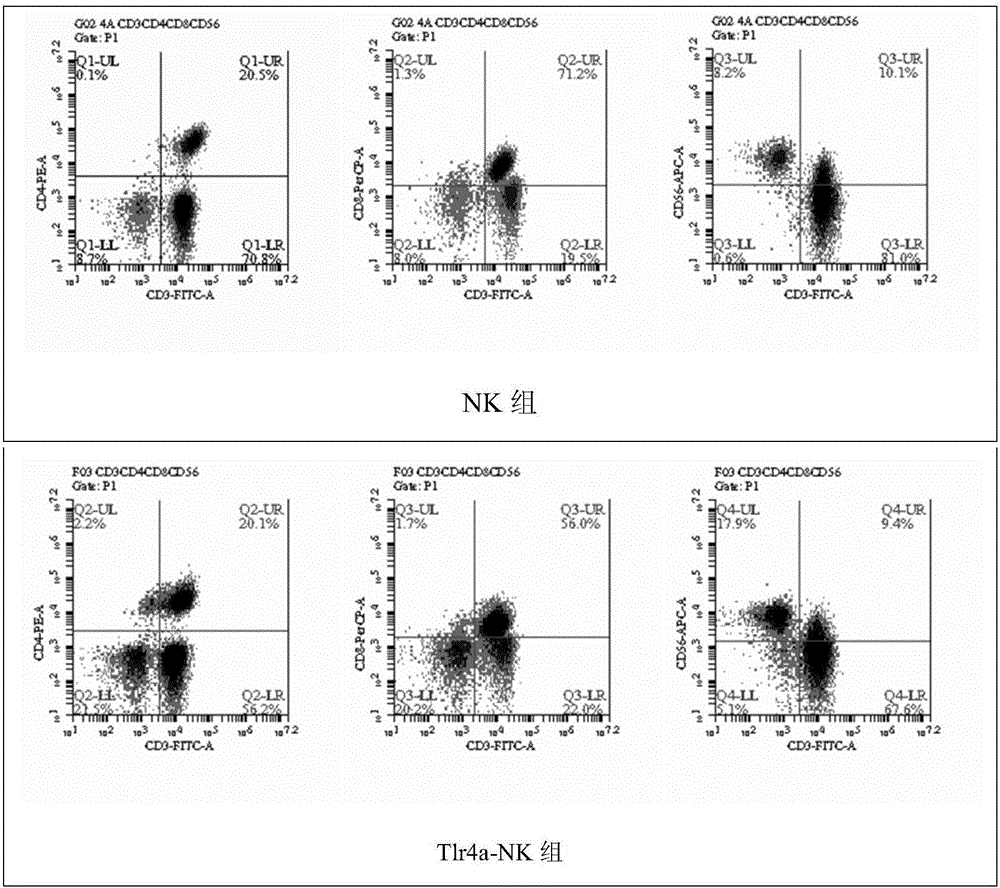
图3:采用流式细胞仪进行免疫表型检测(n=3)。外周血来源的PBMCs,通过不同培养体系培养,在第15天取细胞进行流式荧光抗体:抗CD3-FITC、CD4-PE、CD8-PECY5、CD56-APC进行表面染色并检测。NK组:指采用斯坦福大学应用的培养法培养的NK细胞;NK组:指本发明所采用的培养方式。
图4:采用CCK-8检测试剂盒进行各组不同培养方式培养的外周血来源PBMCs进行细胞毒性检测(n=3)。通过不同方式培养,在第15天取细胞通过CCK-8试剂盒进行细胞毒活性检测。NK组:指未加Tlr4a和Tlr7a的培养法培养的NK细胞;Tlr4a-Tlr7a-NK组:指本发明所采用的培养方法。横坐标:表示效靶细胞比值,E∶T=5∶1、E∶T=10∶1、E∶T=20∶1分别表示效应细胞与靶细胞的比值为5∶1、10∶1、20∶1。
具体实施方式
下面用实例来具体说明本发明,但本发明并不受其限制。下面实例中凡未注明具体条件的实验方法,均为遵照常规方法和厂家提供的操作说明执行。
实施例1
本实施例1是分离获得的PBMCs并进行培养。包括以下步骤:
1.从患者的静脉穿刺采集患者外周血100ml,转移至含有肝素钠的抗凝管中,上下混合均匀,经淋巴分离液密度梯度离心获得单个核细胞。具体步骤为:将混合均匀的全血1500转/分离心10分钟,吸取上层液体,即血浆,56℃灭活30分钟后,2500转/分离心10分钟,备用。用生理盐水1:1稀释沉淀的全血细胞,人淋巴细胞分离液和稀释的全血细胞液按1∶2的比例加入离心管中,2000转/分离心20分钟,吸取白膜层,用生理盐水洗涤2次,转速分别为1600转/分,1300转/分,均离心7分钟,即得到单个核细胞。
2.NK细胞的诱导培养。具体步骤为:将实施例1步骤中收集的单个核细胞重悬于含5~20%自体灭活血浆的RPMI-GT-T551TM培养基等无血清培养基中并加入IFN-γ至终浓度为1000IU/ml,TLR7配体GD至终浓度为10μg/ml,调整细胞密度(1~2)×106/ml左右,最后转移入培养瓶内进行培养,其中每2天补加含有IL-2的新鲜培养基,使补加培养基后的细胞密度控制在(0.5~1)×106/ml。;培养20~28小时后加入抗CD3单抗、IL-1α、IL-2,继续放置于37℃、5%CO2 培养箱中培养。连续培养15天,其中,抗CD3单抗浓度为50ng/ml,IL-1α的浓度为1ng/ml,IL-2的浓度为1000IU/ml。
3.在第0、3、5、7、9、11、13、15天进行细胞计数,检测活率,将当前细胞总数除以开始培养时的细胞总数,所得数值为细胞增殖倍数,结果见图1和表1。
表1:不同培养方式培养的外周血来源PBMCs扩增倍数(n=3)
结果显示,随着培养时间的延长,各组细胞均有95%以上活率,各组细胞均有增长,但从第9天后,Tlr4a-NK、Tlr7a-NK、Tlr4a-Tlr7a-NK较NK组的扩增速度均显著提高(P<0.05)。Tlr4a-NK和Tlr7a-NK无显著差异,Tlr4a-Tlr7a-NK较Tlr4a-NK、Tlr7a-NK组的扩增速度均显著提高(P<0.05)。
4.对NK细胞进行免疫表型检测。步骤如下:
取第15天的细胞,PBS洗涤,重悬,调整细胞密度至1×106/ml,每管加100μl细胞悬液,加荧光标记抗体(抗CD3-FITC、CD4-PE、CD8-PECY5.5、CD56-AP3)染色,避光孵育30min,用上述PBS洗涤,重悬稀释至100μl,用流式细胞仪进行检测,数据文件采用FLOWJO软件分析,结果见图2、图3、表2。
表2:不同培养方式对培养细胞表型影响(n=3)
结果显示,培养第15天,各细胞中,CD3-CD56+细胞的细胞均有表达,Tlr4a-NK、Tlr7a-NK、Tlr4a-Tlr7a-NK较NK组均显著提高(P<0.05)。Tlr4a-NK和Tlr7a-NK无显著差异,Tlr4a-Tlr7a-NK较Tlr4a-NK、Tlr7a-NK组均显著提高(P<0.05)。。
5.对NK细胞进行细胞毒活性检测。包括以下步骤:
取培养第15天的NK细胞,检测对K562肿瘤细胞株的杀伤活性。
调整K562的细胞密度为5×104/孔,96孔板,每孔200ul,分别按1∶5、1∶10、1∶20的比例与各组NK细胞混合,各浓度均设置3复孔,同时设置单独靶细胞(肿瘤细胞)对照、单独效应细胞(NK细胞)对照和单独培养基空白对照。
置于37℃、5%C02和饱和湿度的培养箱内培养18小时后,每孔加入20ul 的CCK-8溶液,再培养4h,然后用酶标仪于450nm波长处测定吸光度(OD)值。
根据公式:杀瘤率(%)=[1-(实验组OD值-效应细胞组OD值)]/(效应细胞组OD值)×100%,计算杀瘤效率。其中,公式中各OD值均为减去空白对照组OD值后的值。结果见图4、表3。
表3:不同培养方式对外周血来源PBMCs细胞毒活性影响(n=3)
结果显示,在各组效靶比之下,Tlr4a-NK、Tlr7a-NK、Tlr4a-Tlr7a-NK比NK组的杀伤活性均显著提高(P<0.05)。Tlr4a-NK和Tlr7a-NK无显著差异,Tlr4a-Tlr7a-NK比Tlr4a-NK、Tlr7a-NK组的杀伤活性均显著提高(P<0.05)。。这说明NK细胞经过改进的方案诱导后,其中的杀伤性细胞的细胞毒活性明显提高,从而使NK细胞整体细胞毒活性也明显提高,说明本发明的联合培养方法制备的NK细胞有更好的治疗优势。
- 还没有人留言评论。精彩留言会获得点赞!