一种产硫酸软骨素裂解酶的重组枯草芽孢杆菌及其应用的制作方法
本发明涉及一种产硫酸软骨素裂解酶的重组枯草芽孢杆菌及其应用,属于生物工程技术领域。
背景技术:
硫酸软骨素(Chondroitin sulfate,CS),是一类D-葡萄糖醛酸和2-乙酰氨基-2-脱氧硫酸-D-半乳糖通过β-1,3糖苷键相结合的双糖为基本单位,聚合而成的一类大分子多糖,分子量在5-50kDa之间。根据CS的结构、分子量的不同,可将CS划分为A、B、C、D、E、F、H、K、L和M等类别。常见的为CS A、B和C,CS A又称为4-硫酸软骨素,硫酸基在氨基半乳糖的第4位碳上,CS C又称为6-硫酸软骨素,硫酸基在氨基半乳糖的第6位碳上。CS B又称为硫酸皮肤素,与CS A互为异构体。目前,小分子量CS在医学领域具有重要作用,因此制备低分子CS具有重要意义。
硫酸软骨素裂解酶(Chondroitinase,ChSase)是一类能将硫酸软骨素、透明质酸等糖胺聚糖降解为不饱和二糖及寡糖的裂解酶。ChSase根据其作用底物的不同分为ChSase ABC、ChSase AC、ChSase B及ChSase C等。普通变形杆菌Proteus vulgaris是ChSase ABC的主要来源,分为ChSase ABC I和ChSase ABC II,两种酶对相同底物具有不同的动力学参数。ChSase ABCI基因含有3063bp的开放阅读框,其中含有72bp的前导肽序列,编码成熟后将切去24个氨基酸的前导肽。ChSase ABC II的基因含有2973bp的开放阅读框。对ChSase ABC I的酶学性质的研究表明,对于不同的底物,ChSase ABC I的测定温度为37℃,缓冲液为40mmol/l Tris-HCl(pH 8.0)并且ChSase ABC I比ChSase ABC II催化效率高。以CS A为底物时,ChSaseABC I比酶活为400U/mg,而ChSaseABC II比酶活为25U/mg;以CS B为底物时,ChSaseABC I比酶活为180U/mg,而ChSaseABC II为23U/mg。以透明质酸为底物时,两种酶的比酶活差不多,在3-5U/mg。
目前对于ChSase ABC的重组表达研究较少,Prabhakar等将cslABC重组到pET-28a载体中,仅得到少量可溶蛋白,大多以沉淀形式存在。高慧玲等建立了ChSase ABC I分泌型真核表达载体,结果以分泌形式表达。然而,已有报道李晔等人将P.vulgaris KCTC2579中的ChSase ABCI基因在Escherichia coli中得到可溶性表达,并通过MBP柱纯化得到了与从P.vulgaris中分离一致的酶,还对重组酶进行了酶活、比酶活和动力学常数等测定。
国内对于ChSase ABC的发酵生产主要存在两个方面的问题:一、发酵生产ChSaseABC 的菌株多数为胞内生产方式,且得到的酶活偏低,而破碎过程相对繁琐同时不易破碎完全。二、ChSase ABC发酵生产后的分离纯化也存在问题,分离后的比酶活虽有一定程度的提高,但总酶活损失较大。因此,发现、筛选或构建以分泌型生产ChSase ABC的菌株越来越重要,另外,优化发酵条件、探索新型的分离纯化方式,对于提高产量和酶活也至关重要。
技术实现要素:
本发明的第一个目的在于提供一种产硫酸软骨素裂解酶的重组枯草芽孢杆菌,以pP43NMK为表达载体,在枯草芽孢杆菌中导入编码硫酸软骨素裂解酶的基因,组成型表达硫酸软骨素裂解酶。
在本发明的一种实施方式中,所述编码硫酸软骨素裂解酶的基因为cslABC,其序列如SEQ ID NO.1所示。。
在本发明的一种实施方式中,所述表达载体上引入信号肽amyX。
在本发明的一种实施方式中,在信号肽amyX的C端与基因cslABC起始密码子之间加入6×His-tag标签,利用pP43NMK质粒本身的RBS,将强组成型启动子与信号肽融合,构建重组质粒,在枯草芽孢杆菌中进行异源表达。
在本发明的一种实施方式中,所述强组成型启动子为P43,或Pppnk,或PcsfB。
在本发明的一种实施方式中,以组成型启动子P43启动编码硫酸软骨素裂解酶的基因的表达。
在本发明的一种实施方式中,所述重组枯草芽孢杆菌以pP43NMK骨架为表达载体,引入信号肽amyX,在信号肽C端与基因起始密码子间加入6×His-tag标签,利用pP43NMK质粒本身的RBS,同时采用强组成型启动子,构建重组质粒,并在枯草芽孢杆菌中异源表达。
在本发明的一种实施方式中,所述枯草芽孢杆菌为Bacillus subtilis 168或Bacillus subtilis WB600。
在本发明的一种实施方式中,所述重组枯草芽孢杆菌是以pP43NMK为表达载体,利用质粒上本身的启动子P43和RBS,并在基因起始密码子前加入信号肽amyX和6×His-tag标签,以枯草芽孢杆菌Bacillus subtilis WB600为宿主,组成型表达编码硫酸软骨素裂解酶的基因。
本发明的第二个目的是提供构建所述重组枯草芽孢杆菌的方法,其步骤如下:(1)构建具有信号肽amyX的pP43NMK,(2)将编码硫酸软骨素裂解酶的基因cslABC插入所述质粒,(3)在信号肽amyX的C端与基因起始密码子间引入6×His-tag标签,(4)将P43启动子与信号肽amyX融合,(5)在枯草芽孢杆菌表达。
在本发明的一种实施方式中,所述方法是在信号肽amyX的基础上,使用三种强组成型 启动子和强RBS,并在信号肽C端与基因起始密码子之间加入6×His-tag标签,以pP43NMK骨架为表达载体,以Bacillus subtilis 168和Bacillus subtilis WB600为表达宿主,在质粒上表达硫酸软骨素裂解酶基因。
本发明的第三个目的是提供一种应用所述重组枯草芽孢杆菌发酵生产硫酸软骨素裂解酶的方法,所述方法是将重组芽孢杆菌接种至发酵培养基,在37℃发酵48h。
在本发明的一种实施方式中,碳源采用蔗糖。
在本发明的一种实施方式中,发酵培养基配方为:20g/L酵母粉,50g/L蔗糖,硫酸钾3.9g/L,硫酸镁1.5g/L,50mM磷酸盐缓冲液,pH 7.0。
有益效果:本发明利用硫酸软骨素裂解酶在枯草芽孢杆菌中的异源表达产裂解酶,具有较大的应用优势。首先,本发明过程中使用的宿主为食品级,可满足医疗卫生和食品安全的要求,无内毒素和病原感染的风险;其次,经调控元件优化后的硫酸软骨素裂解酶表达系统,酶活有一定幅度的提高。本发明能够使摇瓶上硫酸软骨素裂解酶胞外粗酶活达1.02U/ml,3L发酵罐上胞外粗酶活达21.4U/ml,在工业上具有潜在而广泛的应用价值。
附图说明
图1为PCR和凝胶核酸电泳鉴定3种重组质粒P43-H6cslA1、Pppnk-H6cslA1、PcsfB-H6cslA1在B.subtilis 168和B.subtilis WB600中的构建;泳道1-4:B.subtilis 168/P43-H6cslA1;泳道5-8:B.subtilis 168/Pppnk-H6cslA1;泳道9-12:B.subtilis 168/PcsfB-H6cslA1;泳道13-16:B.subtilis WB600/P43-H6cslA1;泳道17-20:B.subtilisWB600/Pppnk-H6cslA1;泳道21-24:B.subtilisWB600/PcsfB-H6cslA1;M:5000DL;
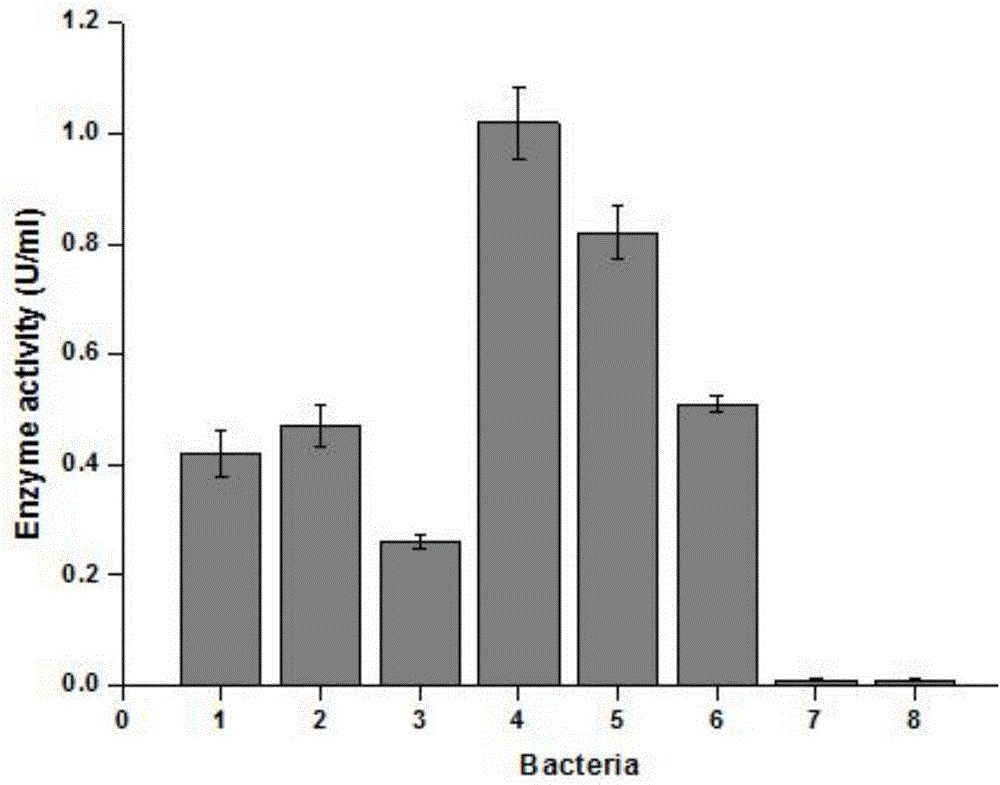
图2所示为6株重组枯草芽孢杆菌发酵第48h摇瓶上的胞外粗酶活;1.B.subtilis 168/P43-H6cslA1;2.B.subtilis 168/Pppnk-H6cslA1;3.B.subtilis 168/PcsfB-H6cslA1;4.B.subtilis WB600/P43-H6cslA1;5.B.subtilis WB600/Pppnk-H6cslA1;6.B.subtilis WB600/PcsfB-H6cslA1;7.B.subtilis 168;8.B.subtilis WB600;
图3所示为3L罐上重组枯草芽孢杆菌B.subtilis WB600/P43-H6cslA1的生长曲线和胞外粗酶活随时间的变化曲线。
具体实施方式
实施例涉及的核苷酸序列信息:
(1)SEQ ID NO.1序列信息为来源于普通变形杆菌(Proteus vulgaris)的硫酸软骨素裂解酶编码基因cslABC编码序列;
(2)SEQ ID NO.2序列信息为枯草芽孢杆菌组成型启动子P43的基因序列;
(3)SEQ ID NO.3序列信息为枯草芽孢杆菌组成型启动子Pppnk的基因序列;
(4)SEQ ID NO.4序列信息为枯草芽孢杆菌组成型启动子PcsfB的基因序列;
(5)SEQ ID NO.5序列信息为信号肽amyX的基因序列。
酶活测定方法:以硫酸软骨素A(CSA)为底物,浓度为1mg/ml,用Tris-HCl缓冲液(pH 8.0)溶解底物。酶活测定的反应体系为250μl,加入50μl粗酶液和200μl硫酸软骨素底物溶液。在37℃反应4min后,加入2ml的5M HCl终止反应。通过分光光度计测定在232nm处的吸光值。酶活单位定义为:1mL酶液每分钟内增加0.2OD为1个酶活单位。
实施例1重组质粒P43-H6cslA1、Pppnk-H6cslA1、PcsfB-H6cslA1的构建
设计引物AmyX-F和AmyX-R,采用标准的PCR扩增体系和程序,扩增获取序列如SEQ ID NO.5所示信号肽amyX。
设计引物CSL-F2和CSL-R2,以P.vulgaris ATCC6896的基因组DNA为模板,采用标准的PCR扩增体系和程序,扩增获取硫酸软骨素裂解酶基因cslABC(SEQ ID NO.1所示)。
启动子Pppnk和PcsfB来源于枯草芽孢杆菌Bacillus subtilis 168,B.subtilis 168菌株接种于5ml LB液体培养基,在37℃200rpm培养16h。收集菌体,采用细菌基因组提取试剂盒提取B.subtilis 168菌株的基因组DNA。根据已公布的基因组信息序列,分别设计引物Pppnk-F/Pppnk-R、PcsfB-F/PcsfB-R,以提取的B.subtilis 168基因组为模板,采用标准的PCR扩增体系和程序,扩增获取启动子Pppnk和PcsfB。
根据pP43NMK质粒图谱,设计引物P43-F和P43-R,以pP43NMK质粒为模板,采用标准的PCR扩增体系和程序,扩增获取启动子P43。
在扩增三个强组成型启动子P43、Pppnk和PcsfB的上游引物P43-F、Pppnk-F和PcsfB-F的5’端引入BamHI限制性酶切位点,在下游引物P43-R、Pppnk-R和PcsfB-R的5’端引入RBS序列(AAGAGAGGAATGTACAC);在扩增信号肽amyX的上游引物AmyX-F的5’端引入RBS序列,在下游引物AmyX-R的5’端引入6×His-tag序列(CACCACCACCACCACCAC);在扩增硫酸软骨素裂解酶基因cslABC的上游引物CSL-F2的5’端引入6×His-tag序列,在下游引物CSL-R2的5’端引入XhoI限制性酶切位点。
引物信息如下:5’-3’方向
AmyX-F:AAGAGAGGAATGTACACATGGTCAGCATCCGCCGCAG
AmyX-R:CCAATGTCATGTGGTGGTGGTGGTGGTGCATGATTTCCTTTTGTTCAGC
Pppnk-F:CGCGGATCCCGATAATATTGGCGTCTGAGTGC
Pppnk-R:GTGTACATTCCTCTCTTTCTCTCATTATACGATTCAATATGAAAAATG
PcsfB-F:CGCGGATCCAGGTGGAGAAGATGGACGAAACAG
PcsfB-R:GTGTACATTCCTCTCTTCTCAGTTTTAATATTATTATCTACTACGTTCAATC
P43-F:CGCGGATCCTGATAGGTGGTATGTTTTCG
P43-R:GTGTACATTCCTCTCTTACC
CSL-F2:CAAAAGGAAATCATGCACCACCACCACCACCACATGACATTGGCTATTATCAG
CSL-R2:CCGCTCGAGTCAAGGGAGTGGCGAGAGTT
将扩增获取的三个启动子分别与信号肽通过RBS序列作为重叠区域进行融合PCR,再与cslABC基因通过6×His-tag序列作为重叠区域进行融合PCR,分别获得P43-amyX-cslABC、Pppnk-amyX-cslABC、PcsfB-amyX-cslABC片段,采用琼脂糖凝胶核酸电泳进行切胶回收,回收产物与质粒pP43-D质粒(Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168,Metabolic Engineering,2016年1月公开)进行BamHI和XhoI双酶切,体系50μL:45μL片段或质粒,5μL 10×Green buffer,2.5μLBamHI酶,2.5μLXhoI酶。37℃酶切30min后将片段柱纯化。酶切后的质粒经1%的琼脂糖凝胶电泳后,切胶回收目标条带。回收产物进行连接,体系10μL:1μL双切的载体,4μL双切的目的片段,5μLSolution I连接酶,16℃连接过夜,转化JM109感受态细胞,挑取单菌落PCR验证,阳性重组子进行测序,比对正确,P43-H6cslA1、Pppnk-H6cslA1、PcsfB-H6cslA1质粒构建成功。
上述构建的3个重组质粒分别转化B.subtilis 168和B.subtilis WB600宿主,获得6个重组枯草芽孢杆菌菌株:B.subtilis 168/P43-H6cslA1;B.subtilis 168/Pppnk-H6cslA1;B.subtilis 168/PcsfB-H6cslA1;B.subtilis WB600/P43-H6cslA1;B.subtilis WB600/Pppnk-H6cslA1;B.subtilis WB600/PcsfB-H6cslA1。
实施例2 6株重组枯草芽孢杆菌的摇瓶培养及酶活测定
分别挑取上述构建的6个重组枯草芽孢杆菌菌株及对照菌B.subtilis 168和B.subtilisWB600,单克隆接种于5mL LB培养基,置于200rpm 37℃过夜培养。16h后按10%的接种量转接于250mL三角摇瓶,培养基为发酵培养基,装液量为25mL,置于200rpm 37℃培养48h。
各取8个摇瓶中第48h发酵液样品在5000×g,4℃离心5min,保留上清,测定上清中的粗酶酶活。从附图2看出,使用强组成型启动子、强RBS并加入组氨酸标签时,6株重组枯草芽孢杆菌B.subtilis 168/P43-H6cslA1;B.subtilis 168/Pppnk-H6cslA1;B.subtilis 168/PcsfB-H6cslA1;B.subtilis WB600/P43-H6cslA1;B.subtilis WB600/Pppnk-H6cslA1;B.subtilis WB600/PcsfB-H6cslA1在发酵第48h所产裂解酶的胞外粗酶活分别为0.42U/ml,0.47U/ml,0.26U/ml,1.02U/ml,0.82U/ml,0.51U/ml,而对照菌B.subtilis 168和B.subtilis WB600 的48h发酵上清中均未检测到硫酸软骨素裂解酶酶活。
实施例3重组枯草芽孢杆菌B.subtilisWB600/P43-H6cslA1的3L罐培养
挑取重组枯草芽孢杆菌菌株B.subtilis WB600/P43-H6cslA1,单克隆接种于 15mL LB培养基,置于200rpm 37℃过夜培养。16h后按10%的接种量转接于250ml三角瓶,装液量为150mL,继续置于200rpm 37℃过夜培养作为种子液。16h后按10%的接种量转接于3L发酵罐,装液量为1.5L,37℃恒温培养,通气量为2vvm,通过5M NaOH溶液调节pH维持在7.0。前4h搅拌转速为400rpm,之后变为600rpm。第7h待初糖耗尽开始补料,第7-9h补料为10g/L/h,第10-12h补料为15g/L/h,第13-24h补料为8g/L/h,第25h以后至发酵结束补料均为5g/L/h,发酵时间为60h。取样时间为第2h,4h,6h,8h,12h,18h,24h,30h,36h,42h,48h,54h,60h,分别测定各时间点取样样品的细胞光密度和胞外粗酶活。测定细胞光密度时,取1ml发酵液,8000×g离心10min,除去上清,将菌体用1ml ddH2O重悬,以ddH2O调零,在600nm处测定细胞密度OD600。胞外粗酶活按照实施例2中所述实施。从附图3中看出,菌体随时间延长而增加,到24h时菌体量达到最大,OD600约为40。酶活呈持续增加状态,但与菌体生长非偶联,当菌体量恒定时,胞外酶活仍上升,在第48h时达到最大,为21.4U/ml。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!