康普瑞汀药物前体、药物制剂和制备方法与流程
本发明属于药物合成领域,具体是涉及一种抗血管生成药物康普瑞汀亲脂性药物前体、合成方法及其纳米制剂和制剂的制备方法。
背景技术:
恶性肿瘤的生长和转移依赖于肿瘤血管,肿瘤依靠血管为自身输送氧气和营养物质,供其细胞的快速增殖,并导致肿瘤细胞向远端转移。随着肿瘤血管新生机制研究的深入,以及以肿瘤血管为靶点的药物在临床治疗肿瘤时取得较好的疗效,证实了通过抑制肿瘤血管新生来抑制肿瘤生长的理念。
康普瑞汀A4(Combretastatin,CA4)是从非洲灌木Combretum Caffrum的树皮分离的一种顺式二苯乙烯类天然物。20世纪80年代初,研究者在评估一系列Combretastatins化合物对体外细胞毒性时发现,CA4与秋水碱结构相似,能在远小于其最大耐受剂量(MTD)时即发挥活性作用,系CA4与微管蛋白结合/解离快,半衰期较短,体内消除快所致(Pettit GR,Singh SB,Hamel E,Lin CM,Alberts DS,Garcia-Kendall D,Isolation and structure of the strong cell growth and tubulin inhibitor combretastatin A4.Experentia,1989,45:209-211)。但是CA4的水溶性极差,生物利用度较低,从而限制了其临床应用。为了提高CA4的水溶性,使其更易于体内用药,传统方式是将CA4设计改造成磷酸二钠前药(CA4P),其磷酸盐基团在体内需要在磷酸酯酶的作用下转化成CA4,但是完全转化尚需要较长的时间,另外,药物动力学研究表明,CA4P的半衰期比较短,在体内消除较快,为维持阻断肿瘤血管,必须短时间内反复用药,副作用较大。
纳米载药体系具有良好的肿瘤靶向性,可改善药物的溶解性,降低药物的毒副作用,通过合理的抗肿瘤药物纳米给药系统的设计,纳米载药系统已经在抗肿瘤研究中取得了良好的应用前景。我们前期的实验中将CA4与两亲性高分子共组装形成纳米粒,但是结果显示,直接包载CA4的纳米粒存在药物快速释放的问题。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种药物释放时间延长、药物的疗效提高的亲脂性康普瑞汀药物前体。
本发明同时提供了上述亲脂性康普瑞汀药物前体的制备方法,该方法操作简单,易于实现大量生产。
本发明还提供了一种药物释放时间延长、药物的疗效提高的抗血管生成药物纳米粒康普瑞汀药物制剂。
本发明还提供了一种上述康普瑞汀药物制剂的制备方法,本发明将该药物前体与先进纳米技术结合,制备抗血管生成药物的纳米体系,延缓CA4的释放,延长药物的作用时间,提高药物的临床药效。
为解决上述技术问题,技术方案分别如下:
一种康普瑞汀药物前体,结构如下:
所述R为C1~C10的烷酰基。
作为优选,所述R为C1~C7的烷酰基。
作为进一步优选,所述康普瑞汀药物前体结构如下:
上述两种康普瑞汀药物前体,药物水解速率快,释放速度大幅度延缓。
一种上述康普瑞汀药物前体的制备方法,包括:康普瑞汀A4与所述烷酰基对应的羧酸、酰氯或者酸酐进行酯化反应,得到所述的康普瑞汀药物前体。
作为优选,采用康普瑞汀A4与所述烷酰基对应的羧酸的进行酯化反应制备得到,反应过程中,可根据需要添加催化剂,缩合剂等,比如可采用1-(3-二甲氨基丙基)-3-乙基碳二亚胺的盐酸盐作为缩合剂,4-二甲氨基吡啶作为催化剂,同时可利用N,N-二异丙基乙胺中和1-(3-二甲氨基丙基)-3-乙基碳二亚胺的盐酸盐中的盐酸。
作为进一步优选,所述康普瑞汀A4与羧酸、催化剂、缩合剂的摩尔比为1:1~1.5:0.5~1.5:1~1.5。
一种康普瑞汀纳米制剂,包括康普瑞汀药物前体和两亲性高分子材料,所述康普瑞汀药物前体的结构如下:
所述R为C1~C10的烷酰基。
作为优选,所述R为C1~C10的烷酰基。
作为优选,所述康普瑞汀药物前体的结构如下:
上述两种康普瑞汀药物制剂,药物水解速率快,8h即可释放约90%的活性药物;同时药物在纳米粒中的释放速度大幅度延缓,有利于药物在体内的长循环,发挥长时间药效。
作为优选,所述两亲性高分子材料选自聚乙二醇-聚乳酸(PEG-PLA)、聚乙二醇-聚乳酸-羟基乙酸(PEG-PLGA)、甲氧基聚乙二醇-聚乳酸(mPEG-PLA)或甲氧基聚乙二醇-聚乳酸-羟基乙酸(mPEG-PLGA)中的任意一种。
作为进一步优选,所述PEG-PLA、PEG-PLGA、mPEG-PLA或mPEG-PLGA中,PEG的分子量为2k~8k,mPEG的分子量为2k~8k,PLA的分子量为2k~16k,PLGA的分子量为2k~16k。
作为进一步优选,所述两亲性高分子材料为mPEG5k-PLA16k。
作为优选,所述康普瑞汀纳米制剂为粉剂或片剂、注射剂、丸剂。
一种制备上述任一技术方案所述康普瑞汀纳米制剂的方法,将康普瑞汀药物前体和两亲性高分子材料溶解在有机溶剂中,然后加入到水中,除去有机溶剂,得到康普瑞汀纳米制剂。
作为优选,所述有机溶剂为丙酮。
本发明提供了一种康普瑞汀亲脂性药物前体的合成及其纳米制剂。本发明中提供的康普瑞汀亲脂性药物前体能够快速水解释放活性药物成分,发挥药效。相对于未改性康普瑞汀组成的纳米粒的快速释放,本发明中的纳米粒可缓慢释放内部药物,有利于延长药物在体内的循环,提高药物的抗血管生成疗效,具有良好的临床应用前景和应用价值。
附图说明
图1为丁酸-CA4合成路线图;
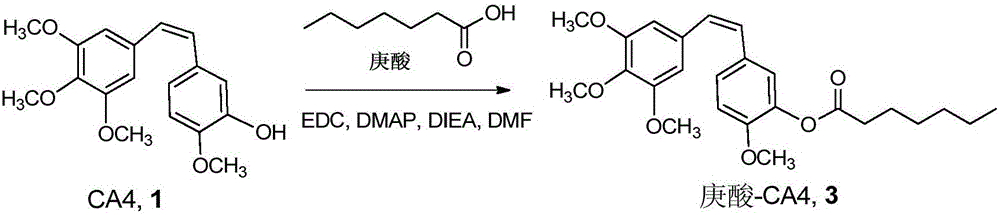
图2为庚酸-CA4合成路线图;
图3为实施例4中纳米粒电镜图;
图4为实施例3、4、5中纳米粒的粒径图;
图5为测试例1中CA4药物前体水解速率图;
图6为测试例2中纳米粒体外释放曲线;
图中,CA4表示康普瑞汀A4,DCM表示二氯甲烷,EDC·HCl表示1-(3-二甲氨基丙基)-3-乙基碳二亚胺的盐酸盐,DMAP表示4-二甲氨基吡啶,DIEA表示N,N-二异丙基乙胺。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步详细说明,但本发明并不受其限制。
实施例1
取丁酸(51.7μL,0.57mmol),CA4(化合物1,180mg,0.57mmol),EDC·HCl(163mg,0.855mmol),DMAP(76.6mg,0.627mmol),DIEA(188.9μL,1.14mmol)溶于4ml DCM中,室温下搅拌过夜,加入乙酸乙酯,分别依次用5%柠檬酸、饱和NaHCO3、饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,过滤,收集滤液后减压除去溶剂;固体用柱层析色谱分离纯化(乙酸乙酯:正己烷=1:3),得到目标产物丁酸-CA4偶联物化合物2(280mg,收率93%)。合成路线如图1所示。
产物丁酸-CA4的1H NMR核磁数据以及质谱数据如下:
1H NMR(400MHz,CDCl3):δ1.00-1.04(t,3H),1.73-1.78(m,2H),2.49-2.53(t,2H),3.71(s,6H),3.80(s,3H),3.83(s,3H),6.45-6.45(d,2H,J=1.2),6.51(s,2H),6.83-6.85(d,1H,J=8.4),7.00-7.01(d,1H,J=1.6),7.10-7.12(q,1H).
HR-ESI Qq-LTMS:计算值:[C22H26O6]+[M+H]+=387.1802;检测值:387.1811。
实施例2
取庚酸(80.8μL,0.57mmol),CA4(180mg,0.57mmol),EDC·HCl(163mg,0.855mmol),DMAP(76.6mg,0.627mmol),DIEA(188.9μL,1.14mmol)溶于4mL DCM中,室温下搅拌过夜,加入乙酸乙酯,分别依次用5%柠檬酸、饱和NaHCO3、饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,过滤,收集滤液后减压除去溶剂;固体用柱层析色谱分离纯化(乙酸乙酯:正己烷=1:3),得到目标产物庚酸-CA4偶联物化合物3(260mg,收率85%)。合成路线如图2所示。
1H NMR(400MHz,CDCl3):δ0.88-0.91(t,3H),1.26-1.41(m,6H),1.70-1.74(t,2H),2.51-2.54(t,2H),3.71(s,6H),3.80(s,3H),3.84(s,3H),6.45-6.45(d,2H,J=1.6),6.51(s,2H),6.83-6.85(d,1H,J=8.4),7.00-7.00(d,1H,J=1.6),7.10-7.12(q,1H).
HR-ESI Qq-LTMS:计算值[C25H32O6]+[M+H]+=429.2212;检测值:429.2282。
实施例3
将CA4(CA4含量0.5mg)和mPEG5k-PLA16k(药物质量的20倍)溶解于1mL丙酮中,均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到CA4纳米药物(记为1-NP)。
实施例4
将实施例1制备的丁酸-CA4偶联物2(按照CA4计,CA4的量为0.5mg)和mPEG5k-PLA16k(CA4前药质量的20倍)溶解于1mL丙酮中,均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到丁酸-CA4纳米药物(2-NP),2-NM电镜下形貌如图3,观察到纳米粒呈较好的圆形,大小均匀。
实施例5
将实施例2制备的庚酸-CA4偶联物3(按照CA4,CA4的量0.5mg)和mPEG5k-PLA8k(CA4前药质量的20倍)溶解于1mL丙酮中,均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到庚酸-CA4纳米药物(3-NP)。
DLS(动态光散射,Dynamic Light Scattering)测得各实施例1、2、3中制备的纳米粒的粒径如图4和表1所示。结果显示实施例3、4、5中制备的1-NP、2-NP、3-NP纳米粒的粒径均在30nm左右,并且粒径分布较窄,呈现较好的均匀性。
表1粒径大小
以下通过测试例进一步阐明本发明所述康普瑞汀前体及其纳米粒的体外特性:
测试例1:药物水解速率
取实施例1、2中制备的CA4药物前体化合物2、化合物3,分别溶于DMSO(CA4等同量2mg/mL),再用HEPES(4-羟乙基哌嗪乙磺酸,pH 8.0)稀释至0.5mg/mL(CA4等同量),置于37℃,每隔一定时间,取出100μL液体分析,绘制药物水解曲线。如图5所示,CA4药物前体化合物2、化合物3能够在体外环境中快速水解,8h即可释放约90%的活性药物。
测试例2:体外释放实验
取实施例3~5中制备的1-NP、2-NP、3-NP各10mL置于分子量为14kDa的透析袋中,释放条件为50mL、pH 7.4的磷酸缓冲液(含0.2%的吐温80),37℃,不同时间点取出外界磷酸缓冲液,用HPLC测得CA4含量,从而得到纳米粒中药物的体外释放情况。药物的释放曲线如图6所示,结果显示与自由药物CA4组成的纳米粒1-NP相比,对CA4进行结构改性后的2-NP和3-NP释放速度明显减缓,24h,1-NP释放率达91%,而2-NP和3-NP的释放率分别为37%和4.6%。实验证实,对CA4的结构改造,有效延缓药物在纳米粒中的释放速度,有利于药物在体内的长循环,发挥长时间药效。
- 还没有人留言评论。精彩留言会获得点赞!