用于H5N6禽流感病毒检测的试剂、检测方法及应用与流程
本申请涉及禽流感病毒检测领域,特别是涉及一种用于H5N6禽流感病毒检测的试剂、检测方法及应用。
背景技术:
禽流感是由病毒引起的动物传染病,通常只感染鸟类。人感染后的症状主要表现为高热、咳嗽、流涕、肌痛等,多数伴有严重的肺炎,严重者心、肾等多种脏器衰竭导致死亡。可通过消化道和呼吸道进入人体传染给人,人类直接接触受禽流感病毒感染的家禽及其粪便或直接接触禽流感病毒也可以被感染,通过飞沫及接触呼吸道分泌物也是传播途径。如果直接接触带有相当数量病毒的物品,如家禽的粪便、羽毛、呼吸道分泌物、血液等,也可经过眼结膜和破损皮肤引起感染。禽流感危害极大,变异极强,宿主范围极广,是传播性极强的传染病和人兽共患病;也是WHO、FDA、OIE等国际组织联合倡导全球共同防控的重大疫病。
禽流感是由禽流感病毒,即甲型流感病毒引起的疾病。禽流感病毒有抗原漂移和抗原转变的要求,变异性极大,不断涌现新的病毒,近年来新型病毒出现的频率明显加大。禽流感病毒是依据病毒表面的血细胞凝集素(H)和神经氨酸酶(N)来命名的,其中H有16个亚型,N有9个亚型。H5N6禽流感病毒是禽流感病毒的一种亚型。
1997年香港首次报道H5N1、H9N2感染人,2004年出现H5N1全球性流行,2013年3月在我国首先出现了H7N9型禽流感,2014年12月20日至2015年1月27新增83起人感染甲型H7N9禽流感病毒。H5N2禽流感主要在越南、韩国、泰国等东亚多国严重爆发,并造成越南多名病人丧生,中国河北省保定市首次发生H5N2禽流感疫情。2016年前后,广东肇庆和深圳接连出现H5N6流感病例,深圳2例病例中,一人死亡。自2014年8月以来,中国境内广东、湖南等12个省份家禽共发生新型H5N6高致病性禽流感25起,我国周边如日本、韩国、俄罗斯也均有H5N6发生流行,新出现的H5N6逐步代替H5N1而成为家禽和人群中的优势流行毒株。目前尚没有比较有效的H5N6禽流感病毒的检测试剂和方法。
技术实现要素:
本申请的目的是提供一种用于H5N6禽流感病毒检测的试剂、检测方法及应用。
本申请采用了以下技术方案:
本申请的一方面公开了一种用于H5N6禽流感病毒检测的试剂,该试剂包括引物对和探针,探针在引物对的扩增靶标区域内,引物对的上游引物为Seq ID No.1所示序列,引物对的下游引物为Seq ID No.2所示序列,探针为Seq ID No.3所示序列或者Seq ID No.3所示序列的反向互补序列;
Seq ID No.1:5’-AAATTATTCTGAGGGTGATTATTTATTATTGT-3’
Seq ID No.2:5’-ATCGGTAGTAAGCCTGCTAATAGGA-3’
Seq ID No.3:5’-GGGTGATTATTTATTATTGTTGTTGTTGGGYTGGT-3’
Seq ID No.3所示序列中,Y为C或者T碱基。
需要说明的是,Seq ID No.3所示序列Y为简并碱基,其可以为C或者T碱基。本申请中,探针为Seq ID No.3所示序列或者Seq ID No.3所示序列的反向互补序列,可以理解,在实时荧光检测中,探针是特异性的结合到双链的其中一条链的,只要PCR扩增的时候,将结合的探针破坏,即可产生荧光信号,因此,可以采用Seq ID No.3所示序列的探针结合到其中一条链上,也可以采用Seq ID No.3所示序列的反向互补序列作为探针结合到另一条链上。
优选的,探针的5’端标记有HEX荧光基因,3’端标记有BHQ淬灭基团。
本申请的另一面公开了本申请的用于H5N6禽流感病毒检测的试剂在H5N6禽流感病毒检测中的应用。
本申请的另一面公开了本申请的用于H5N6禽流感病毒检测的试剂在制备H5N6禽流感病毒检测试剂盒或设备中的应用。
可以理解,本申请的试剂,实际上就针对H5N6禽流感病毒设计的特异性探针和引物,当然可以用于H5N6禽流感病毒的检测,或者用于H5N6禽流感病毒检测的试剂盒或设备。
本申请的另一面公开了一种用于H5N6禽流感病毒检测的试剂盒,该试剂盒中含有本申请的用于H5N6禽流感病毒检测的试剂。
优选的,试剂盒中还含有逆转录实时荧光PCR反应试剂。
需要说明的是,本申请的试剂实际上是针对H5N6禽流感病毒逆转录实时荧光PCR检测而设计的探针和引物,因此,可以将其制成试剂盒直接用于检测,而为了方便使用,试剂盒中还可以包括逆转录实时荧光PCR反应试剂,例如AgPath-ID one-step RT-PCR Kit等试剂,在此不做具体限定。
本申请的再一面还公开了一种H5N6禽流感病毒的逆转录实时荧光PCR检测方法,包括提取待测样品的基因组RNA,采用本申请的用于H5N6禽流感病毒检测的试剂,对提取的基因组RNA进行逆转录实时荧光PCR扩增。
优选的,基因组RNA的提取采用RNA提取试剂盒,或者Trizol核酸抽提法。
本申请的有益效果在于:
本申请的用于H5N6禽流感病毒检测的试剂,对禽流感亚种H5N6具有很强的特异性,能够准确灵敏的从众多禽流感病毒中特异性的检测出H5N6,为紧急疫情的快速诊断和大规模样品的快速检测奠定了基础,特别适合于检验检疫等部门使用,为保障社会安全、避免疫情传播扩散提供了有力的科学工具。
附图说明
图1是本申请实施例中H5N6禽流感病毒逆转录实时荧光PCR检测的特异性检测结果;
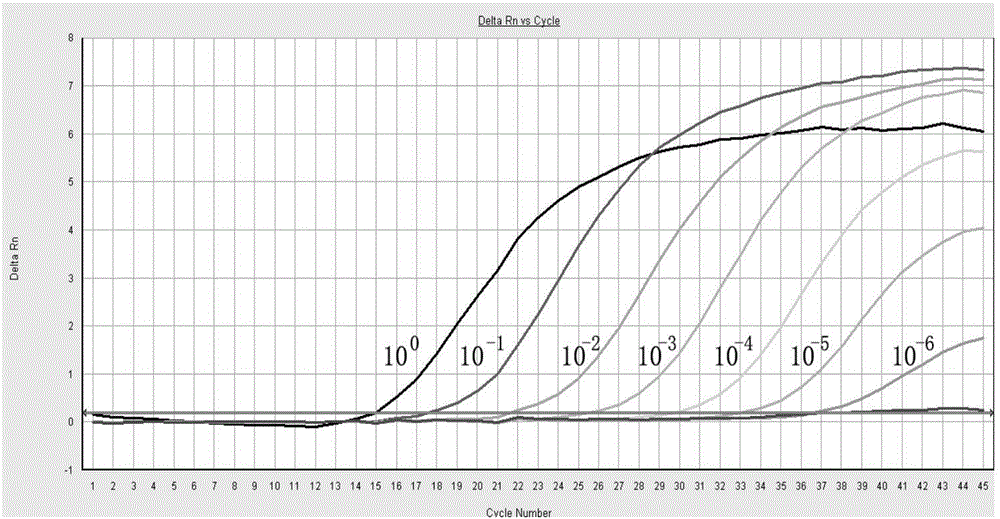
图2是本申请实施例中H5N6禽流感病毒逆转录实时荧光PCR检测的灵敏度检测结果。
具体实施方式
下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。
实施例
一、反应体系的建立和优化
利用人工合成的H5N6禽流感病毒的病毒质粒作为阳性标准品,其它供试样本则利用商品化RNA提取试剂盒或Trizol核酸抽提试剂的提取方法提取病毒基因组RNA,分装后置-20℃保存备用。其它供试样本包括:H5N1灭活毒株、猪流感经典型H1N1毒株、猪流感经典型H3N2毒株和禽流感H7、H9标准检测抗原,以上供试菌株均由深圳出入境检验检疫局动植物检验检疫技术中心保藏。本例针对H5N6禽流感病毒的基因组RNA设计了其特异性检测引物和探针,引物和探针具体序列如表1所示。
表1引物和探针序列
本例对引物浓度、探针浓度进行了优化,具体如下:
(1)引物浓度的优化:在反应体系中其它条件相同的情况下,将引物浓度分别从0.1μmol/L倍比稀释至0.6μmol/L,通过试验结果的分析比较,引物浓度在0.3μmol/L、0.4μmol/L和0.5μmol/L都较为合适,考虑到经济的原因,确定最佳引物浓度终浓度为0.4μmol/L;
(2)探针浓度的优化:在反应体系中其它条件相同的情况下,将探针浓度分别从0.1μmol/L倍比稀释至0.6μmol/L,通过试验结果的分析比较,探针的浓度在0.15μmol/L、0.2μmol/L和0.25μmol/L,都较合适,考虑到经济的原因,确定最佳探针浓度终浓度为0.2μmol/L。
通过对引物和探针浓度的优化,最后确定采用的实时荧光PCR反应体系为25μL,包括12.5μL 2×real time PCR Buffer、1μL 25×enzyme mix、终浓度0.4μM/L的引物、终浓度0.2μM/L的探针、5μL模板,用水补足至25μL。其中模板即H5N6阳性标准品或者提取的供试样本的基因组RNA。
RT-PCR反应程序的建立:
第一步:反转录45℃30min;
第二步:热启动95℃10min,不同的生产商家推荐的时间不同,本例根据AgPath-ID one-step RT-PCR Kit说明书进行;
第三步:95℃15s,60℃45s,40个循环,60℃时设置采集荧光。
仪器检测通道的选择:
进行RT-PCR设置反应荧光信号时,选择的荧光检测通道与探针所标记的荧光报告基团一致,报告荧光设定为HEX,淬灭荧光设定为BHQ,校准荧光设定为None。具体设置方法因仪器而异,应参照仪器使用说明书。程序设置好后,点击运行,进行PCR反应,反应结束后保存文件,打开分析软件,分析实验结果,给出△Rn与循环数图像。其中,△Rn即第n个循环时的荧光增加值。
结果分析和判定:
(1)结果分析条件设定
根据扩增曲线的荧光素种类,直接读取检测结果。
基线和阈值设定原则根据仪器噪声情况进行调整,以阈值线刚好超过正常阴性对照扩增曲线的最高点为准。
(2)质控标准
阴性对照无Ct值,且无扩增曲线,基本为一水平线。
阳性对照的Ct值应小于35.0,并出现典型的扩增曲线,2个阳性对照管的相应源性成分的扩增曲线基本重合,特别是在荧光临界值(英文Threshold)附近。否则,此次实验视为无效。
(3)结果描述及判定
阴性:Ct值应大于38.0或无扩增曲线,表示样品中H5N6流感病毒核酸阳性。
阳性:代表HEX的扩增曲线Ct值小于或等于35.0,且出现典型的扩增曲线,表示样品中H5N6流感病毒核酸阳性。
有效原则:根据对大量样品的检测研究,发现扩增曲线的Ct值处于35.0~38.0之间的样品为可疑样品,建议重做。重做结果Ct值大于38.0或无扩增曲线者为阴性,否则为阳性。
二、禽流感病毒检测
试验1H5N6禽流感病毒检测
本试验,提取H5N6禽流感病毒基因组RNA进行试验,H5N6禽流感病毒基因组RNA提取方法与其它供试样本相同,本例具体采用的是Trizol核酸抽提试剂的提取方法。
分别以提取的H5N6基因组RNA、H5N6阳性标准品为模板进行实时荧光RT-PCR反应,并设置一个水空白对照。
反应体系为:12.5μL2×real time PCR Buffer、1μL 25×enzyme mix、终浓度0.4μM/L的引物、终浓度0.2μM/L的探针、5μL模板,用水补足至25μL。
反应条件为:50℃30min;95℃10min;然后进入40个循环:95℃15s,60℃45s,并于60℃时采集荧光。
结果显示,本例提取的H5N6基因组RNA与H5N6阳性标准品一样能够检测出荧光信号,且Ct值都小于35.0;而水空白对照则无荧光信号。
试验2特异性试验
本试验以提取自H5N6的基因组RNA为阳性模板,以提取自供试样本的H5N1灭活毒株、猪流感经典型H1N1毒株、猪流感经典型H3N2毒株和禽流感H7、H9标准检测抗原的基因组RNA为阴性模板,进行逆转录实时荧光PCR检测,反应体系和反应条件与试验1相同,同时设置一个水空白对照。
检测结果如图1所示,仅H5N6的基因组RNA有扩增曲线,而其它供试样本和水空白对照都没有扩增曲线,说明本例的引物和探针能够对H5N6进行特异性检测。
试验3灵敏度试验
将人工合成的H5N6阳性标准品测定浓度后,作8个10倍系列稀释,进行逆转录实时荧光PCR检测。分别以原始的没有稀释的H5N6阳性标准品(即10-0)、10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8稀释的H5N6阳性标准品为模板进行逆转录实时荧光PCR检测,同时设置一个水空白对照。反应体系和反应条件与试验1相同。
检测结果如图2所示,结果显示,水空白对照没有荧光信号,而10-0、10-1、10-2、10-3、10-4、10-5、10-6七个样品均由荧光信号,10-7、10-8没有荧光信号;可见,本例的H5N6禽流感病毒检测引物和探针对H5N6禽流感病毒的检测灵敏度为10-6稀释度,约相当于20个病毒拷贝。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 人源抗H7N9禽流感病毒中和性抗体1F7L及其应用的制造方法与工艺
- 吲哚衍生物及其制备方法和其抗流感病毒作用与制造工艺
- 检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 检测禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 一种流感病毒逆转录环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶及其应用方法与制造工艺
- 一种保护和稳定病毒RNA的采血管的制造方法与工艺
- H6亚型禽流感病毒荧光定量RT‑PCR检测方法与制造工艺
- 表达H7N9亚型禽流感病毒血凝素蛋白的重组火鸡疱疹病毒株rHOH及构建方法与制造工艺
- 一种提高禽流感疫苗毒株增殖滴度的方法与制造工艺