一种紫苏籽抗氧化肽及其应用的制作方法
本发明涉及一种紫苏籽抗氧化肽及其应用,属于食品生物技术领域。
背景技术:
我国是一个农业大国,农作物的种类繁多,但由于受加工技术条件的所限,农作物的加工大都处于初级阶段,其加工后的残余物中仍有较大含量营养物质,如蛋白质等,而它们大多主要用于动物饲料或肥料工业及自然排放,不仅浪费了资源,同时也造成环境污染。植物活性肽概念的提出及分离检测技术的提高,使人们开始逐渐重视对富含蛋白质的农副产品的深加工并从中获得多种活性肽,如酪蛋白磷酸肽、降血压肽、抗菌肽和易消化吸收肽等,植物来源活性肽的研究和开发对提高我国农产品深加工的附加值具有重要作用。
抗氧化剂近些年来在国内外发展很快,用途也越来越广。研究认为人体内氧化产生的自由基与人的衰老和许多疾病有关,因此抗氧化剂不仅用于含脂肪食品的抗氧化,而且作为功能因子用于保健食品及化妆品等的开发。抗氧化剂的种类很多,但一些化学合成的抗氧化剂如BHA、BHT等,由于其本身肯能具有毒副作用,各国政府纷纷对其强制规定了ADI值控制其过量添加。于是人们把目光逐步转向从各种植物和动物组织中提取天然抗氧化剂。抗氧化活性多肽由于低毒、高效等特点,作为食品和机体的抗氧化剂,被认为是人工合成抗氧化剂的理想替代者。
抗氧化肽能有效地清除体内过剩的活性氧自由基,保护细胞和线粒体的正常结构和功能,防止脂质过氧化的发生,而氧化与人类及其他动物的许多疾病诸如癌症、老化、动脉硬化等的发病机理有关。适当摄入具有抗氧化活性的物质可以降低体内自由基水平,防止脂质过氧化,帮助机体抵御疾病。
紫苏籽又称苏子,为唇形科紫苏属一年生草本植物紫苏(Perilla frutescens)干燥成熟果实。紫苏原产于中国,在我国华北、华南、华中、西南及台湾省均有野生种和栽培种,是我国卫生部首批许可的60种药食同源植物之一。紫苏作为我国传统中药药材始载于明代医圣李时珍《本草纲目》,具有“行气宽中,清痰利肺,和血,温中,止痛,定喘,安胎”的功效。紫苏籽富含油脂,由于受到加工技术条件的限制,目前紫苏籽在我国食品工业中主要局限于提炼油脂。
目前国内外对紫苏籽的研究大量集中在油脂的提炼和生物活性方面,而对其副产物中富含的蛋白质开发和利用研究较少,对其活性多肽或其药理研究国内外几乎没有报道。因此,有必要充分利用我国十分丰富的紫苏(紫苏籽)植物资源,对其进行深入系统研究,为实现紫苏籽中药现代化和开发新型、高效、安全的健康食品提供科学依据。
技术实现要素:
本发明的目的是提供一种制备简单,抗氧化活性强的紫苏籽抗氧化肽,并且可以将该抗氧化肽应用于保健食品和药品的研制与开发。
本发明的一种抗氧化寡肽,其氨基酸序列Tyr-Leu,用单字母表示为YL,即由酪氨酸和亮氨酸2个氨基酸残基构成。
该抗氧化寡肽能够有效的清除ABTS,超氧阴离子自由基以及各种活性氧自由基(ORAC),同时具有很好的脂质过氧化抑制效果;
该抗氧化寡肽对CHO及HepG-2细胞没有毒害作用,且能够保护HepG-2细胞免受过氧化氢诱导的细胞损伤。
紫苏籽抗氧化肽的酶解制备方法:采用碱提酸沉法从紫苏籽粕中得到紫苏籽蛋白,采用碱性蛋白酶将其在酶解条件:pH 9.80、酶添加量3000U/g、底物浓度3%(w/v)、解酶时间5.00h,沸水浴10min灭酶,经12000rpm离心10min,取上清液冷冻干燥,即为紫苏籽蛋白质酶解产物;
所述抗氧化肽分离纯化方法:紫苏籽蛋白质酶解产物利用Sephadex G-25凝胶色谱进行分离,以去离子水为洗脱液,流速0.3 mL/min,测量洗脱组分214 nm波长处的吸光值;收集具有最佳抗氧化活性部分,利用反相高效液相色谱(RP-HPLC)进一步分离;RP-HPLC的洗脱梯度为0~60 min,5%~40%(V/V)乙腈;流速为2.0 mL/min,检测波长214 nm,收集保留时间为34min的洗脱峰,冷冻干燥即得所述抗氧化肽。
本发明的优点在于:
所述抗氧化肽具有强自由基清除活性,对超氧阴离子和ABTS自由基及活性氧自由基都有强的清除作用,表明其在抗氧化活性开发和应用方面有重要价值。紫苏籽天然抗氧化肽YL对ABTS自由基清除率的IC50值为3.71μg/mL; 当浓度为1.0mg/mL时,其对超氧阴离子自由基的清除率为42.63±0.47%。天然抗氧化肽YL的ORAC值为3.90±0.10μmol TE/mg 多肽。
此外,此天然抗氧化肽YL对体外亚油酸脂质过氧化以及鼠肝脂质过氧化都有很好的抑制效果。浓度为1.0mg/mL的抗氧化肽YL与亚油酸混合并放置在40℃的条件下,前四天其对亚油酸过氧化的抑制率接近30%,说明此天然抗氧化肽YL能够有效地缓解脂质过氧化速度,能够防止含油脂食品腐败,延长货架期。此天然抗氧化肽YL对小鼠肝脏提取物脂质过氧化抑制率的IC50值为3.02 mg/mL,说明一定浓度的抗氧化肽YL对肝组织具有很好的保护效应。
此天然抗氧化肽YL对正常CHO细胞及HepG-2细胞均无细胞毒性,且具有保护HepG-2免受过氧化氢氧化损伤的作用。CHO细胞经0.1mg/mL YL 处理24小时后,正常细胞比例96.3%相对于未处理组96.7%没有明显变化,说明YL对CHO细胞没有毒害作用。HepG-2细胞经0.1mg/mL YL 处理24小时后,正常细胞比例77.0%相对于未处理组79.1%略有下降,但死细胞比例9.8%明显下降,说明YL能诱导HepG-2细胞轻微衰亡但不致死。HepG-2细胞经1mM H2O2诱导损伤后,正常细胞比例下降至44.3%,死亡细胞达到39.9%,若在过氧化氢诱导氧化损伤之前用0.1mg/mL YL 预处理HepG-2细胞,则会降低细胞的凋亡率(正常细胞61.7%,死亡细胞29.6%),说明此天然抗氧化肽YL能够有效的保护HepG-2细胞氧化损伤。
附图说明
图1:紫苏籽粕粗蛋白酶解产物Sephedex G-25凝胶过滤色谱图。
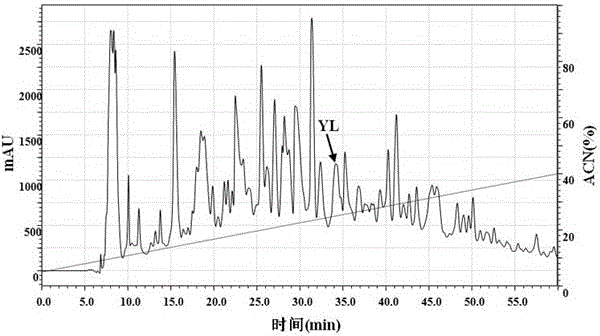
图2:凝胶色谱洗脱峰c峰反相高效液相色谱图。
图3:抗氧化肽的质谱图。
图4:抗氧化肽YL对自由基的清除作用。A:ABTS自由基清除活性;B:超氧阴离子自由基清除活性;C:活性氧自由基清除能力(ORAC)。
图5:抗氧化肽YL对亚油酸脂质过氧化(A)及鼠肝脂质过氧化(B)的抑制作用。
图6:抗氧化肽YL细胞毒性实验。A:正常CHO细胞;B:CHO+0.1mg/mL YL;C:HepG-2细胞;D:HepG-2+0.1mg/mL YL。
图7:抗氧化肽YL对过氧化氢诱导HepG-2细胞氧化损伤的保护作用。A:HepG-2细胞;B:HepG-2+1mM H2O2;C:HepG-2+1mM H2O2+0.1mg/mL YL。
具体实施方式
本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和过程,但本发明的保护范围不仅限于下述的实施实例。
实施例1
本发明所述抗氧化肽的分离纯化包括Sephadex G-25凝胶过滤色谱和反相高效液相色谱(RP-HPLC)两个步骤。
紫苏籽粗蛋白酶解产物的制备:先将紫苏籽用石油醚进行脱脂处理,然后采用碱提酸沉法得到紫苏籽粗蛋白,用碱性蛋白酶酶解紫苏籽粗蛋白,采用碱性蛋白酶在其最佳酶解条件(pH 9.80,酶添加量3000U/g, 底物浓度3%(w/v))下解酶时间5.00h, 沸水浴10min灭活,经12000rpm离心10min,取上清液冷冻干燥,即为紫苏籽蛋白质酶解产物;
Sephadex G-25凝胶过滤色谱:将紫苏籽酶解产物冻干粉,溶解于去离子水中,12000 rpm离心30 min。取上清液用0.22 μm孔径微滤膜过滤。Sephadex G-25凝胶柱(1.6cm×100 cm)用去离子水平衡,将已过滤的样品上柱。用去离子水洗脱,流速0.3 mL/min,于214 nm波长处检测洗脱液吸光值,绘制洗脱曲线,如图1所示。收集洗脱c峰,冷冻干燥,-80 ℃低温保存备用。
高效液相色谱:去离子水溶解上述c峰冻干粉,采用RP-HPLC进一步分离。液相色谱系统为LC-20A,装配Gemini 5μ C18 (250mm×10mm)反相柱 (Phenomenex,UK) ,用水和乙腈(含0.05%(V/V)三氟乙酸)构成的洗脱系统进行梯度洗脱。洗脱梯度:0~60 min,5%~40%(V/V)乙腈;洗脱流速2.0 mL/min,检测波长214 nm,洗脱曲线如图2所示。收集洗脱留时间为34.17min,冷冻干燥即为本发明所述抗氧化寡肽。
将收集到的抗氧化组分冷冻干燥,采用高效液相色谱检验所得到的组分纯度。经检测,该抗氧化肽组分纯度达到95%,可测定其氨基酸序列。
用液相色谱与质谱连用(LC-MS/MS)方法测定氨基酸序列(图3),得到此抗氧化肽的氨基酸序列为Tyr-Leu(YL)。
实施例2
实施例1中得到的天然抗氧化肽活性进行研究:
ABTS自由基清除作用:用蒸馏水配制7 mmol/L的ABTS+溶液和2.45 mmol/L的过硫酸钾溶液(使用前必须先在室温下放置16 h),分别将ABTS+和过硫酸钾溶液按1∶1体积比混合,临用前用pH 7.4 ,5 mmol/L 的磷酸盐缓冲溶液将混合液稀释至吸光值A734 为0.70±0.02。取0.5 mL不同浓度的样品和0.5 mL的ABTS自由基溶液混合静置10 min后于734 nm下测其吸光值。用去离子水和还原型谷胱甘肽代替样品分别作空白对照和阳性对照。ABTS自由基清除活力按下列公式(1)计算:
(1)
式中,A0:空白对照组吸光值;As:样品组吸光值。
超氧阴离子自由基清除作用:取0.4 mL样品溶液加入50 mmol/L的Tris-HCl缓冲溶液(pH 8.3)0.4 mL,以蒸馏水代替样品做为空白对照管。震荡混匀,25℃水浴中保温10 min后加入1.5 mmol/L的邻苯三酚盐酸溶液0.1 mL(25 ℃水浴预热),迅速混匀反应5 min,每隔30 s在320 nm 处测定吸光度值A320。用去离子水和还原型谷胱甘肽代替样品分别作空白对照和阳性对照。作吸光值随时间变化的回归方程,曲线斜率为邻苯三酚自氧化速率,样品对超氧阴离子的清除活力按下列公式(2)计算:
(2)
式中,ΔA0/min:空白对照组吸光值曲线斜率;ΔAs/min:样品组吸光值曲线斜率。
活性氧自由基清除能力(ORAC):将50μL样品溶液与100μL 70nM 荧光素钠溶液混合在不透明的96孔板内,并在37℃下孵化15min,然后,迅速在每个孔加入50μL 200mM AAPH 溶液,振荡30s后迅速放入荧光酶标仪进行荧光测量。激发波长485nm, 发射波长530nm,每隔1min测量一次直至荧光强度不再变化。试验中所有试剂必须用75 mM pH 7.0 磷酸缓冲液配置。用磷酸缓冲液和GSH溶液分别作为空白对照和阳性对照。配置0.625μM、1.25μM、2.5μM、5μM、10μM、20μM、40μM水溶性维生素E(Trolox)溶液作抗氧化标准定义抗氧化性。荧光衰减曲线面积(AUC)按下列公式(3)计算:
(3)
式中:f0表示最初的荧光强度,fi表示第i分钟时的荧光强度。净荧光衰减曲线面积(net-AUC)按下列公式(4)计算:
(4)
根据抗氧化强度与net-AUC呈线性相关确定Trolox标准曲线,最终ORAC值表示为μM Trolox equivalent (TE)/mg 多肽。
亚油酸过氧化抑制活性:将1.0 mg/ml样品1.0 mL、2.5%(V/V)亚油酸无水乙醇溶液1.0 mL、50 mmol/L磷酸盐(pH 7.0)2.0 mL和去离子水1.0 mL置于具塞试管,在40℃下避光恒温培育7天。每隔24 h测定硫氰化铁值表示亚油酸过氧化的程度。取0.1 mL上述反应液与4.7 mL 75%(V/V)乙醇、0.1 mL 30%(W/V)硫氰酸铵溶液、0.1 mL 20 mmol/L 氯化亚铁盐酸(3.5%,W/V)溶液混合,反应3 min后在500 nm下测定光吸收值,吸光值A500nm与亚油酸氧化程度呈正相关。用去离子水作阴性对照,以GSH和BHA作阳性对照。
鼠肝脂质过氧化的抑制活性:取小鼠肝组织1.0 g, 用冰冷的生理盐水漂洗后, 滤纸吸干, 称重。置于5 mL小烧杯中, 量取9倍于体积块体积的生理盐水, 将2/3 的生理盐水倒入烧杯中, 以眼科剪迅速剪碎组织块, 再将剪碎的组织连同生理盐水一起倒入玻璃匀浆器中, 然后用剩余的生理盐水冲洗烧杯和眼科剪, 并倒入匀浆器, 匀浆6 ~ 8 min, 使组织匀浆化, 整个过程应置于冰浴中完成。匀浆完全后将匀浆液以3000 ~ 4000 r/min离心10 ~ 15 min, 上清液即为10%肝组织匀浆液。
快速将0.1ml抗氧化肽样品(浓度分别是0.5、1、2、4、8mg/ml)与1ml 0.5%肝组织匀浆液、0.1ml 6mM FeSO4溶液、0.1ml 60mM H2O2溶液混合,并在37℃水浴1h。随后加入1ml 15%三氯乙酸和1ml 0.67%硫代巴比妥酸溶液,并在95℃下加热15min。冷却至25℃,然后3000rpm 离心10min。测量在532nm波长下的吸光度。GSH作为对照组,蒸馏水作为空白组。鼠肝脂质过氧化抑制率按下列公式(5)计算:
(5)
式中,A0:空白对照组吸光值;As:样品组吸光值。
经本实施例测定,紫苏籽天然抗氧化肽YL对ABTS自由基清除率的IC50值为3.71μg/mL(图4A); 当浓度为1.0mg/mL时,其对超氧阴离子自由基的清除率为42.63±0.47%(图4B)。天然抗氧化肽YL的ORAC值为3.90±0.10μmol TE/mg 多肽(图4C)。
浓度为1.0mg/mL的抗氧化肽YL前四天其对亚油酸过氧化的抑制率接近30%(图5A),说明此天然抗氧化肽YL能够有效地缓解脂质过氧化速度。此天然抗氧化肽YL对小鼠肝脏提取物脂质过氧化抑制率的IC50值为3.02 mg/mL,说明一定浓度的抗氧化肽YL对肝组织具有很好的保护效应(图5B)。
实施例3:
将实施例1中得到的天然抗氧化肽进行细胞毒性及抗氧化性研究:
细胞毒性实验:经复苏的中国仓鼠卵巢细胞(CHO)和肝癌细胞(HepG-2)用含有10% 胎牛血清、2.0 mmol/L谷氨酸盐和100 U/mL青霉素-链霉素的改良型RPMI-1640培养基在湿润的,含5%二氧化碳,温度为37 ℃的环境下贴壁培养24~48 h。用胰酶在37 ℃下消化后加入RPMI-1640培养基终止消化,加入适量的RPMI-1640培养基进行吹打使细胞充分分散,接种到6孔板中继续培养直至细胞贴壁面积达到80%以上。用终浓度为0.1mg/mL的 YL处理细胞24 h后用细胞双染试剂Annexin V-FITC 和PI染色经流式细胞仪检测每孔细胞的细胞状态。
对过氧化氢诱导肝癌细胞氧化损伤的保护实验:经复苏的肝癌细胞(HepG-2)按上述方法培养,在6孔板内细胞贴壁面积达到80%以上,终浓度为0.1mg/mL的 YL处理细胞18 h后再用1mmol/L过氧化氢处理细胞6h后,用细胞双染试剂Annexin V-FITC 和PI染色经流式细胞仪检测每孔细胞的细胞状态。
经本实施实例测定,CHO细胞经0.1mg/mL YL 处理24小时后,正常细胞比例96.3% (图6B)相对于未处理组96.7% (图6A)没有明显变化,说明YL对CHO细胞没有毒害作用。HepG-2细胞经0.1mg/mL YL 处理24小时后,正常细胞比例77.0% (图6D)相对于未处理组79.1% (图6C)略有下降,但死细胞比例9.8%明显下降,说明YL能诱导HepG-2细胞轻微衰亡但不至死。HepG-2细胞经1mM H2O2 诱导损伤后,正常细胞比例下降至44.3%,死亡细胞达到39.9% (图7B),若在过氧化氢诱导氧化损伤之前用0.1mg/mL YL 预处理HepG-2细胞,则会降低细胞的凋亡率(正常细胞61.7%,死亡细胞29.6%) (图7C),说明此天然抗氧化肽YL能够有效的保护HepG-2细胞氧化损伤。
SEQUENCE LISTING
<110> 福州大学
<120> 一种紫苏籽抗氧化肽及其应用
<130> 1
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 2
<212> PRT
<213> 人工序列
<400> 1
Tyr Leu
1
- 还没有人留言评论。精彩留言会获得点赞!