一种全人源抗丙型肝炎病毒的中和抗体的制作方法
本发明本发明属于细胞免疫学、基因工程领域,涉及一种全人源抗HCV的中和抗体。
背景技术:
丙型肝炎病毒(Hepatitis C virus,HCV)是丙型肝炎的主要致病病毒,为单股正链RNA包膜病毒,属于黄病毒家族。HCV感染人数约占世界人口的2%~3%,其中10~15%的感染者可发展为肝脏疾病,从而导致肝纤维化、肝硬化甚至肝癌。目前主要抗HCV药物是长效干扰素联合利巴韦林,但其产生的持续病毒学应答(SVR)率仅有50%~55%,而且具有不良反应且受HCV基因型限制。国外最新上市的索菲布韦(Sofosbuvir)、DCV(Daclatasvir)、艾伯维公司三合一新药、吉利德复合制剂Harvoni等均是针对NS蛋白酶抑制剂的复方组合,尽管这些新药的不良反应轻微,SVR可达90%以上,但是这些药物价格昂贵,可以使用其进行治疗的人群有限。
近年来,随着技术的发展,抗体在HCV感染中的作用开始受到重视。HCV感染宿主时,通过与宿主细胞表面的特异性蛋白(病毒受体)结合,通过内吞作用进入细胞内,然后病毒颗粒将RNA释放到细胞浆(脱壳);释放的HCV基因组翻译、加工病毒蛋白,RNA复制,包装,形成新的病毒颗粒。最后,病毒颗粒破坏宿主细胞膜,释放到细胞外感染其他细胞。研究表明抗体在阻断HCV颗粒与受体分子的结合、或通过中和抑制病毒入胞方面表现出极大的潜力。
目前,几类HCV抗体类药物正在进行临床或临床前实验。
单个B淋巴细胞抗体制备技术作为发展最为迅速和成熟的一类单克隆抗体制备技术,具有准确、高效、简便等诸多优点,产生的抗体更是具有全人源性,高度抗原特异性、亲和性等优势。由永生化的丙型肝炎患者外周血单核细胞获得的AB68属于IgG1型免疫球蛋白,是一种具有高亲和力结合HCV E2不同表位的人单克隆抗体。研究结果表明AB68有效抑制HCV感染,而且不良反应也更低,并且证明了大剂量用药的有效性和安全性。AB68还与另一单抗AB65进行联合研究,临床前实验表明这两种抗体的联合应用可更有效的抑制HCV感染。尽管多种临床试验都已经开始,可至今还没有可靠的数据公布于众。
Bavituximab是发挥独特机制作用的单克隆抗体。该抗体特异性结合HCV感染细胞的表面分子,对健康细胞无害;而且以宿主细胞本身的成分而非病毒组分为靶分子,所以该抗体适用于不同基因型的患者。实验数据显示Bavituximab抗病毒效果好,且安全性和耐受性良好。不过,Bavituximab还未完成临床前研究。
Civacir是目前正在研究的HCV多克隆中和抗体之一,由富含HCV多克隆抗体的患者血浆中获得。研究表明在肝移植的病人中无论应用大剂量或小剂量的Civacir,安全性和病人的耐受性都很好,但其抗病毒效力还需要进一步研究。
种种研究表明,控制HCV复制和免疫清除的关键因素是广谱交叉中和抗体,但是目前进入临床前研究的抗体数量还很少。有必要增加投入并开展更多的研究,最大化的挖掘抗HCV抗体的潜力,为患者的抗病毒治疗提供更好的选择。
技术实现要素:
为了弥补现有技术的不足,本发明的目的之一,提供一种全人源的抗HCV的单克隆抗体。
本发明的目的之二,提供一种治疗HCV感染引起的疾病的的药物组合物和手段。
本发明的目的之三,提供一种检测HCV的工具和手段。
本发明目的之四,提供一种诊断丙型肝炎的方法。
为了实现上述目的,本发明采用如下技术方案:
本发明提供了一种抗HCV的单克隆抗体,所述抗体重链可变区包含含有SEQ ID NO:10、11和12所示氨基酸序列的互补性决定区域,轻链可变区包含含有SEQ ID NO:14、15和16所示氨基酸序列的互补性决定区域。
进一步,所述抗体重链的氨基酸序列如SEQ ID NO:9所示。
进一步,所述抗体轻链的氨基酸序列如SEQ ID NO:13所示。
进一步,所述抗体靶向于HCV的膜糖蛋白。
进一步,所述抗体分子选自具有全长重链和轻链的完整抗体分子或其片段。
本发明的抗体分子可包括具有全长重链和轻链的完全抗体分子或其结合片段并且可以是但不限于Fab、经修饰的Fab、Fab’、经修饰的Fab’、F(ab’)2、Fv、单结构域抗体(例如VH或VL或VHH)、scFv、二价、三价或四价抗体、双特异性-scFv、双抗体、三抗体、四抗体和以上任何抗体的表位结合片段。
本领域技术人员还将理解的是,抗体可以进行各种翻译后修饰。这些修饰的类型和程度常常取决于用于表达抗体的宿主细胞系以及培养条件。这样的修饰可以包括在糖基化、甲硫氨酸氧化、哌嗪二酮形成、天冬氨酸异构化和天冬酰胺脱酰胺化中的变化。常见修饰是由于羧肽酶的作用导致的羧基末端碱性残基(诸如赖氨酸或精氨酸)的缺失。
本发明提供了一种分离的DNA序列,所述DNA序列编码上述所述的抗体的重链和/或轻链。
本发明提供了一种克隆或表达载体,所述克隆或表达载体包含一种或多种DNA序列,所述DNA序列编码上述所述的抗体的重链和/或轻链。本发明的DNA序列可包括例如通过化学处理产生的合成DNA、cDNA、基因组DNA或其任何组合。
编码本发明的抗体分子的DNA序列可由本领域技术人员熟知的方法来获得。例如,编码部分或全部抗体重链和轻链的DNA序列可按需要从确定的DNA序列或基于对应的氨基酸序列来合成。
编码受体框架序列的DNA对于本领域技术人员是广泛可得的并且可基于其已知的氨基酸序列来容易地合成。分子生物学的标准技术可用于制备编码本发明的抗体分子的DNA序列。所需DNA序列可完全或部分地利用寡核苷酸合成技术合成。可适当地采用定点诱变和聚合酶链式反应(PCR)技术。
本发明还提供了包含一种或多种克隆或表达载体的宿主细胞,所述克隆或表达载体包含一种或多种编码本发明所述单克隆抗体的DNA序列。任何适当的宿主细胞/载体系统可用于编码本发明的抗体分子的DNA序列的表达。可使用细菌(例如大肠杆菌)及其它微生物系统,或还可使用真核生物(例如哺乳动物)宿主细胞表达系统。适当的哺乳动物宿主细胞包括CHO、骨髓瘤或杂交瘤细胞。
本发明还提供了制备本发明的抗体分子的方法,其包括在适合于引起从编码本发明的抗体分子的DNA表达蛋白质的条件下培养包含本发明的载体的宿主细胞,以及分离抗体分子。
进一步,所述方法包括以下步骤:
(1)采集HCV阳性患者血清;
(2)分离HCV阳性患者血清的静脉血中的单个核细胞,之后利用流式细胞术进行细胞分选,分选出含有CD235a-/IgD-/CD20+的单个B细胞;
(3)利用单细胞RT-PCR扩增步骤(2)获得的单个B细胞中的抗体轻链和重链可变区的核苷酸片段;
(4)将步骤(3)获得的抗体轻链和重链可变区的核苷酸片段融合到含有人类抗体恒定区的表达载体中构建重组表达载体;
(5)将步骤(4)的重组表达载体共转染入宿主细胞后表达、纯化,获得具有结合活性和中和活性的本发明的全人源抗HCV的单克隆中和抗体。
抗体分子可仅包含重链或轻链多肽,在这种情况下,仅需将重链或轻链多肽编码序列用于转染宿主细胞。对于产生包含重链和轻链的产物,可使用两种载体(编码轻链多肽的第一载体以及编码重链多肽的第二载体)转染细胞系。或者,可使用单一载体,载体包括编码重链和轻链多肽的序列。
本发明公开的抗体和片段从宿主细胞以良好水平表达。因此,抗体和/或结合片段的性质适合用于商业规模的表达。
本发明提供了一种检测HCV的方法,通过抗原抗体结合反应来检测HCV。
进一步,检测HCV的方法包括以下步骤:
(1)获取样品;
(2)将步骤(1)获得的样品处理后与权利要求1-4任一项所述的抗体反应;
(3)检测样品与抗体的中和效应。
本发明提供了上述单克隆抗体在制备用于检测HCV的工具中的应用。
进一步,所述工具包括试剂盒、试纸、芯片等。其中,所述芯片包括蛋白质芯片;所述蛋白质芯片包括固相载体以及固定在固相载体的上述单克隆抗体;所述蛋白免疫检测试剂盒;所述蛋白免疫检测试剂盒包括上述单克隆抗体。
本发明提供了一种检测HCV的工具,所述工具包含上面所述的单克隆抗体。
本发明提供了上述单克隆抗体在制备治疗丙型肝炎病毒引起的疾病的药物组合物中的用途,所述疾病包括(但不限于)丙型肝炎、慢性肝炎、肝硬化、肝癌。
本发明提供了一种上面所述的抗体在制备抑制HCV的药物组合物中的应用。
本发明提供了一种药物组合物,所述药物组合物包括上面所述的单克隆抗体。
本发明的药物组合物可以使用不同的添加剂进行制备,例如缓冲剂、稳定剂、抑菌剂、等渗剂、螯合剂、pH控制剂及表面活性剂。
本发明所述药物组合物只要能达到目标组织,本发明所述药物组合物可以通过任何途径给予受体。
在本发明中,抗体分子可以是药学或诊断组合物中的唯一活性成分。
在本发明中,药物组合物适当地包含治疗有效量的本发明的抗体。如本文中所用的术语“治疗有效量”是指治疗、改善或预防靶疾病或病况、或展现可检测的治疗、药理或预防效应所需的治疗剂的量。组合物可单独地施用至患者或可以与其它药剂、药物或激素组合(例如同时、连续或分开地)施用。
本发明所述的药物组合物也可以脂质体输送系统形式给药,如小单层囊泡、大单层囊泡和多层囊泡。脂质体可有多种磷脂形成,如胆甾醇、硬脂基胺或磷脂酰胆碱。
本发明携带基因的载体是本领域已知的各种载体,如市售的载体、包括质粒、粘粒、噬菌体、病毒等。
本发明中“单克隆抗体”指从一群基本上同质的抗体获得的抗体,即构成群体的各个抗体相同和/或结合相同表位,除了生产单克隆抗体的过程中可能产生的可能变体外,此类变体一般以极小量存在。此类单克隆抗体典型的包括包含结合靶物的多肽序列的抗体,其中靶物结合多肽序列是通过包括从众多多肽序列中选择单一靶物结合多肽序列在内的过程得到的。
克隆抗体在本发明中明确包括“嵌合”抗体,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的剩余部分与衍生自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源,以及此类抗体的片段,只要它们展现出期望的生物学活性。
本发明还包括将上述抗体的氨基酸序列通过对氨基酸残基的添加、删除、修改形成所得到的包括人源与非人源抗体,并具有与HCV002抗体相同功能或改造及优化的一切抗体。
本发明的CDR可包括变体,例如当将本文中所公开的CDR回复突变为不同的框架区时。通常,个体变体CDR与本文所述序列的氨基酸同一性为至少70%或80%,更典型地具有优选至少75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%和几乎100%的渐增的同一性。
如本发明所用,“同一性”指示在比对的序列的任何特定位置上,序列之间的氨基酸残基是相同的。如本文所用,“相似性”指示在比对的序列的任何特定位置上,序列之间的氨基酸残基为相似类型。例如,亮氨酸可被置换成异亮氨酸或缬氨酸。可通常彼此置换的其它氨基酸包括(但不限于):
-苯丙氨酸、酪氨酸和色氨酸(具有芳族侧链的氨基酸);
-赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸);
-天冬氨酸和谷氨酸(具有酸性侧链的氨基酸);
-天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸);以及
-半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸。
通常,一个蛋白质中一个或多个氨基酸的修饰不会影响蛋白质的功能。本领域技术人员会认可改变单个氨基酸或小百分比的氨基酸或对氨基酸序列的个别添加、缺失、插入、替换是保守修饰,其中蛋白质的改变产生具有相似功能的蛋白质。提供功能相似的氨基酸的保守替换表是本领域公知的。
可利用取代、缺失、插入或其任意组合来实现最终的衍生物或变体。通常,这些变化在几个氨基酸上进行以使分子的改变最小化,特别是抗原结合蛋白的免疫原性和特异性。然而,在某些情况下可以容忍更大的变化。氨基酸取代通常是单个碱基的;插入通常将为大约一个至大约二十个氨基酸残基的数量级,虽然可能容忍显著更大的插入。缺失的范围为大约一个至大约二十个氨基酸残基,虽然在一些情况下,缺失可以大得多。
在本发明中,“框架”指除去被定义为CDR的那些区域之外的抗体可变结构域的区域。每个抗体可变结构域框架可被进一步细分为由CDR分隔的连续区域(FRl、FR2、FR3和FR4)。
本发明的抗体包括在单克隆抗体或其CDR移植的抗体片段上利用单点突变或多点组合突变对抗体恒定区/CDR区部分氨基酸/进行改造及优化后的抗体片段或scFv抗体。
通常,一个蛋白质中一个或多个氨基酸的修饰不会影响蛋白质的功能。本领域技术人员会认可改变单个氨基酸或小百分比的氨基酸或对氨基酸序列的个别添加、缺失、插入、替换是保守修饰,其中蛋白质的改变产生具有相似功能的蛋白质。提供功能相似的氨基酸的保守替换表是本领域公知的。
在本发明中,全人源化的抗体具有包含人受体框架区以及本发明具体提供的一个或多个CDR的可变域。框架区不需要具有与受体抗体的框架区完全相同的序列。例如,可将不常见的残基改变成对于该受体链种类或类型更常见的残基。备选地,可改变在受体框架区中的选定残基以使得它们对应于供体抗体中相同位置处所发现的残基。
本发明所公开的抗HCV中和抗体编号为TRN1002。
本发明的优点和有益效果:
本发明提供了一种全新的全人源的抗HCV中和抗体,该抗体具有抗体效价高、特异性强、亲和力、稳定性好、无免疫原性、完全人源性蛋白结构的特点。
本发明提供了一种制备全人源的抗HCV中和抗体的方法,该方法成本低、可高效表达、放大制备、标准化生产。
本发明提供了一种药物组合物,该药物组合物可用于不同基因型丙型肝炎的治疗或预防。
本发明提供的抗体可用于制备HCV检测试剂,发现有效中和抗原表位及开发丙型肝炎重组蛋白及亚单位疫苗。
附图说明
图1为本发明的实施例的抗体TRN1002 SDS-PAGE检测图;
图2为为本发明的实施例的抗体TRN1002与7种不同亚型HCV真病毒结合活性测定图;
图3为本发明的实施例的抗体TRN1002与HCV病毒抗原亲和活性测定图;
图4为本发明的实施例的抗体TRN1002与不同的HCV病毒株的中和活性检测图;其中,图A显示了抗体TRN1002与病毒株h77的中和活性;图B显示了抗体TRN1002与病毒株JFH1的中和活性;图C显示了抗体TRN1002与病毒株s52的中和活性;图D显示了抗体TRN1002与病毒株ED43的中和活性;图E显示了抗体TRN1002与病毒株SA13的中和活性。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring HarborLaboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1抗HCV抗体的生成
1、样本获取:HCV感染者(编号HCV-I002)抗凝外周血采自广东省广州市,该患者确认感染时间为2010年。
2、记忆性B细胞分选
采集HCV-I002血液样本100mL,用淋巴细胞分离管分离外周血单个核细胞(Peripheral blood mononuclear cell,PBMC),利用BD FACSria流式细胞仪(BD Biosciences,San Jose,CA)进行细胞分选,首先去除细胞碎片、黏连细胞和死细胞,通过荧光抗体染色得到CD3-/CD14-/CD16-/IgM-的细胞,选择表达CD235a-/IgD-/CD20+的B细胞,圈出CD27 ALL记忆B细胞,用特异性标记荧光素的抗原得到E2双荧光标记的靶细胞。
3、单细胞RT-PCR
将含有单个B淋巴细胞的96孔板的PCR预测混液中加入0.5μM的各亚型重链与轻链的恒定区引物与Superscript IV逆转录酶(Invitrogen,Carlsbad,CA),同时设置阳性及阴性对照;逆转录PCR条件:55℃60min,降至4℃。产物cDNA-20℃长期保存。
4、抗体可变区目的基因的扩增
采用巢式PCR方法,以逆转录产物(cDNA)为模板,加入AmpliTaq Gold 360Master Mix(Invitrogen,Carlsbad,CA),及0.5μM的各亚型重链与轻链抗体的特异性引物。反应条件:预变性95℃5min,然后进行35个PCR循环,每个循环为:94℃×30s,58/60/64(H/K/L)℃×30s,72℃×1.5min,用72℃延伸7min后降至10℃。
5、DNA凝胶电泳鉴定
使用2%琼脂糖凝胶进行电泳实验进行鉴定。取2μL PCR反应产物与18μL0.1%的Loading Buffer混匀后上样,在E-base电泳系统的EG模式下进行电泳12min。凝胶成像系统检测PCR产物大小。
6、重组抗体的表达载体的构建
用特异性引物获取ELISA检测为阳性的抗体重链与轻链基因片段(包括可变区和恒定区),利用TA克隆的方法分别将重链和轻链基因链接到pcDNA3.3载体上,将连接产物转化DH5α感受态细菌中,在含有氨苄青霉素的平板上37℃培养过夜,随即挑取12个单菌落用特异性引物进行PCR鉴定(PCR反应条件:94℃预变性3min,94℃变性30s,55℃退火30s,72℃延伸1min40s,28个循环,最后72℃再延伸5min),取2μLPCR产物在1%琼脂糖凝胶上进行电泳检测,选取PCR鉴定为阳性的菌落进行基因测序,比对结果正确的即为抗体重链和轻链的重组表达质粒。
7、ELISA检测目的基因的表达
在大肠杆菌DH5α中大量扩增表达阳性抗体重链和轻链基因的质粒,无内毒素抽提试剂盒抽提。在10cm培养皿中用转染试剂Polyetherimide共转染CHO细胞,转染后4-6小时添加新鲜无血清培养基,置于37℃,8%CO2恒温培养箱中培养96小时,收集细胞上清进行检测。
培养72h后细胞上清采用直接竞争ELISA检测目的基因表达的抗体。ELISA筛选:以不同的HCV包膜糖蛋白为抗原,并用包被液将抗原稀释浓度为100ng/ml,包被于ELISA 96孔板,每孔100μl,4℃过夜。封闭液37℃封闭2个小时。封闭后加一抗,抗体起始浓度为25μg/ml,3倍梯度稀释,每孔体积为100μl,37℃孵育1个小时,同时用HCV阳性病人血清作为阳性对照,狂犬抗体为阴性对照。用HRP标记的羊抗人IgG(1:2000稀释)作为二抗37℃孵育1个小时。加入底物显色液(TMB),37℃避光放置5min后,用2M硫酸中止反应,用450nm波长进行比色。
采用脂质体法将配对的重链与轻链基因的质粒与PEI共转染CHO细胞,操作步骤按PolyFect(Qiagen)转染试剂盒说明书进行。待克隆长成后,细胞上清采用直接竞争ELISA检测目的基因表达的抗体。步骤如下:以HCV包膜糖蛋白E2为抗原,并用包被液将抗原10倍稀释后包被96孔ELISA板,每孔100μl 4℃过夜包被,用封闭液常温封闭2个小时。将100μl的瞬时转染上清作为一抗常温孵育2个小时,用HRP标记的羊抗人IgG(1:2000稀释)作为二抗常温孵育1个小时,加入底物显色液100μl/孔,常温避光放置5min后,用2M硫酸钠中止反应,用450nm/630nm波长进行比色。
8、抗体中和实验
将ELISA筛选到的有结合活性的抗体进行中和实验。将不同的HCV包膜糖蛋白的包装成质粒,加入荧光素Luciferase基因转染CHO细胞用于包装HCV假病毒(HCVpp),收取上清用于感染。铺Huh7细胞于96孔板中,每孔细胞约1*104个,每孔体积为100μl,过夜培养,感染时细胞约30%铺满。HCVpp与抗体混合,室温放置30min。加入HCVpp与抗体混合液于96孔板,感染Huh7细胞。对照组仅加入HCVpp,感染24h后换液,继续培养1-2天。感染后2-3天后测定Luciferase活性,测量方法为去掉细胞上清,每孔用30μl裂解液,充分裂解后取20μl细胞裂解液加30μl底物,读取荧光值。比较抗体与对照组,计算中和效率。
9、抗体大量表达与纯化
将中和实验鉴定出的有中和活性的编号为TRN1002的抗体重链与轻链的表达载体(其中,重链可变区的氨基酸序列如SEQ ID NO:1所示;抗体轻链可变区的氨基酸序列如SEQ ID NO:5所示)共转染生长于175cm2细胞培养瓶的CHO细胞(细胞融合度达到90%以上),转染后6-8小时补Pro293A-CDM培养基(LONZA),37℃,5%CO2培养箱中培养96小时;或者转染293T细胞(细胞密度达到1.6×106个/ml),转染后6-8小时补Expi293 Expression培养基(Gibco),37℃,8%CO2,125rpm摇床中培养120小时。然后收集转染上清,4000rp,4℃,离心1小时,弃沉淀,利用蛋白(Protein)A亲和层析法进行纯化。通过SDS-PAGE和western-blot检验抗体TRN1002的表达及纯化情况,结果如图1所示,得到较纯蛋白,并可清晰观察到解链后的抗体轻、重链。
实施例2 TRN1002抗体的结合特异性检测
用实施例1提到的ELISA方法对表达纯化的抗体的结合结合特异性进行检测:将不同的HCV包膜糖蛋白的包装成质粒,加入荧光素Luciferase基因转染CHO细胞用于包装HCV假病毒(HCVpp),收取上清用于感染。铺Huh7细胞于96孔板中,每孔细胞约1*104个,每孔体积为100μl,过夜培养,感染时细胞约30%铺满。HCVpp与不同浓度的抗体TRN1002混合,起始浓度75μg/ml,3倍稀释,室温放置30min。加入HCVpp与抗体TRN1002混合液于96孔板,感染Huh7细胞。对照组仅加入HCVpp,感染24h后换液,继续培养1-2天。感染后2-3天后测定Luciferase活性,测量方法为去掉细胞上清,每孔用30μl裂解液,充分裂解后取20μl细胞裂解液加30μl底物,读取荧光值。
结果:TRN1002能100%与HCV包膜糖蛋白特异性结合,荧光值降低。
实施例3 TRN1002抗体与不同抗原的结合活性检测
以不同的HCV包膜糖蛋白为抗原,并用包被液将抗原稀释浓度为100ng/ml,包被于ELISA 96孔板,每孔100μl,4℃过夜。封闭液37℃封闭2个小时。封闭后加一抗,TRN1002起始浓度为25μg/ml,3倍梯度稀释,每孔体积为100μl,37℃孵育1个小时,同时用HCV阳性病人血清作为阳性对照,狂犬抗体为阴性对照。用HRP标记的羊抗人IgG(1:2000稀释)作为二抗37℃孵育1个小时。加入底物显色液(TMB)100μL/孔,37℃避光放置5min后,用2M硫酸中止反应,用450nm波长进行比色。
结果如图2所示,把表达纯化的抗体TRN1002进行大于2000倍稀释后TRN1002抗体依然可以与抗原结合,具有极强的结合活性(图2中的HCV1a、HCV1b、HCV2、HCV3、HCV4、HCV5、HCV6、HCV7为不同的HCV包膜糖蛋白)。
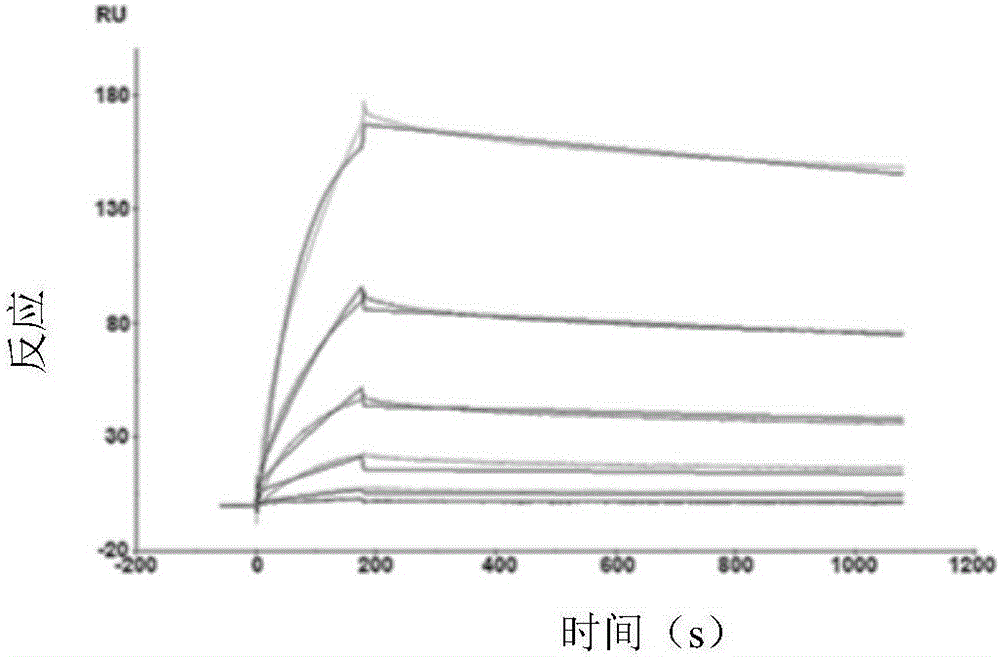
实施例4 TRN1002抗体与HCV的包膜糖蛋白的亲和活性检测
CM5芯片偶联捕获分子:将羊抗人IgG抗体作为捕获分子固定在CM5传感器芯片上,按照偶联试剂盒的操作将其偶联到CM5芯片金薄膜表面上。用EDC、NHS活化芯片的葡聚糖表面,以进样时间确定偶联量,最后用乙醇胺封闭表面残留的活化基团。CM5芯片上捕获分子捕获配体:将制备的全人源抗HCV中和抗体作为配体,以计算得到的信号值确定单抗的进样浓度及接触时间。单抗TRN1002与HCV-E2蛋白(抗原)结合的亲和力和动力学分析:HCV-E2蛋白用HBS-EP缓冲液稀释作为分析物,分析物以逐渐增高的浓度依次流过芯片,分别得到信号曲线。每个浓度作为1个循环,完成1次循环后用3mol/L的氯化镁再生芯片以回复到原始未结合抗原的状态。用BiaCore X-100 System软件进行分析,其中参数设置如下面表2所示。
表2 BiaCore X-100结果参数
结果如图3所示,TRN1002抗体的亲和力达2.85*10-8mol。
实施例5 TRN1002抗体与不同的HCV病毒株的中和活性检测
铺Huh7细胞于96孔板中,过夜培养,感染时细胞约30%铺满。HCV病毒株(h77、JFH1、S52、ED43、SA13)与不同浓度的抗体TRN1002混合,起始浓度25ug/ml,3倍稀释,室温放置30min。加入HCV病毒株(h77、JFH1、S52、ED43、SA13)与抗体TRN1002混合液于96孔板,感染Huh7细胞。对照组仅加入HCV病毒株2G9,感染24h后换液,继续培养1-2天。感染后2-3天后测定活性,读取荧光值。比较抗体与对照组,计算中和效率。
TRN1002抗体与不同的HCV病毒株的中和活性检测结果如图4所示,图A、B、C、D、E分别显示了TRN1002抗体与HCV病毒株h77、JFH1、S52、ED43、SA13的中和活性;TRN1002抗体与不同的HCV病毒株的中和效率如表2所示。
表2 TRN1002抗体与不同的HCV病毒株的中和效率
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
SEQUENCE LISTING
<110> 广州泰诺迪生物科技有限公司 暨南大学
珠海泰诺麦博生物技术有限公司
<120> 一种全人源抗丙型肝炎病毒的中和抗体
<160> 8
<170> PatentIn version 3.5
<210> 9
<211> 126
<212> PRT
<213> 人源
<400> 9
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Arg Val Ser Cys Lys Ala Ser Gly Gly Thr Leu Gly Ser Phe
20 25 30
Ala Gly Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Ile Ile Pro Met Phe Arg Arg Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Gly Thr Thr Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Arg Glu Ile Pro Gly Tyr Cys Thr Gly Gly Arg Cys Phe Gly Tyr
100 105 110
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 10
<211> 8
<212> PRT
<213> 人源
<400> 10
Gly Gly Thr Leu Gly Ser Phe Ala
1 5
<210> 11
<211> 8
<212> PRT
<213> 人源
<400> 11
Ile Ile Pro Met Phe Arg Arg Thr
1 5
<210> 12
<211> 19
<212> PRT
<213> 人源
<400> 12
Ala Arg Glu Ile Pro Gly Tyr Cys Thr Gly Gly Arg Cys Phe Gly Tyr
1 5 10 15
Phe Asp Tyr
<210> 13
<211> 107
<212> PRT
<213> 人源
<400> 13
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Arg Ala Ser Gln His Val Asn Ser Asn
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Arg Gly Gln Thr Pro Arg Leu Leu
35 40 45
Ile Tyr Ala Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Thr Ser Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 14
<211> 7
<212> PRT
<213> 人源
<400> 14
Gln His Val Asn Ser Asn Phe
1 5
<210> 15
<211> 3
<212> PRT
<213> 人源
<400> 15
Ala Ala Ser
1
<210> 16
<211> 8
<212> PRT
<213> 人源
<400> 16
Gln Gln Tyr Gly Thr Ser Leu Thr
1 5
- 还没有人留言评论。精彩留言会获得点赞!