低分子量浒苔多糖及其制备方法、硫酸化低分子量浒苔多糖及其制备方法以及应用与流程
本发明属于浒苔提取物技术领域,具体涉及低分子量浒苔多糖及其制备方法以及硫酸化低分子量浒苔多糖及其制备方法。
背景技术:
人体在新陈代谢过程中会产生自由基,这种活性分子具有一个或几个不配对电子的原子团或原子,具有一定的稳定性、高氧化性和化学性质活泼等特点。正常情况下,自由基对细胞增殖、分化、凋亡、坏死有调节作用;依赖自由基和氧化过程才能使众多机体组织产生能量;机体的氧化与抗氧化处于动态的平衡。但各种外源性和内源性的氧化应激反应均会影响生物体内自由基动态平衡,尤其在机体出现病态时会产生过多的活性氧,导致机体处于氧化应激状态。机体内过多的自由基及其代谢产物引起细胞代谢功能障碍及损伤,过量的自由基攻击dna、蛋白质和碳水化合物等生物大分子,产生多种不同的后果,使得自由基与多种疾病的产生密切相关,如癌症、心血管疾病、类风湿关节炎及动脉粥样硬化其外年龄增加而发生的机体老化也与此密切相关。体内自由基一般可通过抗氧化剂清除。目前常用的抗氧化剂有叔丁基对甲氧酚制剂(bha)和丁基羟基甲苯(bht)。尽管bha和bht具有很好的抗氧化效果,但是随着环保意识的增强,人们开始怀疑这类化学合成的抗氧化剂可能诱发肝损伤并导致癌症。因此,从天然产物的寻找新型抗氧化剂是一个重要方向。
近年来,人们对藻类多糖及低聚糖的抗氧化活性作用有较深入的研究。但随着人们对多糖组成、性质、结构、功能的研究不断深入,注意到以下问题:自然界中存在多糖并不都具有生物活性;有些多糖由于结构或理化性质等障碍而不利于其生物活性的发挥;也有些多糖尽管药效良好,但同时也会产生不良反应,甚至毒副作用;一些从天然生物体内分离的多糖分子量高、但活性较弱,有待进一步提高。因此,采取一定方法对多糖进行降解或结构修饰是解决上述问题的根本途径。
浒苔是青岛沿海常见的绿藻,资源丰富,易采集。多糖作为浒苔的主要有效成分,对其生物活性的研究日渐增多。根据文献报道和本申请人的前期工作证明,浒苔多糖具有抗氧化活性,但这种抗氧化活性明显不足。因此,寻找一种提高浒苔多糖抗氧化活性的方法,更有利于提高浒苔的利用价值。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种低分子量浒苔多糖及其制备方法以及硫酸化低分子量浒苔多糖及其制备方法,本发明提供低分子量的浒苔多糖具有较高的抗氧化活性。
本发明提供了一种低分子量浒苔多糖,所述低分子量浒苔多糖的重均分子量为4.48×104da;所述低分子量浒苔多糖由摩尔比为鼠李糖:葡萄糖:半乳糖:木糖:阿拉伯糖=1.65:1.00:0.09:0.57:0.17的单糖组成。
优选的,所述低分子量浒苔多糖的多分散系数为1.648,所述低分子量浒苔多糖的数均分子量为2.72×104da;所述低分子量浒苔多糖的z均分子量为2.326×105da。
本发明还提供了一种上述低分子量浒苔多糖的制备方法,包括以下步骤:
a)将纯化的浒苔多糖与由保藏编号为cgmccno.12912的饲料类芽孢杆菌发酵制得的浒苔多糖降解酶混合进行酶解反应后,依次经过灭酶、离心,得到上层清液;
b)将所述上层清液醇沉后离心,得到低分子量浒苔多糖溶液,将所述低分子量浒苔多糖溶液经过浓缩、透析和冷冻干燥,得到低分子量浒苔多糖。
优选的,所述浒苔多糖降解酶按照如下方法进行制备:
步骤1:活化保藏编号为cgmccno.12912的饲料类芽孢杆菌,制得种子液;
步骤2:将所述种子液接种至培养基中,经发酵获得发酵物;
步骤3:将所述发酵物离心后取上清液,经除菌、浓缩、除盐后,干燥制得浒苔多糖降解酶。
优选的,所述纯化的浒苔多糖与所述浒苔多糖降解酶的质量比为50:1。
本发明还提供了一种硫酸化的低分子量浒苔多糖的制备方法,包括以下步骤:
a)将低分子量浒苔多糖分散于有机溶剂中,再加入酯化试剂进行反应,得到反应液,所述低分子量浒苔多糖为权利要求1或2所述的低分子量浒苔多糖或权利要求3~5任意一项所述的制备方法制备得到的低分子量浒苔多糖;
b)将碱液加入至所述反应液中进行中和,得到中和液;
c)将所述中和液依次进行离心,透析、浓缩和醇沉,得到纯化液;
d)将所述纯化液依次进行离心、重溶和冷冻干燥得到硫酸化的低分子量浒苔多糖。
优选的,所述酯化试剂按照如下方法进行制备:
将体积比为2:1的无水吡啶与氯磺酸混合后,加热搅拌,得到酯化试剂。
本发明还提供了一种上述制备方法制备得到的硫酸化的低分子量浒苔多糖,所述硫酸化的低分子量浒苔多糖的重均分子量为5.99×104da;硫酸根取代度为0.81,所述硫酸化的低分子量浒苔多糖由摩尔比为鼠李糖∶葡萄糖∶半乳糖∶木糖∶阿拉伯糖=1.09∶1.00∶0.06∶0.10∶0.11的单糖组成。
优选的,所述硫酸化的低分子量浒苔多糖的多分散系数为2.501,所述硫酸化的低分子量浒苔多糖的数均分子量为2.40×104da;所述硫酸化的低分子量浒苔多糖的z均分子量为1.574×105da。
本发明还提供了一种抗氧化剂,包括上述低分子量浒苔多糖或上述制备方法制备得到的低分子量浒苔多糖,或者上述制备方法制备得到的硫酸化的低分子量浒苔多糖或上述硫酸化的低分子量浒苔多糖。
与现有技术相比,本发明提供了一种低分子量浒苔多糖,所述低分子量浒苔多糖的重均分子量为4.48×104da;所述低分子量浒苔多糖由摩尔比为鼠李糖:葡萄糖:半乳糖:木糖:阿拉伯糖=1.65:1.00:0.09:0.57:0.17的单糖组成。本发明采用酶解法得到特定分子量和单糖组成的低分子量浒苔多糖,该低分子量浒苔多糖具有较高的抗氧化活性。另外,在该低分子量浒苔多糖的基础上进行进一步的硫酸化修饰,得到的硫酸化的低分子量浒苔多糖也具有良好的抗氧化活性。
生物保藏说明
ep-1,分类命名:饲料类芽孢杆菌paenibacilluspabuli,于2016年08月29日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。保藏编号为cgmccno.12912。
附图说明
图1为浒苔多糖deaesepharosefastflow阶段梯度洗脱曲线;
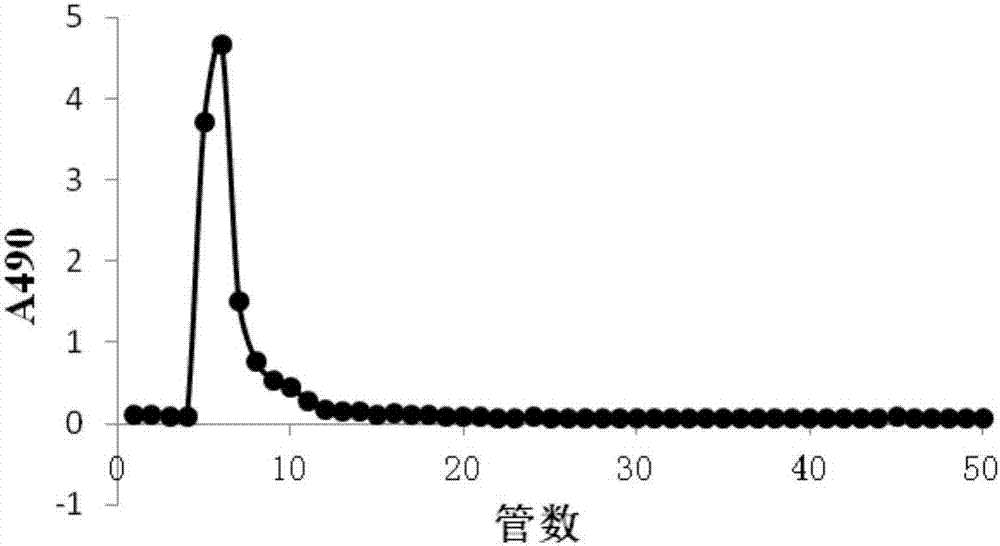
图2为浒苔多糖的sepharose6b凝胶渗透色谱图;
图3为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的红外光谱图;
图4为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的超氧自由基清除活性;
图5为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的羟基自由基清除活性;
图6为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的dpph自由基清除活性;
图7为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的还原能力;
图8为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的金属螯合能力。
具体实施方式
本发明提供了一种低分子量浒苔多糖,所述低分子量浒苔多糖的重均分子量为4.48×104da;所述低分子量浒苔多糖由摩尔比为鼠李糖:葡萄糖:半乳糖:木糖:阿拉伯糖=1.65:1.00:0.09:0.57:0.17的单糖组成。
所述低分子量浒苔多糖的多分散系数为1.648,所述低分子量浒苔多糖的数均分子量为2.72×104da;所述低分子量浒苔多糖的z均分子量为2.326×105da。
本发明还提供了一种上述低分子量浒苔多糖的制备方法,包括以下步骤:
a)将纯化的浒苔多糖与由保藏编号为cgmccno.12912的饲料类芽孢杆菌发酵制得的浒苔多糖降解酶混合进行酶解反应后,依次经过灭酶、离心,得到上层清液;
b)将所述上层清液醇沉后离心,得到低分子量浒苔多糖溶液,将所述低分子量浒苔多糖溶液经过浓缩、透析和冷冻干燥,得到低分子量浒苔多糖。
在本发明中,由保藏编号为cgmccno.12912的饲料类芽孢杆菌发酵制得的浒苔多糖降解酶按照如下方法进行制备:
步骤1:活化保藏编号为cgmccno.12912的饲料类芽孢杆菌,制得种子液;
步骤2:将所述种子液接种至培养基中,经发酵获得发酵物;
步骤3:将所述发酵物离心后取上清液,经除菌、浓缩、除盐后,干燥制得浒苔多糖降解酶。
步骤1所述活化前还包括前处理的步骤;所述前处理为将保藏编号为cgmccno.12912的饲料类芽孢杆菌于含有浒苔多糖的固体培养基上划线培养5天~7天。
本发明实施例中,步骤1中活化保藏编号为cgmccno.12912的饲料类芽孢杆菌的培养基包括:
该培养基的ph值为6.0~8.0,优选为7.0。
用于活化本发明提供的菌种的培养基中,所述蛋白胨为胰蛋白胨或酪蛋白胨;所述酵母提取物为酵母浸膏或酵母浸粉;优选为酵母浸粉。
一些实施例中,活化本发明提供的菌种的培养基中包括
步骤2中发酵所采用的培养基由本发明提供,其中包括:
所述碳源选自α-环糊精、β-环糊精、糊精、淀粉、苦杏仁苷、熊果苷、纤维二糖、d-果糖、d-半乳糖、龙胆二糖、α-d-葡萄糖、α-d-乳糖、乳糖、麦芽糖、甘露糖、d-甘露醇、d-甘露糖、松三糖、密二糖、α-甲基-d-半乳糖苷、β-甲基-d-半乳糖苷、3-甲基-葡萄糖、α-甲基-d-葡萄糖苷、β-甲基-d-葡萄糖苷、α-甲基-d-甘露糖苷、异麦芽酮糖、d-阿洛酮糖、d-棉籽糖、水杨苷、d-山梨醇、水苏糖、蔗糖、d-塔格糖、d-海藻糖、松二糖、醋酸、β-羟丁酸、丙酮酸甲酯、丙酮酸、丁二酸单甲酯、甘油、腺苷、2'-脱氧腺苷、肌苷、胸苷、尿苷、腺苷-5'-磷酸、胸苷-5'-磷酸、尿苷-5'-磷酸、6-磷酸-果糖或6-磷酸-葡萄糖;
该培养基中碳源选自葡萄糖、木糖、鼠李糖、果糖、麦芽糖、蔗糖、乳糖、淀粉、浒苔多糖。一些具体实施例中,该培养基的碳源为浒苔多糖。
碳源的浓度为0.4g/l~4g/l。具体为0.4g/l、0.6g/l、0.8g/l、1g/l、2g/l、3g/l或4g/l。碳源的浓度影响菌体的生长情况及产生酶的活力,随着碳源浓度的升高菌体的生长情况变差,而酶活力则随着碳源浓度的升高表现出先升高再降低的趋势。
所述氮源选自nano3、nh4cl、nh4no3、尿素、酵母提取物、蛋白胨、明胶。本发明实施例中,氮源为蛋白胨和酵母提取物。一些具体实施例中,所述酵母提取物为酵母浸粉;所述蛋白胨为胰蛋白胨或酪蛋白胨。所述蛋白胨与酵母提取物的质量比为(4~16):(2~14)。
本发明实施例中,蛋白胨的浓度为4g/l~16g/l。具体为4g/l、6g/l、8g/l、10g/l、12g/l、14g/l或16g/l。蛋白胨的浓度影响菌体的生长情况及产生酶的活力,随着蛋白胨浓度的升高菌体的生长情况呈现先升高再降低的趋势,其最高值出现在10g/l,酶活力也随着蛋白胨浓度的升高表现出先升高再降低的趋势,最高至出现在6g/l。
与此相似,酵母浸粉的浓度为3g/l~15g/l。具体为3g/l、5g/l、7g/l、9g/l、11g/l、13g/l或15g/l。酵母浸粉的浓度影响菌体的生长情况及产生酶的活力,随着酵母浸粉浓度的升高菌体的生长情况呈现先升高再降低的趋势,其最高值出现在9g/l,酶活力也随着酵母浸粉浓度的升高表现出先升高再降低的趋势,最高至出现在7g/l。
本发明实施例中,nacl的浓度为5g/l~35g/l;具体为5g/l、10g/l、15g/l、20g/l、25g/l、30g/l或35g/l。实验表明,nacl的浓度影响菌体的生长情况及产生酶的活力,随着nacl浓度的升高菌体的生长情况变差,酶的活力也降低。
本发明实施例中,na2hpo4的浓度为1mmol/l~9mmol/l;具体为1mmol/l、2mmol/l、3mmol/l、4mmol/l、5mmol/l、6mmol/l、7mmol/l、8mmol/l或9mmol/l。实验表明,na2hpo4的浓度影响菌体的生长情况及产生酶的活力,随着na2hpo4浓度的升高菌体的生长情况变差,随着na2hpo4浓度的升高酶的活力先升高后下降,其最高值出现在6mmol/l。
本发明实验表明,培养基的ph值影响菌体生长情况及产生酶的活力,本发明实施例中,该培养基的ph值为6.0~8.0。具体为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5或9.0。菌体生长和酶活力的最高值出现在ph值为7.0时。
fepo4的水合物为七水磷酸铁;mgso4的水合物为七水硫酸镁。
实施例中验证效果的培养基中包括:
经验证,效果较好的培养基中包括:
更优选的,培养基中包括:
前处理采用的培养基是在上述发酵使用的培养基中添加琼脂,使其形成固体培养基,具体的,固体培养基中包括:
步骤1中所述活化的条件为24℃~36℃,摇床培养12~24h;所述摇床的转速为150~210rpm。
步骤2中所述发酵的条件为24℃~36℃,摇床培养24~48h;所述摇床的转速为150~210rpm。
实施例中对发酵温度、转速、接种量和发酵体积进行了筛选。
其中,发酵温度为20℃、24℃、28℃、32℃、36℃。结果表明,28℃为最适发酵温度。
发酵的转速为40rpm、80rpm、120rpm、160rpm、200rpm、240rpm。结果表明,200rpm为最适转速。
接种量为1%~8%,具体为1%、2%、3%、4%、5%、6%、7%、8%。揭结果表明,最适接种量为3%。
发酵体积为50ml~120ml,具体为50ml、60ml、70ml、80ml、90ml、100ml、110ml、120ml。结果表明,最适发酵体积为70ml。
本发明研究表明,适宜条件下,24h发酵所得浒苔多糖降解酶的活性和量即可达到较高水平。
步骤3中所述离心的转速为6000rpm,时间为20min。
步骤3中所述离心、除菌、浓缩、除盐皆在4℃进行。
所述除菌采用过滤除菌,滤径为0.22μm。
浓缩采用超滤浓缩。
除盐采用透析除盐。
透析的孔径为8000-14000dada。
透析液的组分包括:5mmpbs缓冲液
干燥为真空冷冻干燥。
以本发明提供的菌种和发酵产生的浒苔多糖降解酶具有良好的酶活性,能够降解浒苔多糖,且可根据不同的参数制备不同聚合度的浒苔多糖寡糖。本发明提供的浒苔多糖降解酶的活性可达1.03u/ml。
将得到的由保藏编号为cgmccno.12912的饲料类芽孢杆菌发酵制得的浒苔多糖降解酶与纯化的浒苔多糖混合,得到混合物。
所述纯化的浒苔多糖按照如下方法进行制备:
1)采用热水浸提法提取浒苔中的多糖,得到浒苔粗多糖;
2)所述浒苔粗多糖与水混合后,得到浒苔粗多糖水溶液,所述浒苔粗多糖水溶液经过经deaesepharosefastflow弱阴离子交换色谱柱洗脱,得到洗脱液;
3)将所述洗脱液经过浓缩和透析后,用sepharose6b凝胶色谱柱纯化,得到纯化的浒苔多糖水溶液;
4)将所述纯化的浒苔多糖水溶液经过浓缩、透析和冻干,得到纯化的浒苔多糖。
所述热水浸提法具体按照如下方法进行操作:
将清洗过后的干净的浒苔多糖与水混合进行加热提取,得到反应产物;
将所述反应产物进行过滤,得到滤液;
将所述滤液脱色和去除气味后进行浓缩,得到浓缩液;
将所述浓缩液过滤,离心后进行冷却,得到凝胶;
将所述凝胶进行冷冻后与体积浓度≥95%的乙醇混合,进行脱水,得到脱水后的多糖;
将所述脱水后的多糖进行干燥,得到浒苔多糖。
其中,本发明首先将清洗过后的干净的浒苔多糖与水混合进行加热提取,得到反应产物。
所述浒苔多糖的清洗按照如下方法进行:
将浒苔多糖置于水中浸泡搅拌,所述浸泡时间优选为10~40min,浸泡结束后用纱布过滤,去除滤液。
所述清洗的次数优选为3~4次。
得到的清洗过后的干净的浒苔多糖与水混合进行加热提取,所述提取温度为80~100℃,料液比为1:20~1:40,提取ph为6~7,提取时间为2~3小时。
按照上述提取方法,得到的浒苔多糖产量较高,而且得到的浒苔多糖溶液较容易由溶胶态转位凝胶态。
最优选的,所述提取条件为温度90℃、ph为6、提取时间为3h、料液比为1:40。
将所述反应产物进行过滤,得到滤液,得到的滤液进一步用500目的筛绢进行过滤,除去不溶的杂质。
接着,将所述滤液进行浓缩到原来体积的五分之一,得到浓缩液。使之形成凝胶或者是对提好的滤液在次加入清洗好的浒苔进行第二次提取,以提高滤液中的多糖含量,使滤液尽快形成凝胶。
得到浓缩液后,把浓缩液加热到40~50℃,然后在浓缩液进行离心,离心的时间为5~15分钟,转速为5000~10000r/min,进一步除去多糖提取液中的不溶物质。
将所述离心好的多糖溶液置于4℃的条件下,得到凝胶。
将所述凝胶进行冷冻后与体积浓度≥95%的乙醇混合,进行脱水,得到脱水后的多糖。
所述冷冻的温度为-20℃,所述冷冻的时间≥8小时。所述脱水的次数优选为2~3次。
采用上述脱水方式得到的浒苔多糖能保护多糖的结构,因而更有利于微球的形成。
将所述脱水后的多糖进行干燥,得到浒苔粗多糖。
所述干燥的温度为50℃,所述干燥的时间为4~5小时。
最后将浒苔多糖粉碎即可。
得到浒苔粗多糖后,将所述浒苔粗多糖与水混合后,得到浒苔粗多糖水溶液,所述浒苔粗多糖水溶液经过经deaesepharosefastflow弱阴离子交换色谱柱洗脱,得到洗脱液;
具体的,取浒苔粗多糖,用适量水溶解,离心除去不溶物,上清液通过deaesepharosefastflow弱阴离子交换色谱柱对粗多糖进行分离纯化,具体分离纯化方法为:
依次以蒸馏水洗脱2个柱体积,0.5mol/lnacl洗脱2个柱体积,1.07mol/lnacl洗脱3个柱体积,用硫酸-苯酚法绘制洗脱曲线。根据洗脱曲线合并0mol/lnacl洗脱液。
得到洗脱液后,将所述洗脱液经过浓缩和透析后,用sepharose6b凝胶色谱柱纯化,得到纯化的浒苔多糖水溶液;
本发明对所述浓缩和透析的方法并没有特殊限制,本领域技术人员公知的方法即可。
将所述洗脱液经浓缩、透析后,进一步用sepharose6b凝胶色谱柱纯化,具体方法如下:
以水为流动相,流速为1ml/min,根据洗脱曲线合并洗脱液,得到纯化的浒苔多糖水溶液。
将所述纯化的浒苔多糖水溶液经过浓缩、透析和冻干,得到纯化的浒苔多糖。
将纯化的浒苔多糖与由保藏编号为cgmccno.12912的饲料类芽孢杆菌发酵制得的浒苔多糖降解酶混合进行酶解反应后,依次经过灭酶、离心,得到上层清液;
所述纯化的浒苔多糖与浒苔多糖降解酶的质量比为25:1~100:1。
在本发明中,所述酶解反应的温度为30~60℃所述酶解反应的时间为60h~96h。
将酶解后的产物进行灭酶、离心,得到上层清液。
所述灭酶采用沸水煮沸灭酶,所述煮沸的时间为10min,是蛋白失活。
所述离心的转速为8000rpm,离心的时间为10min。
得到上层清夜后,将所述上层清液醇沉后离心,得到低分子量浒苔多糖溶液,将所述低分子量浒苔多糖溶液经过浓缩、透析和冷冻干燥,得到低分子量浒苔多糖。
具体的,向所述上层清夜中加入95%的乙醇沉淀去除未反应的多糖。上清液经旋转蒸发浓缩,透析(≤2000da),冷冻干燥,得低分子低分子量浒苔多糖(dup)。
本发明还提供了一种硫酸化的低分子量浒苔多糖的制备方法,包括以下步骤:
a)将低分子量浒苔多糖分散于有机溶剂中,再加入酯化试剂进行反应,得到反应液,所述低分子量浒苔多糖为上述低分子量浒苔多糖或按照上制备方法制备得到的低分子量浒苔多糖;
b)将碱液加入至所述反应液中进行中和,得到中和液;
c)将所述中和液依次进行离心,浓缩和醇沉,得到纯化液;
d)将所述纯化液依次进行离心、重溶和冷冻干燥得到硫酸化的低分子量浒苔多糖。
本发明首先将低分子量浒苔多糖分散于有机溶剂中,再加入酯化试剂进行反应,得到反应液。
所述酯化试剂按照如下方法进行制备:
将体积比为2:1的无水吡啶与氯磺酸混合后,加热搅拌,得到酯化试剂。
具体的,将无水吡啶冰水浴冷却至0℃,磁力搅拌下缓慢地加入氯磺酸,95℃持续搅拌30min,使淡黄色固体充分溶解,密封后冰箱中冷藏,1周内有效。
所述有机溶剂优选为甲酰胺。
在本发明中,所述反应具体为:
将低分子量浒苔多糖粉末悬浮于有机溶剂中,磁搅拌下滴加所述酯化试剂,在95℃反应3h,得到反应液。
反应结束后,将所述反应液冰水浴中冷却至0℃,在向其中加入已预先冷却至0℃的4mol/lnaoh溶液中和,得到中和液;
接着,将所述中和液离心、透析、真空旋转蒸发浓缩后加入3倍体积的95%乙醇进行醇沉,得到纯化液;
将所述纯化液离心、重溶、冷冻干燥得到硫酸化低分子量浒苔多糖(sdup)。
在本发明中,所述硫酸根取代度(ds)按照式(i)公式进行计算:
ds=1.62×s%/(32-1.02×s%),式(i);
式(i)中,s%为硫原子的质量分数。
本发明还提供了一种采用上述制备方法制备得到的硫酸化的低分子量浒苔多糖,所述硫酸化的低分子量浒苔多糖的重均分子量为5.99×104da;硫酸根取代度为0.81,所述硫酸化的低分子量浒苔多糖由摩尔比为鼠李糖:葡萄糖:半乳糖:木糖:阿拉伯糖=1.09∶1.00:0.06:0.10:0.11的单糖组成。
所述硫酸化的低分子量浒苔多糖的多分散系数为2.501,所述硫酸化的低分子量浒苔多糖的数均分子量为2.40×104da;所述硫酸化的低分子量浒苔多糖的z均分子量为1.574×105da。
本发明还提供了一种抗氧剂,所述抗氧剂选自上述低分子量浒苔多糖或者上述硫酸化的低分子量浒苔多糖。
本发明采用酶解法得到特定分子量和单糖组成的低分子量浒苔多糖,该低分子量浒苔多糖具有较高的抗氧化活性。另外,在该低分子量浒苔多糖的基础上进行进一步的硫酸化修饰,得到的硫酸化的低分子量浒苔多糖也具有良好的抗氧化活性。
为了进一步理解本发明,下面结合实施例对本发明提供的低分子量浒苔多糖及其制备方法、硫酸化低分子量浒苔多糖及其制备方法以及应用进行说明,本发明的保护范围不受以下实施例的限制。
实施例1浒苔多糖提取
将浒苔干粉用自来水清洗(去除盐和其他杂质),于60℃烘干备用。用热水浸提法提多糖,按浒苔:水(w/v)=1:30加入蒸馏水,100℃加热搅拌提取2h,用200目筛绢过滤,滤渣重复提取一次,合并两次粗滤液,测量体积。粗滤液放置冷却成凝胶,切条后于-20℃冰箱冷冻。当胶条完全冻透后取出、敲碎,加入1.5倍粗滤液体积的95%酒精,室温放置,使冰块化冻脱水。用200目筛绢过滤,用手挤去水和酒精。再用一定量的95%酒精将滤渣进一步脱水,然后在60℃烘干,得浒苔粗多糖。
实施例2浒苔多糖的分离纯化
采用deaesepharosefastflow弱阴离子交换色谱柱对粗多糖进行分离纯化,用部分收集器收集馏分,采用硫酸-苯酚法检测总糖含量。根据线性洗脱结果,分别用蒸馏水洗脱2个柱体积,0.5mol/lnacl洗脱2个柱体积,1.07mol/lnacl洗脱3个柱体积,4mol/l洗脱2个柱体积,再用去离子水冲洗6个柱体积(目的是除去多余盐溶液);柱体积:60ml;上样量:30mg;流速:3.5ml/min。部分收集器收集,硫酸-苯酚法检测总糖含量,以洗脱体积、吸光度以及盐浓度作图。结果见图1,图1为浒苔多糖deaesepharosefastflow阶段梯度洗脱曲线。收集蒸馏水洗脱组分,透析除盐、浓缩、冻干,置于干燥器中保存。
经deaesepharosefastflow阴离子交换色谱分离得到的多糖组分,继续通过sepharose6b凝胶色谱柱(2.6×80cm)进行进一步的分离纯化。以水为洗脱液,流速为1ml/min。利用部分收集器收集组分(10ml/管);用硫酸-苯酚法检测总糖含量,于490nm波长处测定其吸收值,以吸光度-洗脱时间作图。结果见图2,图2为浒苔多糖的sepharose6b凝胶渗透色谱图。合并含糖量高的组分经透析脱盐、冻干,置于干燥器中保存。
实施例3浒苔多糖降解酶的制备
1)、前处理:将保藏编号为cgmccno.12912的饲料类芽孢杆菌划线于浒苔多糖固体培养基上,在28℃培养5d;
固体培养基为浒苔多糖2g/l,蛋白胨6g/l,酵母浸粉7g/l,nacl5g/l,na2hpo46mmol/l,mgso41g/l,fepo4·7h2o0.05g/l,琼脂15g/l。
2)、活化:将固体培养基菌株接1~3环于种子培养液的试管中,于28℃下以200rpm培养12h。
培养液为浒苔多糖2g/l,蛋白胨6g/l,酵母浸粉7g/l,nacl5g/l。
3)、发酵:将种子培养基接入发酵培养基中,以摇床28℃培养24h,获取发酵物。
发酵培养基为浒苔多糖2g/l,蛋白胨6g/l,酵母浸粉7g/l,nacl5g/l,na2hpo46mmol/l,mgso41g/l,fepo4·7h2o0.05g/l。发酵结束后,测定菌液od600值为1.223,所得菌液6000rpm离心20min得发酵上清液;4℃条件下,将所得发酵上清液过0.22μm滤膜除菌、超滤浓缩、透析除盐、真空冷冻干燥,得到浒苔多糖降解酶。
测定酶活力:酶活的检测方法为dns法,酶活力定义:1ml酶液1min产生1μg还原糖作为一个活力单位,结果为1.03u/ml。
实施例4低分子量浒苔多糖制备
低分子量浒苔多糖的制备通过酶水解方法。利用实施例3制备得到的浒苔多糖降解酶和实施例2制备得到的浒苔多糖按照质量比为50:1于45℃反应72h,沸水煮沸10min,使蛋白失活,8000rpm离心10min,收集上清液加入95%的乙醇沉淀去除未反应的多糖。上清液经旋转蒸发浓缩,透析(≦2000da),冷冻干燥,得低分子量浒苔多糖(dup)。将所述低分子量浒苔多糖进行红外光谱测试,结果见图3,图3为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的红外光谱图。
实施例5硫酸化的低分子量浒苔多糖
硫酸化修饰采用氯磺酸-吡啶法。氯磺酸遇水会产生激烈的反应,甚至爆炸,因此操作过程要避免触水。
1)酯化试剂的制备:加200ml无水吡啶于500ml圆底烧瓶中,冰水浴冷却至0℃,磁力搅拌下缓慢地加入100ml氯磺酸,95℃持续搅拌30min,是淡黄色固体充分溶解,密封后冰箱中冷藏,1周内有效。
2)硫酸化低分子量浒苔多糖的合成:1g实施例4制备的低分子量浒苔多糖粉末悬浮于40ml甲酰胺中,磁搅拌下滴加7.5ml酯化试剂,95℃反应3h。结束后,冰水浴中冷却至0℃,加入已预先冷却至0℃的4mol/lnaoh溶液中和溶液酸碱度,离心、透析、真空旋转蒸发浓缩后加入3倍体积的95%乙醇,离心、重溶、冷冻干燥得到硫酸化低分子量浒苔多糖(sdup)。将所述硫酸化的低分子量浒苔多糖进行红外光谱测试,结果见图3,图3为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的红外光谱图。
硫酸根取代度(ds)计算:ds=1.62×s%/(32-1.02×s%)
s%:硫原子的质量分数。
实施例6化学性质研究
(1)总糖含量测定采用苯酚-硫酸法。标准曲线的绘制:准确配制0.1mg/ml的鼠李糖标准溶液。分别吸取0.0,0.1,0.15,0.2,0.25,0.3,0.35,0.4ml标准溶液,补水使终体积为0.5ml。加入0.3ml6%苯酚,1.5ml浓硫酸,振荡摇匀,100℃水浴中加热15min,冷却后490nm测定吸光度a。以鼠李糖浓度(mg/ml)为横坐标,a为纵坐标,绘制标准曲线。
分别将实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化的低分子量浒苔多糖样品配制成5mg/ml溶液,用时稀释至0.1mg/ml。取0.5ml,其余重复上述标准品操作,以标准曲线计算总糖含量。
(2)糖醛酸含量测定采用硫酸-咔唑法。咔唑试剂:将0.1g咔唑溶于90ml95%乙醇,定容到100ml。硫酸-硼砂溶液:0.9534g硼砂溶于10ml水中,搅拌溶解,于冰水浴中加入90ml浓硫酸,混匀后静置过夜备用。标准曲线的绘制:准确配制浓度为0.25mg/ml葡萄糖醛酸标准溶液。分别吸取标准溶液0,10,20,30,40,50,65,70,80μl,加水至终体积为100μl,加入0.6ml硫酸-硼砂溶液和20μl咔唑,摇匀,100℃加热10min,冷却,530nm处测定吸光度a。以葡萄糖醛酸浓度(mg/ml)为横坐标,吸光值为纵坐标,绘制标准曲线。样品的测定:样品合适浓度下,取100μl按上述步骤操作。以标准曲线计算样品中糖醛酸含量。
(3)硫酸根含量测定采用氯化钡-明胶法。硫酸根标准溶液:准确称取于105℃条件下干燥至恒重的硫酸钾,用1mol/l盐酸溶液溶解,配制浓度为0.6mg/ml硫酸根标准溶液。0.5%明胶溶液:称取2.5g明胶,溶于500ml、70℃左右的蒸馈水中,静置过夜,4℃保存备用。氯化钡-明胶溶液:称取0.5g氯化钡,溶于100ml己静置过夜的0.5%明胶溶液中,4℃保存备用。硫酸根标准曲线的绘制:准确吸取硫酸根标准溶液0.00、0.04、0.08、0.12、0.16和0.20ml于试管中,用1mol/l的hc1溶液补至0.20ml,向各管中分别加入3.8ml、8%三氯乙酸和1.0ml氯化钡-明胶溶液,振荡摇匀后静置,于室温下反应15min,于波长360nm处测定吸光值a1;用相同体积0.5%的明胶溶液代替氯化钡-明胶溶液,于波长360nm处测定吸光值a2。以硫酸根含量为横坐标,(a1-a2)的吸光值为纵坐标绘制标准曲线。分别将实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化的低分子量浒苔多糖样品加入1mol/lhcl,100℃水解6h,加入3.8ml、8%三氯乙酸和1.0ml氯化钡-明胶溶液,振荡摇匀后静置,于室温下反应15min,于波长360nm处测定吸光值a1;用相同体积0.5%的明胶溶液代替氯化钡-明胶溶液。于360nm处测定吸光值a2,用硫酸钠为标准物作标准曲线,计算得硫酸根含量。
(4)采用考马斯亮蓝法测定实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化的低分子量浒苔多糖样品中的蛋白含量。
得到以下表1结果:
表1低分子量浒苔多糖及其硫酸化衍生多糖的理化性质
表1中,nd表示为未检出。得率为由低分子量浒苔多糖制备硫酸化的低分子量浒苔多糖的得率。
实施例7单糖组分测定
单糖组分测定采用pmp柱前衍生高效液相色谱分析(pmp-hplc)。以甲醇配制浓度为0.5mol/l的pmp溶液;配制浓度为10mg/ml的混合单糖(l-鼠李糖,d-木糖,d-葡萄糖,d-半乳糖,d-阿拉伯糖)标准品溶液;分别将实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化的低分子量浒苔多糖样品用三氟乙酸溶液完全水解,水解产物40℃旋转蒸干后,再反复加ch3oh蒸干,直至除去多余三氟乙酸。将蒸干后样品溶于100μl水中制成10mg/ml样品溶液。取样品及标准单糖溶液各100μl,加入0.5mol/mlpmp溶液120μl,0.3mol/l的naoh溶液100μl,70℃水浴反应1h,冷却至室温后加入100μl浓度为0.3mol/l的盐酸溶液中和,二氯甲烷萃取3次,取上层清液过0.22μm微孔滤膜,即得衍生样品及标准品。色谱条件为:色谱柱:agilenttc-c18色谱柱;柱温:30℃;流动相:0.02mol/ml磷酸盐缓冲液(ph6.8)/ch3cn=83:17(v/v)。梯度洗脱为(0min,17%b;5min,18%b;10min,19%b;30min,20%b)。洗脱上样量:20μl;流速:1.0ml/min;检测器:uv(250nm)。根据出峰时间和峰面积比可知样品中的单糖组成及摩尔比。得到以下表2结果:
表2低分子量浒苔多糖及其硫酸化衍生多糖的单糖组分
实施例8分子量测定
分子量的测定采用的是高效凝胶渗透液相色谱法(hpgpc)。采用高效凝胶渗透色谱法(hpgpc)测定多糖的分子量。hpgpc条件:分析柱为sb-806hq和sb-804hq串联柱;流动相为0.1mol/lnano3;流速为1ml/min;柱温为25℃;进样量为20μl;示差检测器检测。分别进样20μl,gpc软件根据6个不同分子量标样的出峰时间不同,绘制标准曲线。样品的测定:分别精密称取实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化的低分子量浒苔多糖样品,加流动相溶解制成5%的溶液,离心取上清液,进样20μl,gpc软件根据出峰时间,对应标准曲线。计算样品的峰位分子量,根据峰宽计算分子量分布宽度系数(d)。得到以下表3结果:
表3低分子量浒苔多糖及其硫酸化衍生多糖的分子量及其多分散系数
实施例9超氧自由基清除活性实验
实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化低分子量浒苔多糖的超氧自由基清除活性实验采用nadh-pms-nbt法。
具体操作为:用tris-hcl缓冲液(ph8.0)制备不同浓度样品(0.01-0.5mg/ml)。每个样品取0.1ml,加入1ml557μmnadh(溶于16mmtris-hcl,ph8.0),1ml45μmpms(溶于16mmtris-hcl,ph8.0),1ml108μmnbt(溶于16mmtris-hcl,ph8.0)。室温反应5min,于560nm测吸光值为a1;a0包含所有试剂但无样品;a2为样品和试剂但用tris-hcl代替nbt。
超氧自由基清除率计算公式:
超氧自由基清除率(%)=[1-(a1-a2)/a0]×100%
结果见图4,图4为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的超氧自由基清除活性。由图4可知,样品浓度在2mg/ml时,低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的超氧自由基清除活性分别为72.48%,93.06%,同浓度的vc的清除率为82.95%。说明浒苔多糖经硫酸化修饰后,超氧自由基清除率明显增强,而且高于同浓度的vc。
实施例10羟基自由基清除活性实验
实施例4制备的低分子量浒苔多糖与实施例5制备的硫酸化低分子量浒苔多糖的羟基自由基清除活性实验
制备不同浓度的多糖样品(0.25-10.0mg/ml),各样品2ml,加入5mmol/l的feso4(2ml),5mmol/l的水杨酸乙醇溶液(2ml);然后加入2ml5mmol/lh2o2。37℃水浴30min,冷却至室温,于510nm处测吸光值为a1,以抗坏血酸做阳性对照。a0为试剂(无样品);a2为无羟基自由基。
羟基自由基清除率计算公式:
羟基自由基清除率=[1-(a1-a2)/a0]×100%
结果见图5,图5为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的羟基自由基清除活性。由图5可知,样品浓度低于4mg/ml时,低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的羟基自由基清除率显著高于vc;而样品浓度高于4mg/ml时,低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的羟基自由基清除率低于vc;在浓度为10mg/ml,低分子量浒苔多糖、硫酸化的低分子量浒苔多糖以及vc的羟基自由基清除率分别为54.29%,73.21%,100%。说明在低浓度下,低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的羟基自由基清除率高于vc;而在高浓度时,经硫酸化修饰后浒苔多糖的羟基自由基清除率低于同浓度的vc,但比未修饰的浒苔多糖的羟基自由基清除率高。
实施例11dpph自由基清除实验
制备0.2mmol/l的dpph乙醇溶液,现配现用。制备不同浓度的多糖浓度(0.25-10mg/ml)。取1ml样品加入2ml的dpph和2ml95%乙醇。反应液剧烈混合,放于暗室反应30min,于517nm处测吸光值为a1。a0为反应液包含2mldpph和3ml乙醇。a2为1ml和4ml95%的乙醇。多糖的dpph自由基清除率计算公式:
dpph自由基清除率(%)=[1-(a1-a2)/a0]×100%
结果见图6,图6为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的dpph自由基清除活性。由图6可知,低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的dpph自由基清除率低于vc;但在样品浓度10mg/ml时,硫酸化的低分子量浒苔多糖的dpph自由基清除率接近vc;在浓度为10mg/ml,低分子量浒苔多糖、硫酸化的低分子量浒苔多糖以及vc的dpph自由基清除率分别为43.67%,93.26%,98.05%。说明浒苔多糖经硫酸化修饰后,dpph自由基清除率显著增强。
实施例12还原力测定
用0.2mmol/ml磷酸缓冲液(ph6.6)配置不同浓度样品(0.25-10.0mg/ml)。具体方法为取样品1.0ml,加入1ml(1%,w/v)铁氰化钾,50℃温浴20min。然后加入2.0ml三氯乙酸(10%,w/v)终止反应。再向反应液中加入1.2ml氯化铁(0.1%,w/v),于700nm处测吸光值。吸光值越大还原力越强。结果见图7,图7为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的还原能力。由图7可知,在浓度为10mg/ml,低分子量浒苔多糖、硫酸化的低分子量浒苔多糖以及vc的还原能力分别为0.9713,2.0449,3.8013;同浓度下硫酸化的低分子量浒苔多糖的还原力虽不及vc,但明显高于未硫酸化修饰低分子量浒苔多糖。说明硫酸化修饰的低分子量浒苔多糖能明显增强其还原能力。
实施例13金属螯合能力测定
多糖的金属螯合能力测定参考文献稍有改动。制备不同浓度的样品(0.2-10mg/ml),加入2mmfecl2(0.1ml)和5mm菲咯嗪(0.4ml),混匀后室温放置10min。edta作为阳性对照,于562nm处测吸光值。金属离子螯合能力计算公式:
金属螯合能力(%)=100%×(a0-a)/a0
a0为无样品的吸光值,a为样品混合液吸光值。
结果见图8,图8为低分子量浒苔多糖以及硫酸化的低分子量浒苔多糖的金属螯合能力。由图8可知,在浓度为10mg/ml,低分子量浒苔多糖、硫酸化的低分子量浒苔多糖以及edta的金属离子螯合能力分别为97.69%,66.78%,99.70%;同浓度下低分子量浒苔多糖的金属离子螯合能力明显高于硫酸化修饰低分子量浒苔多糖,并且接近edta的金属离子螯合能力。说明经硫酸化修饰的低分子量浒苔多糖的金属离子螯合能力有所下降。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!