一类喹啉‑二吡啶衍生物Zn2+荧光探针及其应用的制作方法
【技术领域】
本发明涉及检测技术领域,特别涉及一种用于特异性检测水相中zn2+浓度的荧光探针及其制备方法及该荧光探针在生物活细胞检测中的应用。
背景技术:
在人体中,锌离子是含量第二位的过渡金属离子,在很多生理过程,例如结构和催化因子、信号传输和调节、基因表达调节和细胞凋亡中都起着重要的作用。
在已发现的蛋白组中发现,锌参与基因编码的结合蛋白占总量的10%。锌元素在哺乳动物的总浓度在300~500μm范围内,其中大部分以金属蛋白的形式紧密键合,很小的一部分是可以自由移动或者和一些小分子较松散的键合,并且可以发生离子交换。这一小部分已在前列腺、肠、胰腺、脑中发现。以离子形式存在的锌,大多都是细胞质中的锌离子,参与了生物体的信息传递,而且其传递过程和生物体很多生理学和病理学过程相关。
锌和活性氮(rns),如氧化氮(no)和过氧化亚硝酸盐(onoo-)一样,在生物体的神经系统扮演着重要的角色和生物体的神经功能障碍密切相关。将神经元暴露于高浓度的no中,会导致过氧亚硝酸盐的形成,进而导致贮存的锌离子从细胞中释放,高浓度自由的锌离子,会诱导线粒体功能障碍和活性氧(ros)的产生增加,从而加速了细胞凋亡的过程,致使神经退行性疾病的产生。而且高浓度no和过氧亚硝酸盐会作用于内质网(er),诱导内质网(er)应激和激活细胞应激发生未折叠蛋白反应(upr)。许多神经退行性疾病,如阿尔茨海默氏病、帕金森氏病、朊病毒病、亨廷顿氏病、额颞痴呆、肌萎缩性侧索硬化症等,都是由于蛋白质折叠发生错误。因此,发展一种比较敏感并且识别性强的技术来完成对于锌离子的探测是十分有必要的。
在己报道的检测分析方法中,荧光探针以其明显的优势受到人们的日益关注。zn2+荧光探针可以与zn2+选择性的结合,并导致荧光强度或者是波长发生改变,从而根据荧光光谱的变化来测定zn2+浓度相关参数。基于荧光的信号识别,使荧光探针具有好的选择性、高的灵敏度、价格低廉和操作简便,并且能够快速、实时、原位定量检测和分析等优点,引起了人们的关注。除了上述优点,荧光探针检测方法为非侵入性检测,不破坏样品,可通过荧光强度和zn2+浓度的关系进行浓度的定量分析。这种检测技术是原子吸收或发射光谱检测、离子选择性电极分析等传统方法所无法代替的。
近年来,吡啶衍生物作为荧光分子探针的识别基团得到了广泛应用,特别是双(2-吡啶基甲基)氨(dpa)被经常用于zn2+的荧光分子探针中,提供三个氮原子,是明确的中性zn2+配体。dpa的这种链状敞开式结构使它能够快速与金属离子络合,保证检测的实时性。dpa氨基上的氮原子在pet和ict探针中都是电子给体。
区别于单光子荧光探针,利用有机分子吸收两个较低能量光子而后发生荧光的过程进行探测的方法就是双光子荧光探针。建立在双光子荧光显微探测技术基础上的双光子荧光探针材料在研究金属离子的含量及其对生理的影响、金属离子参与的生理活动机制、特定分子的分布及其相互作用等领域具有不可比拟的优点,例如可有效的避免单光子荧光探针的上述缺点。双光子荧光探针材料的激发波长在700-900nm范围内,避开了生命体系所不能承受的紫外光损伤以及细胞组织自发荧光的干扰;由于荧光激发只发生在聚焦点,消除了不必要的光漂白和光毒化,这可实现在不伤害或杀死细胞下对金属离子进行较长时间的观察;而且,双光子激发产生的荧光强度与入射光强度成二次方关系,这使得荧光发射集中在更小的空间区域,有效地提高了空间分辨率,同时也解决了生物组织中深层物质的成像问题。
传统的单光子荧光探针也可作为双光子荧光探针。但这些荧光化合物双光子吸收截面均比较小。这些荧光物的双光子吸收截面较小,这就使得双光子诱导荧光量子产率偏低,在实验中必须采用高强度激光激发高浓度荧光物的措施来获得足够强的上转换荧光,这样加大了活体生物样品的观测难度。因此开发一些具有生物相容性、特异性结构和位点识别基元、大的双光子吸收截面、高的荧光量子产率和识别响应性的双光子zn2+荧光探针是必要的。
技术实现要素:
本发明的内容在于提供在水相中有很好的溶解性、高的选择性、灵敏度和ph稳定性好的单/双光子锌离子荧光探针。具体地说,本发明是提供一类化合物,该类化合物可以在水相中特异性捕捉锌离子,捕捉后络合物与络合前的化合物的荧光特性相差较为明显且有规律,可以作为zn2+荧光探针而加以利用。再者,本发明另外的内容在于提供含有具有上述特征的化合物的zn2+荧光探针以及使用该zn2+荧光探针的水相中zn2+浓度的测定方法。
本发明者为了解决上述课题,经过研究,以n,n-双(2-吡啶基甲基)-2-喹啉甲胺为取代基的化合物对zn2+具有高的特异选择性地捕获zn2+,络合物的荧光特性较未络合前有明显的变化。本发明者进一步研究,发现了用下述通式(i)表示的化合物具有较大的双光子吸收截面,是具有商业应用潜力的双光子荧光探针。此外化合物中如通式(ia)所示的柔性基团极大得增强了化合物在水相中的溶解性,大大增大了其于水相中zn2+浓度检测的实际应用价值。
即,本发明提供了用下述通式(i)表示的化合物:
{r1、r2、r3、r4和r5表示卤原子、氢原子、烷基、烷氧基或者用下述式(ia)的基团
[式中,m表示0、1或者2,r6表示氢原子、烷基、烷氧基或者用下述式(ib)表示的基团;y表示亚甲基、氧原子或者氮原子和下述式(ib)表示的基团所连接的形成的基团
(式中,r7表示氢原子、烷基或者烷氧基;z1、z2和z3分别独立地表示没有或者氧原子,n、o和p分别独立地表示0、1或者2),y表示亚甲基、氧原子或者氮原子和通式(ib)表示的基团所连接的形成的基团],r1、r2、r3、r4和r5不能同时是卤原子、氢原子、烷基或者烷氧基;x表示ch=ch(即和两侧苯环形成二苯乙烯结构)或者没有(即为联苯结构)}。
作为上述发明优选的方式,提供用下述通式(ii)表示的化合物
式中,r8、r9、r10和r11分别独立地表示卤原子、氢原子、烷基或烷氧基;r12表示表示氢原子、烷基或者烷氧基;x1表示ch=ch(即和两侧苯环形成二苯乙烯结构)或者没有(即为联苯结构)。根据本发明的优选方式,可以提供r8和r11同时是氢原子,r9和r10同时是甲基,r12是甲氧基的化合物。
另外,根据本发明,可以提供用下述通式(iii)表示的化合物
[式中,r13、r14、r15和r16分别独立地表示卤原子、氢原子、烷基或烷氧基,r17和r18分别独立地表示氢原子、烷基、烷氧基或者用下述式(iiia)表示的基团
(式中,r19表示氢原子、烷基或者烷氧基;z4、z5和z6分别独立地表示没有或者氧原子,r、s和t分别独立地表示0、1或者2),x2表示ch=ch(即和两侧苯环形成二苯乙烯结构)或者没有(即为联苯结构);q表示1或者2]。根据本发明优选方式,可以提供r13、r14、r15和r16同时是氢原子,r19为甲氧基的化合物。
更多的,根据本发明,可以提供含有上述通式(i)、通式(ii)或者通式(iii)表示的化合物的zn2+荧光探针;以及由上述通式(i)、通式(ii)或者通式(iii)表示的化合物和zn2+形成的络合物。该zn2+荧光探针可以用于测定强酸性水溶液、细胞和组织内的zn2+浓度。
更进一步,根据本发明,可既提供了水相中zn2+浓度的测定方法,也提供了将用上述通式(i)、通式(ii)或者通式(iii)表示的化合物用作zn2+荧光探针的方法;水相中zn2+浓度的测定方法,其特征在于包含以下工序:(a)使上述通式(i)、通式(ii)或者通式(iii)表示的化合物和zn2+反应的工序,以及(b)测定在上述工序中生成的氢络合物的荧光强度的工序;并且将上述通式(i)、通式(ii)或者通式(iii)表示的化合物用作zn2+荧光探针。
用上述通式(i)、通式(ii)或者通式(iii)表示的化合物作为用于制造上述zn2+荧光探针的中间体是有用的。
本说明书中,“烷基”或者“烷氧基”的烷基部分是指例如碳原子数为1-10个,优选碳原子数1-6个,优选碳原子数1-4个的直链、支链、环状、或者它们组合形成的烷基。更具体地说,作为烷基,优选低级烷基(碳原子数1-6个的烷基)。作为低级烷基,例如可以列举出甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基甲基、正戊基、正己基、环己基等。在本说明书中,有卤素原子的情况下,氟原子、氯原子、溴原子或者碘原子都可以,优选氟原子或氯原子。
在用上述通式(i)表示的化合物中,x优选为ch=ch(即和两侧苯环形成二苯乙烯结构)或者没有(即和两侧苯环形成联苯结构)。在用上述通式(i)表示的化合物中,优选r1、r2、r3、r4和r5之一是用式(ia)表示的基团,另外两个为卤原子、氢原子、烷基、或者烷氧基。r3用通式(ia)且出现在在x表示的基团对位的时候,优选r1、r2、r4和r5同时为卤原子、氢原子、烷基、或者烷氧基。在用式(ia)表示的基团中,m优选为0、1或2,r4优选为烷基、烷氧基或由式(ib)表示的基团。在活细胞造影中,r6优选为由式(ib)表示的基团。对于y,优选为氧原子或者氮原子和用式(ib)表示的基团共价键和形成的基团。优选y为氧原子时,在用式(ib)表示的基团中,z1和z2优选为氧原子,优选n和o为2,p为1;优选y为氮原子和用式(ib)表示的基团共价键和形成的基团时,在r4优选的式(ib)表示的基团中,z1和z2优选为氧原子,优选n为2,o为1,p为0,y中含有的用式(ib)表示的基团中,z1和z2优选为氧原子,z3优选为没有,优选n和o为2,p为1。r7优选为烷基或者烷氧基,另外在活细胞荧光造影的用途中,优选r7为甲氧基。
在用上述同时(ii)表示的化合物中,优选r9和r10同时是甲基,r8和r11同时是氢原子,r12是甲氧基。
在用上述通式(iii)表示的化合物中,优选r13、r14、r15和r16同时为氢原子,r17和r18为用式(iiia)表示的基团。在优选r17为通式(iiia)表示的基团中,优选r为2,s为1,t为0,z4和z5优选为氧原子;优选r18为通式(iiia)表示的基团中,优选r为2,s为1,t为1,z4、z5和z6优选为氧原子;在通式(iiia)表示的基团中,优选r19为烷基或者烷氧基,另外在活细胞荧光造影的用途中,优选r19为甲氧基。优选x2为ch=ch(即和两侧苯环形成二苯乙烯结构)或者没有(即和两侧苯环形成联苯结构)。
用上述通式(i)、(ii)和(iii)表示的本发明的化合物根据取代基的种类,有具有1个或2个以上不对称碳原子的情况,不仅基于1个或2个以上不对称碳原子的光学活性体或给予2个以上不对称碳原子的非对映异构体等的立体异构体、并且立体异构体的任意混合物、外消旋体等都包含在本发明的范围内。
自6号位卤代的2-甲基喹啉(hai为卤素)出发,经由已知文献披露的方法(chem.commun.2012,48(35):4196-4198.),芳基甲烷在二氧化锡的催化下被氧化为芳基醛基,再和2,2'-双(吡啶基甲基)胺发生醛胺缩合反应后经还原得到卤代的6-卤代-2-n,n-双(2-吡啶基甲基)-2-喹啉甲胺化合物,再根据文献方法,如suzuki-miyaura和heck反应,和取代的苯硼酸或者取代苯乙烯化合物形成联苯或者苯乙烯基团的取代结构,即得到部分通式(i)产物;更多的,在产物的基础上脱甲基制备带有羟基的中间体,然后进行成醚、环氧加成、迈克尔共轭加成反应等,所得到的产物应也属于通式(i)所述化合物。
如权利要求3和权利要求4所述的通式(ii)和通式(iii)表示的化合物与如上述通式(i)所述化合物合成方法的差异性体现在它们中取代苯硼酸和取代苯乙烯中的r2基团的不同,根据带有胺基和羟基的柔性链的取代反应,可以较为轻易地制备得到通式(ii)和(iii)所需的取代苯硼酸和苯乙烯中间体,后续合成方式参照通式(i),即可得到通式(ii)和通式(iii)的化合物。
另外,在本说明书的实施例中,更详细且具体地显示了记载在该方案中的示例性化合物的制造方法。因而,本领域技术人员根据这些说明,适当选择反应原料、反应条件和反应试剂等,更具需要,通过对这些合成方法进行修改或者改变,全都可以制造上述通式表示的本发明的化合物。
符合通式(i)结构的示例性化合物列举如下:
用上述通式(i)、通式(ii)和通式(iii)表示的本发明的化合物作为荧光探针是有效的。用上述通式(i)、通式(ii)和通式(iii)表示的本发明的化合物和zn2+的络合物的荧光性质较其本身的荧光性质发生较大变化,且它们荧光性质随着zn2+络合程度的不同呈现出有规律性的变化。上述化合物在水溶液中具有较大的溶解性且具有可以特异性捕获zn2+并形成络合物的特征。形成的络合物还具有在活的细胞中产生荧光的特征。因此,用上述通式(i)、通式(ii)和通式(iii)表示的本发明的化合物作为在生理条件下测定生物细胞和生物组织中的zn2+浓度的zn2+荧光探针是极其有用的。另外,本说明书中使用的所谓“测定”属于包括定性和定量测定,应该作最广义的解释。
本发明的zn2+荧光探针的使用方法没有特别的限定,可以和以往公知的zn2+探针同样使用。通常,将选自用上述(i)表示的化合物溶解在生理盐水或缓冲液等水性介质或者乙醇、丙酮、乙二醇、二甲基亚砜、二甲基甲酰胺等水混溶性有机溶剂和水性介质的混溶物等中,将该溶液添加到含有细胞和组织的适当的缓冲液中,只要测定其荧光发射谱就可以。
【附图说明】
图1:实施例二中的探针probe2与各种金属离子作用的荧光柱形图。
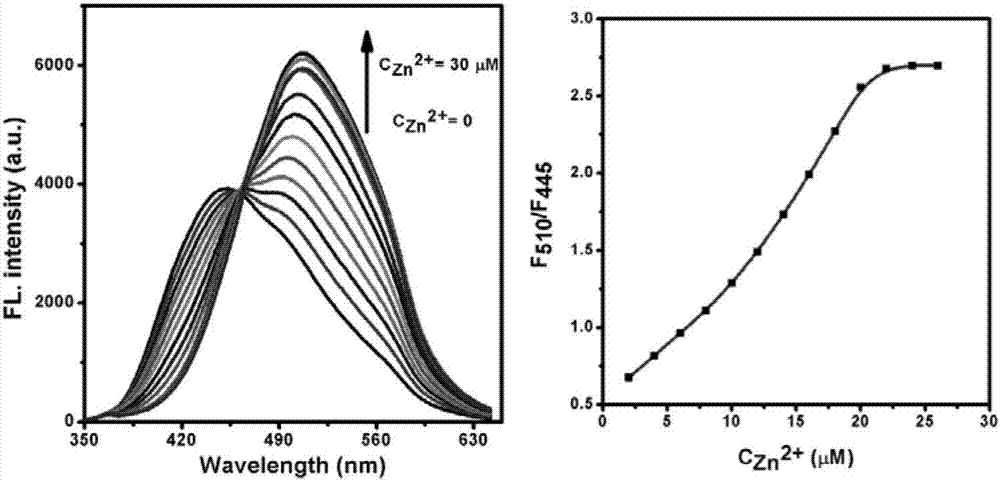
图2:实施例二中探针probe2(2.4×10-5m)的荧光光谱随zn2+浓度(0-30μm)的变化。
图3:逐渐增大锌离子当量条件下实施例一中探针probe1的荧光光谱;插入图:412nm处荧光强度随zn2+浓度的变化曲线。
图4:实施例二中探针probe2的双光子zn2+滴定图。
图5:实施例二中探针probe2的双光子吸收截面(加入zn2+前后)。
图6:实施例一中探针probe1的络合比测试:在探针和zn2+总浓度为10μm的溶液中,随zn2+比例变化的溶液在410nm处荧光强度的变化图。
图7:实施例二中探针2在pc12细胞中的双光子荧光成像照片:(a)(b)(c)(d)探针(20μm)与pc12共同培养的双光子图像;(e)(f)(g)(h)探针(20μm)中加入锌离子(10μm)的pc12细胞图像;(i)(j)(k)(l)探针(20μm)中加入锌离子(20μm)的pc12细胞图像;(m)(n)(o)(p)探针(20μm)中加入锌离子(30μm)的pc12细胞图像。
【具体实施方式】
实施例一:探针probe1的合成
自三乙二醇单甲醚为原料,根据文献方法,经过三步,可以轻易得到化合物3,为褐色粘稠液体状产物。收率79.9%。1hnmr(400mhz,cdcl3,δppm):7.14(t,j=7.8hz,2h),7.01(d,j=8.9hz,4h),6.92(d,j=7.9hz,2h),6.84(s,1h),6.82(d,j=8.9hz,4h),4.11-4.08(m,4h),3.85-3.82(m,4h),3.73(dd,j=5.9,3.5hz,4h),3.69-3.63(m,8h),3.55(dd,j=5.6,3.6hz,4h),3.37(s,6h).
在250ml单口烧瓶中,依次加入中间体3(4.6g,11mmol)、n-溴代丁二酰亚胺(1.96g,11mmol)和50mln,n-二甲基甲酰胺,在室温下搅拌反应4h。加入冰水,用乙酸乙酯萃取,无水硫酸钠干燥,过滤,旋蒸干溶剂,用乙酸乙酯/石油醚(1:1)作为展开剂,经硅胶柱层析得到探针1(2.2g)。淡黄色液体产物。收率30.9%。1hnmr(400mhz,cdcl3,δppm):7.26-7.18(m,2h),7.00(d,j=8.8hz,4h),6.83(d,j=8.8hz,4h),6.78(d,j=8.8hz,2h),4.13-4.07(m,4h),3.87-3.82(m,4h),3.76-3.71(m,4h),3.71-3.63(m,8h),3.57-3.54(m,4h),3.38(s,6h).
在100ml单口烧瓶中,取50ml干燥的四氢呋喃溶解中间体8(2.0g,3.1mmol)并将其加入烧瓶,将体系温度降至-78℃,在氮气保护下加入正丁基锂溶液(8ml,2.5m),搅拌2h,加入硼酸三异丙酯(0.88g,4.7mmol),搅拌反应8h。反应结束后,反应液倒入100ml冰水中,加入盐酸保证体系为酸性,用二氯甲烷萃取,旋蒸除去溶剂,得到粗产品。用乙酸乙酯/甲醇(20:1)作为展开剂,经硅胶柱层析得到化合物9(1.3g)。淡黄色粘稠液体。收率68.8%。1hnmr(400mhz,d6-dmso,δppm):7.76(s,2h),7.59(d,j=8.5hz,2h),7.01(d,j=8.9hz,4h),6.92(d,j=9.0hz,4h),6.68(d,j=8.5hz,2h),4.08-4.04(m,4h),3.77-3.69(m,4h),3.59(dd,j=5.8,3.2hz,4h),3.56-3.50(m,8h),3.43(dd,j=5.8,3.6hz,4h),3.23(s,6h).
根据文献方法,以6-溴-2-甲基喹啉为原料,制得化合物7。淡褐色固体,收率36.6%。1hnmr(400mhz,d6-dmso,δppm):8.52(d,j=4.5hz,2h),8.36-8.31(m,1h),8.24(s,1h),7.91(t,j=10.0hz,1h),7.88-7.72(m,4h),7.63(d,j=7.8hz,2h),7.30-7.24(m,2h),3.98(s,2h),3.85(s,4h).
在100ml三口烧瓶中,依次加入中间体7(460mg,1.1mmol)、中间体5(650mg,1.1mmol)、无水碳酸钾(450mg,3.3mmol)、甲基三辛基氯化铵0.4ml、甲苯、乙醇和水各7.5ml、4.5ml和1.5ml。以锡箔纸包住烧瓶保证避光条件,迅速称取四(三苯基膦)钯(65mg,0.056mmol),迅速倒入烧瓶内。加热到100℃,在氮气氛围下反应24h,冷却至室温,将反应液倒入100ml水中,用乙酸乙醋萃取,旋蒸有机相除去溶剂,得到粗产品。用乙酸乙酯/甲醇(4:1)作为展开剂,走柱得到probe1(290mg)。深褐色粘稠液体产物。收率29.0%。1hnmr(400mhz,d6-dmso,δppm):8.50(d,j=4.0hz,2h),8.35(d,j=8.4hz,1h),8.14(s,1h),7.99(s,1h),7.82-7.73(m,4h),7.68-7.59(m,4h),7.26(dd,j=6.7,5.0hz,2h),7.06(d,j=8.9hz,4h),6.95(d,j=8.9hz,4h),6.88(d,j=8.7hz,2h),4.11-4.05(m,4h),3.95(s,2h),3.82(s,4h),3.77-3.70(m,4h),3.59(dd,j=5.8,3.2hz,4h),3.56-3.50(m,8h),3.46-3.41(m,4h),3.24(s,6h).hrms(m+h)forc55h64n5o8:923.4828(calculated),923.4831(experimental);(m+na)forc55h64n5o8:945.4647(calculated),945.4644(experimental)。
实施例二:探针probe2的合成
在250ml单口烧瓶中,依次加入中间体1(5.5g,16mmol)、3,5-二甲基-4-羟基苯甲醛(2.1g,14mmol)、碘化钾(83mg,0.5mmol)、无水碳酸钾(4.4g,32mmol)和150mln,n-二甲基甲酰胺,在100℃条件下反应12h,tlc检测无3,5-二甲基-4-羟基苯甲醛后,水洗并用乙酸乙酯萃取,无水硫酸钠干燥,过滤,蒸干除去溶剂,用乙酸乙酯/石油醚(1:1)作为展开剂,经硅胶柱层析得到化合物8(4.5g)。无色粘液状产物。收率94.9%。1hnmr(400mhz,cdcl3,δppm):9.86(s,1h),7.54(s,2h),4.02(dd,j=5.5,3.9hz,2h),3.85(dd,j=5.5,3.9hz,2h),3.78-3.73(m,2h),3.73-3.65(m,4h),3.56(dd,j=5.6,3.6hz,2h),3.39(s,3h),2.36(s,6h).
向250ml三口烧瓶中加入甲基三苯溴化磷(3.99g,11mmol),用注射器加入干燥的四氢呋喃50ml,以针头向液面下放通入氮气,另一口插上针头作为氮气出口,冰浴下分三次加入叔丁醇钾(1.23g,3.41mmol),在持续通氮气的条件下搅拌15min。将化合物8(3g,10mmol)加入到反应体系中,冰浴下搅拌10min。置于室温下反应4h。反应结束后,将反应液倒入100ml水中,乙酸乙醋萃取,旋蒸有机相除去溶剂,得到粗产品。用乙酸乙酯/石油醚(1:2)作为展开剂,经硅胶柱层析得到化合物9(2.2g)。淡黄色液体产物收率73.8%。1hnmr(400mhz,cdcl3,δppm):7.06(s,2h),6.60(dd,j=17.6,10.9hz,1h),5.67-5.58(m,1h),5.17-5.12(m,1h),3.93(dd,j=5.7,3.9hz,2h),3.82(dd,j=5.7,4.0hz,2h),3.77-3.74(m,2h),3.73-3.66(m,4h),3.56(dd,j=5.6,3.7hz,2h),3.38(s,2h),2.28(s,6h).
在100ml三口烧瓶中,依次加入化合物7(504mg,1.20mmol)、化合物9(350mg,1.20mmol),无水碳酸钾(270mg,1.95mmol)和25mln,n-二甲基甲酰胺,以锡箔纸包住烧瓶保证避光条件,迅速称取双(三苯基膦)二氯化钯(42mg,0.05mmol),迅速倒入烧瓶内。加热到160°c,在氮气氛围下反应24h,冷却至室温,减压蒸馏除去大部分dmf,用乙酸乙酯作为展开剂,走柱得到probe2(506.2mg)。淡黄色产物,收率66.0%。1hnmr(400mhz,cdcl3,δppm):8.54(d,j=4.8hz,2h),8.09(d,j=8.5hz,1h),8.01(d,j=8.8hz,1h),7.91(dd,j=8.9,1.6hz,1h),7.74(dd,j=7.9,5.0hz,2h),7.66(m,2h),7.59(d,j=7.8hz,2h),7.27(s,1h),7.21(s,1h),7.19–7.12(m,4h),4.04(s,2h),4.00–3.91(m,6h),3.89–3.82(m,2h),3.77(dd,j=5.7,3.2hz,2h),3.70(m,4h),3.57(dd,j=5.6,3.6hz,2h),3.39(s,3h),2.33(s,6h).hrms(m+h)forc39h44n4o4:634.3435(calculated),634.3438(experimental);(m+na)forc39h44n4o4:655.3255(calculated),655.3258(experimental)。
如图1所示,将本实施例制备获得的探针probe2与各种金属离子作用的荧光柱形图:20μmprobe1中加入1.0mmna+,k+,ca2+,mg2+;25μmba2+,mn2+,fe3+,co2+,ni2+,pb2+和5μmforcu2+,cd2+(实心黑色柱),然后加入25μmzn2+(空心白色柱)。
实施例三:离子选择性实验
使用上述实施例二中得到的probe2,评价其对zn2+的选择性。溶剂条件均为甲醇:磷酸缓冲溶液=3:7(v/v),将20μmprobe2中加入1.0mmna+,k+,ca2+,mg2+,25μmba2+,mn2+,fe3+,co2+,ni2+,pb2+和5μmforcu2+,cd2+测试其荧光谱图的变化,然后加入25μmzn2+测试其荧光谱图的变化。
结果如图1所示,图中,纵轴为probe2在不同ph值且含有不同金属离子的水溶液中发射谱中510nm处和445nm处荧光发射强度的比值,实心黑色柱为仅加入杂离子后的比值,空心白色柱为加入zn2+后比值的变化。本发明的probe2对zn2+具有极高的选择性即使在生物体内大量存在的钠离子、钾离子、钙离子、镁离子以高浓度存在的条件下,对探针对zn2+的识别也干扰极小。除了cd2+因为与探针有着与zn2+类似的络合方式而有一些影响。但由于cd2+在生物样品中含量极低,因此没有太大的关系。
实施例四:荧光滴定实验
probe1和probe2对zn2+浓度的检测可以通过荧光滴定实验及其荧光性质(对于probe1,为某一波长处的荧光发射强度,这一波长为最大发射波长附近,对于probe2,为两波长处的荧光发射强度比值,)随zn2+浓度的变化曲线来研究,结果分别示于图2和图3。在加入的zn2+浓度小于等于探针浓度时,荧光强度或比值与加入的zn2+浓度均有一段很好的线性区域,加入过量的zn2+,该强度或比值均基本不变化。表明探针分子对zn2+浓度变化较为敏感,可以用于锌离子的定量测定。
如图2所示,展示了本实施例中探针probe2(2.4×10-5m)的荧光光谱随zn2+浓度(0-30μm)的变化。
图3:逐渐增大锌离子当量条件下实施例一中探针probe1的荧光光谱;插入图:412nm处荧光强度随zn2+浓度的变化曲线。
实施例五:双光子滴定
滴加不同浓度的zn2+对上述实施例二中的probe2进行双光子曲线的测定和双光子吸收截面的测定,结果分别示于图4和图5。用750nm波长激发,随着锌离子的加入(c=0-30μμ),荧光波长从450nm红移至525nm,并且525nm处峰的强度大于450nm处峰的强度,线性范围为0to20μm。随着锌离子的加入,探针的tpa双光子吸收截面显著增加。在750nm处,探针的双光子吸收截面从80±10gm增加到185±25gm;在720nm处,探针的双光子吸收截面从110±20gm增加到145±25gm。结果表明该探针分子是很具有较大的双光子吸收截面的zn2+荧光探针分子,有很大的潜力成为商业应用价值的双光子荧光探针。
实施例六:络合比例的测定
配置了一系列上述探针probe1和zn2+总浓度为10μm,浓度比分别为0:8、1:7、2:6、3:5、4:4、5:3、6:2、7:1和8:0的溶液(甲醇:缓冲液=1:1,pb缓冲液,ph=7.4),在室温下分别测定其荧光光谱,在最大发射410nm处取值,做探针和锌离子总浓度为10μm的溶液中,随锌离子比例变化的溶液在410nm处荧光强度的变化图,结果示于图6。整体来看,荧光强度随锌离子比例增大而减小,但是410nm处荧光强度在锌离子浓度小于探针浓度时比其大于探针浓度时下降的更缓慢,且两段变化趋势都接近线性,这个转折点为探针和锌离子浓度相等时,表明锌离子和探针是1:1络合的。
实施例七:双光子细胞成像
在deme中培养pc12细胞,10%fcs作为补充液。成像前一天,细胞于24孔板继续培养24小时。以20μm的上述探针probe2对培养的pc12细胞在37℃下染色1小时,deme淋洗后,加入含10μm、20μm、和30μmzn2+的培养基,在leicatcssp8显微镜下扫描成像。激发波长:750nm。结果示于图7。
随着锌离子的加入,蓝色荧光减弱,而绿色荧光增强,是很好的比率型荧光探针。在活细胞中的显微成像表明,probe2能够很好地进入细胞中,并且能够用于检测细胞内zn2+浓度的变化。
需要强调的是,上述列举的实施例仅是一些示例性试验,不应被视为是限定性试验或条件。本发明申请所涵盖的创新范围应以权利要求书记载为准。
- 还没有人留言评论。精彩留言会获得点赞!