靶向肿瘤表皮生长因子受体的纳米化小分子核素探针及其制备方法与应用与流程
本发明涉及一种纳米化的18f标记的egfr正电子示踪剂及其制备方法与应用。属于生物医药技术领域。
背景技术:
表皮生长因子(epidermalgrowthfactor,egf)是常见生长因子的一种,能够促进表皮细胞、上皮细胞及间质的生长。表皮生长因子受体(epidermalgrowthfactor,egfr)家族包括egfr、erbb2、erbb3、erbb4等4个成员,其家族受体酪氨酸激酶(egfrtk)以单体形式存在,酪氨酸激酶活性在调节细胞增殖及分化中具有至关重要的作用,可以催化atp的高能磷酸键转移到egfr的数个酪氨酸位点,使其磷酸化,从而激活下游的pi3k/akt、ras/mapk等信号通路,促进细胞生长增殖、代谢,抑制细胞凋亡。细胞中egfr过度表达和突变时,会阻碍细胞程序死亡,使细胞的生长调节失控,而获得无限增殖扣侵袭能力,即发展成为恶性肿瘤细胞。酪氨酸激酶抑制剂(egfrtki)通过与atp竞争胞内酪氨酸激酶的结合位点,阻止受体内酪氨酸的自身磷酸化,抑制egfr酪氨酸激酶激活,从而抑制肿瘤细胞生长、加速肿瘤细胞凋亡,抑制血管生成和肿瘤细胞浸润、转移。
小分子egfrtki的基本结构为喹唑啉胺。egfrtki可分为可逆性tki和不可逆性tki,其中:可逆性tki主要有吉非替尼(gefitinib)、厄洛替尼(erlotinib)、拉帕替尼(lapatinib);不可逆性tki主要有阿法替尼(afatinib)、达可替尼(dacomitinib)。目前,可逆性egfrtki和不可逆性egfrtki对突变egfr非小细胞肺癌短时间内具有显著的疗效,但最终均因产生获得性耐药而导致治疗失败,并没有明显延长患者的生存期。因此,开发和研制具有更强、更持久抗肿瘤活性的新型纳米化egfrtki将可能为突变egfr非小细胞肺癌患者带来生机。
发展靶向egfr的纳米化小分子核素探针具有独特的优势:(1)纳米物质的多功能性:通过在纳米载体中载入影像学对比剂,不仅能实现肿瘤组织内纳米药物的实时监测及肿瘤治疗后的活体影像学监测,而且也为纳米诊疗探针与肿瘤临床治疗技术结合、肿瘤个体化诊疗提供了可能;(2)渗透与滞留增强(epr)效应:肿瘤组织血供丰富,血管结构异常,有很多分支和旁路,血管内皮细胞之间的连接非常少,再加上新生血管缺乏正常的基底膜包绕,所以肿瘤新生血管的通透性非常高,血管内皮间隙可达100~780nm。与小分子物质相比,纳米探针易渗漏到肿瘤组织间隙,停留作用时间延长。肿瘤细胞对纳米探针的摄取能力、肿瘤组织内淋巴回流缺乏进一步放大了epr效应,构成了纳米探针肿瘤被动靶向作用的基础。
技术实现要素:
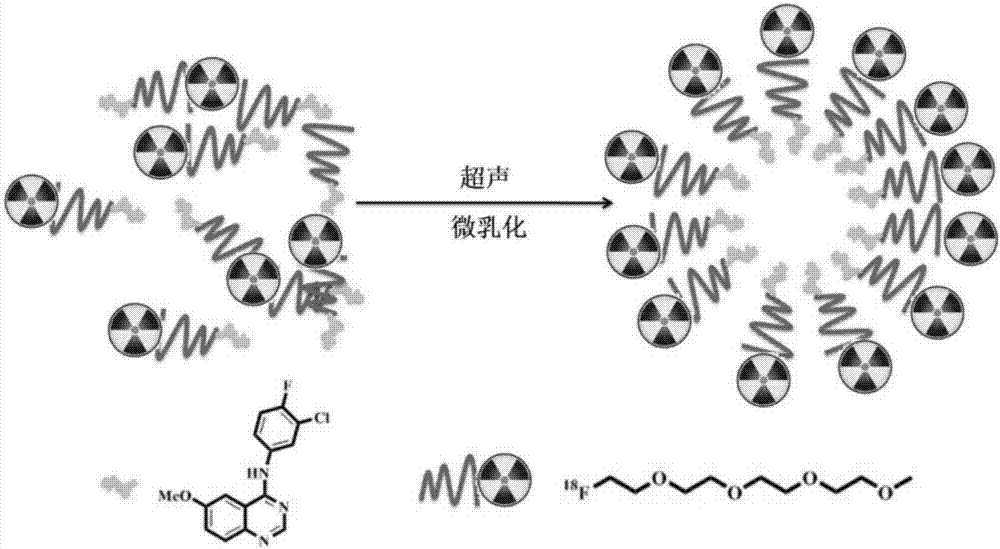
本发明的目的之一是提供一种全新的靶向肿瘤表皮生长因子受体的纳米化小分子核素探针,所述探针是由具抗肿瘤活性的18f标记的表皮生长因子受体酪氨酸激酶抑制剂egfrtki在溶剂中自组装形成的,具有如图1所示的由疏水内核和亲水外壳组成的纳米结构。
本发明的目的之二是提供一种上述靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的制备方法,其机制是通过合成具有两亲性嵌段聚合物18f-egfrtki并对其进行纳米化处理使其成为纳米粒子,从而同时实现对肺癌egfr的主动靶向,并通过纳米物质对肿瘤的epr效应实现对肿瘤的被动靶向。
本发明的目的之三是提供所述的纳米化小分子核素探针在制备egfr突变型肿瘤细胞的靶向特异性成像试剂中的用途。
为了达到上述目的,本发明采用了以下技术手段:
本发明的一种靶向肿瘤表皮生长因子受体的纳米化小分子核素探针,是由经18f标记的表皮生长因子受体酪氨酸激酶抑制剂18f-egfrtki在溶剂中自组装形成的,具有由疏水内核和亲水外壳组成的纳米结构,其中,所述的经18f标记的表皮生长因子受体酪氨酸激酶抑制剂18f-egfrtki的结构如式i所示:
所述的经18f标记的表皮生长因子受体酪氨酸激酶抑制剂18f-egfrtki已记载在申请号为cn201310711309.7,发明名称为“18f标记的喹唑啉类egfr正电子示踪剂及其制备方法和应用”的专利申请中,公开日期为2015年6月24日。
在本发明中,优选的,所述的溶剂为超纯水、乙醇溶液、0.1mph7.2的磷酸盐缓冲液以及0.9w/v%生理盐水中的任一种。
进一步的,本发明还提出了一种制备所述的纳米化小分子核素探针的方法,包括以下步骤:将纯化后的式i所示的18f-egfrtki溶于溶剂中,通过探头超声震荡,将其分散在溶剂中,18f-egfrtki在溶剂中自组装形成具有疏水内核和亲水外壳的纳米结构,即得到靶向肿瘤内皮生长因子受体的纳米化小分子核素探针。
在本发明所述的方法中,优选的,所述的超声震荡的时间为30秒~5分钟。更优选为1分钟。
在本发明所述的方法中,优选的,所述的超声震荡的输出功率为额定功率的10~90%,更优选为90%连续输出功率。
在本发明所述的方法中,优选的,所述的超声震荡是在650w输出功率,25khz频率下,超声分散1分钟。更优选的,所述的超声震荡是在650w输出功率,25khz频率下,在冰水浴中使用探头型超声分散1分钟
在本发明所述的方法中,优选的,所述的溶剂为超纯水、乙醇溶液、0.1mph7.2的磷酸盐缓冲液以及0.9w/v%生理盐水中的任一种,更优选为超纯水。
更进一步的,本发明还提出了所述的纳米化小分子核素探针在制备egfr突变型肿瘤细胞的靶向特异性成像试剂中的用途。
其中,优选的,所述的肿瘤细胞为egfr突变的非小细胞肺癌细胞。
本发明的靶向肿瘤表皮生长因子受体的纳米化小分子核素探针一端含有疏水链段,一端含有亲水链段,当其溶解于含水溶剂中时,对于疏水链段因为水是沉淀剂而驱动聚合物链的聚集,但水作为亲水链段的良溶剂而驱使聚合物溶解以避免沉淀的生成,在合适的条件下,两种驱动力达到平衡时高分子链就会发生可逆的缔合作用从而形成纳米聚集体。其中疏水链段受塌陷成致密的内核,而亲水链段以溶剂化的形式在核周围形成舒展的壳层,以维持纳米粒子的稳定性,18f标记在亲水链段的末端实现egfr的pet靶向分子成像。
本发明与现有技术相比,具有如下优点:
1、纳米尺寸:通过两亲性18f-egfrtki制备纳米化小分子核素探针,增强对肿瘤的渗透吸收。
2、特异性成像:核素小分子探针纳米化后可以通过被动靶向和主动靶向的双增强作用实现肿瘤的特异性成像,包括纳米物质的增强与渗透保留作用(enhancedpermeationandretention,epr),以及抑制表皮生长因子受体酪氨酸激酶磷酸化片段的靶向药物对表皮生长因子受体的主动靶向。
3、满足生物医学应用需求:生物体材料需要药品使用无毒溶剂,通过本发明,靶向肿瘤的18f标记的两亲性小分子药物18f-egfrtki能够分散在水、磷酸盐、生理盐水中,满足生物医学应用需求。
4、简单、方便合成过程:通过探头超声能够快速实现18f-egfrtki的纳米化,建立了一种全新的利用纳米化小分子核素探针实现肿瘤egfr特异性增强成像的新方法。
附图说明
图1为18f-egfrtki在溶剂中形成的具有疏水内核和亲水外壳的自组装纳米粒子示意图;
图2为18f-egfrtki在溶剂中的聚集示意图;
图3为本发明实施例1合成的靶向egfr的纳米化小分子核素探针的动态光散射图;
图4为本发明实施例1合成的靶向egfr的纳米化小分子核素探针的透射电镜图;
图5为本发明实施例3合成的靶向egfr的纳米化小分子核素探针的透射电镜图;
图6为本发明实施例4合成的靶向egfr的纳米化小分子核素探针的透射电镜图;
图7为各细胞系在与18f标记的纳米化小分子核素探针孵育不同的时间后测定的放射性摄入数量;
图8为各细胞系荷瘤小鼠尾静脉注射18f标记的纳米化小分子核素探针不同时间后的成像。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的制备
将总剂量为8mci18f-egfrtki(式i所示)迅速溶于1ml超纯水中,在650w输出功率(90%连续输出模式),25khz频率下,冰水浴中探头超声分散1分钟,18f-egfrtki在溶剂中自组装形成具有疏水内核和亲水外壳的纳米结构,即为所述的纳米小分子核素探针,其形成的自组装纳米粒子示意图如图1所示,聚集示意图如图2所示。靶向egfr的纳米化小分子核素探针的动态光散射图如图3所示,可见形成了动态光散射尺寸为28nm的球形纳米粒子,纳米化小分子核素探针的透射电镜图如图4所示。
实施例2靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的制备
将500μci18f-egfrtki(式i所示)迅速溶于1ml乙醇溶液中,在650w功率(90%连续输出模式),25khz频率下,超声分散2分钟,18f-egfrtki在溶剂中自组装形成具有疏水内核和亲水外壳的纳米结构,即为所述的纳米小分子核素探针,其形成的自组装纳米粒子示意图如图1所示,聚集示意图如图2所示。
注:此实施例不可用于临床实践,应用于实验动物时用超纯水稀释产品至乙醇含量不超过10%使用。
实施例3靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的制备
将500μci18f-egfrtki(式i所示)迅速溶于1ml0.1mph7.2的磷酸盐缓冲液中,在650w功率(90%连续输出模式),25khz频率下,冰水浴中探头超声分散30秒,18f-egfrtki在溶剂中自组装形成具有疏水内核和亲水外壳的纳米结构,即为所述的纳米小分子核素探针,其形成的自组装纳米粒子示意图如图1所示,聚集示意图如图2所示。纳米化小分子核素探针的透射电镜图如图5所示。
实施例4靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的制备
将2mci18f-egfrtki(式i所示)迅速溶于1ml0.9w/v%生理盐水中,在650w功率(90%连续输出模式),25khz频率下,探头超声分散30s,18f-egfrtki在溶剂中自组装形成具有疏水内核和亲水外壳的纳米结构,即为所述的纳米小分子核素探针,其形成的自组装纳米粒子示意图如图1所示,聚集示意图如图2所示。纳米化小分子核素探针的透射电镜图如图6所示。
实施例5:靶向肿瘤表皮生长因子受体的纳米化小分子核素探针在egfr突变型肿瘤细胞的靶向特异性成像中的用途
1、细胞系
hcc827细胞系:19外显子缺失,egfr药物敏感型人非小细胞肺癌细胞
hcc1975细胞系:egfrl858r及t790m突变的egfr耐药型人非小细胞肺癌细胞
h358细胞系:野生型egfr人非小细胞肺癌细胞
h520细胞系:egfr低表达人肺鳞状上皮细胞癌细胞
以上细胞系均购买自美国模式菌种收集中心(atcc)。
2、不同细胞系对靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的放射性摄入
(1)不同egfr表达水平的四种细胞系分别以5×105个铺于12孔板内,贴壁24小时备用;
(2)含有实施例1制备得到的靶向肿瘤表皮生长因子受体的纳米化小分子核素探针(按每孔1μci/1ml探针的量)加入无血清培养液加于各孔之中;
(3)共孵育15min,30min,60min和120min后,移除培养液;
(4)各孔贴壁的细胞用1ml冷的pbs冲洗一次;
(5)各孔加入200μl胰酶后,在37℃下孵育5min;
(6)各孔消化下来的细胞移到计数瓶中,在gamma计数仪中计数。
实验结果:
各细胞系在与18f标记的纳米化小分子核素探针孵育不同的时间后测定的放射性摄入数量(以占总放射性摄入量的百分数(%)表示),如表1及图7所示。从该结果可以看出,egfr药物敏感型人非小细胞肺癌细胞系对于18f标记的纳米化小分子核素探针的摄取量要远高于其他细胞系。吉非替尼(gefitinib)药物作用后,纳米探针的摄取明显减低,说明这是一种针对突变egfr特异性的纳米分子成像探针。
表1
3、不同细胞系荷瘤小鼠对靶向肿瘤表皮生长因子受体的纳米化小分子核素探针的放射性摄入
(1)建立hcc827细胞系、hcc1975细胞系、h358细胞系、h520细胞系的荷瘤小鼠模型;
(2)向各细胞系荷瘤小鼠模型的尾静脉注射实施例1制备得到的靶向肿瘤表皮生长因子受体的纳米化小分子核素探针200μl(1μci/1ml),每组做三次平行实验;
(3)分别在注射后30min、1h以及2h对小鼠的纳米化小分子核素探针的放射性摄入量进行成像和统计,结果如表2及图8所示。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种阿法替尼有关物质的分离检测方法与流程
- 用于检测人血清中HER2含量的ELISA试剂盒、使用方法及用途与流程
- 用于预防或治疗皮疹的药物组合物的制造方法与工艺
- 用于汽车内饰表皮的30ST/R双面布的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 一种肝素结合表皮生长因子的单域抗体及其应用的制造方法与工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种二甲苯磺酸拉帕替尼片剂及其制备方法与制造工艺
- 苯并咪唑衍生物作为ERBB酪氨酸激酶抑制剂用于治疗癌症的制造方法与工艺
- 包含STP和生长因子的活性组合物及其化妆品或护肤品的制造方法与工艺
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法