一种线粒体靶向的双信号turn‑on的甲醛荧光纳米探针及其制备与应用的制作方法
本发明涉及一种线粒体靶向的双信号turn-on的甲醛荧光纳米探针及其制备方法与应用。
背景技术:
1、活性碳簇是一类具有一个或多个羰基的化合物,在人类生理过程起到关键的作用。甲醛作为一种公认的致癌物质,是活性碳簇中最小的分子。一方面,甲醛可来源于工业生产、建筑材料、皮革、燃料,甚至是食物。另一方面,甲醛来源于细胞内氧化酶和去甲基酶产生的内源性代谢物,在正常的细胞的甲醛浓度就可达到0.4mm左右。体内过高的甲醛能够引起神经退行性疾病、阿兹海默病和各种癌症等等。现阶段的甲醛检测方法大多不能实时监测细胞内的甲醛浓度,因此,发展一种新的能够检测细胞内的甲醛是十分必要的。
2、线粒体是一种由两层膜的存在于大多数细胞中细胞器,是细胞的供能中心。有研究表明,线粒体中具有醛脱氢酶2——一种能够降解甲醛生成甲酸的酶。同时,过量的甲醛会降低线粒体膜电势从而影响线粒体功能。目前,还没有相关文献研究线粒体的甲醛浓度,因此,急需开发靶向细胞内线粒体的甲醛探针。
3、荧光探针由于其高灵敏度、实时检测等优点而受到关注,但是现在的绝大部分的探针在检测被分析物时只具备单信号turn-on输出的特征,然而单个信号容易受到外环境的影响而不能准确的检测结果。本发明目的在于开发一个双信号turn-on输出的甲醛荧光纳米探针,也就是,该探针被用于检测甲醛时,我们可以选择两个不同的激发光进行激发从而得到两个对应的turn-on发射信号。
技术实现要素:
本发明目的是提供一种线粒体靶向的双信号turn-on的甲醛荧光纳米探针。
本发明第二个目是提供一种线粒体靶向的双信号turn-on的甲醛荧光纳米探针制备方法。
本发明第三个目是提供一种线粒体靶向的双信号turn-on的甲醛荧光纳米探针的应用。
本发明为实现上述目的采用以下技术方案:
一种荧光纳米探针,其特征在于,所述荧光纳米探针由化合物(i)
在水中自组装而制得:
所述化合物(i)结构式为:
一种所述的荧光纳米探针的制备方法,所述制备方法为:
对羟基苯甲醛与3-溴丙炔在碱性条件下发生亲核取代反应,生成化合物(ii);化合物(ii)与氨甲醇溶液生成席夫碱化合物,随后与丙烯基硼酸邻二叔醇酯发生取代反应生成化合物(iii);化合物(iii)与化合物(iv)在酸性条件下,生成席夫碱中间产物,其碳氮双键被还原剂三乙酰氧基硼氢化钠还原生成化合物(v);化合物(vi)与3-叠氮丙胺发生酰胺反应生成化合物(vii);最后,将化合物(v)与化合物(vii)在一价铜的催化下,生成化合物(i);再将化合物(i)溶于dmso作为母液,用超纯水或pbs缓冲液或细胞培养液稀释,超声数分钟,然后剧烈震荡,化合物(i)自组装得到所述荧光纳米探针;
所述荧光纳米探针反应路线如下:
更进一步,本发明所述制备方法具体为:
(1)对羟基苯甲醛与3-溴丙炔按物质的量比1:2在碱性条件下反应,经后处理a制备得化合物(ii);反应温度为60-70℃,反应时间为3小时,反应溶剂为丙酮;
(2)将化合物(ii)与氨甲醇溶液、丙烯基硼酸邻二叔醇酯在0℃下混合后转至20-35℃反应,经后处理b制备得化合物(iii);反应时间为12小时,反应溶剂为甲醇;所述化合物(ii)与氨甲醇溶液中的氨、丙烯基硼酸邻二叔醇酯的物质的量比为1:10:1.5;
(3)化合物(iv)与化合物(iii)、三乙酰氧基硼氢化钠按理论物质的量比1:1.2:4在酸性条件下0℃混合后转至20-30℃反应,经后处理c制备得化合物(v);反应时间为12小时,反应溶剂为四氢呋喃;
(4)化合物(vi)与3-叠氮丙胺按物质的量比1:1.2反应,经后处理d制备得化合物(vii);反应温度为室温,反应时间为10小时,反应溶剂为二氯甲烷;
(5)将化合物(v)与化合物(vii)按理论物质的量比1:1在一价铜催化下反应,蒸干溶剂,粗产物利用高效液相色谱纯化得到化合物(i);反应温度为室温,反应时间为6小时,反应溶剂为四氢呋喃和水;
(6)将化合物(i)溶于dmso配制成浓度为0.1~2mm的探针母液,用超纯水或pbs缓冲液或dmem培养基稀释成原来母液体积的99倍,超声数分钟,然后剧烈震荡,化合物(i)自组装得到所述荧光纳米探针。
本发明化合物(iv)为公开的化合物,其制备方法可参考文献[h.park,s.-k.chang,signalingofwatercontentinorganicsolventsbysolvatochromismofahydroxynaphthalimide-basedmerocyaninedye,dyespigm.122(2015)324–330.]。
进一步,步骤(1)中所述碱性条件采用缚酸剂碳酸钾实现,所述缚酸剂的物质的量用量为对羟基苯甲醛的1.5倍当量。
进一步,步骤(2)中所述氨甲醇溶液中的氨浓度为7mol/l。
进一步,步骤(3)中所述酸性条件采用乙酸实现,乙酸与化合物(iv)的物质的量比为8~20:1,优选10:1。
进一步,本发明步骤(4)中可加入1-羟基苯并三氮唑、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐作为酰胺反应缩合剂,三乙胺作为缚酸剂,三者物质的量比推荐为3:3:4。
本发明所述后处理a为:反应液减压旋蒸除去溶剂后加入水,乙酸乙酯萃取,合并有机相,取有机相用水以及饱和食盐水洗涤数次,无水硫酸钠干燥,过滤,旋干溶剂,经柱层析分离后得到目标产物,洗脱剂为体积比1:10的乙酸乙酯和石油醚;
本发明所述后处理b为:反应液减压旋蒸除去溶剂,粗产物进行层析柱分离后得到目标产物,洗脱剂为体积比40:1的二氯甲烷和甲醇;
本发明所述后处理c为:反应液减压旋蒸除去溶剂,粗产物进行层析柱分离后得到目标产物,洗脱剂为体积比20:1的二氯甲烷和甲醇;
本发明所述后处理d为:反应液采用薄层层析进行分离,展开剂为体积比20:1的二氯甲烷和甲醇,得到目标化合物。
本发明提供一种所述的荧光纳米探针在检测甲醛浓度中的应用。
进一步,本发明所述甲醛以水溶液形式存在,浓度为0~5mmol/l,所述浓度为0的含义为无限接近于0但不等于0。
更进一步,本发明所述甲醛优选为细胞内甲醛,浓度为0~1mmol/l。
再进一步,本发明所述细胞为人乳腺癌细胞mcf-7。
本发明上述的荧光纳米探针即为线粒体靶向的双信号turn-on的甲醛荧光纳米探针nano-mtdf。
本发明所述由化合物(i)自组装的可作为一种线粒体靶向的双信号turn-on的甲醛荧光纳米探针,可应用于甲醛的荧光定量检测。所述的定量甲醛浓度的荧光检测原理为:以纳米探针nano-mtdf作为荧光探针,与甲醛进行反应后,生成中间产物,随后2-氮杂-柯普重排以及水解,生成荧光物质化合物viii和化合物ix,测定在激发为440nm以及535nm下的荧光强度变化,从而获得甲醛浓度。
使用本发明的新型线粒体靶向的双信号turn-on的甲醛荧光探针检测水中甲醛浓度的原理如下所示:
本发明线粒体靶向的双信号turn-on的甲醛荧光纳米探针在水中是几乎没有荧光的,也就是探针中的两个荧光团1,8-萘酰亚胺和罗丹明b的荧光都是被淬灭的,其中的原理是1,8-萘酰亚胺由于荧光共振能量转移导致荧光淬灭,同时1,8-萘酰亚胺的疏水性导致化合物(i)在水中自主装成纳米颗粒,罗丹明b由于聚集诱导淬灭原理导致荧光淬灭。当纳米探针nano-mtdf和甲醛反应后,释放出两个分离的荧光团,纳米探针自组装去除,1,8-萘酰亚胺和罗丹明b的荧光同时恢复,从而实现了双信号turn-on的效果。其中罗丹明b结构中的n+还具有靶向线粒体的作用。
与现有技术相比,本发明有益效果主要体现在:本发明选用的1,8-萘酰亚胺和罗丹明b荧光团在水中自组装成纳米级的荧光探针可以实现双信号turn-on的效果,双信号turn-on纳米探针其优点在于和甲醛反应后能够通过对比两个不同的turn-on信号进行自身对照从而提高探针检测的准确性。纳米探针nano-mtdf对甲醛水溶液具有很好的特异性,在激发波长440nm的检测下限为3μm,在激发波长535nm的检测下限为8μm。同时,纳米探针nano-mtdf实现了细胞中线粒体内甲醛的成像实验,这个研究是还没有相关文献报道的。综上所述,新型线粒体靶向的双信号turn-on的甲醛荧光纳米探针nano-mtdf为研究细胞中甲醛的生理作用提供一种有效的研究工具。
附图说明
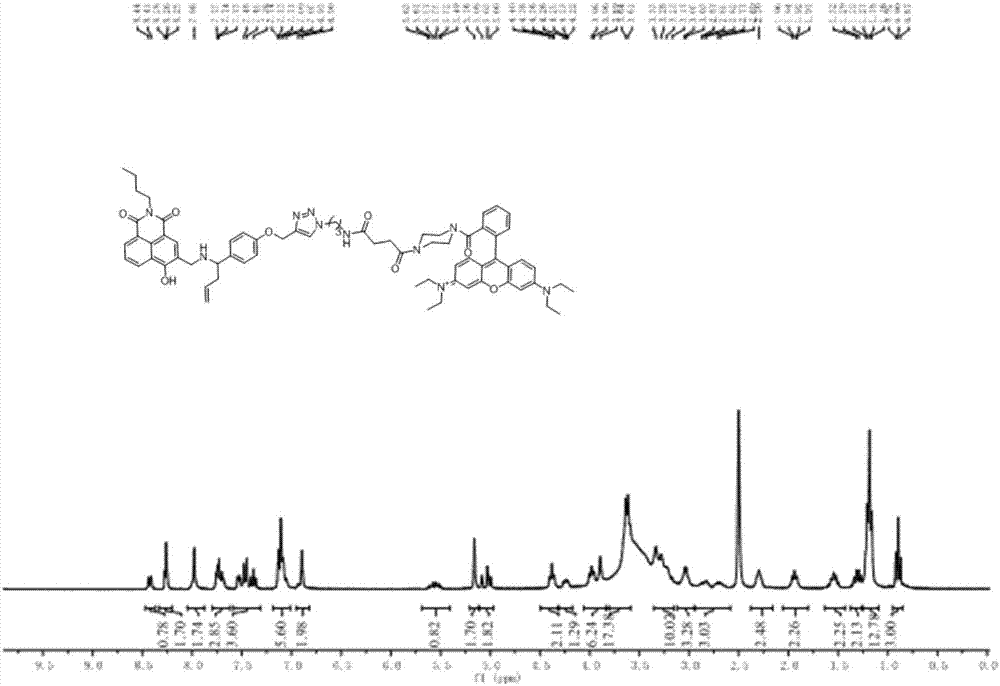
图1为本发明中实施例1制备的化合物(i)的核磁氢谱。
图2为本发明中实施例1制备的化合物(i)的核磁碳谱。
图3为本发明中实施例1制备的纳米探针nano-mtdf(1μm)在dmso/水(v/v=1/99)条件下用动态光衍射测试粒子粒径,以及通过透射电子显微镜(标准尺1μm)进行纳米颗粒成像。
图4为本发明中实施例1制备的纳米探针nano-mtdf(1μm)在不同dmso/水比例的荧光发射光谱图。图a为荧光发射光谱图,激发波长440mm。图b为荧光发射光谱图,激发波长535nm。
图5为本发明中实施例1制备的纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下加入不同当量甲醛下的荧光发射光谱图。图a为荧光发射光谱图,激发波长440mm。图b为荧光发射光谱图,激发波长535mm。
图6为本发明中实施例1制备的纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下与甲醛(1mm)作用过程中的随时间变化的荧光图。图a激发波长440nm,发射波长540nm。图b激发波长535nm,发射波长585nm。
图7为本发明中实施例1制备的纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下选择性结果的荧光图。1-17分别为pbs、甲醛、乙醛、丙酮醛、苯甲醛、对硝基苯甲醛、对羟基苯甲醛、丙酮、甲酸、丙酮酸钠、葡萄糖、谷胱甘肽、同型半胱氨酸、半胱氨酸、硫酸氢钠、双氧水、叔丁基过氧化氢。图a激发波长440nm,发射波长540nm。图b激发波长535nm,发射波长585nm。
图8为本发明中实施例1制备的纳米探针nano-mtdf(1μm)在dmso/不同ph缓冲液(v/v=1/99)条件下与甲醛反应前后的荧光图。图a激发波长440nm,发射波长540nm。图b激发波长535nm,发射波长585nm。
图9为本发明中实施例1制备的纳米探针nano-mtdf在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下加入甲醛前后的的高效液相色谱图以及质谱图。
图10为本发明中实施例1制备的纳米探针nano-mtdf对细胞中甲醛荧光成像。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
实施例1(1)化合物(ii)的制备
将1.22g对羟基苯甲醛(10mmol)溶于50ml丙酮溶液中,随后加入2.07g碳酸钾(15mmol),60-70℃下反应半小时后,再加入2.37g3-溴丙炔(20mmol),60-70℃下反应2小时后停止,减压蒸出溶剂。向混合物中加入水,乙酸乙酯萃取,合并有机相,水以及饱和食盐水洗涤数次,无水硫酸钠干燥,过滤,旋干溶剂,柱层析分离(乙酸乙酯:石油醚=1:10为洗脱剂),得到白色固体化合物(ii)(1.53g,95%收率)。1hnmr(500mhz,cdcl3)δ9.88(s,1h),7.95–7.75(m,2h),7.18–6.98(m,2h),4.77(d,j=2.4hz,2h),2.58(t,j=2.4hz,1h).13cnmr(126mhz,cdcl3)δ190.69,162.30,131.81,130.51,115.11,77.51,76.35,55.87.esicalcd.forc10h8o2[m+h]+161.05,found161.18。
(2)化合物(iii)的制备
将0.64g化合物(ii)(4mmol)溶于40ml甲醇中,冰浴至0℃,加入6ml氨甲醇溶液(7mol/l,42mmol),0℃下反应半小时,随后加入1g丙烯基硼酸邻二叔醇酯(6mmol),反应转至25-35℃且反应过夜。减压旋蒸除去溶剂,粗产物进行层析柱分离(二氯甲烷:甲醇=40:1为洗脱剂),得到无色油状液体化合物(iii)(0.613g,76%产率)。1hnmr(500mhz,cdcl3)δ7.32–7.25(m,2h),6.99–6.91(m,2h),5.79–5.71(m,1h),5.16–5.05(m,2h),4.69(d,j=2.4hz,2h),3.98–3.95(m,1h),2.53(t,j=2.4hz,1h),2.49–2.41(m,1h),2.40–2.29(m,1h).13cnmr(126mhz,cdcl3)δ156.51,138.87,135.46,127.35,117.56,114.75,78.65,75.42,55.82,54.71,44.17.esicalcd.forc13h15no[m+h]+202.12,found202.29。
(3)化合物(v)的制备
将0.15g化合物(iv)(0.5mmol)加入15ml无水四氢呋喃中,冷却至0℃,随后依次加入0.18g化合物(iii)(0.6mmol)、0.3g乙酸(5mmol)和0.42g三乙酰氧基硼氢化钠(2mmol)。反应转至20-30℃且反应过夜。减压旋蒸除去溶剂,粗产物进行层析柱分离(二氯甲烷:甲醇=20:1),得到橘色固体化合物(v)(0.14g,59%产率)。1hnmr(500mhz,cdcl3)δ8.38(t,j=7.2hz,2h),7.93(s,1h),7.53(t,j=7.8hz,1h),7.30(d,j=8.6hz,2h),7.03(d,j=8.6hz,2h),5.81-5.73(m,1h),5.22–5.13(m,2h),4.71(d,j=2.4hz,2h),4.13–4.05(m,2h),4.02(d,j=14.2hz,1h),3.91(d,j=14.2hz,1h),3.81(t,j=7.0hz,1h),2.70–2.59(m,2h),2.56(t,j=2.3hz,1h),1.70–1.64(m,2h),1.49–1.37(m,2h),0.97(q,j=7.8hz,3h).13cnmr(126mhz,cdcl3)δ164.60,163.76,162.42,157.39,133.86,132.93,132.48,131.08,128.81,128.29,124.93,123.02,121.68,118.77,115.34,111.71,78.39,75.74,61.41,55.85,49.83,41.43,39.98,30.21,24.81,20.39,13.85.esicalcd.forc30h30n2o4[m–h]-481.22,found481.27。
(4)化合物(vii)的制备
将0.06g化合物(vi)(0.1mmol)溶于5ml二氯甲烷中,随后依次加入1-羟基苯并三氮唑(0.02g,0.15mmol)、0.03g1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.15mmol)),0.02g三乙胺(0.2mmol)和0.01g3-叠氮-丙胺(0.12mmol),室温下反应过夜,待反应结束后,粗产物用制备薄层层析(二氯甲烷:甲醇=20:1)进行分离,得到暗红色固体化合物(vii)(0.057g,82%产率)。1hnmr(400mhz,dmso)δ7.89(s,1h),7.83–7.66(m,3h),7.54(s,1h),7.13(dt,j=9.7,5.6hz,4h),6.95(d,j=1.7hz,2h),3.66(dd,j=13.6,6.5hz,8h),3.56–3.16(m,10h),3.08(dd,j=12.2,6.2hz,2h),2.50(d,j=1.5hz,3h),2.29(s,2h),1.73–1.49(m,2h),1.21(t,j=6.9hz,12h).13cnmr(75mhz,dmso)δ171.70,170.45,166.94,159.23,158.77,158.30,157.83,157.44,155.95,155.51,135.64,132.13,131.05,130.76,130.14,127.87,118.34,114.63,113.41,96.29,48.73,47.13,45.75,44.63,41.44,36.12,30.59,28.80,28.07,12.76.esicalcd.forc39h49n8o4[m]+693.39,found693.48。
(5)化合物(i)的制备
将0.027g化合物(vii)(0.04mmol)和化合物(v)(0.04mmol)溶于3ml四氢呋喃中,将0.004g维生素c(0.02mmol)和0.003g五水硫酸铜(0.02mmol)的水溶液(3ml)加入上述的混合液中,常温反应6小时。蒸干溶剂,粗产物利用制备高效液相色谱纯化得到暗红色古化合物(i)(0.03g,65%产率)。此处维生素c起到将二价铜还原成一价铜的作用。
1hnmr(300mhz,dmso)δ8.43(d,j=7.9hz,1h),8.26(t,j=3.5hz,2h),7.98(s,2h),7.72(ddd,j=13.2,7.3,4.6hz,3h),7.46(ddd,j=28.1,12.0,6.5hz,4h),7.18–7.01(m,6h),6.91(d,j=11.8hz,2h),5.56(td,j=17.0,6.8hz,1h),5.16(s,2h),5.04(t,j=12.8hz,2h),4.38(t,j=6.8hz,2h),4.24(dd,j=9.2,5.5hz,2h),3.96(dd,j=20.2,13.1hz,6h),3.63(d,j=6.9hz,18h),3.25(dd,j=33.1,17.3hz,10h),3.04(d,j=5.9hz,3h),2.94–2.58(m,3h),2.30(s,2h),1.93(dd,j=11.2,4.5hz,2h),1.63–1.43(m,2h),1.30(dd,j=14.8,7.4hz,2h),1.19(dd,j=12.5,5.8hz,12h),0.90(t,j=7.3hz,3h).13cnmr(75mhz,dmso)δ175.28,171.87,170.47,166.91,164.51,163.03,158.72,157.38,155.91,155.46,142.82,135.74,135.61,133.43,132.07,131.86,131.05,130.88,130.77,130.67,130.18,130.08,130.03,128.28,127.86,126.90,125.00,122.23,121.37,119.09,115.27,114.60,114.28,113.37,100.35,96.26,61.61,60.13,48.00,47.57,47.05,45.75,41.46,38.96,37.95,36.03,30.59,30.35,30.29,29.33,28.79,28.10,20.20,14.13,12.78.hrms(esi)calcd.forc69h79n10o8[m]+1175.6082,found1175.6067。
(6)纳米探针nano-mtdf的制备
将化合物(i)溶于dmso作为母液,母液加入到超纯水、pbs缓冲液或细胞培养液,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf。
实施例2纳米探针nano-mtdf在dmso/水缓冲液(ph=7.4,v/v=1/99)条件下用动态光衍射测试粒子粒径以及通过透射电子显微镜进行纳米颗粒成像。
准确称取一定量实施例1制备的化合物(i),用dmso配制成浓度为0.1mm的探针母液,移液枪吸取0.02ml加入到1.98ml水中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf,然后用nano-zs90particleanalyzer测定nano-mtdf在水中的粒径大小,同时取以上的混合液滴在铜网上,37℃烘干进行投射电子显微镜成像,结果见图3。
参看图3(a)可以发现,动态光衍射测试得到的结果为粒子的平均粒径为161.9nm,多分散系数pdi指数为0.262。参看图3(b),从透射电子显微镜(标准尺:1μm)得到的纳米粒径与动态光衍射得到的数据基本一致,从而证明化合物(i)在水中形成了纳米材料。
实施例3纳米探针nano-mtdf(1μm)在不同dmso/水比例下的荧光光谱检测。
准确称取一定量实施例1制备的化合物(i),用二甲基亚砜配制成浓度为0.1mm的探针母液,移液枪吸取0.02ml加入到1.98ml不同的dmso/水比例(dmso为1%、5%、10%、20%、40%、60%、70%、80%、90%),超声数分钟,然后剧烈震荡,然后测定化合物(i)的荧光光谱。
实验结果表明,随着dmso的比例的提高,化合物(i)的荧光增强,从而证明在随着dmso比例的降低,化合物(i)的聚集效果增强,不同激发波长下的荧光都减弱,表明罗丹明b的荧光是由于聚集导致淬灭。同时也可以观察到无论dmso比例高低,在激发波长为440nm下探针只有一个发射峰,说明萘酰亚胺的荧光确实是通过荧光共振能量转移被罗丹明b淬灭。荧光图谱见图4。
实施例4本发明中纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下加入不同当量甲醛下的荧光光谱检测。
准确称取一定量实施例1制备的探针(i),用二甲基亚砜配制成浓度为0.1mm的母液,移液枪吸取0.02ml加入到1.96mlpbs缓冲液中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf,每次吸取396μl纳米探针nano-mtdf溶液,分别加入4μl不同当量甲醛溶液(最终甲醛在水中的浓度分别为0、0.0025、0.0075、0.01、0.025、0.04、0.05、0.06、0.075、0.1、0.15、0.25、0.4、0.5、0.6、0.75、1、2、5mm),37℃下反应3h后,测定其荧光值。激发波长为分别为440nm或者535nm,荧光谱图见图5。
实验结果表明,随着甲醛当量的增加,纳米探针nano-mtdf产生的两个自由荧光团增多,两个的荧光团的荧光强度分别增加。
实施例5本发明中纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下与甲醛(1mm)作用过程中的随时间变化的荧光图。
准确称取一定量的探针(i),用二甲基亚砜配制成浓度为0.1mm的母液,移液枪吸取0.02ml加入到1.96mlpbs缓冲液中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf,每次吸取396μl纳米探针nano-mtdf溶液,加入4μl甲醛水溶液(最终甲醛在水中的浓度为1mm),37℃下反应,在不同时间点(分别为0、0.5、1、1.5、2、2.5、3、4h)测定其荧光值。荧光谱图6(a):激发波长为440nm,发射波长为540nm,荧光谱图见图6(b):激发波长为535nm,发射波长为585nm。
实验证明,随着时间的增加,两个荧光团的荧光强度也能随之增强,符合探针检测甲醛的效果。
实施例6本发明中纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下选择性结果的荧光光谱检测。
准确称取一定量的探针(i),用二甲基亚砜配制成浓度为0.1mm的母液,移液枪吸取0.02ml加入到1.96mlpbs缓冲液中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf,每次吸取396μl纳米探针nano-mtdf溶液,分别加入4μl甲醛水溶液(最终甲醛在水中的浓度均1mm)和生物相关活性小分子水溶液(乙醛、丙酮醛、丙酮、甲酸、4-羟基苯甲醛、4-硝基苯甲醛、苯甲醛、双氧水、叔丁基过氧化氢、硫氢化钠、谷胱甘肽、半胱氨酸、高半胱氨酸、丙酮酸钠、葡萄糖,最终浓度均为1mm),37℃下反应3h,测定其荧光值。荧光谱图7(a):激发波长为440nm,发射波长540nm,荧光谱图见图7(b):激发波长为535nm,发射波长为585nm。
实验结果表明,除了甲醛,纳米探针nano-mtdf在其它相关生物活性分子存在下荧光强度基本没有变化,表明其抗干扰能力十分好,即对甲醛的专一性比较好。
实施例7本发明中纳米探针nano-mtdf(1μm)在dmso/不同ph缓冲液(v/v=1/99)条件下与甲醛反应前后的荧光光谱检测。
准确称取一定量的探针(i),用二甲基亚砜配制成浓度为0.1mm的母液,移液枪吸取0.02ml加入到1.96ml不同ph缓冲液(ph分别为3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5)中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf,每次吸取396μl纳米探针nano-mtdf溶液,分别加入4μl甲醛水溶液(最终甲醛在水中的浓度为0和1mm),37℃下反应3h,测定其荧光值。荧光谱图8(a):激发波长为440nm,发射波长为540nm,荧光谱图见图8(b):激发波长为535nm,发射波长为585nm。
实验证明,在ph从5到7.5范围内,ph的变化对nano-mtdf的影响不大,即nano-mtdf适合在生物体内检测甲醛的浓度。
实施例8本发明中纳米探针nano-mtdf(1μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下加入甲醛反应后的机理证明。
准确称取一定量的探针(i),用二甲基亚砜配制成浓度为2mm的母液,移液枪吸取0.02ml加入到1.96mlpbs缓冲液中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf,吸取0.99ml纳米探针nano-mtdf溶液,分别加入10μl甲醛水溶液,反应过夜,然后利用高效液相色谱分析。高效液相谱图见图9。
实验证明,我们描述的纳米探针nano-mtdf与甲醛反应的机理是正确的。nano-mtdf与甲醛生成两个自由的荧光物质化合物viii和化合物ix,从而实验双信号turn-on效果。
实施例9本发明中纳米探针nano-mtdf在癌细胞中的甲醛成像分析
准确称取一定量的探针(i),用二甲基亚砜配制成浓度为0.5mm的母液,移液枪吸取0.02ml加入到1.98mldmem培养基中,超声数分钟,然后剧烈震荡,得到纳米探针nano-mtdf。取1ml含有纳米探针nano-mtdf的培养液加入到mcf-7细胞中,37℃下孵化0.5h,用新鲜dmem培养基洗涤两次,然后用不同甲醛浓度(最终甲醛浓度分别为0、1)孵化3小时,新鲜dmem培养基洗涤两次,加入商品化的
实验结果表明,在甲醛浓度提高的情况下,我们能够看到细胞中的荧光信号也在变强,说明我们的物质能够检测细胞内的甲醛。同时,通过与商品化的
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺