用于扩增雌性乌龟雌激素受体α基因的RT‑PCR引物和方法与流程
本发明涉及分子生物学研究领域,具体地,涉及用于扩增雌性乌龟雌激素受体α基因的rt-pcr引物和方法。
背景技术:
乌龟(chinemysreevesii)隶属于爬行纲、龟鳖目、淡水龟科、乌龟属。乌龟有较高的药用和营养价值,深受人们的喜爱。近几十年来,人为经济活动不断加剧,龟类赖以生存的生态环境受到严重破坏,加之对野生乌龟的过度捕捞、生境破坏、化学污染以及河流建坝导致其生活水域的片断化、岛屿化,已经使野生乌龟的数量急剧下降,野生物种有面临灭绝的危险。可见,对乌龟的野生种群保护已经迫在眉睫。随着野生种群日益稀少,乌龟的人工养殖规模却在不断扩大;自上世纪80年代以来,随着科学研究和养殖技术的不断发展,我国乌龟养殖得到了空前的发展,养殖产量居世界之首。而在乌龟育种的过程中,雌性乌龟输卵管激素的变化影响了雌雄交配后雄性乌龟的精子在雌性乌龟输卵管中的储存,为精子能够在雌性输卵管中储存提供了有利条件。
因此,研究雌性乌龟输卵管激素水平的变化,可以更好的了解乌龟在养殖过程中遇到的繁殖与交配问题。而以往的报道中未曾有过关于雌性乌龟雌激素受体α基因的相关研究。
技术实现要素:
针对上述现有技术,本发明的目的在于实现对雌性乌龟输卵管激素水平的变化的大规模研究,更为直观地观察输卵管雌激素受体α基因mrna水平的变化的效果,从而提供一种可以快速、稳定扩增雌性乌龟输卵管雌激素受体α基因的用于扩增雌性乌龟雌激素受体α基因的rt-pcr引物和方法。
为了实现上述目的,本发明提供了一种用于扩增雌性乌龟雌激素受体α基因的rt-pcr引物,其中,所述rt-pcr引物包括seqidno:1和seqidno:2所示的引物对。
本发明还提供了一种利用rt-pcr引物扩增雌性乌龟雌激素受体α基因的方法,其中,所述方法包括:
1)提取待扩增样品的总rna;
2)将步骤1)中提取的总rna反转录成cdna;
3)采用rt-pcr引物对步骤2)中反转录的cdna进行扩增;其中,
所述rt-pcr引物为上述所述的rt-pcr引物。
通过上述技术方案,本发明通过设计一组rt-pcr引物,先将待扩增样品的总rna进行提取,再将上述总rna反转录,得到cdna,进一步地,对该cdna采用上述rt-pcr引物进行扩增,在节约成本的前提下,即可大量地快速、准确地扩增得到雌性乌龟输卵管中的雌激素受体α基因,有效地实现了能够对雌性乌龟雌激素受体α基因的大规模和更为直观的研究。
本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
图1是是实施例1-5和对比例1-5的扩增产物的糖凝胶电泳图;其中,泳道1和泳道6来自雌性乌龟输卵管的阴道部样品、泳道2和7来自雌性乌龟输卵管的子宫部样品、泳道3和8来自雌性乌龟输卵管的峡部样品、泳道4和9来自雌性乌龟输卵管的蛋白部样品、泳道5和10来自雌性乌龟输卵管的漏斗部样品、泳道m为分子量标记。
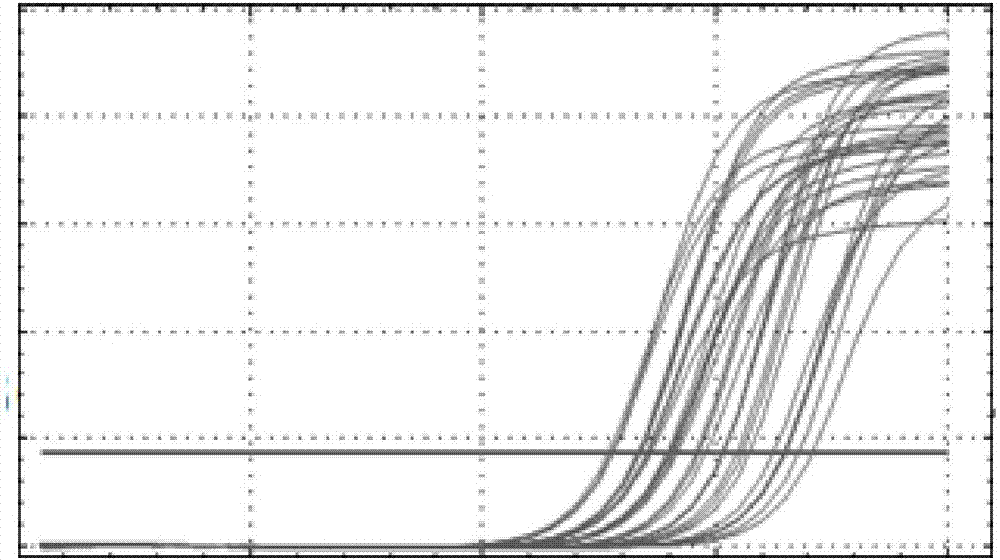
图2a是实施例6的扩增曲线;
图2b是实施例6的溶解曲线。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明提供了一种用于扩增雌性乌龟雌激素受体α基因的rt-pcr引物,其中,所述rt-pcr引物包括seqidno:1和seqidno:2所示的引物对。
本发明还提供了一种利用rt-pcr引物扩增雌性乌龟雌激素受体α基因的方法,其中,所述方法包括:
1)提取待扩增样品的总rna;
2)将步骤1)中提取的总rna反转录成cdna;
3)采用rt-pcr引物对步骤2)中反转录的cdna进行扩增;其中,
所述rt-pcr引物为上述所述的rt-pcr引物。
在本发明中,为了达到更好的pcr扩增效果,使得得到的琼脂糖凝胶电泳图更清晰可见,便于更好地确定实验结果,所述扩增过程为普通pcr扩增,且以12.5μl的pcr扩增体系为基准,每条引物的浓度分别为0.01-0.03pmol/l,cdna模板的用量为30-80ng。其中,用于pcr扩增的聚合酶以及缓冲液可以为本领域常规使用的聚合酶和缓冲液类型。
另一优选的实施方式中,所述扩增过程为rt-pcr扩增,且以20μl的rt-pcr扩增体系为基准,每条引物的浓度分别为0.01-0.05pmol/l,cdna模板的用量为50-150ng。其中,rt-pcr扩增可以使用本领域常规使用的此类试剂盒进行操作,其用量具体的可以参照产品说明书中的详细说明。本发明在此不再详细赘述。
一种更为优选的实施方式中,所述扩增过程为顺次进行的普通pcr扩增和rt-pcr扩增;其中,
在普通pcr扩增过程中,以12.5μl的pcr扩增体系为基准,每条引物的浓度分别为0.01-0.03pmol/l,cdna模板的用量为30-80ng;
在rt-pcr扩增过程中,以20μl的rt-pcr扩增体系为基准,每条引物的浓度分别为0.01-0.05pmol/l,cdna模板的用量为50-150ng。
为了能对扩增后的产物进行更好的判定和检测,所述方法还包括取普通pcr扩增后的扩增的产物做琼脂糖凝胶电泳检测。
进一步优选的实施方式中,扩增的产物的泳道中出现的条带中所含有的dna片段的长度为220bp。
扩增过程中的退火过程可以为本领域所常规使用的退火方式及返火参数,在本发明中,为了得到更好的扩增效果,所述扩增过程的退火温度为50-60℃,退火时间为15-25s。另外,对于普通pcr扩增和rt-pcr中的变性条件、延伸条件以及循环数等参数的设置均可以按照本领域常规的设置进行操作,本发明在此不再详细赘述。
以下将通过实施例对本发明进行详细描述。以下实施例中,所述引物均由生工生物工程(上海)有限公司合成且引物浓度为5pmol/l(实施例和对比例中的引物为稀释10倍后进行使用,即实施例和对比例中的引物的浓度为0.5pmol/l),本发明中使用的dntpmix为takara公司的市售品,使用rt-pcr的试剂盒为天根生物公司的市售品,该试剂盒的型号为superrealpremixplus(sybrgreen),其余所使用的化学试剂均为常规市售分析纯试剂。其中,雌性乌龟输卵管分为五个部分:阴道部、子宫部、峡部、蛋白部和漏斗部。
实施例1
1)总rna的提取:采用快速热酚抽提法,取100mg输卵管阴道部的组织样本,放入研磨器中充分碾碎后,置于已灭菌的2.0ml的ep管;在ep管中加入1ml的trizol溶液,室温孵育5min使其充分裂解;离心力为12000g,4℃的条件下离心10min,取出上层水相至另一2.0mlep管中;在ep管中加入0.2ml氯仿(二氯甲烷)和1mltrizol溶液,轻轻摇晃15s,室温放置2min;而后置于离心力为12000g,4℃的条件下离心15min,取出上层水相至另一2.0mlep管中;在ep管中加入0.5ml异丙醇和1mltrizol,充分混匀,室温孵育10min;离心力为12000g,4℃下离心10min,弃上清;加入1ml的75%酒精清洗(上下轻轻颠倒ep管即可);离心力为7500g,室温(25℃左右)离心5min弃上清,室温晾干;加入50μlrnase-freeddh2o,于60℃金属浴10min;测od值,得到总rna,将总rna放于-80℃保存。
2)总rna反转录成cdna:向pcr仪的样品管中加入2μl的5*gdnabuffer和5μl的总rna,并用rnase-freeddh2o补齐至10μl;彻底混匀,简短离心,42℃孵育3min,然后置于冰上;加入2μl的10*fastrtbuffer,1μl的rtenzymemix,2μl的fq-rtprimermix,并用rnase-freeddh2o补齐至20μl,充分混匀,42℃孵育15min,95℃孵育3min之后放于冰上,得到的总cdna。(其中,得到的总cdna使用双蒸水稀释至总cdna的浓度为50ng/μl后使用)
3)pcr扩增:向pcr仪的样品管中加入hpbuffer1.25μl,每条引物各0.5μl,1μl的dntpmix,0.2μl的taqdna聚合酶和1μl的总cdna,并用双蒸水补齐至12.5μl。pcr反应条件为:95℃预变性5min;然后进行34个循环,该循环包括:95℃变性30s,55℃退火20s和72℃延伸20s;最后再作72℃延伸10min。在上述反应条件下进行pcr扩增。将扩增后的产物进行琼脂糖凝胶电泳,电泳结果如图1所示。(泳道编号为1)
实施例2
按照实施例1的制备方法进行制备,不同的是,将实施例1中的输卵管阴道部由输卵管子宫部代替,电泳结果如图1所示。(泳道编号为2)
实施例3
按照实施例1的制备方法进行制备,不同的是,将实施例1中的输卵管阴道部由输卵管峡部代替,电泳结果如图1所示。(泳道编号为3)
实施例4
按照实施例1的制备方法进行制备,不同的是,将实施例1中的输卵管阴道部由输卵管蛋白部代替,电泳结果如图1所示。(泳道编号为4)
实施例5
按照实施例1的制备方法进行制备,不同的是,将实施例1中的输卵管阴道部由输卵管漏斗部代替,电泳结果如图1所示。(泳道编号为5)
实施例6
按照实施例1的制备方法进行制备,不同的是,步骤3)为rt-pcr扩增,且扩增过程为:在得到总的cdna以后,向rt-pcr仪的样品管中加入10μl的2*superrealpremixplus,每条引物各0.6μl和2μl的总cdna,并用rnase-freeddh2o补齐至20μl。rt-pcr反应条件为:95℃预变性15min;然后进行40个循环,该循环包括:95℃变性10s,55℃退火20s和72℃延伸20s,在上述反应条件下进行rt-pcr扩增。使用软件bio-radcfxmanager可以观察扩增的扩增曲线和溶解曲线,结果如图2所示。
对比例1
按照实施例1的制备方法进行制备,不同的是,引物采用的为内参β-actin基因引物序列(其序列如seqidno:3和seqidno:4所示),电泳结果如图1所示。(泳道编号为6)。
对比例2
按照实施例2的制备方法进行制备,不同的是,引物采用的为内参β-actin基因引物序列(其序列如seqidno:3和seqidno:4所示),电泳结果如图1所示。(泳道编号为7)。
对比例3
按照实施例3的制备方法进行制备,不同的是,引物采用的为内参β-actin基因引物序列(其序列如seqidno:3和seqidno:4所示),电泳结果如图1所示。(泳道编号为8)。
对比例4
按照实施例4的制备方法进行制备,不同的是,引物采用的为内参β-actin基因引物序列(其序列如seqidno:3和seqidno:4所示),电泳结果如图1所示。(泳道编号为9)。
对比例5
按照实施例5的制备方法进行制备,不同的是,引物采用的为内参β-actin基因引物序列(其序列如seqidno:3和seqidno:4所示),电泳结果如图1所示。(泳道编号为10)。
通过图1可以看出,实施例1-实施例5中出现的条带中所含有的dna片段的长度为220bp,对比例1-对比例5中出现的条带中所含有的dna片段的长度为260bp,通过内参基因的对比,可以看出本发明的rt-pcr引物能够对雌性乌龟雌激素受体α基因进行有效的扩增,并且具有特异性地扩增到我们需要的220bp的dna片段的长度。并且,通过图1可以进一步看出,本发明通过设计上述引物,对待扩增样品仅需通过一次普通的pcr扩增,并且通过琼脂糖凝胶电泳检测可以看出,图中的条带只有一条且显示非常明亮,证实了该引物扩增效果非常明显且非常可靠。图2可以看出,该引物应用在rt-pcr中可以扩增出单一峰的溶解曲线,为特异性扩增产物。本实验结果说明了该引物能够简单,快速,特异性地扩增出雌性乌龟输卵管雌激素受体α基因,有利于后续研究大规模用该引物进行扩增。同时,所用的模板可直接从雌性乌龟输卵管中提取,大大降低了取样的难度,而且该方法简便快捷,经济实用。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
sequencelisting
<110>安徽师范大学
<120>用于扩增雌性乌龟雌激素受体α基因的rt-pcr引物和方法
<130>2017002
<160>4
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<400>1
tgaacagaccacagctgaaga21
<210>2
<211>21
<212>dna
<400>2
ggctagtagagctgtacaccg21
<210>3
<211>20
<212>dna
<400>3
agacccgacagactacctca20
<210>4
<211>20
<212>dna
<400>4
cacctgaccatcaggcaact20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种二化螟Bt蛋白受体ALP4基因及其应用
- 一种二化螟Bt蛋白受体ALP5基因及其应用
- 水稻ABA受体OsPYL3基因、其编码蛋白及其应用
- 检测表皮生长因子受体基因位点突变的荧光定量pcr试剂盒的制作方法
- 抗人雌激素受体单克隆抗体及抗人孕激素受体单克隆抗体的制备及应用的制作方法
- 子宫癌遗传检测试剂盒的制作方法
- 一种利用雌激素受体α基因预测优秀冰雪运动员身高的细胞生物学方法
- T1r味觉受体及其编码基因的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和脑受体显像剂<sup>99m</sup>Tc-Memantine的油水分配系数测定方法
- 猕猴雌二醇受体β基因片段及其应用的制作方法
- Virosaine A的四氢吡咯基和吗啉基衍生物的组合物在抗骨质疏松药物中的应用
- 鉴定嗅觉受体调节剂的方法
- 用于治疗局部晚期或转移性雌激素受体阳性乳腺癌的雌激素受体调节剂的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- Virosaine A的哌嗪基和咪唑基衍生物的组合物在抗骨质疏松药物中的应用
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法
- 雄激素受体调节剂的晶形的制作方法
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法