用于检测鲤春病毒的特异性引物对、探针、检测试剂盒的制作方法
本发明属于生物技术领域,涉及用于检测鲤春病毒的特异性引物对、探针、检测试剂盒。
背景技术
鲤春病毒血症(springviraemiaofcarp,svc)是一种由病毒引起的,发生在鱼类中的出血性、高传染性疫病,经常在鲤科鱼类,尤其是鲤、锦鲤,常爆发于春季,导致患病鱼大量死亡,给渔农带来巨大的经济损失。依照国际动物卫生组织(oie)的规定,鲤春病毒血症是必须向oie申报的疾病,同时也是《中华人民共和国进境动物一、二类传染病、寄生虫病名录》中的二类动物疫病。该病的病原为鲤春病毒血症病毒(springviraemiaofcarpvirus,svcv),又名鲤鱼弹状病毒(rhabdoviruscarpio),属于弹状病毒科,水泡病毒属(vesiculorirus)。该病毒的基因组为单股、负链、不分节段的rna,长约11019个核苷酸,主要包含5个基因。
目前鲤春病毒检测的“金标准”是通过细胞培养的方法,分离出病毒,再利用免疫学技术进行鉴定,病毒的整个培养和检测过程周期较长且工作量大,不符合快速检测的原则。为了减轻鲤春病毒培养法的工作量,缩短检测时间,需要一种快速简单的检测方法来检测鲤春病毒。因此出现了灵敏度和准确性更高的pcr(polymerasechainreaction)检测鲤春病毒。
pcr以4种dntp为底物,在引物存在的情况下,在dna模板的3’末端进行互补链的延伸,多次反复的循环能使微量的模板核酸得到指数级的扩增。由于鲤春病毒是一种rna病毒,因此rt-pcr检测方法尤其适用于非常耗时的鲤春病毒的检测鉴定。rt-pcr法检测鲤春病毒的基本步骤包括样本的前处理,在rt-pcr总反应体系中加入缓冲液、氯化镁、taq酶、逆转录酶、dntp、模板和引物,设置扩增条件扩增反应。取微量扩增产物进行琼脂糖凝胶电泳,用紫外检测仪观察并用凝胶成像系统照相,观察是否有目的片段出现。pcr方法由于引物设计特异性较强,可以进行种属的鉴别。pcr产物的分析一般采用琼脂糖凝胶电泳分析,初步判断pcr产物片段的大小与预计是否一致。高隆英等人根据鲤春病毒糖蛋白基因序列利用rt-pcr方法检测鲤春病毒,koutna等人用rt-pcr和套氏pcr相结合的方法,从感染的鱼组织中鉴定出svcv,shimahara等人建立了一种经过优化后检测鲤春病毒的rt-pcr技术。但最令人头痛的问题是pcr扩增产物污染,因为pcr产物拷贝量大,极其微量的污染即可造成假阳性的产生。最可能造成pcr产物污染的形式是气溶胶污染,在操作时比较剧烈地摇动反应管,尤其是打开反应管的盖进行电泳点样操作时都可形成气溶胶而污染。一个气溶胶颗粒包含大量拷贝,因而由气溶胶造成的污染产生的假阳性是一个值得特别重视的问题。随着分子生物学的发展,逐渐发展了利用荧光定量rt-pcr技术进行svcv检测手段,如张力峰等人建立了快速检测svcv的荧光rt-pcr检测技术。
荧光定量pcr(real-timefluorescencequantitativepcr)是1996年由美国appliedbiosystems公司推出的一种核酸新定量试验技术,荧光定量pcr是在常规pcr基础上加入荧光探针或相应的荧光染料来实现实时定量的。随着pcr反应的进行,pcr反应产物不断累计,荧光信号强度也等比例增加。每经过一个循环,收集一次荧光信号,这样我们就可以通过荧光强度变化监测产物量的变化,从而得到一条荧光扩增曲线。在实时荧光定量pcr技术中ct值是指每个反应管内的荧光信号到达设定阈值时所经历的循环数。每个模板的ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表ct值。因此,只要获得未知样品的ct值,即可从标准曲线上计算出该样品的起始拷贝数。随着实时荧光定量pcr的使用,出现了很多利用此技术检测svcv的研究,zhiqinyue等利用svcvg基因保守序列设计了tapman探针,建立了一步法rt-pcr,定量检测svcv。虽然实时荧光定量pcr简化了操作步骤,采用闭管检测可避免pcr跑胶导致的气溶胶假阳性的出现,敏感性高,可以实现实时监控,还可以实现定量判断。实时荧光定量pcr具有比pcr检测快,灵敏度高的优势,尤其适合样品模板含量较低时使用,实时荧光定量pcr能通过溶解曲线能够判断特异性扩增。实时荧光定量pcr需要配套价格高昂的荧光定量pcr仪器,而且设备维护费用高,机器设置操作复杂,需专业人员,难以得到全面推广。
环介导等温扩增技术(loop-mediatedisothermalamplificationmethod,lamp)是一种新兴的基因扩增技术,由日本学者notomi2000年在nucleicacidsres杂志上公开发表,作为一种分子生物学检测技术,现先已广泛应用于分子检测领域,吴业颖、shivappa、liu分别利用鲤春病毒不同的保守基因建立了快速检测鲤春病毒的rt-lamp技术。lamp原理是针对靶基因的6个区域设计4种特异引物,在链置换dna聚合酶(如bst酶)的作用下,水浴锅中63℃左右,60分钟即可实现10^9~10^10倍的核酸扩增,具有很高的扩增效率,操作简单,检测不需要使用特殊的仪器。lamp虽然增加了扩增效率,但引物间的非特异性配对容易导致假阳性结果,限制了lamp方法的使用。
目前常规pcr需要具有较好的控温仪器,尤其对于荧光定量pcr仪器,都非常昂贵。常规pcr需要热变性/退火/延伸进行多个循环的重复,所耗时间至少要2个小时;现也有少量等温扩增检验的公开资料或专利文献,但是均为lamp技术,其扩增时间要约45分钟~1小时,温度要求更高,65℃左右,且对于温度非常敏感,需要严格控制温度。而且,均采用sybrgreen等荧光染料进行判断扩增与否,对于非特异扩增无法区分。
技术实现要素:
发明目的:本发明所要解决技术问题是提供了一种用于检测鲤春病毒的特异性引物对。本发明通过vectornti软件对比文献上列出鲤春病毒常见的保守基因,并选定保守性强的糖蛋白g基因作为目标扩增区段,利用oligo6软件在保守区分别设计了4对引物和3条探针,将设计好的序列在ncbi上进行blast比对,确保种类的保守性及种间的特异性。
本发明还要解决的技术问题是提供了与所述的引物对配合使用的探针。
本发明还要解决的技术问题是提供了包含上述引物对和/或与引物对配合使用的探针的试剂盒。
技术方案:为了解决现有技术存在的问题,本发明采用以下技术方案:一种用于检测鲤春病毒的特异性引物对,所述引物对包括上游引物和下游引物,所述上游引物的核苷酸序列如seqidno:1或seqidno:3或seqidno:5或seqidno:7所示,所述下游引的核苷酸序列如seqidno:2或seqidno:4或seqidno:6或seqidno:8所示。
本发明内容还包括与所述的引物对配合使用的探针,所述探针的核苷酸序列如seqidno:9或seqidno:10或seqidno:11所示。
其中,所述探针为荧光染料标记的探针,所述荧光染料为syto-13,syto-82,fam,fitc,sybrgreeni,syto-13,syto-82,vic,hex,joe,tamra,tet,cy3,rox,texas-red或cy5中的一种。
其中,所述探针的长度为35-55个核苷酸碱基,位于第28-35位的一个碱基被替换为核酸类似物,所述核酸类似物为thf,在thf的两侧分别为两个t碱基并标记荧光基团和淬灭基团,探针在3’-末端通过封闭基团进行封闭。
本发明内容还包括所述的特异性引物对、所述的探针在制备鲤春病毒检测或诊断试剂盒中的应用。
本发明内容还包括一种鲤春病毒的检测试剂盒,所述鲤春病毒的检测试剂盒包括所述的引物对和/或所述的探针。
其中,所述的检测试剂盒反应体系包括:重组酶,聚合酶,单链dna结合蛋白,核酸酶,至少一对引物,一条探针,dntp、拥挤试剂、重组加载蛋白、能量系统和盐离子。
其中,所述重组酶选自噬菌体uvsx蛋白,大肠杆菌reca蛋白的任一种或一种以上的组合。
其中,所述聚合酶选自klenow聚合酶,bsu聚合酶或phi29聚合酶及其这些酶的突变体或大片段的任一种或一种以上的组合。
其中,所述单链dna结合蛋白选自大肠杆菌ssb蛋白,gp32蛋白的任一种或其组合。
其中,所述核酸酶选自核酸外切酶iii或核酸内切酶iv的任一种或一种以上的组合。
其中,所述重组加载蛋白选自噬菌体uvsy蛋白,大肠杆菌reco或大肠杆菌recr的任一种或一种以上的组合。
其中,所述拥挤试剂选自聚乙二醇,聚乙烯醇,右旋糖酐或聚蔗糖的一种或一种以上的组合。
其中,所述聚乙二醇选自peg1450,peg3000,peg8000,peg10000,peg14000,peg20000,peg25000,peg30000,peg35000或peg40000中的一种或几种。
其中,所述能量系统选自atp、磷酸肌酸、肌酸激酶的一种或一种以上的组合。
其中,所述盐离子选自tris,或钾离子的任一种或一种以上的组合。反应的激活剂为镁离子。
具体的,本发明的引物和探针的组合有以下四种组合:
组合一:
上游引物:5’-caaatactaattacaaggtagtaccccatt-3’
下游引物:5’-attcccgtacataattccttcaacttcctc-3’
探针:5’-aagtgtgtgaaatgaaagggaaccactc(fam-dt)a(thf)(bhq1-dt)tggatcacagatgag(c3-spacer)-3’
组合二:
上游引物:5’-tgggcatctgtcacaacagtgtcaaatact-3’
下游引物:5’-tctcggagcattcccgtacataattccttcc-3’
探针:5’-aagtgtgtgaaatgaaagggaaccactc(fam-dt)a(thf)(bhq1-dt)tggatcacagatgag(c3-spacer)-3’
组合三:
上游引物:5’-caaatactaattacaaggtagtaccccatt-3’
下游引物:5’-acattcatgctgcacggtctcatctgtgat-3’
探针:5’-ttcatttggagccgtacggaggacactgga(fam-dt)c(thf)a(bhq1-dt)catgaattcaatggg(c3-spacer)-3’
或组合四:
上游引物:5’-aattcaatgggggcgaatgcagagaaaaagtg-3’
下游引物:5’-ttcccgtacataattccttcaacttcctct-3’
探针:5’-tgcacggtctcatctgtgatccaaatagag(fam-dt)g(thf)(bhq1-dt)tccctttcatttca(c3-spacer)-3’
重组酶聚合酶扩增技术在扩增时间、扩增特异性、扩增所需要的能耗等方面均具有明显的优势。原理为通过反应体系中通常为28-35个碱基的两条特异性引物与重组酶形成复合物,在模板dna上寻找同源序列发生链交换,并在dna聚合酶作用下发生延伸。经过上下游引物在模板的特异性区段两端分别结合延伸,循环往复发生指数级扩增。扩增产物虽然可通过添加sybrgreen染料实现荧光信号的增加,但因荧光染料无法区分非特异性,而通过反应体系中增加可以被核酸外切酶iii或者核酸内切酶iv进行碱基类似物切除的方式的特异性荧光探针技术进行检测,从而大大提高了检测的特异性。
本发明通过vectornti软件对比文献上列出鲤春病毒常见的保守基因,并选定保守性强的糖蛋白g基因作为目标扩增区段,利用oligo6软件在保守区分别设计了4对引物和3条探针,将设计好的序列在ncbi上进行blast比对,确保种类的保守性及种间的特异性。
因此,本发明还包括了检测鲤春病毒的方法,该方法采用的扩增体系同前所述检测试剂盒的体系,该方法至少包括两条引物和一条探针,引物分别结合于待扩增区域的上游和下游,引物的长度为15-45核苷酸碱基,优选为28-35核苷酸碱基;所述探针长度为35-55个核苷酸碱基,优选地46-52个碱基,探针中位于第28-35位的一个碱基被替换为核酸类似物,所述核酸类似物优选为thf,在thf的两侧分别为两个t碱基并标记荧光基团和淬灭基团,探针在3’-末端通过封闭基团进行封闭。引物和探针的组合同前所述的四种组合。
有益效果:与现有技术相比,本发明的优点是:
(1)本发明以鲤春病毒中糖蛋白g基因为检测靶点,通过恒温扩增技术,使用特异性的引物和探针组合,提高了鲤春病毒的检测便捷性和特异性,同时检测时间也大大缩短。
(2)与pcr检测方法相比,本发明的检测方法省去了产物电泳验证过程,避免了假阳性结果出现,提高检测的准确度。与qpcr相比,本发明的方法简便易行,也不需要操作复杂的仪器设备,节约了成本,提高了检测效率,同时便于在大范围内推广使用。与其他恒温扩增方法相比,本发明的检测方法所需时间更短,检测的准确率更高。
(3)本发明的检测方法依赖于酶促扩增反应,在恒定的温度下即可进行连续的扩增反应,其扩增速率远远高于常规的pcr变温反应。整个扩增在20分钟即检测完成;而且在操作上,不需要对多种参数进行设置,不需要具备很专业的技能也可以进行检测操作。
(4)本发明的反应条件为37~42℃,对温度控制不需要特别严格,并且采用了特异性的荧光探针,可以更好的区分非特异性扩增。因此,对于基层测试使用更为便捷,且耗能更低,对于现场操作尤为适合。
附图说明
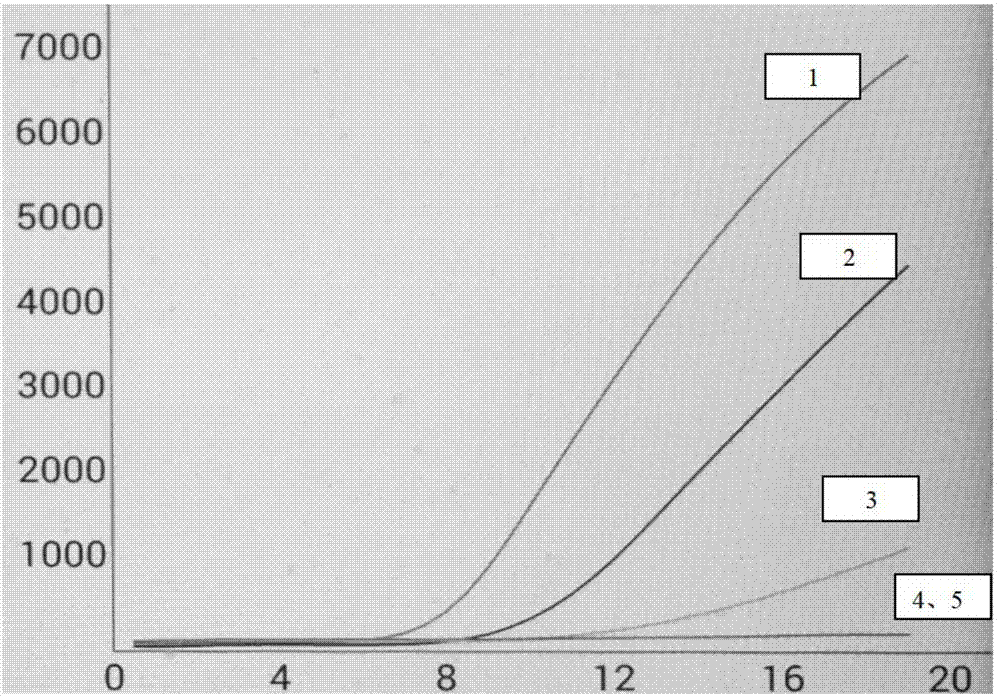
图1为svcv重组酶聚合酶扩增(结合核酸外切酶iii)方法灵敏度测试结果。1.质粒6(10-4ng/μl)2.质粒7(10-5ng/μl)3.质粒8(10-6ng/μl)4.质粒9(10-7ng/μl)5.ddh2o
图2为svcv重组酶聚合酶扩增(结合核酸外切酶iii)方法特异性测试结果。1.svcv2.gcrv-i3.gcrv-ii4.gcrv-iii5.isknv6.khv7.ihnv8.giv9.cyhv-ii10.depc处理水
图3为svcv重组酶聚合酶扩增(结合核酸内切酶iv)方法灵敏度测试结果。1.质粒6(10-4ng/μl)2.质粒7(10-5ng/μl)3.质粒8(10-6ng/μl)4.质粒9(10-7ng/μl)5.ddh2o
具体实施方式
下面结合具体实施例对本发明做进一步详细说明。
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。以下实施例是为了对本发明作进一步详细说明,并非对发明的限制。
本发明中采用的鲤春病毒感染的病鱼组织样本均由江苏省渔业技术推广中心提供。
实施例1
1、鲤春病毒的阳性质粒的获得:通过ncbi搜索文献上列出常见的鲤春病毒糖蛋白g基因,利用vectornti软件进行比对找出其保守区域,选区糖蛋白g基因部分区域作为目标扩增区段,将其构建至载体puc57中,制备成鲤春病毒的阳性质粒,质粒由生工生物工程(上海)股份有限公司合成,选取的糖蛋白g基因部分序列如下:
atttcaaggattgcatcaggaactgatgaagatctggggtttccccctcaaagttgcggatgggcatctgtcacaacagtgtcaaatactaattacaaggtagtaccccattctgttcatttggagccgtacggaggacactggatcgatcatgaattcaatgggggcgaatgcagagaaaaagtgtgtgaaatgaaagggaaccactctatttggatcacagatgagaccgtgcagcatgaatgtgaaaagcacatagaggaagttgaaggaattatgtacgggaatgctccgagaggggatgcaatatatattaacaactttattatagataaacatcatagagtatacagattcggggggtcttgtcgaatgaaattctgtaataaagatggtataaaattcacaagaggagactgggtagaaaaaacagctgaaacattgacgaatatttatgcaaatatacctgaatgtgctgatggaacgttggtatctggtcac。
2、选择通过步骤1合成的含有鲤春病毒保守区基因序列的质粒为检测目标,
上游引物序列是:5’-caaatactaattacaaggtagtaccccatt-3’(seqidno.1);
下游引物序列是:5’-attcccgtacataattccttcaacttcctc-3’(seqidno.2);
探针序列是:5’-aagtgtgtgaaatgaaagggaaccactc(fam-dt)a(thf)(bhq1-dt)tggatcacagatgag(c3-spacer)-3’。
利用重组酶聚合酶扩增(结合核酸外切酶iii)方法扩增反应体系进行扩增,构建25μl扩增反应体系如下:
30mm三羟甲基氨基甲烷-醋酸缓冲液ph8.0
100mm醋酸钾
14mm醋酸镁
3mm二硫苏糖醇
5%聚乙二醇(分子量20000)
2mmatp
20mm磷酸肌酸
100ng/μl肌酸激酶
600ng/μl大肠杆菌ssb蛋白
150ng/μl噬菌体uvsx蛋白
25ng/μl噬菌体uvsy蛋白
50ng/μlklenow聚合酶大片段(exo-)
4u/μl逆转录酶
50ng/μl核酸外切酶iii
450μmdntp
420nm每条上游引物
420nm每条下游引物
120nm每条荧光探针
模板为合成的阳性质粒,1.5μl
扩增温度为37℃,反应20min,用gs8荧光恒温扩增仪进行检测荧光的变化值,每30s读取一次荧光。重组酶聚合酶扩增不需要复杂的样品dna前处理过程,不需要模板的热变性,反应在较低的恒定温度条件下完成,反应敏感度高,特异性强,上机检测20min即可出结果。反应通过荧光数值判读,省去了pcr产物电泳验证的过程,避免了气溶胶污染。
模板处理:用nanodrop标定阳性质粒的浓度,用te先将其稀释至10ng/μl(命名为质粒1),随后10倍依次稀释,稀释至1ng/μl(命名为质粒2)、稀释至10-1ng/μl(命名为质粒3)、稀释至10-2ng/μl(命名为质粒4)、稀释至10-3ng/μl(命名为质粒5)、稀释至10-4ng/μl(命名为质粒6)、稀释至10-5ng/μl(命名为质粒7)、稀释至10-6ng/μl(命名为质粒8)、稀释至10-7ng/μl(命名为质粒9);经过检测最终确认其灵敏度能检测到10-6ng/μl(命名为质粒8),(结果参见图1),灵敏度完全能达到应用需求。
核酸提取:柱式动物组织总rna抽提纯化试剂盒(b518651)购自生工生物工程(上海)股份有限公司,取待检样本鲤春病毒感染的病鱼组织约25mg,rna提取过程按照试剂盒内标准抽提步骤,将提取好的核酸进行分装,冻存于-80℃备用。
特异性检测:为了验证引物及探针的特异性,分别以鱼类常见病毒gcrvi、ii、iii、isknv、khv、ihnv、giv、cyhv-2的阳性样本(江苏省渔业技术推广中心提供)为模板进行检测;经过检测仅svcv阳性样品出现正常扩增,阴性对照(depc处理水,购自生工)及gcrv、isknv、khv、ihnv、giv、cyhv-2阳性样品均未出现扩增(结果参见图2)。
实施例2
选取实施例1中设计的引物及探针序列,进行重组酶聚合酶扩增(结合核酸内切酶iv)方法版本扩增测试,构建25μl扩增反应体系如下:
30mm三羟甲基氨基甲烷-醋酸缓冲液ph8.0
100mm醋酸钾
14mm醋酸镁
3mm二硫苏糖醇
5%聚乙二醇(20000)
2mmatp
20mm磷酸肌酸
100ng/μl肌酸激酶
400ng/μl大肠杆菌reca蛋白
200ng/μl大肠杆菌ssb蛋白
60ng/μl大肠杆菌reco蛋白
40ng/μl大肠杆菌recr蛋白
60ng/μl大肠杆菌recf蛋白
8units枯草芽孢杆菌dna聚合酶i
4u/μl逆转录酶
50ng/μl核酸内切酶iv
450μmdntp
420nm每条上游引物
420nm每条下游引物
120nm荧光探针
模板为合成的阳性质粒1.5μl
扩增温度为42℃,反应20min,用gs8荧光恒温扩增仪进行检测荧光的变化值,每30s读取一次荧光。以上述合成的阳性质粒为模板进行检测。
模板处理:同实施例1,经过检测最终确认其灵敏度能检测到10-6ng/μl质粒8,灵敏度与重组酶聚合酶扩增(结合核酸外切酶iii)方法基本相同(见图3)。
实施例3
选择通过合成含有鲤春病毒保守区基因序列的质粒为检测目标,
上游引物序列是:5’-tgggcatctgtcacaacagtgtcaaatact-3’(seqidno.3);
下游引物序列是:5’-tctcggagcattcccgtacataattccttc-3’(seqidno.4);
探针序列是:5’-aagtgtgtgaaatgaaagggaaccactc(fam-dt)a(thf)(bhq1-dt)tggatcacagatgag(c3-spacer)-3’。
利用重组酶聚合酶扩增(结合核酸外切酶iii)方法扩增反应体系进行扩增,构建25μl扩增反应体系如下:
60mm三羟甲基氨基甲烷-醋酸缓冲液ph8.0
100mm醋酸钾
14mm醋酸镁
3mm二硫苏糖醇
5%聚乙二醇(分子量20000)
2mmatp
20mm磷酸肌酸
100ng/μl肌酸激酶
600ng/μl噬菌体gp32蛋白
150ng/μl噬菌体uvsx蛋白
25ng/μl噬菌体uvsy蛋白
20ng/μlklenow聚合酶大片段(exo-)
4u/μl逆转录酶
50ng/μl核酸外切酶iii
450μmdntp
420nm每条上游引物
420nm每条下游引物
120nm每条荧光探针
模板为合成的阳性质粒1.5μl
扩增温度为37℃,反应20min,用gs8荧光恒温扩增仪进行检测荧光的变化值,每30s读取一次荧光。以实施例1合成的阳性质粒为模板进行检测。
模板处理:同实施例1,经过检测最终确认其灵敏度能检测到10-5ng/ul质粒7。
实施例4
选择通过合成含有鲤春病毒保守区基因序列的质粒为检测目标,
上游引物序列是:5’-caaatactaattacaaggtagtaccccatt-3’(seqidno.5);
下游引物序列是:5’-acattcatgctgcacggtctcatctgtgat-3’(seqidno.6);
探针序列是:5’-ttcatttggagccgtacggaggacactgga(fam-dt)c(thf)a(bhq1-dt)catgaattcaatggg(c3-spacer)-3’。
利用重组酶聚合酶扩增(结合核酸外切酶iii)方法扩增反应体系进行扩增,构建25μl扩增反应体系如下:
30mm三羟甲基氨基甲烷-醋酸缓冲液ph8.0
60mm醋酸钾
14mm醋酸镁
3mm二硫苏糖醇
5%聚乙二醇(分子量20000)
2mmatp
20mm磷酸肌酸
100ng/μl肌酸激酶
600ng/μl噬菌体gp32蛋白
150ng/μl噬菌体uvsx蛋白
25ng/μl噬菌体uvsy蛋白
80ng/μlklenow聚合酶大片段(exo-)
4u/μl逆转录酶
50ng/μl核酸外切酶iii
450μmdntp
420nm每条上游引物
420nm每条下游引物
120nm每条荧光探针
模板为合成的阳性质粒1.5μl
扩增温度为37℃,反应20min,用gs8荧光恒温扩增仪进行检测荧光的变化值,每30s读取一次荧光。以实施例1合成的阳性质粒为模板进行检测。
模板处理:同实施例1,经过检测最终确认其灵敏度能检测到10-5ng/μl质粒7。
实施例5
选择通过合成含有鲤春病毒保守区基因序列的质粒为检测目标,
上游引物序列是:5’-aattcaatgggggcgaatgcagagaaaaagtg-3’(seqidno.7);
下游引物序列是:5’-ttcccgtacataattccttcaacttcctct-3’(seqidno.8);
探针序列是:5’-tgcacggtctcatctgtgatccaaatagag(fam-dt)g(thf)(bhq1-dt)tccctttcatttca(c3-spacer)-3’。
利用重组酶聚合酶扩增(结合核酸外切酶iii)方法扩增反应体系进行扩增,构建25μl扩增反应体系如下:
30mm三羟甲基氨基甲烷-醋酸缓冲液ph8.0
100mm醋酸钾
14mm醋酸镁
3mm二硫苏糖醇
5%聚乙二醇(分子量20000)
2mmatp
20mm磷酸肌酸
100ng/μl肌酸激酶
600ng/μl噬菌体gp32蛋白
150ng/μl噬菌体uvsx蛋白
25ng/μl噬菌体uvsy蛋白
40ng/μlklenow聚合酶大片段(exo-)
4u/μl逆转录酶
50ng/μl核酸外切酶iii
450μmdntp
420nm每条上游引物
420nm每条下游引物
120nm每条荧光探针
模板为合成的阳性质粒1.5μl
扩增温度为37℃,反应20min,用gs8荧光恒温扩增仪进行检测荧光的变化值,每30s读取一次荧光。以实施例1合成的阳性质粒为模板进行检测。
模板处理:同实施例1,经过检测最终确认其灵敏度能检测到10-5ng/μl质粒6。
综上,实施例1为最佳实施例,最佳引物及探针分别是seqidno.1、seqidno.2和seqidno.9的组合。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
序列表
<110>江苏水产渔业推广中心、苏州先达基因科技有限公司
<120>用于检测鲤春病毒的特异性引物对、探针、检测试剂盒
<160>12
<170>siposequencelisting1.0
<210>1
<211>30
<212>dna
<213>上游引物(artificialsequence)
<400>1
caaatactaattacaaggtagtaccccatt30
<210>2
<211>30
<212>dna
<213>下游引物(artificialsequence)
<400>2
attcccgtacataattccttcaacttcctc30
<210>3
<211>30
<212>dna
<213>上游引物(artificialsequence)
<400>3
tgggcatctgtcacaacagtgtcaaatact30
<210>4
<211>30
<212>dna
<213>下游引物(artificialsequence)
<400>4
tctcggagcattcccgtacataattccttc30
<210>5
<211>30
<212>dna
<213>上游引物(artificialsequence)
<400>5
caaatactaattacaaggtagtaccccatt30
<210>6
<211>30
<212>dna
<213>下游引物(artificialsequence)
<400>6
acattcatgctgcacggtctcatctgtgat30
<210>7
<211>32
<212>dna
<213>上游引物(artificialsequence)
<400>7
aattcaatgggggcgaatgcagagaaaaagtg32
<210>8
<211>30
<212>dna
<213>下游引物(artificialsequence)
<400>8
ttcccgtacataattccttcaacttcctct30
<210>9
<211>44
<212>dna
<213>探针(artificialsequence)
<400>9
aagtgtgtgaaatgaaagggaaccactcatggatcacagatgag44
<210>10
<211>47
<212>dna
<213>探针(artificialsequence)
<400>10
ttcatttggagccgtacggaggacactggacacatgaattcaatggg47
<210>11
<211>45
<212>dna
<213>探针(artificialsequence)
<400>11
tgcacggtctcatctgtgatccaaatagaggtccctttcatttca45
<210>12
<211>501
<212>dna
<213>糖蛋白g基因(artificialsequence)
<400>12
atttcaaggattgcatcaggaactgatgaagatctggggtttccccctcaaagttgcgga60
tgggcatctgtcacaacagtgtcaaatactaattacaaggtagtaccccattctgttcat120
ttggagccgtacggaggacactggatcgatcatgaattcaatgggggcgaatgcagagaa180
aaagtgtgtgaaatgaaagggaaccactctatttggatcacagatgagaccgtgcagcat240
gaatgtgaaaagcacatagaggaagttgaaggaattatgtacgggaatgctccgagaggg300
gatgcaatatatattaacaactttattatagataaacatcatagagtatacagattcggg360
gggtcttgtcgaatgaaattctgtaataaagatggtataaaattcacaagaggagactgg420
gtagaaaaaacagctgaaacattgacgaatatttatgcaaatatacctgaatgtgctgat480
ggaacgttggtatctggtcac501
- 还没有人留言评论。精彩留言会获得点赞!
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 实时荧光PCR特异性检测肉苁蓉的引物及检测方法与制造工艺
- 小酸浆的分子特异性标记引物和检测方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 脯氨酸特异性蛋白酶基因及其应用