新型化合物、染色或印花用着色组合物、喷墨用油墨、布帛印花方法及被染色或印花布帛与流程
本发明涉及一种新型化合物、染色或印花用着色组合物、喷墨用油墨、对布帛进行印花的方法及被染色或印花的布帛。
背景技术:
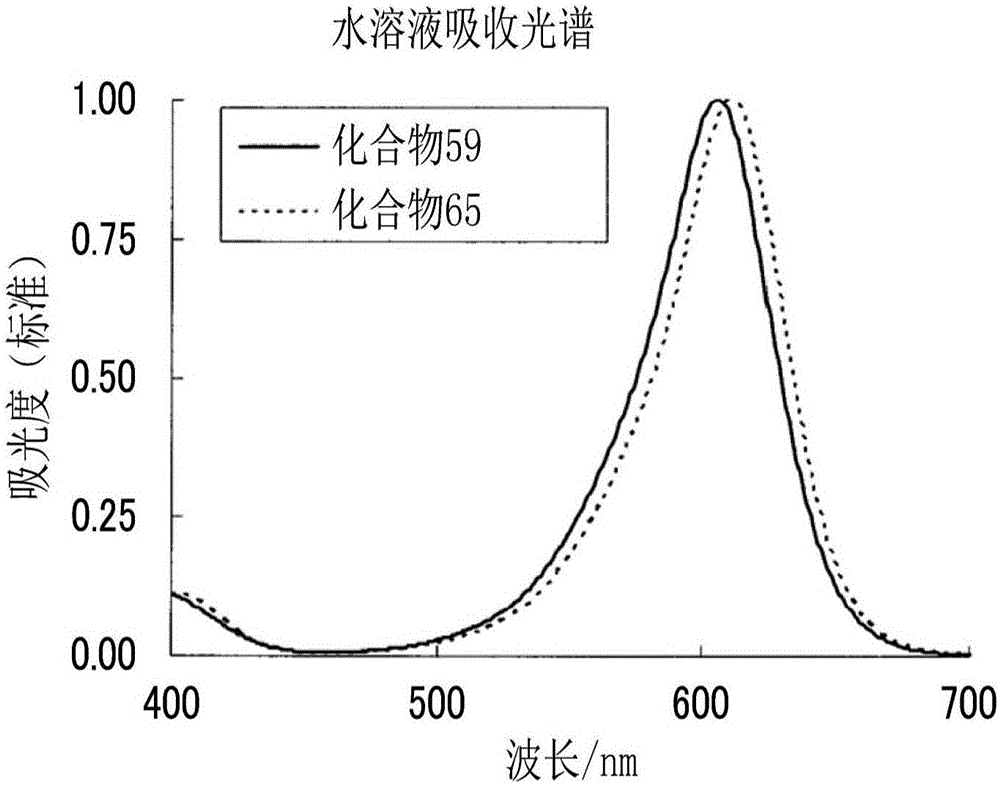
:以往,作为用于对布帛进行染色的染料,使用了酸性染料、反应染料、直接染料、分散染料等。例如,作为对棉或粘胶人造纱线等纤维素纤维进行染色的染料,已知有反应染料、直接染料、硫化染料、瓮染料、萘酚染料等,作为对丝绸、羊毛、尼龙等聚酰胺纤维进行染色的染料,已知有酸性染料、金属复合盐酸性染料、酸性媒染染料、直接染料等。关于聚酯纤维、纤维素酯纤维等酯纤维,已知利用分散染料或颜料的染色。并且,丙烯酸纤维通常用阳离子染料进行染色,但也有用酸性染料进行染色的纤维。作为染料可使用各种颜色的染料,尤其作为青色,广泛使用酞菁染料或三芳基甲烷染料。并且,目前,作为用于对布帛进行染色的产业性染色方法,进行了网版印花、辊式印花、转印印花等。这些方法为综合设计图案的企划、雕刻或制版、印花浆的制作、布料的准备等一系列的各工序才能完成的染色技术。相对于此,提出有利用能够将染料直接供给至布的喷墨方式的喷墨印花。喷墨印花与以往的印花不同,无需制作版,具有能够迅速形成层次优异的图像的优点,具备缩短交期、对应少量多品种生产、无需制版工序等优点。而且,仅使用作为形成图像所必须的量的油墨,因此可以说是与以往方法相比还具有废液较少等环境性优点的优异的图像形成方法。专利文献1中记载有如下方法:使用喷墨印花,设计符合服饰的立体形状的图案,在原材料上迅速且无损设计形象地重现该图案。并且,专利文献2中记载有在喷墨印花方法中适用酞菁染料的例子。专利文献3中记载有在喷墨印花方式中适用三芳基甲烷染料的例子。另一方面,专利文献4中记载有具有杂环的三芳基甲烷化合物,利用包含该化合物的着色组合物对纸进行喷墨印刷,并对色调、耐光性等进行了研究。专利文献5中记载有具有UV吸收剂作为抗衡阴离子的三芳基甲烷化合物,利用该化合物对有机EL显示器的耐光性等进行了研究。以往技术文献专利文献专利文献1:日本专利第2939908号公报专利文献2:日本特开2002-348502号公报专利文献3:日本特开平7-292581号公报专利文献4:日本特开2003-73358号公报专利文献5:日本特开2006-306933号公报发明的概要发明要解决的技术课题然而,专利文献2中利用DirectBlue87对布帛进行印花,但已知该酞菁染料对以尼龙为首的聚酰胺纤维的染色性较差,尤其,后述的喷墨印花方式的染色中,成色浓度并不充分。相对于此,已知为AcidBlue9的具有三芳基甲烷骨格的染料呈现鲜艳的青色,对聚酰胺也能够以高浓度进行染色。专利文献3中,利用AcidBlue9对布帛进行印花,但该三芳基甲烷染料在耐光性方面并不充分。专利文献4中记载的具有杂环的三芳基甲烷化合物对光具有耐性,但专利文献4中,并未对作为对布帛进行染色的用途时的课题(尤其是耐光性)进行研究。专利文献5中记载的具有UV吸收剂作为抗衡阴离子的三芳基甲烷化合物在对布帛尤其将酸性染料染色于聚酰胺纤维时,酸性基与聚酰胺纤维进行离子键合,因此可预料到抗衡阴离子不会残留在布帛上。因此,很难将该三芳基甲烷化合物用作染色或印花用。因此,要求能够获得具有较高染色性、耐光性、耐水性、耐氯性等各性能优异的染色布帛的染色或印花用着色组合物。本发明的目的在于提供一种色调优异、成色浓度较高、耐光性、耐水性及耐氯性优异的化合物及包含该化合物的染色或印花用着色组合物。并且,其目的在于提供一种含有上述染色或印花用着色组合物的喷墨用油墨、对布帛进行印花的方法及被染色或印花的布帛。用于解决技术课题的手段即,本发明如下。[1]以下述通式(1)~(3)的任一个表示的化合物。[化学式1]通式(1)中,R101及R103分别独立地表示氢原子、烷基、芳基或杂环基。R102及R104分别独立地表示烷基、芳基或杂环基。R105及R106分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R107、R108及R109分别独立地表示取代基,X101、X102及X103分别独立地表示CH或氮原子。其中,X101~X103各个组中的氮原子的数量为0~2。n101及n102分别独立地表示0~4的整数,n103表示0~3的整数。通式(1)中的氢原子可脱落而键合有取代基。n101、n102及n103分别表示2以上的整数时,多个R107、R108及R109可相同,也可不同。R107与R108可键合而形成环。通式(1)在化合物中具有抗衡阴离子。[化学式2]通式(2)中,R111及R113分别独立地表示氢原子、烷基、芳基或杂环基。R112及R114分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R115、R116、R117、R118及R119分别独立地表示取代基,X111、X112及X113分别独立地表示CH或氮原子。其中,X111~X113各个组中的氮原子的数量为0~2。Ar111及Ar112分别独立地表示苯环、萘环或杂环。n111及n112分别独立地表示0~4的整数,n113表示0~5的整数,n114及n115分别独立地表示0~5的整数。通式(2)中的氢原子可脱落而键合有取代基。n111、n112、n113、n114及n115分别表示2以上的整数时,多个R115、R116、R117、R118及R119可相同,也可不同。R115与R116可键合而形成环。通式(2)在化合物中具有抗衡阴离子。[化学式3]通式(3)中,L121、L122、L123、L124及L125分别独立地表示2价的连结基团,T121、T122、T123、T124及T125分别独立地表示氢原子或以下述通式(T-1)~(T-8)的任一个表示的基团。其中,T121、T122、T123、T124及T125中的至少1个表示以通式(T-1)~(T-8)的任一个表示的基团。R121、R122及R123分别独立地表示取代基,X121、X122及X123分别独立地表示CH或氮原子。其中,X121~X123各个组中的氮原子的数量为0~2。n121及n122分别独立地表示0~4的整数,n123表示0~5的整数。n124、n125、n126、n127及n128分别独立地表示0~1的整数。n121、n122及n123分别表示2以上的整数时,多个R121、R122及R123可相同,也可不同。R121与R122可键合而形成环。通式(3)在化合物中具有抗衡阴离子。[化学式4][化学式5][化学式6]R201、R202、R204及R207分别独立地表示烷基。R205及R208分别独立地表示氢原子或烷基。R209及R210分别独立地表示氢原子、烷基或烷氧基。R203、R206、R211、R213及R217分别独立地表示取代基。L201表示p103价的连结基团。R214表示氢原子、氧自由基(-O·)、羟基、烷基或烷氧基。R215及R216分别独立地表示烷基。R215及R216可相互键合而形成环。R218及R219分别独立地表示氢原子、烷基、芳基或杂环基。X202表示氧原子或氮原子。X203表示碳原子或氮原子。R212表示芳基、杂环基或与X202连结而形成芳基或者杂环基的基团。Ar201表示芳基或杂环基。p101表示0~3,p102及p104分别独立地表示0~2,p103表示2或3,p106表示1~3。p105及p107分别独立地表示0~4。p108表示2~3。X201表示氧原子或NR220,R220表示氢原子或烷基。其中,X201表示NH时,R209及R210的至少一个表示烷基或烷氧基。p101、p102、p104、p105及p107分别表示2以上的数时,多个R203、R206、R211、R213及R217可相同,也可不同。另外,以通式(T-1)~(T-8)的任一个表示的基团中,各个式中的任一个氢原子可脱落而键合有连结基团。其中,示出*的氢原子不会脱落来连结。通式(T-6)中的R214为氢原子时,不会脱落来连结。通式(3)或通式(T-1)~(T-8)中的氢原子可脱落而键合有取代基。其中,示出*的氢原子不会脱落来键合有取代基。[2]根据[1]所述的化合物,其为以上述通式(1)~(3)的任一个表示的化合物,具有至少1个磺基。[3]根据[1]或[2]所述的化合物,其中,上述T121、T122、T123、T124及T125中的至少1个表示以上述通式(T-1)、(T-3)、(T-4)、(T-5)或(T-6)表示的基团。[4]根据[1]~[3]中任一项所述的化合物,其中,上述通式(T-4)以下述通式(T-41)、(T-42)或(T-43)表示。[化学式7]R401、R402、R403、R404及R405分别独立地表示取代基。R406及R407分别独立地表示芳基或杂环基。p401、p403、p404及p405分别独立地表示0~4,p402表示0~5。p401、p402、p403、p404及p405分别表示2以上的数时,多个R401、R402、R403、R404及R405可相同,也可不同。[5]一种染色或印花用着色组合物,其含有[1]~[4]中任一项所述的化合物。[6]一种喷墨用油墨,其含有[1]~[4]中任一项所述的化合物。[7]一种印花方法,其包含下述(1)~(4)的工序。(1)对至少包含高分子化合物及水的液体,添加[5]所述的染色或印花用着色组合物来制备色浆的工序(2)将上述(1)的色浆印染于布帛的工序(3)对已印染的布帛吹送蒸汽的工序(4)对已印染的布帛进行水洗、干燥的工序[8]一种印花方法,其包含下述(11)~(14)的工序。(11)对布帛赋予至少包含高分子化合物及水的浆料的工序(12)通过喷墨法,将[6]所述的喷墨用油墨印染于布帛的工序(13)对已印染的布帛吹送蒸汽的工序(14)对已印染的布帛进行水洗、干燥的工序[9]根据[7]或[8]所述的印花方法,其中,上述布帛包含聚酰胺。[10]一种被染色或印花的布帛,其为利用[5]所述的染色或印花用着色组合物染色或印花的布帛。[11]一种布帛,其为通过[7]~[9]中任一项所述的方法印花的布帛。发明效果根据本发明,能够提供一种色调优异、成色浓度较高、耐光性、耐水性及耐氯性优异的化合物及包含该化合物的染色或印花用着色组合物。并且,能够提供一种含有上述染色或印花用着色组合物的喷墨用油墨、对布帛进行印花的方法及被染色或印花的布帛。附图说明图1是表示化合物59与化合物65的水溶液吸收光谱的图。图2是表示化合物110与化合物105的水溶液吸收光谱的图。图3是表示用化合物59与化合物65染色的6尼龙布帛的吸收光谱的图。具体实施方式以下,对本发明进行详细说明。首先,将本发明中的取代基的具体例定义为取代基组A。(取代基组A)作为例子,可举出卤原子、烷基、芳烷基、烯基、炔基、芳基、杂环基、氰基、羟基、硝基、烷氧基、芳氧基、甲硅烷氧基、杂环氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、芳氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、芳氧基羰基氨基、氨磺酰基氨基、烷基或芳基磺酰基氨基、巯基、烷硫基、芳硫基、杂环硫基、氨磺酰基、烷基或芳基亚磺酰基、烷基或芳基磺酰基、酰基、芳氧羰基、烷氧羰基、氨基甲酰基、芳基或杂环偶氮基、酰亚胺基、膦基、氧膦基、氧膦基氧基、氧膦基氨基、甲硅烷基、离子性亲水性基团。这些取代基可进一步被取代,作为进一步的取代基,可举出选自以上说明的取代基组A的基团。作为卤原子,例如可举出氟原子、氯原子、溴原子或碘原子。作为烷基,可举出直链、分支、环状的取代或未取代的烷基,还包含环烷基、二环烷基、环结构更多的三环结构等。以下说明的取代基中的烷基(例如,烷氧基、烷硫基的烷基)也表示这种概念的烷基。作为烷基,优选为碳原子数1至30的烷基,例如可举出甲基、乙基、正丙基、异丙基、叔丁基、正辛基、二十烷基、2-氯乙基、2-氰乙基、2-乙基己基等,作为环烷基,优选为碳原子数3至30的取代或未取代的环烷基,例如可举出环己基、环戊基、4-正十二环己基等,作为二环烷基,优选为碳原子数5至30的取代或未取代的二环烷基即从碳原子数5至30的二环烷烃去除1个氢原子的一价的基,例如可举出二环[1,2,2]庚烷-2-基、二环[2,2,2]辛烷-3-基等。作为芳烷基,可举出取代或未取代的芳烷基,作为取代或未取代的芳烷基,优选为碳原子数7~30的芳烷基。例如可举出苄基及2-苯乙基。作为烯基,可举出直链、分支、环状的取代或未取代的烯基,包含环烯基、二环烯基。作为烯基,可优选举出碳原子数2至30的取代或未取代的烯基,例如乙烯基、烯丙基、异戊二烯基、香叶基、油烯基等,作为环烯基,可优选举出碳原子数3至30的取代或未取代的环烯基即从碳原子数3至30的环烯烃去除1个氢原子的一价的基,例如2-环戊烯-1-基、2-环己烯-1-基等,作为二环烯基,可举出取代或未取代的二环烯基、优选为碳原子数5至30的取代或未取代的二环烯基即去除具有1个双键的二环烯烃的1个氢原子的一价的基,例如二环[2,2,1]庚-2-烯-1-基、二环[2,2,2]辛-2-烯-4-基等。作为炔基,可优选举出碳原子数2至30的取代或未取代的炔基,例如乙炔基、炔丙基、三甲基甲硅烷基乙炔基等。作为芳基,可优选举出碳原子数6至30的取代或未取代的芳基,例如苯基、对甲苯基、萘基、间氯苯基、邻十六酰氨基苯基等。作为杂环基,可优选举出从5或6元的取代或未取代的芳香族或者非芳香族的杂环化合物去除一个氢原子的一价的基,进一步优选为碳原子数3至30的5或6元的芳香族的杂环基,例如2-呋喃基、2-噻吩基、2-嘧啶基、2-苯并噻唑基等。作为非芳香族的杂环基的例子,可举出吗啉基等。作为烷氧基,可优选举出碳原子数1至30的取代或未取代的烷氧基,例如甲氧基、乙氧基、异丙氧基、叔丁氧基、正辛氧基、2-甲氧基乙氧基等。作为芳氧基,可优选举出碳原子数6至30的取代或未取代的芳氧基,例如苯氧基、2-甲基苯氧基、4-叔丁基苯氧基、3-硝基苯氧基、2-十四酰基氨基苯氧基等。作为甲硅烷氧基,可优选举出碳原子数0至20的取代或未取代的甲硅烷氧基,例如三甲基甲硅烷氧基、二苯基甲基甲硅烷氧基等。作为杂环氧基,可优选举出碳原子数2至30的取代或未取代的杂环氧基,例如1-苯基四唑-5-氧基、2-四氢吡喃基氧基等。作为酰氧基,可优选举出甲酰氧基、碳原子数2至30的取代或未取代的烷基羰酰氧基、碳原子数6至30的取代或未取代的芳基羰酰氧基,例如乙酰氧基、叔戊酰氧基、硬脂酰氧基、苯酰氧基、对甲氧基苯基羰酰氧基等。作为氨基甲酰氧基,可优选举出碳原子数1至30的取代或未取代的氨基甲酰氧基,例如N,N-二甲基氨基甲酰氧基、N,N-二乙基氨基甲酰氧基、吗啉基羰氧基、N,N-二-正辛基氨基羰氧基、N-正辛基氨基甲酰氧基等。作为烷氧基羰氧基,可优选举出碳原子数2至30的取代或未取代的烷氧基羰氧基,例如甲氧基羰酰氧基、乙氧基羰酰氧基、叔丁氧基羰酰氧基、正辛基羰酰氧基等。作为芳氧基羰氧基,可优选举出碳原子数7至30的取代或未取代的芳氧基羰氧基,例如苯氧基羰酰氧基、对甲氧基苯氧基羰酰氧基、对正十六烷氧基苯氧基羰酰氧基等。作为氨基,包含烷基氨基、芳基氨基、杂环氨基,可优选举出氨基、碳原子数1至30的取代或未取代的烷基氨基、碳原子数6至30的取代或未取代的苯胺基,例如甲基氨基、二甲基氨基、苯胺基、N-甲基-苯胺基、二苯基氨基、三嗪基氨基等。作为酰氨基,可优选举出甲酰基氨基、碳原子数1至30的取代或未取代的烷基羰基氨基、碳原子数6至30的取代或未取代的芳基羰基氨基,例如乙酰基氨基、叔戊酰基氨基、月桂酰基氨基、苯甲酰基氨基、3,4,5-三-正辛氧基苯基羰基氨基等。作为氨基羰基氨基,可优选举出碳原子数1至30的取代或未取代的氨基羰基氨基,例如氨基甲酰基氨基、N,N-二甲基氨基羰基氨基、N,N-二乙基氨基羰基氨基、吗啉羰基氨基等。作为烷氧基羰基氨基,可优选举出碳原子数2至30的取代或未取代的烷氧基羰基氨基,例如甲氧基羰基氨基、乙氧基羰基氨基、叔丁氧基羰基氨基、正十八烷氧基羰基氨基、N-甲基-甲氧基羰基氨基等。作为芳氧基羰基氨基,可优选举出碳原子数7至30的取代或未取代的芳氧基羰基氨基,例如苯氧基羰基氨基、对氯苯氧基羰基氨基、间正辛氧基苯氧基羰基氨基等。作为氨磺酰基氨基,可优选举出碳原子数0至30的取代或未取代的氨磺酰基氨基,例如氨磺酰基氨基、N,N-二甲基氨基磺酰基氨基、N-正辛基氨基磺酰基氨基等。作为烷基或芳基磺酰基氨基,可优选举出碳原子数1至30的取代或未取代的烷基磺酰基氨基、碳原子数6至30的取代或未取代的芳基磺酰基氨基,例如甲基磺酰基氨基、丁基磺酰基氨基、苯基磺酰基氨基、2,3,5-三氯苯基磺酰基氨基、对甲苯基磺酰基氨基等。作为烷硫基,可优选举出碳原子数1至30的取代或未取代的烷硫基,例如甲基硫基、乙基硫基、正十六烷硫基等。作为芳硫基,可优选举出碳原子数6至30的取代或未取代的芳硫基,例如苯硫基、对氯苯硫基、间甲氧基苯硫基等。作为杂环硫基,可优选举出碳原子数2至30的取代或未取代的杂环硫基,例如2-苯并噻唑基硫基、1-苯基四唑-5-基硫基等。作为氨磺酰基,可优选举出碳原子数0至30的取代或未取代的氨磺酰基,例如N-乙基氨磺酰基、N-(3-十二烷氧基丙基)氨磺酰基、N,N-二甲基氨磺酰基、N-乙酰基氨磺酰基、N-苯甲酰基氨磺酰基、N-(N’-苯基氨基甲酰基)氨磺酰基等。作为烷基或芳基亚磺酰基,可优选举出碳原子数1至30的取代或未取代的烷基亚磺酰基、碳原子数6至30的取代或未取代的芳基亚磺酰基,例如甲基亚磺酰基、乙基亚磺酰基、苯基亚磺酰基、对甲苯基亚磺酰基等。作为烷基或芳基磺酰基,可优选举出碳原子数1至30的取代或未取代的烷基磺酰基、碳原子数6至30的取代或未取代的芳基磺酰基,例如甲基磺酰基、乙基磺酰基、苯基磺酰基、对甲苯基磺酰基等。作为酰基,可优选举出甲酰基、碳原子数2至30的取代或未取代的烷基羰基、碳原子数7至30的取代或未取代的芳基羰基、通过碳原子数2至30的取代或未取代的碳原子与羰基键合的杂环羰基,例如乙酰基、新戊酰基、2-氯乙酰基、硬脂酰基、苯甲酰基、对正辛氧基苯基羰基、2-吡啶基羰基、2-呋喃基羰基等。作为芳氧羰基,可优选举出碳原子数7至30的取代或未取代的芳氧羰基,例如苯氧基羰基、邻苯氯苯氧基羰基、间硝基苯氧基羰基、对叔丁基苯氧基羰基等。作为烷氧羰基,可优选举出碳原子数2至30的取代或未取代的烷氧羰基,例如甲氧基羰基、乙氧基羰基、叔丁氧基羰基、正十八烷氧基羰基等。作为氨基甲酰基,可优选举出碳原子数1至30的取代或未取代的氨基甲酰基,例如氨基甲酰基、N-甲基氨基甲酰基、N,N-二甲基氨基甲酰基、N,N-二-正辛基氨基甲酰基、N-(甲基磺酰基)氨基甲酰基等。作为芳基或杂环偶氮基,可优选举出碳原子数6至30的取代或未取代的芳基偶氮基、碳原子数3至30的取代或未取代的杂环偶氮基,例如苯基偶氮基、对氯苯基偶氮基、5-乙硫基-1,3,4-噻二唑-2-基偶氮基等。作为酰亚胺基,可优选举出N-琥珀酰亚胺基、N-邻苯二甲酰亚胺基等。作为膦基,可优选举出碳原子数0至30的取代或未取代的膦基,例如二甲基膦基、二苯基膦基、甲基苯氧基膦基等。作为氧膦基,可优选举出碳原子数0至30的取代或未取代的氧膦基,例如氧膦基、二辛氧基氧膦基、二乙氧基氧膦基等。作为氧膦基氧基,可优选举出碳原子数0至30的取代或未取代的氧膦基氧基,例如二苯氧基氧膦基氧基、二辛氧基氧膦基氧基等。作为氧膦基氨基,可优选举出碳原子数0至30的取代或未取代的氧膦基氨基,例如二甲氧基氧膦基氨基、二甲基氨基氧膦基氨基。作为甲硅烷基,可优选举出碳原子数0至30的取代或未取代的甲硅烷基,例如三甲基甲硅烷基、叔丁基二甲基甲硅烷基、苯基二甲基甲硅烷基等。作为离子性亲水性基团,可举出磺基、羧基、硫代羧基、亚磺基、膦酰基、二羟基膦基、4级铵基等。尤其优选为磺基、羧基。并且,羧基、膦酰基及磺基可以是盐的状态,形成盐的抗衡阳离子的例子中包含铵离子、碱金属离子(例,锂离子、钠离子、钾离子)及有机阳离子(例,四甲基铵离子、四甲基胍离子、四甲基鏻),优选为锂盐、钠盐、钾盐、铵盐,进一步优选为钠盐或以钠盐为主成分的混合盐,最优选为钠盐。另外,本发明中,当化合物为盐时,水溶性油墨中,盐解离在离子中而存在。〔以通式(1)~(3)的任一个表示的化合物〕若将以通式(1)~(3)的任一个表示的化合物用作染色或印花用着色组合物,则可获得染色成青色至蓝色的布帛。确认到了被染色的布帛的着色部的耐光性的优化。作用机理虽不明,但认为以通式(1)或(2)表示的化合物遮蔽易光分解的部位,因此耐光性得到优化。并且,认为以通式(3)表示的化合物通过共价键连结对染料导入防褪色部位,因此染料不会光褪色而存在于很靠近染料的附近的防褪色部位发挥作用,由此耐光性得到优化。并且,利用以通式(3)表示的化合物实施染色或印花时,确认到了耐氯性的优化。作用机理虽不明,但认为通式(3)中,导入有酚等易氧化的部位,因此染料在氯水中不会被氧化而该部分被氧化,因此氯抗性得到优化。首先,对以通式(1)表示的化合物进行说明。[化学式8]通式(1)中,R101及R103分别独立地表示氢原子、烷基、芳基或杂环基。R102及R104分别独立地表示烷基、芳基或杂环基。R105及R106分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R107、R108及R109分别独立地表示取代基,X101、X102及X103分别独立地表示CH或氮原子。其中,X101~X103各个组中的氮原子的数量为0~2。n101及n102分别独立地表示0~4的整数,n103表示0~3的整数。通式(1)中的氢原子可脱落而键合有取代基。n101、n102及n103分别表示2以上的整数时,多个R107、R108及R109可相同,也可不同。R107与R108可键合而形成环。通式(1)在化合物中具有抗衡阴离子。通式(1)中的R101、R102、R103及R104表示烷基、芳基或杂环基时,它们可具有取代基。R105及R106表示烷基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基或酰亚胺基时,它们可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。R101及R103优选为氢原子、可具有取代基的烷基或可具有取代基的芳基。R102及R104优选为可具有取代基的烷基或可具有取代基的芳基,更优选为具有取代基的烷基或可具有取代基的芳基。作为R101、R102、R103及R104的烷基,优选为碳原子数1~6的烷基,更优选为碳原子数1~3的烷基,进一步优选为甲基或乙基。R102及R104为烷基时,最优选苯基所取代的甲基。苯基所取代的甲基可进一步具有取代基。作为R101、R102、R103及R104的芳基,优选为苯基或萘基,更优选为苯基。R102及R104表示芳基时,优选R101及R103表示氢原子。R105及R106优选表示卤原子、可具有取代基的烷基、可具有取代基的烷氧基、可具有取代基的酰氧基、可具有取代基的氨磺酰基、可具有取代基的酰基、可具有取代基的烷氧羰基或磺基。R105及R106更优选为可具有取代基的烷基或卤原子,作为卤原子,优选为氯基。作为R107、R108及R109所表示的取代基,可举出选自上述取代基组A的取代基,优选为烷基、磺基、可具有取代基的氨磺酰基、卤原子、可具有取代基的烷氧基、可具有取代基的芳氧基、可具有取代基的杂环氧基、可具有取代基的酰氧基、可具有取代基的烷基氨基、可具有取代基的芳基氨基、可具有取代基的杂环氨基、可具有取代基的酰氨基、可具有取代基的氨基羰基氨基、可具有取代基的烷氧基羰基氨基、可具有取代基的芳氧基羰基氨基、可具有取代基的烷基或芳基磺酰基氨基,优选为烷基、磺基、可具有取代基的烷基氨基、可具有取代基的芳基氨基。n101及n102优选表示0~2。n103优选表示0~1。X101、X102及X103分别独立地表示CH或氮原子,优选表示CH。X101、X102及X103表示CH时,氢原子可脱落而键合有取代基R109。另外,通常三苯甲烷化合物为离子性化合物,取共振结构,因此例如AcidBlue7中,下述(A)~(C)表示相同的化合物。[化学式9]通式(1)优选以下述通式(1-1)或(1-2)表示,更优选以通式(1-2)表示。[化学式10]通式(1-1)中,R101及R103分别独立地表示氢原子、烷基、芳基或杂环基。R105及R106分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R102a、R104a、R107、R108及R109分别独立地表示取代基,X101、X102及X103分别独立地表示CH或氮原子。其中,X101~X103的各个组中的氮原子的数量为0~2。n101及n102分别独立地表示0~4的整数,n103表示0~3的整数,n104及n105分别独立地表示0~5的整数。通式(1-1)中的氢原子可脱落而键合有取代基。n101、n102、n103、n104及n105分别表示2以上的整数时,多个R107、R108、R109、R102a及R104a可相同,也可不同。通式(1-1)在化合物中具有抗衡阴离子。[化学式11]通式(1-2)中,R105及R106分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R112及R114分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R102b、R104b、R107、R108及R109分别独立地表示取代基,X101、X102及X103分别独立地表示CH或氮原子。其中,X101~X103的各个组中的氮原子的数量为0~2。n101及n102分别独立地表示0~4的整数,n103表示0~3的整数。n104及n105分别独立地表示0~5的整数。通式(1-2)中的氢原子可脱落而键合有取代基。n101、n102、n103、n104及n105分别表示2以上的整数时,多个R107、R108、R109、R102b及R104b可相同,也可不同。通式(1-2)在化合物中具有抗衡阴离子。通式(1-1)中,R101及R103的具体例及优选范围与通式(1)中的R101及R103相同。通式(1-1)及(1-2)中,R105、R106、R107、R108及R109的具体例及优选范围与通式(1)中的R105、R106、R107、R108及R109相同。通式(1-1)及(1-2)中,X101、X102、X103、n101、n102及n103的优选范围与通式(1)中的X101、X102、X103、n101、n102及n103相同。通式(1-1)及(1-2)中,R102a、R104a、R102b及R104b的具体例及优选范围与R107、R108及R109相同。通式(1-2)中,R112及R114的具体例及优选范围与后述的通式(2)中的R112及R114相同。通式(1-1)及(1-2)中,n104及n105优选表示1~3。接着,对与通式(2)表示的化合物进行说明。[化学式12]通式(2)中,R111及R113分别独立地表示氢原子、烷基、芳基或杂环基。R112及R114分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R115、R116、R117、R118及R119分别独立地表示取代基,X111、X112及X113分别独立地表示CH或氮原子。其中,X111~X113各个组中的氮原子的数量为0~2。Ar111及Ar112分别独立地表示苯环、萘环或杂环。n111及n112分别独立地表示0~4的整数,n113表示0~5的整数,n114及n115分别独立地表示0~5的整数。通式(2)中的氢原子可脱落而键合有取代基。n111、n112、n113、n114及n115分别表示2以上的整数时,多个R115、R116、R117、R118及R119可相同,也可不同。R115与R116可键合而形成环。通式(2)在化合物中具有抗衡阴离子。R111及R113表示烷基、芳基或杂环基时,它们可具有取代基。R112及R114表示烷基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基或酰亚胺基时,它们可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。R111及R113优选为氢原子、可具有取代基的烷基,更优选为氢原子。R112及R114优选为卤原子、可具有取代基的烷基、可具有取代基的烷氧基、可具有取代基的酰氧基、可具有取代基的氨磺酰基、可具有取代基的酰基、可具有取代基的烷氧羰基、氨甲酰基或磺基,更优选为可具有取代基的烷基或卤原子。作为卤原子,优选为氯基。作为R111、R112、R113及R114的烷基,优选为碳原子数1~6的烷基,更优选为碳原子数1~3的烷基,进一步优选为甲基或乙基,最优选为甲基。作为R115、R116、R117、R118及R119所表示的取代基,可举出选自上述取代基组A的取代基,优选为烷基、磺基、可具有取代基的氨磺酰基、卤原子、可具有取代基的烷氧基、可具有取代基的芳氧基、可具有取代基的杂环氧基、可具有取代基的酰氧基、可具有取代基的氨基、可具有取代基的烷基氨基或可具有取代基的芳基氨基、可具有取代基的杂环氨基、可具有取代基的酰氨基、可具有取代基的氨基羰基氨基、可具有取代基的烷氧基羰基氨基、可具有取代基的芳氧基羰基氨基、可具有取代基的烷基或芳基磺酰基氨基、可具有取代基的烷硫基、可具有取代基的烷基磺酰基、可具有取代基的烷基氨基羰基,优选为烷基、磺基、可具有取代基的烷基氨基或可具有取代基的芳基氨基。作为上述烷基氨基及芳基氨基具有取代基时的取代基,可举出选自上述取代基组A的取代基,优选为烷基、卤原子、烷氧羰基、磺基。作为R115、R116、R117、R118及R119所表示的烷基,优选为碳原子数1~10的烷基,更优选为碳原子数1~6的烷基,进一步优选为甲基、乙基、异丙基或叔丁基。从耐光性观点考虑,比甲基更优选乙基,比乙基更优选异丙基。作为R115及R116的芳香环上的取代位置,优选从氮原子来看为邻位。Ar111及Ar112优选为苯环、萘环,更优选为苯环。n111及n112优选表示0~2。n113优选表示0~3。n114及R115优选表示0~5。X111、X112及X113分别独立地表示CH或氮原子,优选表示CH。X111、X112及X113表示CH时,氢原子可脱落而键合有取代基R117。通式(2)优选以下述通式(2-1)或(2-2)表示,更优选以通式(2-2)表示。[化学式13]通式(2-1)中,R112a、R112b、R114a及R114b分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R115、R116、R117、R118及R119分别独立地表示取代基,X111、X112及X113分别独立地表示CH或氮原子。其中,X111~X113的各个组中的氮原子的数量为0~2。n111及n112分别独立地表示0~4的整数,n113表示0~5的整数,n116及n117分别独立地表示0~3的整数。通式(2-1)中的氢原子可脱落而键合有取代基。n111、n112、n113、n116及n117分别表示2以上的整数时,多个R115、R116、R117、R118及R119可相同,也可不同。通式(2-1)在化合物中具有抗衡阴离子。通式(2-1)中,R112a、R112b、R114a及R114b的具体例及优选范围与通式(2)中的R112及R114相同。通式(2-1)中,R115、R116、R117、R118、R119的具体例及优选范围与通式(2)中的R115、R116、R117、R118、R119相同。通式(2-1)中,X111、X112、X113、n111、n112及n113的优选范围与通式(2)中的X111、X112、X113、n111、n112及n113相同。n116及n117优选表示0~2。[化学式14]通式(2-2)中,R112a、R112b、R114a、R114b、R105及R106分别独立地表示卤原子、烷基、氰基、硝基、烷氧基、酰氧基、氨基甲酰氧基、烷氧基羰氧基、氨基、酰氨基、氨基羰基氨基、烷氧基羰基氨基、氨磺酰氨基、烷基磺酰基氨基、烷硫基、氨磺酰基、烷基亚磺酰基、烷基磺酰基、酰基、烷氧羰基、氨甲酰基、酰亚胺基或磺基。R115、R116、R117a、R118及R119分别独立地表示取代基,X111、X112及X113分别独立地表示CH或氮原子。其中,X111~X113的各个组中的氮原子的数量为0~2。n111及n112分别独立地表示0~4的整数,n116、n117及n118分别独立地表示0~3的整数。通式(2-2)中的氢原子可脱落而键合有取代基。n111、n112、n116、n117及n118分别表示2以上的整数时,多个R115、R116、R118、R119及R117a可相同,也可不同。通式(2-2)在化合物中具有抗衡阴离子。通式(2-2)中,R112a、R112b、R114a及R114b的具体例及优选范围与通式(2)中的R112及R114相同。通式(2-2)中,R115、R116、R117a、R118、R119的具体例及优选范围与通式(2)中的R115、R116、R117、R118、R119相同。通式(2-2)中,X111、X112、X113、n111及n112的优选范围与通式(2)中的X111、X112、X113、n111及n112相同。n116及n117优选表示0~2。n118优选表示0~1。接着,对以通式(3)表示的化合物进行说明。[化学式15]通式(3)中,L121、L122、L123、L124及L125分别独立地表示2价的连结基团,T121、T122、T123、T124及T125分别独立地表示氢原子或以下述通式(T-1)~(T-8)的任一个表示的基团。其中,T121、T122、T123、T124及T125中的至少1个表示以通式(T-1)~(T-8)的任一个表示的基团。R121、R122及R123分别独立地表示取代基,X121、X122及X123分别独立地表示CH或氮原子。其中,X121~X123的各个组中的氮原子的数量为0~2。n121及n122分别独立地表示0~4的整数,n123表示0~5的整数。n124、n125、n126、n127及n128分别独立地表示0~1的整数。n121、n122及n123分别表示2以上的整数时,多个R121、R122及R123可相同,也可不同。R121与R122可键合而形成环。通式(3)在化合物中具有抗衡阴离子。[化学式16]R201、R202、R204及R207分别独立地表示烷基。R205及R208分别独立地表示氢原子或烷基。R209及R210分别独立地表示氢原子、烷基或烷氧基。R203、R206、R211、R213及R217分别独立地表示取代基。L201表示p103价的连结基团。R214表示氢原子、氧自由基(-O·)、羟基、烷基或烷氧基。R215及R216分别独立地表示烷基。R215及R216可相互键合而形成环。R218及R219分别独立地表示氢原子、烷基、芳基或杂环基。X202表示氧原子或氮原子。X203表示碳原子或氮原子。R212表示芳基、杂环基或与X202连结而形成芳基或者杂环基的基团。Ar201表示芳基或杂环基。p101表示0~3,p102及p104分别独立地表示0~2,p103表示2或3,p106表示1~3。p105及p107分别独立地表示0~4。p108表示2~3。X201表示氧原子或NR220,R220表示氢原子或烷基。其中,X201表示NH时,R209及R210的至少一个表示烷基或烷氧基。p101、p102、p104、p105及p107分别表示2以上的数时,多个R203、R206、R211、R213及R217可相同,也可不同。另外,以通式(T-1)~(T-8)的任一个表示的基团中,各个式中的任一个氢原子脱落而与连结基团键合。其中,示出*的氢原子不会脱落来连结。通式(T-6)中的R214为氢原子时,不会脱落来连结。通式(3)或通式(T-1)~(T-8)中的氢原子可脱落而键合有取代基。其中,示出*的氢原子不会脱落来键合有取代基。作为L121、L122、L123、L124及L125表示2价的连结基团时的2价的连结基团,具体而言,可举出亚烷基、亚芳基、杂芳基、醚键、氨基、硫醚键、羰基、磺酰基及组合这些的至少2个的2价的连结基团。这些连结基团可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。T121、T122、T123、T124及T125中,优选任意1~4个为以通式(T-1)~(T-8)的任一个表示的基团,更优选任意1~3个为以通式(T-1)~(T-8)的任一个表示的基团,进一步优选任意1~2个为以通式(T-1)~(T-8)的任一个表示的基团。以通式(T-1)~(T-8)的任一个表示的基团越多,越有可获得耐光性、耐氯性的倾向。作为R121、R122及R123所表示的取代基,可举出选自上述取代基组A的取代基,优选为烷基、磺基、可具有取代基的氨磺酰基、卤原子、可具有取代基的烷氧基、可具有取代基的芳氧基、可具有取代基的杂环氧基、可具有取代基的酰氧基、可具有取代基的烷基氨基或可具有取代基的芳基氨基、可具有取代基的杂环氨基、可具有取代基的酰氨基、可具有取代基的氨基羰基氨基、可具有取代基的烷氧基羰基氨基、可具有取代基的芳氧基羰基氨基、可具有取代基的烷基或芳基磺酰基氨基。优选为烷基、磺基、可具有取代基的烷基氨基或可具有取代基的芳基氨基。n121及n122优选表示0~2。n123优选表示0~3。X121、X122及X123分别独立地表示CH或氮原子,优选表示CH。X121、X122及X123表示CH时,氢原子可脱落而键合有取代基,作为取代基,可举出-(L125)n128-T125或R123。通式(T-1)~(T-3)中,R201、R202、R204、R205、R207及R208表示烷基时,烷基可具有取代基。R209及R210表示烷基或烷氧基时,它们可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。X201表示氧原子或NR220,R220表示氢原子或可具有取代基的烷基。作为R220的烷基,优选为碳原子数1~6的烷基,更优选为碳原子数1~4的烷基,具体而言可举出甲基、乙基、丙基等。作为R201、R202、R204、R205、R209及R210的烷基,优选为碳原子数1~6的烷基,更优选为碳原子数1~4的烷基,进一步优选为甲基、乙基、异丙基、叔丁基。其中,X201为NH时,R209及R210的至少一个表示烷基或烷氧基。作为R207及R208的烷基,优选为碳原子数1~10的烷基,更优选为碳原子数1~6的烷基,进一步优选为甲基、乙基、丙基、丁基、异丁基、己基。作为R209及R210的烷氧基,优选为碳原子数1~6的烷氧基,更优选为碳原子数1~3的烷氧基,进一步优选为甲氧基、乙氧基。作为L201的2价的连结基团,与L121、L122、L123、L124及L125相同。作为3价的连结基团,可举出三嗪连结基团、三聚氰酸连结基团。L201优选表示2价的连结基团。作为R203、R206及R211所表示的取代基,可举出选自上述取代基组A的取代基。p101表示0~3,优选表示0~1。p102及p104表示0~2,优选表示0~1。以下示出通式(T-1)及(T-3)连结时的优选形态。表示经由*与连结基团键合。[化学式17]通式(T-4)中,R212的芳基、杂环基、与X202连结而形成的芳基或杂环基可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。R212优选表示芳基。作为R212的芳基,可举出苯基、萘基,优选为苯基。R212还优选与X202连结而形成杂环基。作为所形成的环的例子,可举出苯并三唑环、三唑环、三嗪环、嘧啶环。作为R213的取代基,可举出选自取代基组A的取代基。p105表示0~4,优选表示0~2。通式(T-4)优选以下述通式(T-41)、(T-42)或(T-43)表示。[化学式18]R401、R402、R403、R404及R405分别独立地表示取代基。R406及R407分别独立地表示芳基或杂环基。p401、p403、p404及p405分别独立地表示0~4,p402表示0~5。p401、p402、p403、p404及p405分别表示2以上的数时,多个R401、R402、R403、R404及R405可相同,也可不同。R401、R402、R403、R404及R405分别独立地表示取代基。作为取代基,可举出选自上述取代基组A的取代基。R406及R407分别独立地表示芳基或杂环基。R406及R407优选为苯基。p401、p403、p404及p405优选表示0~2。p402优选表示0~2。以下示出通式(T-4)连结时的优选形态。[化学式19]R406a及R407a分别独立地表示取代基。R406a及R407a的优选范围与R405相同。p406及p407分别独立地表示0~5。p406及p407分别表示2以上的数时,多个R406a及R407a可相同,也可不同。通式(T-5)中,以Ar201表示的芳基或杂环基可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。Ar201优选表示芳基。作为Ar201的芳基,可举出苯基、萘基,优选为苯基。p106表示1~3,优选表示1~2。以下示出通式(T-5)连结时的优选形态。[化学式20]通式(T-6)中,R214的烷基、烷氧基及R215的烷基可具有取代基。作为各基具有取代基时的取代基,可举出选自上述取代基组A的取代基。R214优选为氢原子、烷基。作为R214的烷基,优选为碳原子数1~6的烷基,更优选碳原子数1~4,进一步优选甲基、乙基、丙基、丁基。作为R215及R216的烷基,优选为分支状的烷基,更优选为碳原子数1~10的2级烷基或碳原子数1~10的3级烷基。2级烷基具体而言可举出异丙基、仲丁基、环己基等。3级烷基具体而言可举出叔丁基、叔戊基等。R215及R216可相互键合而形成环。形成环时,所形成的环的碳原子数优选为2~20,更优选为2~10。作为所形成环的例子,可举出氮丙啶环、哌啶环、吡咯烷环等。其中,优选R215及R216表示3级烷基,且R215及R216相互键合而形成哌啶环的形态。通式(T-6)优选以下述通式(T-61)表示。[化学式21]以下示出通式(T-6)连结时的优选形态。[化学式22]通式(T-7)中,作为R217的取代基,可举出选自上述取代基组A的取代基。p107表示0~4,优选表示0~2。p108表示2~3。通式(T-8)中,R218及R219的烷基、芳基、杂环基可具有取代基。R218及R219优选表示氢原子、烷基或芳基。作为R218及R219的烷基,优选为碳原子数1~6的烷基,更优选碳原子数1~4,进一步优选为甲基、乙基、丙基、丁基。作为R218及R219的芳基,可举出苯基、萘基,优选为苯基。以下示出通式(T-8)连结时的优选形态。[化学式23]优选T121、T122、T123、T124及T125中的至少1个表示以通式(T-1)、(T-3)、(T-4)、(T-5)或(T-6)表示的基团。以通式(1)~(3)的任一个表示的化合物优选具有至少1个磺基。优选以通式(1)~(3)的任一个表示的化合物所具有的阳离子的反盐(countersalt)为存在于分子内的磺基。以下,示出以通式(1)~(3)的任一个表示的染料化合物的具体例。其中,本发明中,并不限定于这些具体例。iPr表示异丙基,Ac表示乙酰基。[化学式24][化学式25][化学式26][化学式27][化学式28][化学式29][化学式30][化学式31][化学式32][化学式33][化学式34][化学式35][化学式36][化学式37][化学式38][化学式39][化学式40][化学式41][化学式42]〔合成方法〕对以通式(1)~(3)的任一个表示的化合物的合成方法进行说明。能够依据以往公知的三芳基甲烷染料的合成法合成。例如,使2当量的苯胺衍生物与1当量的苯甲醛衍生物进行缩合反应,之后进行氧化,由此可获得通式(1)~(2)的化合物。关于以通式(3)表示的化合物,可使预先导入取代基的苯胺衍生物和/或苯甲醛衍生物缩合来同样地合成,也可通过公知的合成法合成三芳基甲烷化合物之后,通过加成反应等导入取代基。后者的情况可使用市售的三芳基甲烷化合物。以通式(1)~(3)表示的化合物的制造方法能够通过公知的制造方法合成,因此并不限定于上述方法。以通式(1)表示的化合物的一般的合成方法[化学式43]以通式(2)表示的化合物的一般的合成方法[化学式44]〔着色组合物〕本发明的着色组合物至少含有以上述通式(1)~(3)的任一个表示的化合物。本发明的着色组合物可含有以通式(1)~(3)表示的化合物中的任一个,也可含有多个。并且,以各个通式表示的化合物可仅使用1种,也可组合2种以上来使用。本发明的着色组合物中,作为着色剤,可以是仅含有以通式(1)~(3)表示的化合物的着色剂,也可在无损本发明的效果的范围内进一步含有其他着色剤。作为可同时使用的着色剤,可举出公知的着色剂,例如可举出染色笔记本(shikisenshaCO.,LTD.发行的第24版,以下相同)33页~121页的染料、124页~130页的颜料等。着色组合物中的以通式(1)~(3)表示的化合物的含量优选为1~20质量%,更优选为1~10质量%。通过将着色组合物中包含的以通式(1)~(3)表示的化合物的含量设为1质量%以上,能够使印刷时的记录介质上的油墨的印刷浓度良好,且能够确保所需要的图像浓度。并且,通过将着色组合物中包含的以通式(1)~(3)表示的化合物的总计量设为20质量%以下,利用喷墨方法时,能够使着色组合物的吐出性良好,而且可获得喷墨喷嘴不易堵塞等效果。本发明中的着色组合物除了以通式(1)~(3)的任一个表示的化合物以外,通常还含有溶剂。溶剂的种类或数量根据以通式(1)~(3)的任一个表示的化合物的种类、染色的浓度和染色方法而不同,优选相对于着色组合物的总量,含有40质量%以上的溶剂。作为溶剂,优选含有水,优选相对于溶剂总量,含有50质量%以上的水。并且,优选相对于着色组合物的总量,含有30质量%以上的水。作为用于印刷本发明的着色组合物的记录介质,除了各种布帛以外,还有纸、涂布有油墨收容层等的涂布纸、塑料膜等,而且正在开发适于对各种记录介质进行喷墨记录的油墨。本发明的着色组合物能够使用于用于对布帛进行染色或印花的着色组合物、对纸进行印刷的喷墨记录用油墨、彩色调色剂、滤色器用抗蚀剂等,尤其适合作为用于对布帛进行染色或印花的着色组合物。〔染色或印花用着色组合物及染色或印花方法〕本发明的染色或印花用着色组合物只要是用于对纤维进行染色的着色组合物,则使用方式并无限定。纤维的染色法大致分为浸染法与印花法。浸染是指在将染料溶解或分散于溶剂的染料液中浸渍被染布或被染纱线,使其均匀地吸附于纤维表面,将染料扩散于纤维内部,并通过键合进行染色的工序。印花是指将染料或颜料涂布于被染布上来赋予花纹的形状,通过使染料、颜料染色或固定来制作具有花纹的染色物的染色法,利用单色或多色在被染布上显现花纹效果。产业上进行使用版的网版印花、辊式印花、使用转印纸的转印印花、无制版的喷墨印花。〔〔浸染用着色组合物及利用该浸染用着色组合物的方法〕〕浸染由在染料液中浸渍布帛或纱线来使染料染色的工序、冲洗未染色于纤维的未固定的染料的清洗工序及干燥工序构成。在浸染中使用本发明的着色组合物时,上述着色组合物用作能够浸染布帛或纱线的染色液。此时,作为染色液,除了染料以外,还能够含有溶剂、均染助剂、pH调整剂、无机中性盐、分散剂等。作为溶剂,通常使用水。作为均染助剂等添加剂,可使用公知的添加剂,例如可举出染色笔记本134页~145页中记载的湿润剂、渗透剂、染色笔记本147页~154页记载的金属离子密封剂、染色笔记本216页~222页记载的分散剂、染色笔记本230页~255页记载的均染剂、染色笔记本285页~286页记载的防染剂、染色笔记本279页~284页记载的迁移抑制剂、染色笔记本304页~321页记载的染料固定剂、染色牢度提高剂、染色笔记本322页~334页记载的pH调整剂等。为了以高浓度均匀地将染料进行染色,除了使用添加剂以外,还能够通过控制染料浓度、染浴pH、盐浓度、染色温度、染色时间、压力、液流来进行调整。清洗工序中,通常使用常温至100℃的范围的水或温水。清洗水可含有皂洗剂。通过未固定的色材被完全去除,可在各种耐水性例如洗涤坚牢性、耐汗坚牢性等中获得良好的结果。干燥工序中,具体而言,将已清洗的布帛拧干或脱水之后,晾干或使用干燥机、加热辊、熨斗等来使其干燥。〔〔网版印花、辊式印花、转印印花用着色组合物及使用该组合物的印花方法〕〕将本发明的着色组合物用于网版印花、辊式印花或转印印花时,上述着色组合物用作经由版或转印纸印花于布帛的色浆。本发明的印花方法至少包含以下的下述(1)~(4)的工序。(1)对至少包含高分子化合物及水的液体,添加本发明的染色或印花用着色组合物来制备色浆的工序(2)将上述(1)的色浆印染于布帛的工序(3)对已印染的布帛吹送蒸汽的工序(4)对已印染的布帛进行水洗、干燥的工序色浆中要求满足适于印染于版的印染适性与染色、水洗处理等印花物中需要的印花适性。因此,为了赋予印染适性、印花适性,色浆除了染料以外,还能够含有浆剂、溶剂、染色助剂等。作为浆剂,可使用成为着色组合物的介质的水溶性高分子。作为水溶性高分子,可举出淀粉类、海藻类、天然胶类、纤维素衍生物、海藻酸钠、蛋白质物质、单宁类物质、木质素类物质等公知的天然水溶性高分子。并且,还可将聚乙烯醇系化合物、聚环氧乙烷系化合物、丙烯酸系水性高分子、苯乙烯系水性高分子、马来酸酐系水性高分子等公知的合成高分子用作浆剂。例如,可举出染色笔记本349页~361页记载的印花用浆剂等。并且,还能够同时使用染色笔记本367页~369页记载的印花浆改性剂。还可混合2种以上的浆料来使用。作为溶剂,优选使用水溶性溶剂,最优选使用至少包含水的溶剂。作为染色助剂,可举出酸或碱等显色剂、染料溶解剂、湿润剂、吸湿剂、浓缩染剂、还原抑制剂、金属离子密封剂、紫外线吸收剂、分散剂、防染剂、拔染剂、防腐剂、防霉剂、抗氧化剂、迁移抑制剂、染料固定剂、消泡剂等。作为染色助剂,可使用公知的助剂,例如可举出染色笔记本336页~338页中记载的溶解剂、可溶化剂、染色笔记本339页~345页中记载的浓缩染剂、均染剂、渗透剂、染色笔记本346页~348页记载的消泡剂、染色笔记本147页~154页记载的金属离子密封剂、染色笔记本216页~222页记载的分散剂、染色笔记本370页~374页记载的防染剂、染色笔记本375页~381页记载的拔染剂、染色笔记本362页~363页记载的防腐剂、防霉剂、染色笔记本279页~284页记载的迁移抑制剂、染色笔记本426页~429页记载的染料固定剂、日本特开平6-166969公报记载的湿润牢度提高剂、US5336443记载的光牢度提高剂等。在将浆料溶解或分散于溶剂的浆溶液中添加染色助剂,对此添加将染料溶解或分散于溶剂的染料液并搅拌来制备色浆(制备色浆的工序)。印花方法中,与浸染方法不同,进行在布帛印染上述色浆(将色浆印染于布帛的工序)之后,将印染于布帛的色材染色于纤维的处理。将此称作显色工序,有利用加热空气的方法、利用常压饱和蒸汽、过热蒸汽的方法,优选使用常压饱和蒸汽的方法。本发明中,进行对已印染的布帛吹送蒸汽的工序。对已印染的布帛吹送蒸汽的工序中,用蒸汽处理的温度、时间根据着色组合物的种类和布帛的种类而不同,但温度优选为90℃~140℃,更优选为100℃~108℃。时间优选为1~60分钟,更优选为1~30分钟。在对已印染的布帛吹送蒸汽的工序之后,经过与浸染相同的清洗工序、干燥工序,获得印花物。优选上述布帛包含聚酰胺。〔〔喷墨印花用着色组合物及利用该组合物的方法〕〕将本发明的着色组合物用于喷墨印花时,上述着色用组合物用作喷墨印花用油墨。喷墨印花方法与现有的印花方法相比,具有能够迅速形成层次优异的图像的优点,具备缩短交期、对应少量多品种生产、无需制版工序等优点。而且,由于仅使用作为形成图像所需的量的油墨,因此可以说是与现有方法相比还具有废液较少等环境上的优点的优异的图像形成方法。若喷墨用油墨因来自喷嘴前端的水或水性有机溶剂等的蒸发而高粘度化或者析出固态物染料,则会堵塞喷墨头的喷嘴,因此要求比以往的印花更高显色的油墨。并且,还要求赋予油墨保存稳定性、吐出稳定性等的油墨适性、防渗色、防污染等印染适性、耐光性、耐水性、耐氯性等图像牢度。本发明的喷墨印花方法包含下述(11)~(14)的工序。(11)对布帛赋予至少包含高分子化合物及水的浆料的工序(12)通过喷墨法将本发明的喷墨用油墨印染于布帛的工序(13)对已印染的布帛吹送蒸汽的工序(14)对已印染的布帛进行水洗、干燥的工序喷墨印花方法中,若使用在现有的印花方法中使用的色浆,则会堵塞喷嘴,因此需要进行预先对布帛赋予浆料的预处理工序(对布帛赋予至少包含高分子化合物及水的浆料的工序)。通过实施预处理工序,布帛的操作也变得容易。具体而言,将含有浆剂、溶剂及水溶助长剂的浆溶液附着于布帛并进行干燥,由此可获得已进行预处理的布帛。优选布帛包含聚酰胺。作为浆剂,可使用与在网版印花等中使用的浆剂相同的浆剂。作为溶剂,优选使用水溶性溶剂,最优选使用至少包含水的溶剂。被赋予有油墨组合物的布帛在蒸汽下被加热时,水溶助长剂通常发挥提高图像的成色浓度的作用。例如,通常使用脲、烷基脲、亚乙基脲、丙烯基脲、硫基脲、胍酸盐、卤化四烷基铵等。并且,还能够使用公知的助剂,可举出染色笔记本426页~429页记载的染料固定剂等。水溶助长剂相对于浆溶液总固体成分的含量优选为0.01质量%~20质量%。浆溶液可根据需要还含有pH调整剂、水性(水溶性)金属盐、防水剂、表面活性剂、迁移抑制剂、微孔形成剂等。作为这些添加剂,可使用公知的添加剂,例如可举出染色笔记本336页~338页中记载的溶解剂、可溶化剂、染色笔记本339页~345页中记载的浓缩染剂、均染剂、渗透剂、染色笔记本147页~154页记载的金属离子密封剂、染色笔记本370页~374页记载的防染剂、染色笔记本375页~381页记载的拔染剂、染色笔记本362页~363页记载的防腐剂、防霉剂、染色笔记本279页~284页记载的迁移抑制剂、日本特开平7-316991公报记载的微孔形成剂、日本特开平6-166969公报记载的湿润牢度提高剂、US5336443记载的光牢度提高剂等。并且,还能够使用日本特开2013-209786号公报的段落[0096]~[0101]记载的添加剂。预处理中,优选以轧液率5%~150%、优选以10%~130%的范围对浆溶液进行浸轧。预处理中,使布帛中含有上述各浆溶液的方法并无特别限制,可举出通常进行的浸漬法、垫法、涂布法、网版法、喷涂法、转印法、喷墨法等。接着,对已进行预处理的布帛,利用喷墨印花用油墨进行印染。喷墨印花用油墨可通过在亲油性介质或水性介质中溶解和/或分散上述本发明的以通式(1)~(3)表示的化合物(也可以是混合物)来制作。优选为使用水性介质的油墨。因此,为了赋予油墨适性、印花适性、图像坚牢性,喷墨印花油墨可除了染料以外,还含有溶剂、表面活性剂。作为溶剂,根据所使用的通式(1)~(3)中的取代基的种类、为了制造着色组合物而使用的溶剂成分的种类及所染色的布帛的种类等而确定,优选使用水性介质,更优选使用水或水溶性有机溶剂。作为溶剂,可通过使用亲油性溶剂或水溶性溶剂,在这些溶剂中溶解和/或分散以上述通式(1)~(3)表示的化合物来制作。本发明的油墨组合物可含有的有机溶剂优选为水性有机溶剂,例如可举出二甘醇、丙三醇等多元醇类,除此以外还可举出胺类、一元醇类、多元醇的烷基醚类等。并且,优选日本特开2002-371079号公报的段落[0076]中记载的作为水混溶性有机溶剂的例示而举出的各化合物。本发明的油墨组合物中的有机溶剂的含量相对于喷墨用油墨组合物的总质量,优选为10质量%以上60质量%以下。作为表面活性剂,还能够使用阳离子性、阴离子性、两性、非离子性中的任意的表面活性剂。作为阳离子性表面活性剂,例如可举出脂肪族胺盐、脂肪族4级铵盐等。作为阴离子性表面活性剂,例如可举出脂肪酸皂、N-酰基-N-甲基甘氨酸盐等。作为两性表面活性剂,例如可举出羧基甜菜碱型、磺基甜菜碱型、氨基羧酸盐、甜菜碱等。作为非离子性表面活性剂,例如可举出聚氧乙烯烷基醚、乙炔二醇、炔醇等。优选使用日本特开2002-371079号公报的段落[0073]中记载的作为表面张力调整剂的例示而举出的表面活性剂、日本特开2008-266466、日本特开平11-2693929公报记载的表面活性剂。并且,本发明的喷墨用油墨可根据需要,在无损本发明的效果的范围内含有其他添加剂。作为其他添加剂,例如可举出干燥防止剂(湿润剂)、褪色防止剂、乳化稳定剂、渗透促进剂、紫外线吸收剂、红外线吸收剂、防腐剂、防霉剂、pH调整剂、表面张力调整剂、消泡剂、粘度调整剂、分散剂、分散稳定剂、防锈剂、螯合剂、还原抑制剂、抗氧化剂、抗静电剂、荧光增白剂等公知的添加剂。这些各种添加剂为水溶性油墨时,直接添加于油墨液。以分散物形态使用油溶性染料时,通常在制备染料分散物之后添加于分散物,但也可以在制备时添加于油相或水相。将油溶性染料设为分散物形态时,可使用分散剂,作为分散剂,例如可使用染色笔记本216页~222页记载的分散剂。干燥防止剂、褪色防止剂、紫外线吸收剂、防霉剂、pH调整剂、表面张力调整剂、消泡剂、螯合剂可适用日本特开2014-5462公报〔0224〕~〔0231〕记载的添加剂。并且,还能够含有日本特开平6-166969公报记载的湿润牢度提高剂、US5336443记载的光牢度提高剂。渗透促进剂优选为了使喷墨用油墨更良好地渗透、固定于纤维内部而使用。作为渗透促进剂,可使用公知的渗透促进剂,例如可使用染色笔记本223页~255页中记载的湿润剂、渗透剂、均染剂、缓染剂、乙醇、异丙醇、丁醇,二(三)乙二醇单丁醚、1,2-己二醇等醇类和十二烷基硫酸钠、油酸钠、非离子性表面活性剂和WO10/109867、日本特开平6-57644记载的分支多元醇等。油墨中含有5~35质量%的这些时,通常有效,优选在不会引起染色后的渗色、油墨的背面泄漏的添加量的范围内使用。使本发明的化合物分散于水性介质时,能够通过日本特开2014-5462公报〔0232〕~〔0233〕记载的方法分散。本发明中,着色组合物中包含的以通式(1)~(3)表示的化合物的含量根据所使用的通式(1)~(3)中的取代基的种类及为了制造着色组合物而使用的溶剂成分的种类等而确定,着色组合物中的以通式(1)~(3)表示的化合物的含量相对于着色组合物的总质量,优选包含1~20质量%,更优选包含1~10质量%。本发明的喷墨记录用油墨的粘度优选为30mPa·s以下。并且,其表面张力优选为25mN/m以上且70mN/m以下。粘度及表面张力能够通过添加各种添加剂来调整,例如粘度调整剂、表面张力调整剂、比电阻调整剂、皮膜调整剂、紫外线吸收剂、抗氧化剂、褪色防止剂、防霉剂、防锈剂、分散剂及表面活性剂。本发明的喷墨用油墨不仅能够用于形成单色的图像,还能够用于形成全彩的图像。为了形成全彩图像,能够使用品红色调油墨、青色调油墨及黄色调油墨,并且为了调整色调,可进一步使用黑色调油墨。作为能够适用的染料,可举出日本特开2014-5462公报〔0237〕~〔0240〕记载的染料。通过喷墨方法印染的布帛在干燥之后,与其他印花方法相同地经过显色工序、清洗工序、干燥工序,从而获得印花物。显色工序~干燥工序的优选方法与网版印花等相同。本发明中使用的布帛可根据需要使用预先进行处理的布帛。在喷墨印花方法中,可在将浆剂附着于布帛之前进行处理,也可在之后进行处理。并且,可在染色之前对所附着的浆溶液添加预处理剂来使用。具体而言,可举出日本特开2002-339268、日本特开2000-54277、日本特开平7-150482、日本特开2008-174865、日本特开2012-154006、日本特开2012-12730、日本特开平2-68372、特公昭63-31594、日本特开2002-275769、日本特开2001-81680、日本特开2004-68208、日本特开平11-43873、日本特开2007-217829、日本特开2006-83495、日本特开2005-154936、日本特开2002-105875、日本特开2002-348786、日本特开平11-81163、日本特开平2-61183、日本特开2001-295186、日本特开2004-60073、日本特开2003-113583、日本特开平8-100379、日本特开平2-53976、日本特开2000-226781、日本特开2004-292989、日本特开2002-249991、日本特开2002-363872、日本特开平6-341070、日本特开2004-197237、日本特开2008-223192、日本特开2011-179130公报记载的预处理方法等。本发明的已染色的布帛可根据需要进行日本特开昭62-257464公报等中记载的阻燃处理、日本特开平2-47378公报等中记载的等离子体处理、日本特开昭60-94678、日本特开2002-266236、日本特开2007-321247、日本特开平3-287873、日本特开2004-131919公报等中记载的耐光性或耐湿润性、耐氯性等牢度改良处理。这些处理可在染色之前进行,也可在染色之后进行。作为喷墨印花本发明的油墨的方法,只要包含利用喷墨装置对布帛吐出油墨的工序,则并无限定。例如,在日本特开平9-296379、日本特开平11-43873、日本特开平7-70953、日本特开平7-197384、日本特开平7-70950、日本特开平3-104977、日本特开2007-303046、日本特开2007-313717、日本特开2008-248437等中已知有喷墨印花的方法。并且,作为喷墨印花时使用的装置,能够使用任意的喷墨装置。例如,已知有日本特开平3-45774、日本特开2001-277656、日本特开2000-290882、日本特开2001-18390、日本特开2010-83040、日本特开2011-31418等。〔着色组合物的形态与所染色的布帛〕本发明的以上述通式(1)~(3)表示的化合物为了作为染料对布帛进行染色或印花而使用。能够通过改变以通式(1)~(3)表示的化合物的取代基的种类来准备各种染料。以通式(1)~(3)表示的化合物为至少含有1个磺基或羧基等酸性基时,能够作为酸性染料对丝绸或羊毛等蛋白纤维、6尼龙、66尼龙等聚酰胺纤维进行染色。以通式(1)~(3)表示的化合物为不溶于水的油溶性化合物时,通常能够作为分散染料对聚酯等疏水性纤维进行染色,还能够对丙烯酸纤维或聚酰胺纤维进行染色。以通式(1)~(3)表示的化合物含有至少1个氨基等碱性基时,能够作为阳离子染料对丙烯酸纤维进行染色。以通式(1)~(3)表示的化合物含有至少1个与纤维反应的基团时,能够作为反应染料对棉等纤维素纤维或聚酰胺纤维进行染色。作为与纤维反应的基团,具体而言可举出氯三嗪基、氯嘧啶基、乙烯基磺酰基、氯乙基磺酰基、硫酸基乙基磺酰基、硫代硫酸基乙基磺酰基。作为布帛,可使用由1种纤维构成的布帛,也可使用由2种以上的纤维构成的复合纤维。本发明的以通式(1)~(3)表示的化合物优选为酸性染料,尤其,对聚酰胺纤维进行染色时,具有明显高的染色性,且耐光性、耐水性、耐氯性等作为染色布帛的各种性能可得到改善。作为优选作为被染布的聚酰胺纤维,含有聚酰胺纤维即可,可以是单独由聚酰胺构成的布帛,也可以是由复合纤维构成的布帛。作为复合纤维,可举出日本特开2008-202210、日本特开2006-322131、日本特开2007-100270公报等记载的纤维。聚酰胺纤维中,优选为包含6尼龙、66尼龙的纤维。作为所使用的纤维,优选为布帛,对纱线进行染色时也可获得相同效果。[实施例]以下,示出实施例对本发明进行详细说明,但本发明并不限定于这些实施例。关于例中的“%”及“份”,除非另有指明,则为质量%及质量份。〔合成例〕(化合物1的合成)根据日本特开平8-333517公报的方法,使1当量的2,6-二甲基苯甲醛、2当量的N-(间磺基苄基)-N-乙基苯胺、2.5L/mol的甲磺酸溶解于反应底物合成的2倍量的水并进行缩合反应,用异丙醇清洗所析出的固体,从而获得了中间体A。接着,对1当量的中间体A,用3当量的硫代硫酸铵进行氧化,并用氢氧化钠进行中和,由此获得了化合物1。进行所获得的晶体的ESI-质谱测定,确认了695的峰值([M-Na]-、100%)。[化学式45](比较化合物1的合成)将2,6-二甲基苯甲醛变更为2-甲基苯甲醛,除此以外与化合物1的合成相同地合成了比较化合物1。进行所获得的晶体的ESI-质谱测定,确认了681的峰值([M-Na]-、100%)。[化学式46](化合物19的合成)与化合物1的合成相同,使1当量的磺基苯甲醛钠、2当量的N-(2,4,6-三甲基苯基)苯胺、2.5L/mol的甲磺酸溶解于反应底物合成的2倍量的水并进行缩合反应,用异丙醇清洗所析出的固体,从而获得了中间体B。接着,对1当量的中间体B,用3当量的硫代硫酸铵进行氧化,根据日本特开2014-5462公报的方法进行了氯磺基化之后,用氢氧化钠进行碱性水解以及中和,由此获得了化合物19。进行所获得的晶体的ESI-质谱测定,确认了747的峰值([M-2Na+H]-、100%)。化合物19的溶液吸收光谱:λmax=605nm(水溶液)。[化学式47](比较化合物2的合成)将N-(2,4,6-三甲基苯基)苯胺变更为二苯基苯胺,除此以外与化合物19的合成相同地合成了比较化合物2。进行所获得的晶体的ESI-质谱测定,确认了663的峰值([M-2Na+H]-、100%)。[化学式48](化合物23的合成)与化合物1的合成相同,使1当量的2,6-二甲基苯甲醛、2当量的N-(2,4,6-三甲基苯基)苯胺、2.5L/mol的甲磺酸溶解于反应底物合成的2倍量的水并进行缩合反应,用异丙醇清洗所析出的固体。接着,与化合物19的合成相同地进行氧化反应,用氯化钾进行盐交换,从而获得了化合物23。(化合物21的合成)根据日本特开2014-5462公报的方法对所获得的化合物23进行氯磺基化之后,用氢氧化钠进行碱性水解以及中和,由此合成了化合物21。进行所获得的晶体的ESI-质谱测定,确认了695的峰值([M-Na]-、100%)。[化学式49](化合物34的合成)用磷酰氯对市售的AcidBlue9进行氯磺基化,由此获得了中间体C。对1当量的中间体C,使2当量的2,4-二甲氧基苯胺在二甲基乙酰胺中反应,由此获得了中间体D。以与化合物19的合成相同的方法,使该中间体进一步进行氯磺基化,接着进行碱性水解及中和,由此获得了化合物34。进行所获得的晶体的ESI-质谱测定,确认了1177的峰值([M-2Na+H]-、100%)。[化学式50](化合物30的合成)将市售的AcidBlue7溶解于二甲基乙酰胺,加成2,4-二甲氧基苯胺,由此合成了中间体E。以与化合物19的合成相同的方法,对该中间体进行氯磺基化,接着进行碱性水解及中和,由此获得了化合物30。进行所获得的晶体的ESI-质谱测定,确认了978的峰值([M-3Na+2H]-、100%)。[化学式51](化合物29的合成)将2,4-二甲氧基苯胺变更为4-氨基-2,6-二叔丁基酚,除此以外,以与化合物30相同的方法获得了化合物29。进行所获得的晶体的ESI-质谱测定,确认了966的峰值([M-2Na+H]-、100%)。[化学式52](化合物32的合成)用磷酰氯对市售的AcidBlue7进行氯磺基化,由此合成了中间体F。对于中间体F,使1当量的甘氨酸在二甲基醛中反应,接着,滴加1.2当量的亚硫酰氯,缓慢升温至23℃并搅拌。确认到反应结束之后,滴加将2,4-二羟基二苯甲酮溶解于二甲基乙酰胺的溶液,之后,同样滴加三乙基胺。在90℃下搅拌反应液,确认到反应结束之后,用乙酸乙酯进行提取,并用氢氧化钠进行碱性水解以及中和,由此获得了化合物32。进行所获得的晶体的ESI-质谱测定,确认了1080的峰值([M-2Na+H]-、100%)。[化学式53](化合物37的合成)根据日本特开平8-333517公报的方法,使1当量的2,4-二磺基苯甲醛、2当量的N-(对硝基苄基)-N-乙基苯胺、2.5L/mol的甲磺酸溶解于反应底物合成的2倍量的水并进行缩合反应,用异丙醇清洗所析出的固体,从而获得了中间体G。接着,对1当量的中间体G,用3当量的硫代硫酸铵进行氧化,并用氢氧化钠进行中和,由此获得了化合物37。进行所获得的晶体的ESI-质谱测定,确认了757的峰值([M-Na]-、100%)。[化学式54](化合物31的合成)将2,4-二甲氧基苯胺变更为4-氨基-2,2,6,6、-四哌啶,除此以外,以与化合物30相同的方法获得了化合物31。进行所获得的晶体的ESI-质谱测定,确认了966的峰值([M-2Na+H]-、100%)。[化学式55](化合物43的合成)将2,4-二甲氧基苯胺变更为3-巯基丙磺酸钠,除此以外,以与化合物30相同的方法获得了化合物43。进行所获得的晶体的ESI-质谱测定,确认了901的峰值([M-3Na+2H]-、100%)。[化学式56](化合物44的合成)根据日本特开2014-5462公报的方法,对市售的AcidBlue9进行氯磺基化之后,加成2当量的2-氨基-4,6-二氯嘧啶,进一步加成2当量的2,5-二甲氧基苯胺来合成了中间体J。进一步进行氯磺基化,用氢氧化钠进行碱性水解以及中和,由此获得了化合物44。进行所获得的晶体的ESI-质谱测定,确认了1431的峰值([M-2Na+H]-、100%)。[化学式57](化合物20的合成例)[化学式58]将2,4,6-三甲基苯胺30g、溴苯34g、叔丁氧羰基钠39g、甲苯200mL添加到烧瓶,在氮气流下充分搅拌。对其添加乙酸钯210mg、三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4)45mg,将反应液升温至110℃并搅拌6小时。冷却所获得的反应液之后注入到水中,并用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,在浓缩之后用硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了21g的中间体20C。将16g的中间体20C、12g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸80mL放入烧瓶,在100℃下搅拌6小时。将所获得的反应液注入到500mL的冰水中,滤取所获得的中间体20B的晶体(20g)。混合9g的中间体20B、3.4g的氯醌、甲醇200mL,在50℃表搅拌3天。滤取恢复到室温而获得的晶体,由此获得了7g的中间体20A。将5g的中间体20A添加到硫酸20mL,冷却的同时进行搅拌。以内温不超过5℃的方式,经4小时对其滴加25%发烟硫酸25mL。滤取将反应液注入到冰200g中来析出的晶体。将晶体溶解于甲醇,并用乙酸钠进行中和之后,用柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了1g的化合物20。化合物20的溶液吸收光谱:λmax=612nm(水溶液)。(化合物51的合成例)[化学式59]将5g的中间体20A添加到硫酸25mL,并在50℃下搅拌4小时。滤取将反应液注入到冰80g中来析出的晶体。将晶体溶解于甲醇,并用乙酸钠进行中和之后,用柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了2g的化合物51。化合物51的溶液吸收光谱:λmax=613nm(水溶液)。(化合物56的合成例)[化学式60]以与中间体20C的合成法相同的方法,将溴苯变更为2-溴甲苯来进行反应,由此获得了中间体56C。以与中间体20B的合成法相同的方法,将中间体20C变更为中间体56C来进行反应,由此获得了中间体56B。以与中间体20A的合成法相同的方法,将中间体20B变更为中间体56B来进行反应,由此获得了中间体56A。以与化合物51的合成法相同的方法,将中间体51A变更为中间体56A来进行反应,由此获得了化合物56。化合物56的溶液吸收光谱:λmax=616nm(水溶液)。(化合物58的合成例)[化学式61]以与中间体20C的合成法相同的方法,将2,4,6-三甲基苯胺变更为2,6-二甲基苯胺来进行反应,由此获得了中间体58C。以与中间体56B的合成法相同的方法,将中间体56C变更为中间体58C,并将4-甲酰基苯-1,3-二磺酸二钠变更为磺基苯甲醛钠来进行反应,由此获得了中间体58B。以与中间体56A的合成法相同的方法,将中间体56B变更为中间体58B来进行反应,由此获得了中间体58A。以与化合物56的合成法相同的方法,将中间体56A变更为中间体58A来进行反应,由此获得了化合物58。化合物58的溶液吸收光谱:λmax=603nm(水溶液)。(化合物59的合成例)[化学式62]以与中间体20A的合成法相同的方法,将中间体20B变更为中间体B来进行反应,由此获得了中间体59A。以与化合物51的合成法相同的方法,将中间体51A变更为中间体59A来进行反应,由此获得了化合物59。化合物59的溶液吸收光谱:λmax=605nm(水溶液)。将所测定的溶液吸收光谱记载于图1。(化合物62的合成例)[化学式63]以与中间体20C的合成法相同的方法,将2,4,6-三甲基苯胺变更为2,6-二乙基-4-甲基苯胺来进行反应,由此获得了中间体62C。以与中间体58B的合成法相同的方法,将中间体58C变更为中间体62C来进行反应,由此获得了中间体62B。以与中间体56A的合成法相同的方法,将中间体56B变更为中间体62B来进行反应,由此获得了中间体62A。以与化合物56的合成法相同的方法,将中间体56A变更为中间体62A来进行反应,由此获得了化合物62。化合物62的溶液吸收光谱:λmax=607nm(水溶液)。(化合物65的合成例)[化学式64]以与中间体58B的合成法相同的方法,将中间体58C变更为中间体56C来进行反应,由此获得了中间体65B。以与中间体56A的合成法相同的方法,将中间体56B变更为中间体65B来进行反应,由此获得了中间体65A。以与化合物56的合成法相同的方法,将中间体56A变更为中间体65A来进行反应,由此获得了化合物65。化合物65的溶液吸收光谱:λmax=611nm(水溶液)。将所测定的溶液吸收光谱记载于图1。(化合物67的合成例)[化学式65]向15g的硫酸滴加15g的25wt%的发烟硫酸。用冰水冷却该溶液,并对其添加3g的中间体59A。在5℃以下搅拌3小时之后,将反应液注入到冰150g中。用50%氢氧化钠水溶液将所获得的溶液中和至pH5.5之后,用蒸发器蒸馏去除溶剂。将所获得的晶体分散于甲醇中,通过过滤去除不溶成分,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了0.8g的化合物67。化合物67的溶液吸收光谱:λmax=600nm(水溶液)。(化合物101的合成例)[化学式66]将1g的中间体20A溶解于100mL的水中,用0.1M氢氧化钠水溶液将pH调整为7.0。通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了0.8g的化合物101。化合物101的溶液吸收光谱:λmax=614nm(水溶液)。(化合物102的合成例)[化学式67]将1g的中间体56A溶解于100mL的水中,用0.1M氢氧化钠水溶液将pH调整为7.0。通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了0.7g的化合物102。化合物102的溶液吸收光谱:λmax=618nm(水溶液)。(化合物103的合成)[化学式68]将2,4,6-三甲基苯胺21g、3-溴甲苯24g、叔丁氧羰基钠14.4g、甲苯200mL添加到烧瓶中,在氮气流下充分搅拌。对其添加45mg的乙酸钯、210mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,并用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,浓缩之后通过硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了35g的中间体103A。将29g的中间体103A、10g的2-磺基苯甲醛钠、甲磺酸100mL放入烧瓶中,并在100℃下搅拌12小时。将所获得的反应液注入到600mL的冰水中,滤取所获得的晶体。将该晶体溶解于异丙醇400mL中,添加三乙基胺50mL,进行减压浓缩。对所获得的残渣添加乙腈200mL,滤取所析出的晶体,由此获得了23.5g的中间体103B。混合10g的中间体103B、4.1g的氯醌、甲醇50mL、浓盐酸2mL,在50℃下搅拌48小时。滤取所获取的晶体,由此获得了6g的中间体103C。混合5.1g的中间体103C、浓硫酸50mL,在室温下搅拌20小时。将反应液注入到200g的冰水中,滤取所析出的化合物103的粗产物。将化合物103的粗产物溶解于甲醇,用乙酸钠进行中和之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了1g的化合物103。化合物103的溶液吸收光谱:λmax=627nm、ε=68900L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):696.2(M-Na+2H)。(化合物104的合成)[化学式69]将13.2g的2,4,6-三甲基苯胺、18.7g的2-溴苯甲醚、20g的叔丁氧羰基钠、甲苯150mL添加到烧瓶中,在氮气流下充分搅拌。对其添加90mg的乙酸钯、340mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥并浓缩。向所获得的油添加甲醇50mL,接着添加水10mL,滤取所析出的晶体,由此获得了9g的中间体104A。将1.2g的中间体104A、0.6g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸8mL放入烧瓶,并在110℃下搅拌10小时。将所获得的反应液注入到120mL的乙酸乙酯中。用倾析法去除有机相,向所获得的胶状油添加乙酸乙酯50mL并搅拌,并滤取所获得的晶体,由此获得了1.2g的中间体104B。混合7.3g的中间体104B、3g的氯醌、甲醇70mL并搅拌1小时。用乙酸钠将反应液中和至pH=5之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了2g的化合物104。化合物104的溶液吸收光谱:λmax=650nm(水溶液)。ESI-质谱(Posi):728.2(M-Na+2H)。(化合物105的合成)[化学式70]将22.6g的2,4,6-三甲基-1,3-苯二胺、15.7g的溴苯、20g的叔丁氧羰基钠、甲苯200mL添加到烧瓶中,在氮气流下充分搅拌。对其添加90mg的乙酸钯、340mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌10小时。用乙酸乙酯从所获得的混合物提取有机物,通过硅胶柱色谱法进行纯化,由此获得了11.2g的中间体105A作为晶体。将9.6g的中间体105A、6.6g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸100mL放入烧瓶中,并在110℃下搅拌5小时。将所获得的反应液注入到400mL的饱和食盐水中。通过滤取所析出的晶体,获得了49g的中间体105B作为湿滤饼(含有大量食盐)。混合15g的中间体105B的湿滤饼、2g的氯醌、甲醇100mL,并在50℃下搅拌6小时。过滤所析出的晶体,将晶体添加到甲醇50mL中,添加乙酸钠来中和至pH=5。通过过滤从所获得的混合物去除固体,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了1.8g的化合物105。化合物105的溶液吸收光谱:λmax=616nm、ε=100700L·mol-1·cm-1(水溶液)。将所测定的溶液吸收光谱记载于图2。ESI-质谱(Posi):698.2(M-Na+2H)。(化合物106及化合物107的合成)[化学式71]将19.2g的3-乙酰氨基-2,4,6-三甲基苯胺、20.3g的溴苯、20g的叔丁氧羰基钠、甲苯200mL添加到烧瓶中,在氮气流下充分搅拌。对其添加90mg的乙酸钯、340mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌10小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥并浓缩。向浓缩物添加正己烷50mL,滤取所析出的晶体,由此获得了22g的中间体106A。将5.4g的中间体106A、3.1g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸50mL放入烧瓶中,并在100℃下搅拌20小时。将所获得的反应液注入到200mL的饱和食盐水中。滤取所析出的晶体,由此获得了25.4g的中间体106B(含有大量食盐)。混合23g的中间体106B(含有大量食盐)、3g的氯醌、甲醇300mL、浓盐酸2.5mL,并在室温下搅拌6小时。向反应液添加乙酸钠来中和至pH=5。通过过滤从所获得的混合物去除固体,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了0.4g的化合物106、0.3g的1个乙酰基受到水解的副产物即化合物107。化合物106的溶液吸收光谱:λmax=613nm、ε=84800L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):782.2(M-Na+2H)。化合物107的溶液吸收光谱:λmax=614nm、ε=82300L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):740.2(M-Na+2H)。(化合物108的合成)[化学式72]将65g的2,6-二乙基-4-甲基苯胺、50g的2-氯甲苯、92g的叔丁氧羰基钠、甲苯500mL添加到烧瓶中,在氮气流下充分搅拌。对其添加90mg的乙酸钯、340mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,浓缩之后通过硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了100g的中间体108A。将8g的中间体108A、5g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸50mL放入烧瓶中,并在100℃下搅拌6小时。将所获得的反应液注入到400mL的冰水中,滤取所获得的中间体108B的晶体(6g)。混合5g的中间体108B、1.7g的氯醌、丙酮80mL、甲醇80mL,并搅拌5小时。滤取所获得的晶体,由此获得了7g的化合物108的粗产物。将7g的化合物108的粗产物溶解于甲醇中,用乙酸钠中和之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了3g的化合物108。化合物108的溶液吸收光谱:λmax=620nm、ε=84700L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):752.3(M-Na+2H)。1HNMR:δ=9.08(s,2H),8.18(s,1H),7.61(d,1H),7.17(d,2H),7.11(s,2H),7.07(s,4H),6.92(d,1H),6.08(d,2H),2.41(q,8H),2.26(s,6H),2.10(s,6H),1.16(t,12H),400MHzinDMSO-d6(化合物109的合成)[化学式73]将18g的2,4,6-三甲基苯胺、25g的1-溴-2-乙基苯、31g的叔丁氧羰基钠、甲苯250mL添加到烧瓶中,在氮气流下充分搅拌。对其添加30mg的乙酸钯、115mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,浓缩之后通过硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了30g的中间体109A。将8g的中间体109A、5g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸50mL放入烧瓶中,并在100℃下搅拌6小时。将所获得的反应液注入到400mL的冰水中,滤取所获得的中间体109B的晶体(17g)。混合7g的中间体109B、2.3g的氯醌、丙酮110mL、甲醇110mL,并搅拌9小时。滤取所获得的晶体,由此获得了7g的化合物109的粗产物。将7g的化合物109的粗产物溶解于甲醇中,用乙酸钠进行中和之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了1g的化合物109。化合物109的溶液吸收光谱:λmax=620nm、ε=90800L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):724.3(M-Na+2H)。1HNMR:δ=9.14(s,2H),8.18(s,1H),7.60(d,1H),7.20(s,1H),7.17(d,2H),7.05(s,4H),6.95(s,1H),6.94(d,1H),6.09(d,2H),2.67(q,4H),2.29(s,6H),2.10(s,12H),1.20(t,6H),400MHzinDMSO-d6(化合物110的合成)[化学式74]向N-甲基吡咯烷酮50mL中添加3.0g的氢化钠(60%的油分散物)并搅拌10分钟之后,添加10.6g的中间体20C,接着添加11.2g的对甲苯磺酸甲酯,在100℃下将反应液搅拌2小时。将反应液冷却至室温并滴加于水中。用乙酸乙酯从所获得的混合物提取有机物,通过硅胶柱色谱法进行纯化,由此获得了6.7g的中间体110A作为油。混合5.2g的中间体110A、3.6g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸25mL,并在100℃下搅拌3小时。将所获得的反应液注入到120mL的饱和食盐水中,滤取所析出的晶体,由此获得了16.6g的中间体110B(包含大量食盐)。混合13.7g的中间体110B(包含大量食盐)、3.5g的氯醌、甲醇100mL,对其添加浓盐酸2mL。在室温下搅拌1天之后,添加乙酸钠直至成为pH=5。通过过滤去除不溶物,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了5g的化合物110。化合物110的溶液吸收光谱:λmax=633nm、ε=108200L·mol-1·cm-1(水溶液)。将所测定的溶液吸收光谱记载于图2。ESI-质谱(Posi):696.23(M-Na+2H)。(化合物201的合成)[化学式75]将6.0g的中间体105A溶解于240mL的丙酮并冷却至0℃之后,分批添加7.2g的3,5-二-叔丁基-4-羟基苯甲酰氯。搅拌30分钟之后,对反应液进行浓缩并进行柱色谱法,由此获得了8.5g的中间体201B。混合3.3g的中间体201B、1.4g的4-甲酰基苯-1,3-二磺酸二钠、乙酸30mL、甲磺酸2mL,并搅拌3小时。将所获得的反应液注入到120g的冰水中,滤取所析出的晶体,由此获得了6.6g的中间体201C(包含大量食盐)。向6.6g的中间体201C混合2.5g的氯醌、甲醇100mL,并在室温下搅拌3小时。向反应液添加乙酸钠来中和至pH=5。通过过滤从所获得的混合物去除固体,通过柱色谱(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了3.8g的化合物201。化合物201的水溶液中的吸收光谱:λmax=614、ε=6.32·104L·mol-1·cm-1。ESI-质谱(Posi):1142.6(M-Na+2H)。σ=10.08(s,2H),9.66(s,2H),8.18(s,1H),7.78(s,4H),10.08(s,2H),7.63(s,2H),7.48(s,2H),7.34(d,4H),7.17(s,2H),7.10(d,2H),6.97(d,2H),6.11(d,2H),2.18(s,6H),2.15(s,6H),2.01(s,6H),1.42(s,6H),400MHzinDMSO-d6(化合物202的合成)[化学式76]将11.0g的中间体105A溶解于300mL的丙酮中并冷却至0℃之后,分批添加9.0g的4-硝基苯甲酰氯。搅拌30分钟之后,对反应液进行浓缩并进行柱色谱法,由此获得了12.5g的中间体202B。混合6.6g的中间体202B、2.8g的4-甲酰基苯-1,3-二磺酸二钠、乙酸60mL、甲磺酸4mL,并混合3小时。将所获得的反应液注入到120g的冰水中,滤取所析出的晶体,由此获得了6.0g的中间体202C(包含大量食盐)。向6.0g的中间体202C添加2g的氯醌与甲醇100mL,并在0℃下搅拌6小时。过滤所析出的晶体,将晶体添加到甲醇50mL,添加乙酸钠来中和至pH=5。通过过滤从所获得的混合物去除固体,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了2.8g的化合物202。化合物202的水溶液中的吸收光谱:λmax=613nm、ε=8.12·104L·mol-1·cm-1。ESI-质谱(Posi):975.3(M-Na+2H)。σ=10.26(s,1H),10.25(s,1H),10.78(s,1H),10.75(s,1H),8.38(d,4H),8.24(d,4H),8.19(s,1H),7.64(d,1H),7.35(d,4H),7.20(s,2H),7.12(d,2H),6.98(d,1H),6.12(d,2H),2.21(s,6H),2.16(s,6H),2.03(s,6H),400MHzinDMSO-d6(化合物302的合成)[化学式77]在冰冷下搅拌13.6g的1,3-二甲基-5-甲氧基苯、19.8g的N-溴琥珀酰亚胺、乙腈100mL,进一步在室温下搅拌10小时。向所获得的反应液添加水,并用乙酸乙酯进行提取,对所收集的有机相进行浓缩,由此获得了25g的中间体302A。将18.7g的中间体302A、9.2g的苯胺、17.3g的叔丁氧羰基钠、甲苯200mL添加到烧瓶中,在氮气流下充分搅拌。对其添加45mg的乙酸钯、200mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥并浓缩,用硅胶柱色谱法对所获得的残渣进行纯化,由此获得了8.0g的中间体302B。将2.3g的中间体302B、1.6g的4-甲酰基苯-1,3-二磺酸二钠、乙酸20mL、甲磺酸0.5mL放入烧瓶中,并在室温下搅拌1小时。将所获得的反应液注入到100mL的乙腈中。滤取所析出的晶体,由此获得了中间体302C。混合所获得的中间体302C总量、1.5g的氯醌、甲醇100mL,并在室温下搅拌1小时。向反应液添加乙酸钠,中和至pH=5。通过过滤从所获得的混合物去除固体,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了0.8g的化合物302。所获得的化合物的ESI-MS(正)为701.2(M-Na+2H)。水溶液中的吸收光谱为λmax=614nm、ε=9.57·104L·mol-1·cm-1。(化合物303的合成)[化学式78]通过J.Med.Chem.,1999,43,4485中记载的方法合成了中间体303A。将4.5g的中间体303A、4.3g的溴苯、5.3g的叔丁氧羰基钠、甲苯50mL添加到烧瓶中,在氮气流下充分搅拌。对其添加45mg的乙酸钯、200mg的三叔丁基膦·四苯基硼酸酯络合物(tBu3P·HBPh4),将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥并浓缩,通过硅胶柱色谱法对所获得的残渣进行纯化,由此获得了5.5g的中间体303B。将3.1g的中间体303B、2.0g的4-甲酰基苯-1,3-二磺酸二钠、乙酸25mL、甲磺酸0.5mL放入烧瓶中,并在室温下搅拌3小时。将所获得的反应液注入到300mL的乙酸乙酯中。滤取所析出的晶体,由此获得了中间体303C。混合所获得的中间体303C总量、4.0g的氯醌、甲醇100mL,并在回流下搅拌10分钟。将反应液冷却至室温,添加乙酸钠来中和至pH=5。通过过滤从所获得的混合物去除固体,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)对所获得的溶液进行纯化,由此获得了0.2g的化合物303。所获得的化合物的ESI-MS(正)为729.2(M-Na+2H)。水溶液中的吸收光谱为λmax=613nm、ε=9.05·104L·mol-1·cm-1。(化合物401的合成)[化学式79]将9.0g的2,6-异丙基苯胺、6.3g的2-氯甲苯、11g的叔丁氧羰基钠、甲苯75mL添加到烧瓶中,在氮气流下充分搅拌。对其添加12mg的乙酸钯、43mg的1,3-双(2,6-异丙基苯基)氯化咪唑,将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,浓缩之后通过硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了12g的中间体401A。将12g的中间体401A、7g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸60mL放入烧瓶,并在60℃下搅拌6小时。将所获得的反应液注入到300mL的冰水中,滤取了所获得的中间体401B的晶体(6g)。混合5g的中间体401B、1.7g的氯醌、甲醇80mL,并搅拌5小时。滤取所获得的晶体,由此获得了5g的化合物401的粗产物。将5g的化合物401的粗产物溶解于甲醇,并用乙酸钠进行中和之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了3g的化合物401。化合物401的溶液吸收光谱:λmax=618nm、ε=71700L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):782.3(M-Na+2H)。1HNMR:δ=8.64(s,1H),7.96(d,1H),7.42~7.17(m,10H),6.18(d,2H),2.98(dt,4H),2.33(s,6H),1.20(t,12H),1.11(t,12H),400MHzinMeOH-d4(化合物402的合成)[化学式80]将24g的2,6-二甲基苯胺、25g的2-氯甲苯、42g的叔丁氧羰基钠、甲苯300mL添加到烧瓶中,在氮气流下充分搅拌。对其添加50mg的乙酸钯、170mg的1,3-双(2,6-异丙基苯基)氯化咪唑,将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,浓缩之后通过硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了40g的中间体402A。将10g的中间体402A、13g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸100mL放入烧瓶中,并在60℃下搅拌6小时。将所获得的反应液注入到300mL的冰水中,滤取了所获得的中间体402B的晶体(6g)。混合5g的中间体402B、1.7g的氯醌、甲醇80mL,并搅拌5小时。滤取所获得的晶体,由此获得了5g的化合物402的粗产物。将5g的化合物402的粗产物溶解于甲醇中,通过乙酸钠进行中和之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了3g化合物402。化合物402的溶液吸收光谱:λmax=617nm、ε=73600L·mol-1·cm-1(水溶液)。ESI-质谱(Posi):670.2(M-Na+2H)。1HNMR:δ=8.65(s,1H),7.95(d,1H),7.29(m,4H),7.20(m,7H),6.17(d,2H),2.31(s,6H),2.17(s,12H),400MHzinMeOH-d4(化合物403的合成)[化学式81]将7g的2,4,6-三甲基苯胺、10g的2-氯甲苯、11g的叔丁氧羰基钠、甲苯75mL添加到烧瓶中,在氮气流下充分搅拌。对其添加24mg的乙酸钯、85mg的1,3-双(2,6-异丙基苯基)氯化咪唑,将反应液升温至110℃并搅拌3小时。冷却所获得的反应液之后注入到水中,用乙酸乙酯进行提取。用硫酸钠对所获得的有机相进行干燥,浓缩之后通过硅胶柱色谱法(显影液:乙酸乙酯/己烷=1/20)进行纯化,由此获得了10g的中间体403A。将10g的中间体403A、13g的4-甲酰基苯-1,3-二磺酸二钠、甲磺酸100mL放入烧瓶中,并在60℃下搅拌6小时。将所获得的反应液注入到300mL的冰水中,滤取了所获得的中间体403B的晶体(6g)。混合5g的中间体403B、1.7g的氯醌、甲醇80mL,并搅拌5小时。滤取所获得的晶体,由此获得了5g的化合物403的粗产物。将5g的化合物403的粗产物溶解于甲醇中,通过乙酸钠进行中和之后,通过柱色谱法(填充剂:葡聚糖、显影液:甲醇)进行纯化,由此获得了3g的化合物403。化合物403的溶液吸收光谱:λmax=621nm、ε=xxxL·mol-1·cm-1(水溶液)。ESI-质谱(Posi):754.3(M-Na+2H)。1HNMR:δ=8.63(s,1H),7.94(d,1H),7.47(s,2H),7.18(m,3H),7.02(s,4H),6.18(s,2H),3.20(dt,2H),2.31(s,6H),2.13(s,12H),1.30(dd,12H),400MHzinMeOH-d4〔浸染评价〕将布帛即尼龙6运动衫(shikisenshaCO.,LTD.制造,对于以下的布帛,也使用了shikisenshaCO.,LTD.制造的布帛)投入到包含表1及表2的染料1.5g、乙酸0.2g及水的染浴150g中,经40分钟而升温至98℃,并在相同温度下进行30分钟的染色。染色之后,逐渐冷却至60℃,并进行了水洗。所染色的布帛在水洗之后也不会掉色,获得了染成高浓度的青色~蓝色的染色物。将所获得的染色物的评价结果示于表1及表2。〔〔评价方法〕〕1.耐光性评价利用氙褪色计,对依据ISO105-B02制作的染色样品照射6小时的氙气光。在照射该氙气光的前后,用分光浓度测定计(X-rite公司制,“X-rite938”),对各样品测定CIEL*a*b*表色系(国际照明委员会标准(1976年)/或JIS标准Z8781-4:2013)中的明度L*与色度a*及b*,作为由L*a*b*表色系中的坐标值L*、a*、b*之差即ΔL*、Δa*、Δb*定义的两个试料之间的色差,求出了ΔEab。值越小,表示光照射前后的变动较小而良好。将ΔEab40以下设为容许范围。色差ΔEab=(ΔL*2+Δa*2+Δb*2)0.52.耐水性评价对上述中制作的染色样品,通过根据JIS-L0846试验法(2010年版)的方法进行评价,并通过根据该试验法的评价方法进行了判定。等级的数值越大,表示越良好。3.耐氯性评价对上述中制作的染色样品,通过根据JIS-L0856试验法(2010年版)的方法进行评价,并通过根据该试验法的评价方法进行了判定。[表1]染料耐光性△Eab耐水性耐氯性实施例1化合物1344级2~3级实施例2化合物19344级2~3级实施例3化合物21324级2~3级比较例1比较化合物1504级2级比较例2比较化合物2504级2级实施例4化合物34324级3级实施例5化合物30344级3级实施例6化合物29344级3级实施例7化合物32344级3级实施例8化合物37364级3级实施例9化合物31344级3级实施例10化合物43364级3级比较例3AcidBlue9514级2级实施例11化合物20344级2~3级实施例12化合物56334级2~3级实施例13化合物58354级2~3级实施例14化合物59344级2~3级实施例15化合物62334级2~3级实施例16化合物65334级2~3级实施例17化合物67354级2~3级实施例18化合物101344级2~3级实施例19化合物102334级2~3级实施例101化合物103344级2~3级实施例102化合物104334级2~3级实施例103化合物105354级2~3级实施例104化合物106324级2~3级实施例105化合物107334级2~3级实施例106化合物108324级2~3级实施例107化合物109354级2~3级实施例108化合物110344级2~3级[表2]染料耐光性△Eab耐水性耐氯性实施例201化合物201264级2~3级实施例202化合物202254级2~3级实施例203化合物302354级2~3级实施例204化合物303354级2~3级实施例205化合物401304级2~3级实施例206化合物402394级2~3级实施例207化合物403244级2~3级[化学式82]AcidBlue9〔印花评价〕对布帛即尼龙6运动衫,用网版印花机将下述印花浆印染成实心图像。印花浆将所印染的布帛干燥之后,用105℃的饱和蒸汽进行了蒸汽处理。之后,水洗布帛,冲洗未固定的染料。用包含乙酸0.1g、硫酸铵0.6g、SunLifeTN(NICCACHEMICALCO.,LTD.制造的固定剂)6g的200mL的浴,在60℃下对所染色的布进行5分中的固定处理,从而使其干燥。所染色的布帛不会掉色,获得了染成高浓度的青色~蓝色的染色物。将染色物的评价结果示于表3及表4。〔〔评价方法〕〕对所印染的实心图像,与上述浸染相同地进行了评价。[表3]染料耐光性△Eab耐水性耐氯性实施例20化合物1344级2~3级实施例21化合物19344级2~3级实施例22化合物21324级2~3级比较例4比较化合物1504级2级比较例5比较化合物2504级2级实施例23化合物34324级3级实施例24化合物30344级3级实施例25化合物29344级3级实施例26化合物32344级3级实施例27化合物37364级3级实施例28化合物31344级3级实施例29化合物43364级3级比较例6AcidBlue9504级2级实施例30化合物20344级2~3级实施例31化合物56334级2~3级实施例32化合物58354级2~3级实施例33化合物59344级2~3级实施例34化合物62334级2~3级实施例35化合物65334级2~3级实施例36化合物67354级2~3级实施例37化合物101344级2~3级实施例38化合物102334级2~3级实施例131化合物103334级2~3级实施例132化合物104344级2~3级实施例133化合物105344级2~3级实施例134化合物106324级2~3级实施例135化合物107334级2~3级实施例136化合物108334级2~3级实施例137化合物109344级2~3级实施例138化合物110334级2~3级[表4]染料耐光性△Eab耐水性耐氯性实施例208化合物201274级2~3级实施例209化合物202264级2~3级实施例210化合物302354级2~3级实施例211化合物303354级2~3级实施例212化合物401304级2~3级实施例213化合物402394级2~3级实施例214化合物403254级2~3级另外,将布帛从尼龙6运动衫变更为丝绸制布帛、羊毛制布帛及尼龙66运动衫,同样地进行印染的结果,在水洗后也不会掉色,获得了染成高浓度的染色物,耐光性、耐氯性也良好。〔喷墨印花评价〕喷墨印花中,根据日本特开2013-209786号公报记载的方法进行。<预处理工序>对布帛即尼龙6运动衫,混合以下所示的成分来制备了预处理剂A。利用所获得的预处理剂A,将布帛设为轧液率90%来浸轧,使其自然干燥,从而获得了已处理的布帛。(预处理剂A)<印染工序>接着,在30~40℃下加热由下述组成构成的油墨组合物的同时搅拌了1小时。用平均孔径0.5μm的微过滤器对所获得的液体进行减压过滤来制备了喷墨用油墨液。·表5及表6所示的染料5质量%·丙三醇〔WakoPureChemicalIndustries,Ltd.制造〕(水性有机溶剂)10质量%·二甘醇〔WakoPureChemicalIndustries,Ltd.制造〕(水性有机溶剂)10质量%·OlfineE1010〔NissinChemicalCo.,Ltd.制造)(乙炔二醇系表面活性剂)1质量%·水74质量%在喷墨打印机(Dimatix,Inc.制造,DMP-2381)中安装所获得的各喷墨用油墨液之后,对所获得的已进行预处理的布帛印染了实心图像。<后处理工序>将所印染的布帛干燥之后,通过蒸汽工序,在饱和蒸汽中,在100℃下吹送30分钟的蒸汽,使染料固定于布帛的纤维。之后,将布帛用冷水清洗10分钟,用60℃的温水清洗5分钟之后,使其自然干燥。所染色的布帛不会掉色,获得了染成高浓度的青色~蓝色的染色物。将实施例52(化合物59)及实施例54(化合物65)中使用的尼龙6运动衫染色布帛的吸收光谱记载于图3。〔〔评价方法〕〕对所印染的实心图像,与上述浸染相同地进行了评价。[表5]染料耐光性△Eab耐水性耐氯性实施例39化合物1334级2~3级实施例40化合物19334级2~3级实施例41化合物21314级2~3级比较例7比较化合物1494级2级比较例8比较化合物2494级2级实施例42化合物34314级3级实施例43化合物30334级3级实施例44化合物29334级3级实施例45化合物32334级3级实施例46化合物37354级3级实施例47化合物31334级3级实施例48化合物43354级3级比较例9AcidBlue9494级2级实施例49化合物20334级2~3级实施例50化合物56324级2~3级实施例51化合物58344级2~3级实施例52化合物59334级2~3级实施例53化合物62324级2~3级实施例54化合物65324级2~3级实施例55化合物67344级2~3级实施例56化合物101334级2~3级实施例57化合物102324级2~3级实施例161化合物103334级2~3级实施例162化合物104324级2~3级实施例163化合物105344级2~3级实施例164化合物106324级2~3级实施例165化合物107324级2~3级实施例166化合物108314级2~3级实施例167化合物109334级2~3级实施例168化合物110334级2~3级[表6]染料耐光性△Eab耐水性耐氯性实施例215化合物201274级2~3级实施例216化合物202264级2~3级实施例217化合物302354级2~3级实施例218化合物303344级2~3级实施例219化合物401314级2~3级实施例220化合物402394级2~3级实施例221化合物403254级2~3级另外,将布帛从尼龙6运动衫变更为丝绸制布帛、羊毛制布帛及尼龙66运动衫,同样根据日本特开2013-209786号公报记载的方法,对各个布帛实施喷墨印花的结果,在水洗之后也不会掉色,可获得染成高浓度的染色物,耐光性、耐氯性也良好。并且,将记录介质从布帛变更为普通纸,根据日本特开2013-49776公报记载的方法进行喷墨印刷并进行评价的结果,示出优异的分光特性、耐光性,得知作为纸用油墨也示出优异的性质。将包含作为反应染料的化合物44的着色组合物网版印花于棉的结果,水洗后也不会掉色,获得了染成高浓度的青色的染色物。将油溶性染料即化合物23作为分散染料,将包含上述染料的着色组合物网版印花于聚酯的结果,水洗后也不会掉色,获得了染成高浓度的青色的染色物。作为油溶性染料的化合物23中,根据日本特开2013-49776公报记载的方法,作为彩色调色剂进行评价的结果,示出优异的分光特性、耐光性,得知作为调色剂示出优异的性质。产业上的可利用性根据本发明,可提供色调优异、成色浓度较高、耐光性、耐水性及耐氯性优异的化合物及包含该化合物的染色或印花用着色组合物。并且,可提供含有上述染色或印花用着色组合物的喷墨用油墨、对布帛进行印花的方法及被染色或印花的布帛。参考特定实施方式对本发明进行了详细说明,但本领域技术人员应可理解在不脱离本发明的精神和范围内,可加以各种变更和修正。本申请为基于2014年7月4日申请的日本专利申请(专利申请2014-139182)、2014年11月6日申请的日本专利申请(专利申请2014-226290)及2015年2月20日申请的日本专利申请(专利申请2015-31985)的申请,其内容通过参考编入本说明书中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1