开关型荧光纳米颗粒探针以及使用其的荧光分子成像法的制造方法与工艺
本发明涉及具有生物适应性的、在由两亲性物质构成的分子聚集体中内含荧光色素而成的荧光纳米颗粒及使用其作为探针的荧光成像。
背景技术:
近年来对纳米技术的关注在高涨,开发了利用纳米尺寸物质特有的性质的新型功能性材料。该新型功能性材料可以在能源、电子及医药等广泛的领域中应用。纳米技术尤其在生物体样本中的物质的检测、体内(invivo)成像中引人注目。在医药领域中,让近红外荧光色素在肿瘤部分聚集、将肿瘤部分成像的近红外荧光摄影法受到了关注。在该方法中,将具有通过激发光照射而在近红外区域发射荧光的性质的化合物作为造影剂给药于生物体内。接着,从身体的外侧照射近红外波长的激发光,检测由在肿瘤部分聚集的荧光造影剂发射的荧光,确定病变部位。用作成像用探针的物质主要由载剂和荧光色素构成,分别报告了各种形态的物质。作为载剂,可列举出脂质体纳米颗粒(日本特开2005-220045号公报(专利文献1))、肽型纳米颗粒(JournalofControlledRelease51(1998)241-248(非专利文献1)、使用具有聚谷氨酸甲酯的两亲性嵌段聚合物作为疏水性嵌段的纳米颗粒(日本特开2008-024816号公报(专利文献2))、使用由聚肌氨酸链和聚乳酸链构成的两亲性嵌段聚合物的纳米颗粒(ChemistryLetters,vol.36,no.10,2007,p.1220-1221(非专利文献2))、使用由聚肌氨酸链和聚乳酸链构成的两亲性嵌段聚合物和聚乳酸的纳米颗粒(国际公开第2009/148121号小册子(专利文献3))等。荧光色素是通过共价键与载剂键合或者通过非共价键内含在载剂中的物质,可使用荧光素系色素、花青系色素、若丹明系色素等。作为花青系色素,大多使用吲哚菁绿(indocyaninegreen,ICG),开发了各种吲哚菁衍生物(BioconjugateChem.1996,7,356-362(非专利文献3),日本药学会第131年会,29p-am395Q海报,2010年3月29日(非专利文献4))。另外,还报道了使通过同时内含吲哚菁衍生物和猝灭剂而猝灭的纳米颗粒在达到肿瘤组织时获得荧光性的方法(CancerResearch,60,4953-4958,September1,2000(非专利文献5)、BioconjugateChem.2002,13,605-610(非专利文献6)、CancerResearch,2009;69:(4).February15,2009(非专利文献7))。更具体而言,在上述非专利文献4中公开了用500μL由聚肌氨酸链和聚乳酸链构成的两亲性聚合物(PSar70-PLLA30)的6mg/mL溶液和3.16μL吲哚菁衍生物IC7-1的1mg/mL溶液制作纳米颗粒IC7-1lactosome。即,公开了该纳米颗粒IC7-1lactosome中的吲哚菁衍生物IC7-1的内含量为0.48mol%。该内含量相当于,相对于一个纳米颗粒IC7-1lactosome,具有一个吲哚菁衍生物IC7-1分子。现有技术文献专利文献专利文献1:日本特开2005-220045号公报专利文献2:日本特开2008-024816号公报专利文献3:国际公开第2009/148121号小册子非专利文献非专利文献1:“ジャーナル·オブ·コントロールド·リリース(JournalofControlledRelease)”,第51卷,1998年,第241-248页非专利文献2:“ケミストリ·レターズ(ChemistryLetters)”,第36卷,第10号,2007年,第1220-1221页非专利文献3:“バイオコンジュゲート·ケミストリ(BioconjugateChemistry)”,1996年,第7卷,第356-362页非专利文献4:日本药学会第131年会,29p-am395Q海报,2010年3月29日非专利文献5:“キャンサー·リサーチ(CancerResearch)”,第60卷,第4953-4958页,2000年9月1日非专利文献6:“バイオコンジュゲート·ケミストリ(BioconjugateChemistry)”,2002年,第13卷,第605-610页非专利文献7:“キャンサー·リサーチ(CancerResearch)”,2009年,第69卷;(第4号),2009年2月15日
技术实现要素:
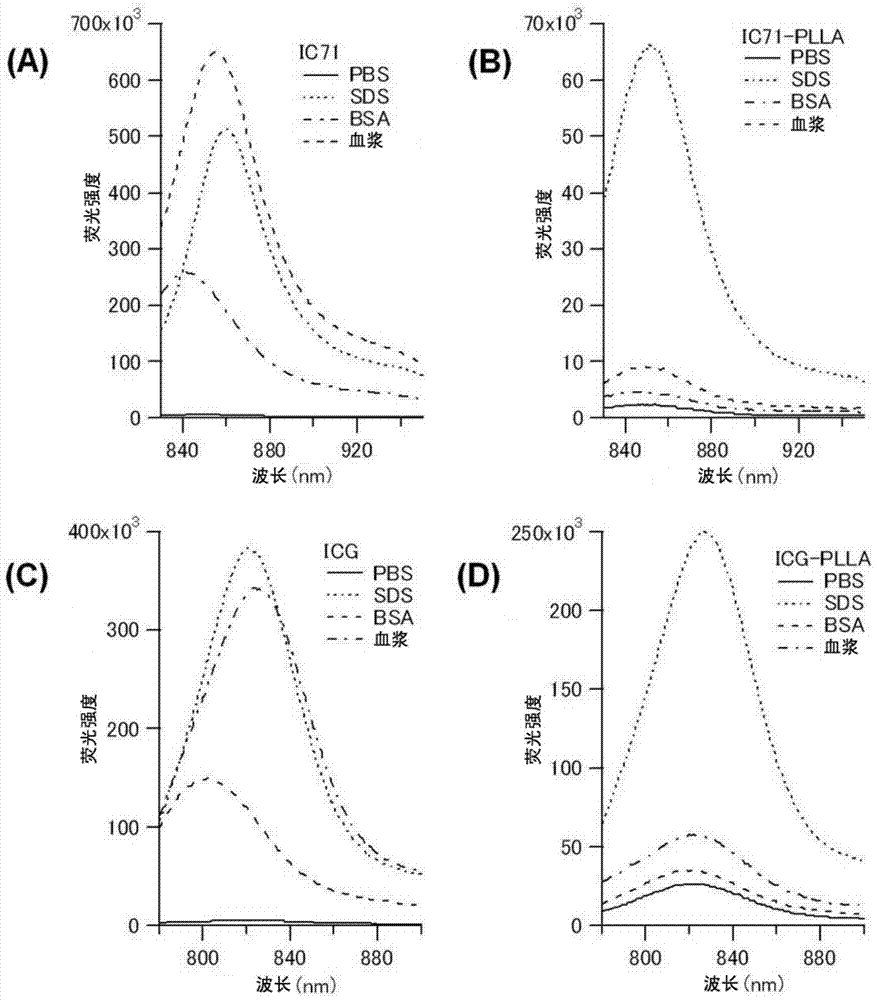
发明要解决的问题本发明的目的在于提供具有开关功能(在制备纳米颗粒时和在血液成分中荧光色素猝灭,在所要成像的肿瘤或炎症部位发出荧光的功能)的新型成像用荧光纳米颗粒探针。用于解决问题的方案本发明人等已经发现了通过高浓度地内含花青系荧光化合物而自猝灭了的纳米颗粒通过与血液成分接触而恢复荧光强度这一令人惊奇的效果。本发明人等经过进一步的深入研究,结果发现通过高浓度地内含聚乳酸结合花青系荧光化合物而自猝灭了的纳米颗粒在与血液成分接触下保持自猝灭状态,通过与细胞接触或被细胞吸收而恢复荧光强度这一令人惊奇的效果,从而完成了本发明。本发明包括以下的开关型荧光纳米颗粒探针以及使用其的成像法。(1)一种荧光纳米颗粒探针,其包括:由具有亲水性嵌段链和疏水性嵌段链的两亲性嵌段聚合物构成的分子聚集体,和在前述分子聚集体中内含的荧光色素,(a)前述亲水性嵌段链含有选自肌氨酸单元和环氧烷单元中的单元作为亲水性必需构成单元,且具有20个以上前述亲水性必需构成单元,(b)前述疏水性嵌段链含有选自由氨基酸单元和羟基酸单元组成的组中的单元作为疏水性必需构成单元,且具有15个以上前述疏水性必需构成单元,(c)所述荧光色素是包含下述结构式(I)所示的荧光基团和具有5~50个乳酸单元的聚乳酸基团的聚乳酸结合花青化合物,[化学式1](式(I)中,R1为可以被取代的烃基,R2为可以被取代的二价烃基;A-为阴离子,m为0或1;环B和环D为可以彼此相同或不同的含氮杂环;L为可以包含环状结构、可以被取代的构成聚甲炔链的连接基团。)每一个所述分子聚集体内含多个分子的前述荧光色素。在上述开关型荧光纳米颗粒探针中,由于内含的多个分子的荧光色素缔合而发生荧光猝灭。(2)根据(1)所述的荧光纳米颗粒探针,其中,前述荧光色素以相对于前述两亲性嵌段聚合物和前述荧光色素的总计为1~50mol%的量内含于前述分子聚集体中。上述荧光纳米颗粒中的荧光色素内含量相当于相对于一个颗粒具有2~200分子荧光色素。(3)根据(1)或(2)所述的荧光纳米颗粒探针,其中,与细胞接触或被细胞吸收时的荧光强度是与血液成分接触时的荧光强度的10倍以上。作为上述荧光强度达到10倍时的一个例子,可列举出荧光色素内含量为20mol%(即,相当于相对于一个荧光纳米颗粒具有50分子荧光色素)的情况。荧光纳米颗粒探针的荧光强度通过添加到细胞中而上升,在添加24小时后能够达到10倍以上。(4)根据(1)~(3)中的任一项所述的荧光纳米颗粒探针,其中,L所表示的前述连接基团具有以下所示结构中的任意者。[化学式2](式中,R3和R3’为氢或者它们相互连接而形成前述环状结构,X为氢或卤素。)(5)根据(1)~(4)中的任一项所述的荧光纳米颗粒探针,其中,前述环B为以下所示结构中的任意者:[化学式3](式中,R1为可以被取代的烃基,R4和R5为氢或阴离子性取代基,或者它们相互连接而形成芳环。),前述环D为以下所示结构中的任意者:[化学式4](式中,R2为可以被取代的二价烃基,R4和R5为氢或阴离子性取代基,或者它们相互连接而形成芳环。)(6)根据(1)~(5)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光基团为下述结构式(II)所示的基团。[化学式5](式中,R1为可以被取代的烃基,R2为可以被取代的二价烃基;R3和R3’为氢或者它们相互连接而形成环状结构;X为氢或卤素;A-为阴离子,m为0或1;环B和环D为可以彼此相同或不同的含氮稠合芳香族杂环;R4和R5为氢或阴离子性取代基,或者它们相互连接而形成芳环。)(7)根据(1)~(6)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光基团为下述结构式(III)所示的基团。[化学式6](式中,R2为可以被取代的二价烃基。)(8)根据(1)~(6)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光基团为下述结构式(IV)所示的基团。[化学式7](式中,R2为可以被取代的二价烃基。)(9)根据(1)~(3)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光基团为下述结构式(X)所示的基团。[化学式8](式中,R2为可以被取代的二价烃基。)(10)根据(1)~(6)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光色素为下述式(III-i)。[化学式9](式中,n为5~50的整数。)(11)根据(1)~(6)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光色素为下述式(IV-i)。[化学式10](式中,n为5~50的整数。)(12)根据(1)~(4)中的任一项所述的荧光纳米颗粒探针,其中,前述荧光色素为下述式(X-i)。[化学式11](式中,n为5~50的整数。)(13)根据(1)~(12)中的任一项所述的荧光纳米颗粒探针,其中,前述疏水性嵌段链选自由具有10个以上疏水性氨基酸单元的疏水性多肽链、具有15个以上羟基酸单元的疏水性聚酯链、和具有总计20个以上的氨基酸单元和羟基酸单元两者的疏水性酯肽链组成的组。(14)根据(1)~(13)中的任一项所述的荧光纳米颗粒探针,其中,前述疏水性嵌段链具有25个以上的乳酸单元。(15)根据(1)~(14)中的任一项所述的荧光纳米颗粒探针,其中,前述亲水性嵌段链通过具有抗体从而利用前述抗体修饰了表面。(16)根据(15)所述的荧光纳米颗粒探针,其中,前述抗体为针对肿瘤所具有的物质的抗体。(17)一种荧光分子成像法,其包括将(1)~(16)中的任一项所述的荧光纳米颗粒探针给药于非人动物的工序以及检测荧光的工序。发明的效果根据本发明,可以提供具有开关功能(在血液成分中荧光色素猝灭,在所要成像的肿瘤或炎症部位发出荧光的功能)的新型成像用荧光纳米颗粒探针。更具体而言,根据本发明,可以提供纳米颗粒,其为将聚乳酸结合花青化合物作为应该内含的荧光色素,将荧光色素内含量设为比以往的纳米颗粒更高的浓度,从而在制备时和存在于含有血液成分的环境内时被内含的荧光色素的荧光依赖于(荧光色素的)浓度而减少,且在与细胞接触或被细胞吸收时恢复荧光的纳米颗粒,其具有因EPR效果而获得的在期望的组织中的良好集聚性。因此,可以提供在生物体内的期望的组织中特异性地呈现高亮度荧光的荧光纳米颗粒以及使用其的荧光成像法。附图说明图1是实施例2中获得的内含ICG-PLLA的Lactosome(以ICG浓度计为0.48μM)的荧光强度测定结果。分别示出内含0.6、1、1.5、2、3、4或8mol%的ICG-PLLA30或ICG-PLLA32时的荧光强度((A)、(B)),以及817nm下的荧光强度(C)。图2是对实施例3中获得的分别内含20mol%IC7-1、IC71-PLLA、ICG、ICG-PLLA的Lactosome添加PBS、SDS、BSA或血浆时的荧光光谱测定结果。图3示出了实施例4中获得的内含20mol%IC71-PLLA30的Lactosome因外部环境变化而产生的荧光强度的经时变化。图4是实施例5-1中获得的内含1mol%和20mol%IC71-PLLA30的Lactosome和内含1mol%和20mol%IC71-PLLA30的抗体修饰Lactosome在与细胞接触或被细胞吸收时的荧光光谱测定结果。图5是实施例5-2中获得的内含1mol%Cy5-PLLA30且被抗体修饰了的Lactosome(Cy5antiHER2lactosome)、和内含1mol%Cy5-PLLA30且未被抗体修饰的Lactosome(Cy5lactosome)分别与细胞接触或被细胞吸收时的利用荧光显微镜得到的观察结果。图6是实施例5-3中获得的内含20mol%Cy5-PLLA30且被抗体修饰了的Lactosome(Cy5antiHER2lactosome)、和内含20mol%Cy5-PLLA30且未被抗体修饰的Lactosome(Cy5lactosome)分别被细胞吸收的形态的利用荧光显微镜得到的观察结果。图7是实施例5-4中获得的内含20mol%IC71-PLLA30且被抗体修饰过的Lactosome(antiHER2lactosome)、和内含20mol%IC71-PLLA30且未被抗体修饰的Lactosome(lactosome)分别与细胞(N87、BT-474、SK-BR-3和MCF-7)接触或被上述细胞吸收时的荧光光谱测定结果。图8是实施例6中获得的使用了1mol%IC71-PLLA30抗HER2scFv-lactosome(A)和20mol%IC71-PLLA30抗HER2scFv-lactosome(B)的荷瘤小鼠的荧光成像结果。图9根据实施例6中获得的荧光成像结果示出了肿瘤部位(A)和背景(B)的荧光强度的经时变化。图10根据实施例6中获得的荧光成像结果示出了肿瘤部位与背景的荧光强度比的经时变化。具体实施方式[1.两亲性嵌段聚合物]本发明的两亲性嵌段聚合物具有以下的亲水性嵌段和疏水性嵌段。以下,在本发明中,用语“氨基酸”以包含天然氨基酸、非天然氨基酸、以及由它们的修饰和/或化学改性生成的衍生物的概念来使用。此外,在本说明书中,氨基酸包括α-、β-、γ-氨基酸。优选α氨基酸。[1-1.亲水性嵌段链]在本发明中,对亲水性嵌段链所具有的所谓“亲水性”这一物性的具体水平没有特别限定,至少亲水性嵌段链相对于下述特定的疏水性嵌段链为亲水性相对较强的区域,只要该亲水性嵌段链具有通过与该疏水性嵌段链形成共聚物、作为共聚物分子整体可实现两亲性的水平的亲水性即可。或者,具有该两亲性嵌段聚合物可在溶剂中自组装而形成自聚集体、优选粒状的自聚集体的水平的亲水性即可。亲水性嵌段链是含有选自由衍生自肌氨酸的单元和衍生自环氧烷或亚烷基二醇的单元组成的组中的单元作为亲水性必需构成单元,且具有20个以上前述亲水性必需构成单元的亲水性分子链。具体而言,亲水性分子链包括具有20个、优选30个以上肌氨酸单元的亲水性多肽链;具有20个以上环氧烷单元的亲水性聚醚链;以及具有总计20个、优选30个以上肌氨酸单元和环氧烷单元两者的亲水性复合链。肌氨酸也就是N-甲基甘氨酸。作为环氧烷单元,具体而言,可列举出环氧乙烷单元(聚乙二醇单元)、环氧丙烷单元(丙二醇)等。另外,在环氧烷单元中,氢也可以被取代。含有除肌氨酸单元和环氧烷单元以外的构成单元时,对这种构成单元没有特别限定,例如,可以为除肌氨酸以外的氨基酸(包括亲水性氨基酸和其它氨基酸)。作为这种氨基酸,优选是α氨基酸。例如,可列举出丝氨酸、苏氨酸、赖氨酸、天冬氨酸、谷氨酸等。在亲水性嵌段链中,构成该链的构成单元的种类和比率由本领域技术人员适当确定,使得嵌段链整体为如上所述的亲水性。亲水性嵌段链例如可以将构成单元数500左右作为上限来设计。在本发明中,可以合成具有通常30~300、更优选50~200左右的构成单元数的亲水性嵌段链。构成单元数超过500左右时,形成分子聚集体时,该形成的分子聚集体有缺乏稳定性的倾向。构成单元数低于30时,分子聚集体的形成本身有变难的倾向。在亲水性嵌段链中,所有的相同构成单元可以是连续的,也可以是非连续的。在亲水性嵌段链中包含除上述特定单元以外的其它构成单元时,其它构成单元的种类和比率可由本领域技术人员适当确定,使得嵌段链整体为上述亲水性。另外,在该情况下,优选以不损害后述基本特性的方式进行分子设计。肌氨酸(即N-甲基甘氨酸)的水溶性高,另外,肌氨酸的聚合物具有N取代酰胺,因此与通常的酰胺基团相比,可进行顺-反异构化,进而,Cα碳周围的位阻少,因此,具有高的柔软性。从该嵌段链具备兼具高亲水性和高柔软性的基本特性的观点来看,使用这种多肽作为构成嵌段链是非常有用的。另外,聚环氧烷链的亲水性高,不会造成免疫原性、毒性等不良影响。从具备对该嵌段链赋予高亲水性、使载剂减少抗原性且赋予良好的血中稳定性和血中保留性的基本特性的观点来看,使用这种聚醚链作为构成嵌段链是非常有用的。[1-2.疏水性嵌段链]在本发明中,对疏水性嵌段链所具有的所谓“疏水性”这一物性的具体水平没有特别限定,至少疏水性嵌段链相对于上述特定的亲水性嵌段链为疏水性相对较强的区域,只要该疏水性嵌段链具有通过与该亲水性嵌段链形成共聚物、作为共聚物分子整体可实现两亲性的水平的疏水性即可。或者,具有该两亲性嵌段聚合物可在溶剂中自组装而形成自聚集体、优选粒状的自聚集体的水平的疏水性即可。疏水性嵌段链是含有选自由衍生自氨基酸的构成单元和衍生自羟基酸的构成单元组成的组中的单元作为必需构成单元、且具有20个以上该必需构成单元的疏水性分子链。具体而言,疏水性分子链包括:具有20个以上疏水性氨基酸单元的疏水性多肽链;具有20个以上羟基酸单元的疏水性聚酯链;以及具有总计20个以上氨基酸单元和羟基酸单元两者的疏水性酯肽链。本发明中的疏水性嵌段链优选具有螺旋结构。疏水性氨基酸大多具有脂肪族侧链、芳香族侧链等。对于天然氨基酸,可列举出甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、蛋氨酸、酪氨酸和色氨酸等。对非天然氨基酸没有特别限定,可列举出谷氨酸甲酯、谷氨酸苄酯、天冬氨酸甲酯、天冬氨酸乙酯、天冬氨酸苄酯等氨基酸衍生物。作为羟基酸没有特别限定,可列举出乙醇酸、乳酸、羟基异丁酸等。在疏水性嵌段链中,构成该链的构成单元的种类和比率可由本领域技术人员适当确定,使得链整体为疏水性。疏水性嵌段链例如可以将构成单元数100左右作为上限来设计。在本发明中,可以合成具有通常10~80、优选20~50左右的构成单元数的疏水性嵌段链。构成单元数超过100左右时,形成分子聚集体时,该形成的分子聚集体有缺乏稳定性的倾向。构成单元数低于10时,分子聚集体的形成本身有变难的倾向。在疏水性嵌段链中,所有的相同构成单元可以是连续的,也可以是非连续的。在疏水性嵌段链中包含除上述特定单元以外的其它构成单元时,其它构成单元的种类和比率可由本领域技术人员适当确定,使得嵌段链整体为上述疏水性。另外,在该情况下,优选以不损害后述基本特性的方式进行分子设计。疏水性嵌段链中采用的氨基酸单元和羟基酸单元具有优异的生物适应性和稳定性。因此,从对生物体、尤其是人体的应用性的观点来看,由以这种聚乳酸作为构成嵌段的两亲性物质获得的分子聚集体是非常有用的。另外,尤其是聚乳酸由于具有优异的生物降解性,因此代谢快,在生物体内向除癌组织以外的组织的集聚性低。因此,从在癌组织中的特异集聚性的观点来看,由以这种聚乳酸作为构成嵌段的两亲性物质获得的分子聚集体是非常有用的。而且,由于聚乳酸对低沸点溶剂的溶解性优异,因此,由以这种聚乳酸作为构成嵌段的两亲性物质获得分子聚集体时,可避免使用有害的高沸点溶剂。因此,从对生物体的安全性的观点来看,这种分子聚集体是非常有用的。进而,从作为由以这种聚乳酸为构成单元的两亲性物质获得的分子聚集体的形状控制和尺寸控制的一个要因起作用的观点来看,优选调整聚乳酸的链长。因此,从得到的分子聚集体形状的用途性优异的观点来看,使用这种构成嵌段是非常有用的。从光学纯度的观点来看,疏水性嵌段链还可以具有以下变化。例如,疏水性嵌段链中的乳酸单元可以仅由L-乳酸单元构成,也可以仅由D-乳酸单元构成,还可以由L-乳酸单元和D-乳酸单元两者构成。疏水性嵌段链可以单独使用选自上述例示的物质中的一种,也可以组合多种来使用。在乳酸单元由L-乳酸单元和D-乳酸单元两者构成时,对L-乳酸单元和D-乳酸单元的聚合顺序没有限定。L-乳酸单元和D-乳酸单元可以每一个或两个交替地聚合,也可以无规地聚合,还可以嵌段聚合。因此,在乳酸单元由L-乳酸单元和D-乳酸单元两者构成时,对各乳酸单元的含量没有特别限定。即,可以以不同的量含有L-乳酸单元和D-乳酸单元,也可以以相同的量含有L-乳酸单元和D-乳酸单元。这种情况下,以该10个以上的乳酸单元作为整体,可以是光学纯度0%的外消旋体。[1-3.其它基团]在本发明中,构成两亲性嵌段聚合物的构成单元还可以具有其它基团。作为这样的基团,例如在本发明的纳米颗粒作为用于分子成像系统、药剂输送系统的分子探针使用时,可列举出能够使其具有作为这种分子探针更有用的形态/功能等的功能性基团。功能性基团例如为有机基团,可以由本领域技术人员适当选择。功能性基团可列举出提高纳米颗粒的血中稳定性的基团、通过与靶细胞所表达的生物分子结合来控制纳米颗粒对靶细胞的指向性从而提高纳米颗粒的靶向性的基团。作为水溶性高分子的例子,可列举出聚醚链、聚乙烯醇链等高分子。作为糖链的例子,可列举出羧甲基纤维素、直链淀粉等稳定剂、对靶部位的细胞所表达的蛋白质具有特异性结合能力的物质。作为抗体的例子,可列举出对靶部位的细胞所表达的抗原具有特异性结合能力的物质。作为配体的例子,可列举出RGD(精氨酸-甘氨酸-天冬酰胺)等粘接因子。这些基团可以与两亲性嵌段聚合物的亲水性嵌段侧的末端构成单元结合。由此,在形成作为胶束的纳米颗粒时,纳米颗粒可以具有将功能性基团保持于其表面的形态,即利用功能性基团的表面修饰的形态。[2.荧光色素]在本发明中,载剂中内含的荧光色素是至少包含荧光基团和聚乳酸基团的聚乳酸结合花青化合物。[2-1.荧光基团]荧光色素中的荧光基团用以下通式(I)表示。[化学式12]上述式(I)中,R1为可以被取代的烃基,R2为可以被取代的二价烃基。R1中的烃基可以是碳数1~20、优选碳数2~5的烷基。R2中的烃基可以是碳数1~20、优选碳数2~5的亚烷基。R1和R2中的取代基是可以为阴离子性的取代基,可以是羧基、羧酸酯基、金属羧酸盐基、磺酰基、磺酸酯基、金属磺酸盐基、或羟基。前述金属可以是碱金属或碱土金属。L是构成聚甲炔链的连接基团,可以包含环状结构,也可以被取代。聚甲炔链的链长例如可以是碳数3~7。作为构成聚甲炔链的连接基团L的优选的形态,可列举出具有以下结构的形态。[化学式13]在上述式中,R3和R3’为氢,或它们相互连接而形成环状结构。环状结构至少具有一个烯属双键等不饱和键,该不饱和键作为聚甲炔链的一部分而发生电子共振,例如可列举出环戊烯环、环己烯环等。R3和R3’相互连接而形成环状结构,从而可以使荧光色素的分子结构刚性化。X为氢或卤素。卤素可以为Cl、Br或I。A-为阴离子,m为0或1。m为0时,R1、R2、后述的R4和R5均为阴离子性基团,作为分子整体,形成甜菜碱结构。m为1时,A-可以为Cl-、Br-、I-等卤素离子、CIO4-、BF4-、PF6-、SbF6-、SCN-等。环B和环D是可以相同或不同的含氮杂环。优选的是含氮稠合芳香族杂环。例如可以是含氮双环式或三环式芳香族杂环。优选的是环B和环D相同。作为环B优选的形态,可列举出以下所示结构。[化学式14]作为环D优选的形态,可列举出以下所示结构。[化学式15]在上述式中,R4和R5可以是氢或阴离子性取代基。阴离子性取代基可以是羧酸酯基、金属羧酸盐基、磺酸酯基或金属磺酸盐基。前述金属可以是碱金属或碱土金属。或者,R4和R5可以是相互连接而形成芳环。前述芳环可以是可以被取代的苯环。在本发明中,优选的荧光基团的例子为衍生自下述结构式(II)所示的吲哚菁化合物的基团。[化学式16]作为结构式(II)所示的荧光基团的具体例子,可列举出环B和环D均为含氮三环式芳香族杂环的IC7-1基团(III)、ICG基团(IV)及IR820基团(V);环B和环D均为含氮二环式芳香族杂环的IR783基团(VI)及IR806基团(VII);以及环B为含氮三环式芳香族杂环且环C为含氮二环式芳香族杂环的IC7-2基团(VIII)。这些基团的结构式如以下所示。[化学式17][化学式18][化学式19][化学式20][化学式21][化学式22]上述(II)~(VIII)中例示出的花青系荧光基团发出近红外光。在近红外区域(700~1300nm)中,具有氢键的各取代基的吸收虽然存在,但该吸收比较小。因此,近红外光具有容易透过生物组织的特性。如果利用这种近红外光的特性,就能够获得体内的信息而不会对身体施加不必要的负担。在本发明中优选的荧光基团的其它例子为衍生自下述结构式(IX)所示的吲哚菁化合物的基团。[化学式23]作为结构式(IX)所示的荧光基团的具体例子,可列举出Cy5衍生的基团、Cy7衍生的基团。作为Cy5衍生的基团的更具体的例子,可列举出下述结构式(X)所示的基团。[化学式24]在如上述(IX)和(X)中例示出的花青系荧光基团那样的、聚甲炔交联的碳数少于上述荧光基团(II)~(VIII)的荧光基团的情况下,波长比上述荧光基团(II)~(VIII)短,因此,与非侵入地获取体内信息的用途相比,对于在需要进行外科手术时在开腹或开胸后获取应当切除的组织的尺寸及位置的信息的用途是更有用的。[2-2.聚乳酸基团]聚乳酸基团是以乳酸单元为主要构成成分的基团。所有乳酸单元可以是连续的,也可以是不连续的。基本来说,聚乳酸基团的结构、链长可以通过与上述1-2的疏水性嵌段链的分子设计时相同的观点来确定。通过这样设计,可以得到在分子聚集体中荧光色素(聚乳酸结合花青化合物)与两亲性嵌段聚合物的疏水性嵌段链之间的亲和性优异的效果。聚乳酸基团的乳酸单元数为5~50,优选为15~35。在该范围内,可以以聚乳酸结合花青化合物整体的长度不超过上述两亲性嵌段聚合物的长度的方式进行分子设计。优选的是,以不超过两亲性嵌段聚合物中的疏水性嵌段长度的二倍的方式进行分子设计。构成单元数超过上述范围时,在形成分子聚集体时,存在缺乏该形成的分子聚集体的稳定性的倾向。构成单元数低于上述范围时,存在纳米颗粒难以在血液成分中维持关闭状态的倾向。从光学纯度的观点出发,聚乳酸基团还可以具有以下变化。例如,聚乳酸基团中的乳酸单元可以仅由L-乳酸单元构成,也可以仅由D-乳酸单元构成,还可以由L-乳酸单元和D-乳酸单元两者构成。疏水性聚合物A2可以单独使用选自上述例示的物质中的一种,也可以组合多种来使用。该乳酸单元由L-乳酸单元和D-乳酸单元两者构成时,对L-乳酸单元和D-乳酸单元的聚合顺序没有限定。L-乳酸单元和D-乳酸单元可以每一个或两个交替地聚合,也可以无规地聚合,还可以嵌段聚合。因此,在乳酸单元由L-乳酸单元和D-乳酸单元两者构成时,对各乳酸单元的含量没有特别限定。即,可以以不同的量含有L-乳酸单元和D-乳酸单元,也可以以相同的量含有L-乳酸单元和D-乳酸单元。这种情况下,以该10个以上的乳酸单元作为整体,可以是光学纯度0%的外消旋体。[2-3.聚乳酸结合花青化合物的具体例子]在聚乳酸结合花青化合物中,荧光基团可以结合到聚乳酸基团的末端乳酸单元。此外,聚乳酸结合花青化合物还可以是在分子设计上具有化学或生物化学上可接受的除荧光基团和乳酸单元之外的构成要素的任何物质。这种情况下,以聚乳酸结合花青化合物作为整体而不造成超出上述定义的“疏水性”的范畴的影响的水平来包含其它构成要素。以下,示出聚乳酸结合花青化合物的具体例子(III-i)、(VI-i)和(X-i)。在下述式中,n是5~50的整数。化合物(III-i)具有IC7-1基团作为荧光基团。此外,化合物(VI-i)具有ICG基团作为荧光基团。此外,化合物(X-i)具有Cy5基团作为荧光基团。在本说明书中,聚乳酸结合花青化合物中的n例如为30时,将该化合物记为例如IC71-PLLA30、IC71-PDLA30、ICG-PLLA30、ICG-PDLA30、Cy5-PLLA30、Cy5-PDLA30等。同样,对于具有其它结构的荧光基团,可以由本领域技术人员决定聚乳酸结合花青化合物的结构。[化学式25][化学式26][化学式27][3.纳米颗粒]本发明的纳米颗粒是以通过上述两亲性嵌段聚合物的聚集或通过自聚集性的取向缔合而构成的分子聚集体作为载剂且内含上述荧光色素的结构体。[3-1.纳米颗粒的结构]本发明中的分子聚集体构成胶束。两亲性嵌段聚合物通过自组装,从而疏水性嵌段链形成为芯部。另一方面,荧光色素位于该疏水芯部。此时,具有花青系荧光基团的荧光色素发生缔合。由此,荧光猝灭(即,处于后述关闭状态)。作为本发明的纳米颗粒的载剂的分子聚集体在后述关闭状态下可以兼具能响应外部环境的柔软性和能将荧光色素保持在分子聚集体中的内含稳定性。[3-2.纳米颗粒中的荧光色素的内含量]本发明的纳米颗粒相对于一个纳米颗粒内含多个分子的荧光色素。例如,相对于两亲性嵌段聚合物和荧光色素的总计,荧光色素的量可以为1~50mol%。优选可以为5~20mol%或10~20mol%。在本发明中,通常相对于两亲性嵌段聚合物和荧光色素的总计为1mol%的荧光色素的量相当于一个纳米颗粒中内含2分子的荧光色素。低于上述范围时,存在无法具备开关功能的倾向;高于上述范围时,存在难以形成纳米颗粒的倾向。此外,通过内含荧光色素,具有增大纳米颗粒的疏水芯部的体积的效果,因此也有时通过荧光色素的内含量来控制纳米颗粒的粒径。[3-3.纳米颗粒的开关功能][3-3-1.关闭功能]本发明的纳米颗粒中内含多个分子的荧光色素。内含的多个分子由于缔合而自猝灭。猝灭的程度取决于内含的荧光色素的量。即,内含的荧光色素的量越多,每特定量的荧光色素的荧光强度呈指数函数关系地减少。减少的程度可根据荧光色素而不同,在特定荧光色素浓度(例如0.48μM)下进行测定时,荧光色素内含量每增加2.8~3.7mol%,荧光强度有时减少到1/2。例如,作为每增加2.8mol%荧光强度可减少到1/2的情况,可列举出将在Lactosome(其为纳米颗粒的载体部分,由聚肌氨酸-聚乳酸两亲性嵌段聚合物构成的分子聚集体)中内含聚(D)乳酸结合ICG的纳米颗粒调整至上述浓度来测定的情况。另外,作为每增加3.7mol%荧光强度可减少到1/2的情况,可列举出将在Lactosome中内含聚(L)乳酸结合ICG的纳米颗粒调整至上述浓度来测定的情况。因此,本发明的纳米颗粒可利用少量的荧光分子数来有效地猝灭。如上所述的猝灭状态(关闭状态)至少在纳米颗粒制备时的环境和存在血液成分的环境中被保持。作为保持关闭状态的环境,只要不是引起后述开启状态的环境,就可以为任意环境。例如,可列举出不含表面活性剂的水、水溶液等水系环境、无水环境和存在血液成分的环境。作为水、水溶液,只要在生物化学、药学上可接受即可,具体而言,可列举出注射用蒸馏水、生理盐水、缓冲液等,优选地可列举出磷酸缓冲生理盐水。另外,处于无水环境中的纳米颗粒即是指冷冻干燥处理过的纳米颗粒。作为血液成分,可列举出血液、血浆、血清、白蛋白等。处于存在血液成分的环境中的纳米颗粒是指例如被给药于血管内且未到达靶部位细胞(还未接触细胞)的状态的纳米颗粒。[3-3-2.开启功能]处于上述关闭状态的纳米颗粒在外部环境变化时,通过响应外部环境,成为恢复了荧光的状态(即开启状态)。作为引起开启状态的环境,只要是能够解除纳米颗粒中内含的荧光色素的缔合的环境就没有特别限定。可以认为,能够解除荧光色素的缔合的环境是指具有使作为载剂的分子聚集体结构变形的作用的环境。作为引起开启状态的环境中所包含的成分,具体而言,可列举出细胞成分。即,通过与细胞接触或被细胞吸收而引起开启状态。作为细胞并没有特别限定。从本发明的纳米颗粒利用EPR效果的观点来看,更具体而言,是存在于血管病变部位(例如恶性肿瘤部位、炎症部位、动脉硬化部位、血管新生部位等)的细胞。作为细胞成分的具体例子,只要为构成细胞的成分即可,不包含能够在不同细胞间移动的成分即细胞分泌物、细胞组织液等。例如可列举出具有使作为本发明载剂的分子聚集体结构变形或分解的作用的蛋白酶、酯酶、肌氨酸脱氢酶等酶或者溶酶体分解酶等细胞内酶这样的可以解除分子聚集体中内含的荧光色素的缔合的白蛋白等蛋白质和脂质等细胞内成分。作为被视作引起开启状态的机制之一,例如利用溶酶体分解酶等细胞内酶使作为载剂的分子聚集体结构分解后,游离的色素吸附于附近的蛋白质、脂质膜,从而形成开启状态。细胞成分只要至少是生物的体内环境中的浓度,就可以引起纳米颗粒的开启状态。作为能够引起开启状态的细胞成分浓度范围,仅作为一个例子,例如为0.03~10重量%、或内含的荧光色素的0.4~47倍(摩尔基准)。上述范围相当于细胞成分例如为白蛋白等的情况。低于上述范围时,存在荧光强度不充分恢复的倾向。虽然也允许高于上述范围的范围,但高于上述范围时,荧光强度由于荧光最大限度地恢复而倾向于达到顶点。通过形成开启状态,在关闭状态时猝灭了的荧光得到恢复。恢复后的荧光强度可根据载剂、内含的荧光色素而不同,只要大于关闭状态(例如在磷酸缓冲生理盐水中、血液成分中存在的状态)下的荧光强度即可。仅作为一个例子,内含的荧光色素的量为1~50mol%(相当于每一个纳米颗粒具有2~200分子荧光色素)时,最大限度可达1.1~12000倍左右,或者内含的荧光色素的量为10~20mol%(相当于每一个纳米颗粒具有22~50分子荧光色素)时,最大限度可达11~130倍左右。在本发明中,恢复后的荧光强度优选为关闭状态下的荧光强度的10倍以上。更优选为100倍以上。对上述范围的上限没有特别限定,例如为20000倍或15000倍。[3-4.纳米颗粒的尺寸][3-4-1.纳米颗粒的尺寸]本发明纳米颗粒的尺寸例如为粒径10~500nm。此处,“粒径”是指在粒径分布中出现频率最高的粒径,即中心粒径。粒径小于10nm的纳米颗粒难以制作,而大于500nm的纳米颗粒尤其通过注射到生物体内来给药时,有时不优选作为注射剂。[3-4-2.纳米颗粒尺寸的测定]对用于测定本发明纳米颗粒的尺寸的方法没有特别限定,可由本领域技术人员来适当选择。例如,可列举出利用透射型电子显微镜(TransmissionElectronMicroscope;TEM)的观察法、动态光散射(DynamicLightScattering;DLC)法等。在DLS法中,测定溶液中进行布朗运动的颗粒的移动扩散系数。[3-4-3.纳米颗粒的尺寸控制]作为控制分子聚集体尺寸的手段的例子,可列举出控制两亲性嵌段聚合物的链长。优选地,调整两亲性嵌段聚合物中的疏水性嵌段的聚合度是有效的。此外,作为控制分子聚集体尺寸的手段的其它例子,可列举出控制荧光化合物的配混量。[3-5.纳米颗粒的形成]对纳米颗粒的制作方法没有特别限定,本领域技术人员可根据期望的纳米颗粒的尺寸、特性、负载的荧光色素的种类、性质、含量等来适当选择。根据需要,如下所述形成纳米颗粒之后,可以通过公知的方法对得到的纳米颗粒进行表面修饰。其中,颗粒形成的确认也可以通过电子显微镜来进行。[3-5-1.薄膜法]薄膜法是用于制备脂质体的方法。由于本发明中的两亲性嵌段聚合物具有对低沸点溶剂的溶解性,因此可以使用该方法制备纳米颗粒。薄膜法包括以下工序。即,其包括:在容器(例如玻璃容器)中准备在有机溶剂中包含两亲性嵌段聚合物和荧光色素的溶液的工序;从前述溶液中去除前述有机溶剂,在前述容器的内壁上获得包含两亲性嵌段聚合物和荧光色素的薄膜的工序;以及在前述容器中添加水或水溶液,进行超声波处理或加热处理,将前述薄膜状物质转换为内含荧光色素的分子聚集体,从而获得纳米颗粒的分散液的工序。进而,薄膜法还可以包括将前述纳米颗粒的分散液供给于冷冻干燥处理的工序。在有机溶剂中包含两亲性嵌段聚合物和荧光色素的溶液还可以如下制备:将两亲性嵌段聚合物预先在薄膜的状态下储存,在纳米颗粒制备时,添加包含荧光色素的溶液,将薄膜溶解,从而制备。作为用于薄膜法的有机溶剂,优选使用低沸点溶剂。本发明的低沸点溶剂是指,在一个大气压下的沸点为100℃以下、优选为90℃以下的溶剂。具体而言,可列举出氯仿、二乙醚、乙腈、乙醇、丙酮、二氯甲烷、四氢呋喃、己烷等。通过在两亲性嵌段聚合物和荧光色素的溶解中使用这种低沸点溶剂,溶剂的去除变得非常简单。对溶剂的去除方法没有特别限定,本领域技术人员根据所使用的有机溶剂的沸点等适当确定即可。例如可以进行减压下的溶剂去除,也可以进行利用自然干燥的溶剂去除。去除有机溶剂之后,在容器内壁上形成了包含两亲性嵌段聚合物和荧光色素的薄膜。在贴附有该薄膜的容器中添加水或水溶液。作为水或水溶液,没有特别限定,本领域技术人员适当选择在生物化学、药学上可接受的水或水溶液即可。例如可列举出注射用蒸馏水、生理盐水、缓冲液等。添加水或水溶液之后,进行加热处理。在通过加热将薄膜从容器内壁剥离的过程中,形成分子聚集体。加热处理例如可以在70~100℃、5~60分钟的条件下进行。加热处理结束时,在容器中制备得到内含荧光色素的分子聚集体(纳米颗粒)在上述水或水溶液中分散的分散液。得到的分散液可直接给药于生物体。即,也可以不在无溶剂的纳米颗粒本身的状态下保存。另一方面,可以将得到的分散液进行冷冻干燥处理。作为冷冻干燥处理的方法,可以没有特别限定地使用公知的方法。例如,可以通过利用液氮等将如上所述获得的纳米颗粒的分散液冷冻、在减压下升华来进行。由此,可获得纳米颗粒的冷冻干燥处理物。即,可以将纳米颗粒以冷冻干燥处理物的形态保存。根据需要,通过在该冷冻干燥物中添加水或水溶液,获得纳米颗粒的分散液,从而可以将纳米颗粒投入使用。作为水或水溶液,没有特别限定,本领域技术人员适当选择在生物化学、药学上可接受的水或水溶液即可。例如可列举出注射用蒸馏水、生理盐水、缓冲液等。此处,在冷冻干燥处理前的分散液中,除了由两亲性嵌段聚合物和荧光色素形成的本发明的纳米颗粒以外,没有对形成这种纳米颗粒做出贡献的两亲性嵌段聚合和/或荧光色素分别可以以其自身的形态残留。将这种分散液供给于冷冻干燥处理时,在使溶剂浓缩的过程中,可以由没有形成本发明的纳米颗粒而残留的两亲性嵌段聚合物和荧光色素进一步形成纳米颗粒。因此,可以有效地进行本发明的纳米颗粒的制备。[3-5-2.注射法]注射法不限于本发明的纳米颗粒,是用于制备其它许多纳米颗粒的方法。在该方法中,通过将两亲性嵌段聚合物和荧光色素溶解在有机溶剂例如三氟乙醇、乙醇、六氟异丙醇、二甲亚砜、二甲基甲酰胺等中,将得到的溶液分散在注射用蒸馏水、生理盐水、缓冲液等水性溶剂中,进行纯化处理例如凝胶过滤色谱法、过滤、超速离心等处理,然后去除有机溶剂,从而可以制备纳米颗粒。将由此获得的纳米颗粒给药于生物体内时,有机溶剂使用对生物体有害的物质时,需要严格地进行该有机溶剂的去除。[4.荧光分子成像法]本发明的荧光分子成像法包括将上述荧光纳米颗粒作为探针给药于生物体内。本发明的荧光分子成像法的特征在于使用上述荧光探针,其它具体的步骤可以由本领域技术人员根据公知的荧光分子成型法来适当确定。[4-1.荧光探针的给药]作为给药荧光探针的生物体,没有特别限定,可以是非人动物。作为非人动物,没有特别限定,可列举出人以外的哺乳类,更具体而言,可列举出灵长类、啮齿类(小鼠、大鼠等)、兔子、狗、猫、猪、牛、羊和马等。作为给药于生物体内的方法,没有特别限定,本领域技术人员可适当确定。因此,作为给药方法,只要是荧光探针能够与细胞成分接触的方式即可,可以是全身给药和局部给药。即,分子探针的给药可以通过注射(有针型、无针型)、内服、外用中的任意方法来进行。本发明的荧光探针具有开关功能。因此,在荧光探针制备后给药于生物体内并与血液成分接触的状态下荧光猝灭,而通过与靶部位细胞接触或被其吸收,发出荧光。[4-2.给药靶]在本发明的方法中,作为荧光探针使用的纳米颗粒向血管病变部位(例如恶性肿瘤部位、炎症部位、动脉硬化部位、血管新生部位等)的特异集聚性优异。本发明的荧光探针由于EPR(高通透性和滞留;enhancedpermeabilityandretention)效应而在这些部位的组织中集聚,因此,该集聚性不依赖于血管病变部位的组织的种类。作为本发明的荧光探针的给药靶,优选为癌。可作为给药靶的癌涉及多方面。例如,可列举出肝癌、胰腺癌、肺癌、宫颈癌、乳腺癌、大肠癌等。[4-3.荧光探针的检测]本发明的分子成像系统中包括检测源自所给药的荧光探针的荧光的工序。通过检测所给药的荧光探针,可以从体外观测给药靶的状况(尤其是癌等的组织的位置和尺寸)。作为检测方法,可以使用能够使所给药的荧光探针可视化的所有手段。作为该手段,本领域技术人员可以根据荧光探针所具有的荧光色素的种类来适当确定。例如,可以对给药荧光探针的生物体进行激发光照射,检测体内的荧光探针所具有的荧光色素发出的荧光。激发波长、应检测的荧光波长等参数可以由本领域技术人员根据所给药的荧光探针所具有的荧光色素的种类和给药靶的种类而适当确定。从给药到检测开始的时间可以由本领域技术人员根据所给药的荧光探针所具有的荧光色素的种类和给药靶的种类来适当确定。例如,可以设定为给药后1~24小时。低于上述范围时,信号过强,存在不能明确区分给药靶与其它部位(背景)的倾向。另外,高于上述范围时,存在荧光探针从给药靶排泄出的倾向。从准确性的观点出发,优选的是,荧光探针的检测通过不是从生物体的一个方向而是从多个方向的测定来进行。具体而言,可以从至少三个方向、更优选至少五个方向来进行测定。从五个方向测定时,例如,可以从左右腹两侧、从左右体两侧、和从背部侧方向进行测定。实施例以下举出实施例来更详细地说明本发明。在实施例中,作为本发明的纳米颗粒,制备以聚肌氨酸-聚乳酸两亲性嵌段聚合物(PSar-PLLA)或抗体修饰聚肌氨酸-聚乳酸两亲性嵌段聚合物(抗HER2scFv-PSar-PLLA)作为载剂且内含用荧光化合物标记了的聚乳酸ICG-PLLA30、ICG-PDLA32或IC71-PLLA30(聚乳酸结合花青化合物)作为荧光色素的纳米颗粒。但本发明不限于这些实施例。另外,作为比较用的纳米颗粒,制备以上述聚肌氨酸-聚乳酸两亲性嵌段聚合物(PSar-PLLA)作为载剂且内含ICG(Sigma)或IC7-1作为荧光色素的纳米颗粒。[实验例1:N-[5-Anilino-3-chloro-2,4-(propane-1,3-diyl)-2,4-pentadiene-1-ylidene]aniliniumChloride(N-[5-苯胺基-3-氯-2,4-(丙-1,3-二基)-2,4-戊二烯-1-叉基]苯胺盐酸盐;化合物1)的合成]在100mL三口烧瓶中投入无水DMF(13mL,0.17mol),冷却至0℃。用15分钟向其中滴加三氯氧化磷(11mL,0.12mol)。在0℃下搅拌1小时后,加入环己酮(5.5mL,0.053mol)。在室温下搅拌1小时后,使其加热回流,进一步搅拌1小时。冷却至室温后,加入苯胺(aniline)/乙醇(EtOH)=1/1(体积比)的混合溶液18mL。30分钟后,加入H2O/HCl=10/1(体积比)的混合溶液110mL,在5℃下放置过夜。滤取沉淀物,用THF、冷水清洗后,将晶体与P2O5一起在干燥器内干燥,获得化合物1(反应路线1)。产率为53.6%(10.2g)。[化学式28]反应路线1[实验例2:3-(5-Carboxy-pentyl)-1,1,2-trimethyl-1H-benzo[e]indolium;iodide(3-(羧基-戊基)-1,1,2-三甲基-1H-苯并[e]吲哚鎓碘化物;化合物2)的合成]在50mL的茄形烧瓶中加入6-BromohexanoicAcid(6-溴己酸;8.4g,43.0mmol)、碘化钾(7.2g,43mmol)和5mL甲苯后,添加1,1,2-Trimethyl-1H-benzo[e]indole(1,1,2-三甲基-1H-苯并[e]吲哚;3.0g,14.3mmol)。加热回流15小时之后,滤取析出的固体。固体依次用THF、冷水、氯仿清洗,然后在干燥器中干燥,获得化合物2(反应路线2)。产率为77%(5.0g)。[化学式29]反应路线2[实验例3:中间体3的合成]将化合物1(3.00g,8.35mmol)、化合物2(3.77g,8.35mmol)、无水醋酸钠(0.753g,,9.19mmol)溶解在75.0mL无水乙醇中,在氮气氛下加热回流6小时。反应结束后,加入0.2mol/L的磷酸缓冲液pH=7.0进行中和,然后用氯仿提取有机物。一旦将提取物浓缩,用柱色谱法纯化,获得中间体3(反应路线3)。产率为25.5%(1.45g)。[化学式30]反应路线3[实验例4:3-(2-Hydroxy-ethyl)-1,1,2-trimethyl-1H-benzo[e]indolium;iodide(3-(2-羟基-乙基)-1,1,2-三甲基-1H-苯并[2]吲哚鎓碘化物;化合物4)的合成]在50mL的三口烧瓶中加入1,1,2-Trimethyl-1H-benzo[e]indole(1,1,2-三甲基-1H-苯并[e]吲哚;2.0g,9.556mmol)和10mL无水甲苯,在氮气氛下加热至80℃。1,1,2-Trimethyl-1H-benzo[e]indole(1,1,2-三甲基-1H-苯并[e]吲哚)完全溶解于甲苯后,加入2-Iodoethanol(2-碘乙醇;1.64g,9.556mmol)。进行2小时加热回流后,冷却至室温,滤取析出的淡蓝色晶体。将晶体用甲苯清洗,在干燥器内干燥,获得化合物4(反应路线4)。产率为33%(1.21g)。[化学式31]反应路线4[实验例5:IC7-1的合成]将中间体3(1.16g,1.70mmol)、化合物4(0.714g,1.87mmol)和无水醋酸钠(0.153g,1.87mmol)溶解在29.0mL无水乙醇中,在氮气氛下加热回流5小时。反应结束后,加入0.2mol/L的磷酸缓冲液pH=7.0进行中和,然后用氯仿提取有机物。一旦将提取物浓缩,用柱色谱法纯化,获得IC7-1(反应路线5)。产率为85.3%(1.22g)。[化学式32]反应路线5[实验例6:IC7-1NHS酯的合成]将IC7-1(600mg,0.713mmol)溶解在12mL无水DMF中,在冰浴中冷却至0度。然后,加入二环己基碳二亚胺(DCC)(440mg,2.14mmol)并搅拌20分钟后,加入N-羟基丁二酰亚胺(NHS)(246mg,2.14mmol),用1.5小时恢复至室温。然后在室温下搅拌2天(反应路线6)。反应结束后,加入醋酸乙酯使DC脲析出并进行滤取。浓缩滤液,用快速柱色谱法纯化,获得目标C7-1NHS酯。产率为14.9%(100.0mg)。[化学式33]反应路线6[实验例7:氨基化聚L-乳酸和氨基化聚D-乳酸的合成]在本实验例中,使用L-丙交酯(化合物6)和N-苄氧羰基-1,2-二氨基乙烷盐酸盐(化合物7)合成氨基化聚L-乳酸(a-PLA)(反应路线7)。[化学式34]反应路线7在作为聚合引发剂的N-苄氧羰基-1,2-二氨基乙烷盐酸盐(化合物7)(310mg,1.60mmol)中加入使辛酸锡(6.91mg)在甲苯(1.0mL)中扩散而成的溶液。将甲苯减压蒸馏去除后,加入L-丙交酯(化合物6)(3.45g,24mmol),在Ar气氛下、在120℃下进行聚合反应。12小时后,将反应容器空气冷却至室温。将得到的黄白色固体溶解于少量氯仿(10mL左右)中。将该氯仿滴加到冷甲醇(100mL)中,从而获得白色沉淀。得到的白色沉淀通过离心分离回收,并减压干燥。在得到的白色沉淀(500mg)的二氯甲烷(1ml)溶液中加入25v/v%溴化氢/醋酸(2.0mL),在避光、干燥空气下搅拌2小时。反应结束后,将反应溶液滴加到冷甲醇(100mL)中,利用离心分离回收析出的沉淀。将得到的白色沉淀溶解于氯仿后,用饱和NaHCO3水溶液清洗,用无水MgSO4进行脱水操作。通过硅藻土(R)过滤去除MgSO4后,进行真空干燥,从而获得白色的非晶质粉末a-PLA(440mg)。除了使用D-丙交酯代替L-丙交酯之外,采用与上述相同的方法制备氨基化聚D-乳酸。[实验例8:聚乳酸结合荧光化合物(IC71-PLLA30、ICG-PLLA30和Cy5-PLLA30)的合成]在包含2.0mg(1.0eq)a-PLA的DMF溶液加入溶解有1.3eq的IC7-1NHS酯、ICG-Sulfo-OSu或Cy5NHS酯的DMF溶液,在室温下搅拌约20小时。然后,用LH20柱进行纯化,减压蒸馏去除溶剂,获得聚乳酸结合荧光化合物。IC71-PLLA30的合成反应路线示于反应路线8。[化学式35]反应路线8除了分别使用ICG-Sulfo-OSu和Cy5NHS酯代替IC7-1NHS酯之外,采用与上述相同的方法制备ICG-PLLA30和Cy5-PLLA30。[实验例9:聚肌氨酸-聚乳酸两亲性嵌段聚合物(PSar70-PLLA30)的合成]在本实验例中,由肌氨酸-NCA(Sar-NCA)和氨基化聚L-乳酸(a-PLA)合成聚肌氨酸-聚乳酸两亲性嵌段聚合物(PSar70-PLLA30)(反应路线9)。[化学式36]反应路线9在Ar气氛下,在a-PLA(383mg,0.17mmol)和肌氨酸-NCA(Sar-NCA)(3.21g,27.9mmol)中加入二甲基甲酰胺(DMF)(140mL),在室温下搅拌12小时。将反应溶液冷却至0℃后,加入乙醇酸(72mg,0.95mmol)、O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HATU)(357mg,0.94mmol)和N,N-二异丙基乙胺(DIEA)(245μL,1.4mmol),在室温下反应18小时。利用旋转蒸发仪减压蒸馏去除DMF后,用LH20柱进行纯化。将在UV270nm处检测到峰的级分回收、浓缩。在0℃下将得到的浓缩溶液滴加到二乙醚中,进行再沉淀,从而获得作为目标产物的PSar70-PLLA30(1.7g)。[实验例10:NH化聚肌氨酸-聚乳酸两亲性嵌段聚合物(NH-PSar56-PLLA30)的合成]在Ar气氛下,在a-PLA(1.48g,0.654mmol)和肌氨酸-NCA(Sar-NCA)(7.53g,6.54mmol)中加入二甲基甲酰胺(DMF)(140mL),在室温下搅拌12小时。利用旋转蒸发仪减压蒸馏去除DMF后,用LH20柱进行纯化。将在UV270nm处检测到峰的级分回收、浓缩。在0℃下将得到的浓缩溶液滴加到二乙醚中,进行再沉淀,从而获得作为目标产物的NH-PSar56-PLLA30(4.7g)。[实施例1:内含荧光色素的纳米颗粒的制作]将作为纳米颗粒的载剂部分的由聚肌氨酸-聚乳酸两亲性嵌段聚合物构成的分子聚集体记为Lactosome。另外,将由抗体修饰聚肌氨酸-聚乳酸两亲性嵌段聚合物构成的分子聚集体记为抗体修饰Lactosome。[实施例1-1:内含荧光色素的Lactosome的制作1]在本实施例中,如下制备内含ICG-PLLA30或ICG-PDLA32作为荧光色素的Lactosome。分别制备作为载剂的聚乳酸-聚肌氨酸两亲性嵌段聚合物(PSar70-PLLA30·26H2O,MW=7767)和上述荧光色素各自的氯仿溶液(0.2mM)。对于荧光色素ICG-PLLA30和ICG-PDLA32,在玻璃容器内以荧光色素的摩尔浓度分别为0.6mol%、1mol%、1.5mol%、2mol%、3mol%、4mol%和5mol%的方式将两种溶液混合。另外,对于荧光色素ICG-PLLA30,在玻璃容器内以荧光色素的摩尔浓度为8mol%的方式将两种溶液混合。然后,按照薄膜法制作Lactosome。薄膜法如下所述地进行。从混合液中减压蒸馏去除溶剂,并在玻璃容器的壁面上形成包含载剂和荧光色素的薄膜。进而,在形成有薄膜的玻璃容器内加入水或缓冲液,在温度82℃下水浴加热20分钟后,在室温下放置30分钟,用0.2mm的过滤器过滤并冷冻干燥。[实施例1-2:内含荧光色素的Lactosome的制作2]在本实施例中,如下制备内含IC71-PLLA30、ICG-PLLA30、IC7-1(比较用)或ICG(比较用)作为荧光色素的Lactosome。分别制备作为载剂的聚乳酸-聚肌氨酸两亲性嵌段聚合物(PSar70-PLLA30·26H2O,MW=7767)和上述荧光色素各自的氯仿溶液(0.2mM)。在玻璃容器内以荧光色素的摩尔浓度分别为20mol%的方式将两种溶液混合。然后,按照薄膜法进行与实施例1-1相同的操作。[实施例1-3:内含荧光色素的抗体修饰Lactosome的制作1]在本实施例中,如下制备内含IC71-PLLA30作为荧光色素的抗体修饰Lactosome(抗HER2scFv-lactosome)。将100mg的NH-PSar56-PLLA30溶解于2.5mL干燥的二甲基甲酰胺(DMF)中后,加入21.3mg(5当量)N-succimidyl3-Maleimidopropyonate(3-马来酰亚胺基丙酸N-羟基琥珀酰亚胺酯;NSMP)和5.45μL(2当量)Diisopropylethylamine(二异丙基乙胺;DIEA),在室温下搅拌7小时(反应路线10)。蒸馏去除DMF后,将得到的白色沉淀用醋酸乙酯清洗3次,获得马来酰亚胺修饰PSar56-PLLA30(产量:59.1mg)。将马来酰亚胺修饰PSar56-PLLA30与PSar72-PLLA30以1:1(摩尔比)混合后,加入IC71-PLLA30,按照薄膜法制作马来酰亚胺Lactosome。[化学式37]反应路线10利用大肠杆菌表达系统制备抗HER2单链抗体(抗HER2scFv),使用IMAC试剂盒(Bio-RadLaboratories,Inc.制造),按照附带的说明书进行纯化。向100μL抗HER2scFv(3mg/mLPBS)中加入63.7μg(10当量)Tris(2-carboxyethyl)phosphineHCl(三(2-羧乙基)膦;TCEP),在冰冷却下搅拌2小时。用旋转柱(SephadexG-50;GeneralElectricHealthcareCompany制造)纯化后,加入1mL上述马来酰亚胺Lactosome(1mg/mLPBS),在冰冷却下反应4小时。进而,加入50μLCysteine·HCl(20mMPBS),在冰冷却下搅拌30分钟。然后,使用Amicon(Millipore公司制造)(100kDacut)进行纯化。对得到的抗HER2scFv-lactosome用体积排阻柱(Superdex20010/300GL;GeneralElectricHealthcareCompany制造)进行确认。此外,抗体结合量用BCA蛋白定量试剂盒(ThermoScientific公司制造)进行定量。得到的内含荧光色素的抗体修饰Lactosome的粒径为38.5nm(Intensity),抗体结合数为10/lactosome。[实施例1-4:内含荧光色素的Lactosome的制作3]在本实施例中,除了使用聚乳酸结合花青化合物Cy5-PLLA30作为荧光色素之外,进行与实施例1-1和1-2相同的步骤,分别制作荧光色素Cy5-PLLA30的摩尔浓度为1mol%和20mol%的内含荧光色素的Lactosome。[实施例1-5:内含荧光色素的抗体修饰Lactosome的制作2]在本实施例中,除了使用聚乳酸结合花青化合物Cy5-PLLA30作为荧光色素之外,进行与实施例1-3相同的步骤,制作内含Cy5-PLLA30的抗体修饰Lactosome(Cy5antiHER2lactosome)。[实施例2:内含荧光色素的Lactosome的荧光光谱]关于实施例1-1中得到的内含荧光色素的Lactosome(ICG-PLLA30/Lactosome、ICG-PDLA32/Lactosome),如下所述地对内含0.6mol%、1mol%、1.5mol%、2mol%、3mol%和4mol%的荧光色素ICG-PLLA30或ICG-PDLA32的Lactosome的冷冻干燥品,以及内含8mol%的荧光色素ICG-PLLA30的Lactosome的冷冻干燥品进行荧光光谱的测定。荧光光谱用荧光分光光度计(RF-5300PC,岛津制作所株式会社制造)在激发波长730nm下对750-900nm的范围进行测定。分别使各Lactosome按照以两亲性聚合物浓度计为1mg/ml的方式分散在超纯水中,以荧光剂浓度为0.48μM的方式稀释,然后,测定荧光光谱(图1的(A)和图1的(B))。在图1的(A)和图1的(B)中,横轴表示波长(Wavelength),纵轴表示荧光强度(Fluorescenceintensity)。此外,将它们各自在817nm下的荧光强度的降低示于图1的(C)。在图1的(C)中,纵轴表示荧光强度(Fluorescenceintensity)。结果可知,通过内含1mol%以上的ICG-PLLA30或ICG-PDLA32,荧光强度下降。在ICG-PLLA30的情况下,显示出荧光色素配混量每增加3.7mol%荧光强度下降至1/2的倾向,在ICG-PDLA32的情况下,显示出荧光色素配混量每增加2.8mol%,荧光强度下降至1/2的倾向。因此,显而易见,在高密度地内含聚乳酸结合花青化合物的Lactosome中,荧光猝灭。[实施例3:由外部环境变化引起的内含荧光色素的Lactosome的荧光强度变化1]对于配混有20mol%的IC71(比较用)、IC71-PLLA30、ICG(比较用)和ICG-PLLA30的Lactosome(1mg/ml),分别以1:1(体积比)混合磷酸缓冲生理盐水(PBS;具有相对于1L超纯水包含29gNa2HPO4·12H2O、2.96gNaH2PO4·2H2O、8.7gNaCl的组成)、血浆(Plasma;(采血自ddY雄性))、5重量%白蛋白(BSA)和5重量%SDS(十二烷基硫酸钠),避光下于室温放置30分钟后,按照以两亲性聚合物浓度为1/15mg/ml的方式用PBS稀释,测定荧光光谱(图2的(A)-(D))。在图2中,横轴表示波长(Wavelength),纵轴表示荧光强度(Fluorescenceintensity)。结果,对于未结合有聚乳酸的IC7-1和ICG,在SDS、血浆和BSA溶液中观测到荧光强度的恢复。另一方面,在结合有聚乳酸的IC71-PLLA30和ICG-PLLA30的情况下,在血浆和BSA溶液中荧光保持猝灭状态,仅在SDS溶液中荧光强度恢复。可以认为,SDS为表面活性剂,因而Lactosome颗粒的结构变化,从而荧光强度恢复。[实施例4:由外部环境变化引起的内含荧光色素的Lactosome的荧光强度经时变化2]对于配混有20mol%IC71-PLLA30的Lactosome(1mg/ml),分别以1:1(体积比)混合PBS、5重量%SDS、5重量%BSA、血浆、RPMI(RoswellParkMemorialInstitute)1640培养基,避光下于室温放置30分钟、1小时、3小时、6小时和24小时后,按照以两亲性聚合物浓度计为1/30mg/ml的方式用PBS稀释,测定荧光光谱(图3)。在图3中,横轴表示时间(时间(小时)),纵轴表示荧光强度(Fluorescenceintensity)。结果,在PBS和RPMI1640培养基中,至24小时后荧光强度仍未发生变化,保持猝灭状态。在BSA和血浆中,与30分钟后的荧光强度相比,荧光强度分别在24小时后增加至1.7倍和2.2倍。在SDS中,至3小时后荧光强度增加,之后至24小时保持恒定。[实施例5-1:荧光强度的恢复1(生物体外;invitro)]向12孔板以1x105细胞/孔加入表达HER2的N87细胞,培养过夜后,用PBS清洗2次。分别以1mL/孔逐一加入内含1mol%或20mol%的IC71-PLLA30的抗HER2scFv-lactosome和内含1mol%或20mol%的IC71-PLLA30的lactosome(40μg/mLRPMI1640)。避光下在37℃、5%CO2下培养,在培养开始30分钟、1小时、3小时、6小时、24小时后用PBS清洗细胞2次。用ClairvivoOPT(岛津制作所制造)对PBS清洗后的各细胞进行荧光摄像(激发:785nm、荧光:845nm、曝光时间20秒(1mol%)5秒(20mol%))。其结果示于图4。在图4中,横轴表示时间(时间(小时)),纵轴表示荧光强度(Normalizedintensity/mgprotein)。归一化强度(Normalizedintensity)是细胞的荧光强度除以添加的溶液的荧光强度而获得的值。如图4所示,内含1mol%聚乳酸结合花青化合物的情况与内含20mol%的情况相比,在表面未修饰的Lactosome中,内含20mol%时在添加24小时后显示出约93倍高的荧光强度。另一方面,在抗HER2scFv修饰Lactosome中,内含20mol%时在添加24小时后显示出约120倍高的荧光强度。抗HER2scFv修饰Lactosome显示出更高的荧光强度的理由可以认为是由于抗HER2scFv与在细胞表面表达的HER2结合,变得更容易被细胞吸收。[实施例5-2:荧光强度的恢复2(生物体外;invitro)]在本实施例中,对于内含1mol%的作为荧光色素的聚乳酸结合花青化合物Cy5-PLLA30且被抗体修饰了的Lactosome(Cy5antiHER2lactosome)、和内含1mol%Cy5-PLLA30且未被抗体修饰的Lactosome(Cy5lactosome),用荧光显微镜评价被吸收到细胞内的形态。向3.5cm玻璃皿(Glassbasedish;IWAKI)中加入1×105细胞(cells)的N87细胞,培养过夜后,用PBS清洗2次,作为Lactosome溶液,加入1mL/孔的Cy5antiHER2lactosome(40μg/mLRPMI)或1mL/孔的Cy5lactosome(40μg/mLRPMI)。在添加各Lactosome溶液后1小时、3小时、6小时和24小时后,去除Lactosome溶液,用PBS清洗2次,在荧光显微镜下(BZ9000,KEYENCE)观察。图5的(A)中与明视野图像一起示出抗体修饰了的Lactosome(HER2lactosome)的荧光观察结果,图5的(B)中与明视野图像一起示出未被抗体修饰的Lactosome的荧光观察结果。如图5所示可知,即使没有抗体修饰时,添加Lactosome后24小时也被吸收到细胞内。另外可知,在有抗体修饰时,从添加后1小时开始在细胞膜处观察到荧光,缓慢地局部存在于细胞内。[实施例5-3:荧光强度的恢复3(生物体外;invitro)]在本实施例中,对于内含20mol%的作为荧光色素的聚乳酸花青化合物Cy5-PLLA30且被抗体修饰了的Lactosome(Cy5antiHER2lactosome)、和内含20mol%的Cy5-PLLA30且未被抗体修饰的Lactosome(Cy5lactosome),用荧光显微镜更详细地评价吸收到细胞内的形态。向3.5cm玻璃皿(IWAKI)中加入1×105细胞的N87细胞,培养过夜后,用PBS清洗2次,作为Lactosome溶液,加入1mL/孔的抗体修饰了的LactosomeCy5antiHER2lactosome(40μg/mLRPMI)或1mL/孔的未被修饰的LactosomeCy5lactosome(40μg/mLRPMI)。在添加各Lactosome溶液后的3小时、6小时和24小时后,去除Lactosome溶液,用PBS清洗2次。进而,使用作为细胞核染色剂的Hoechst33342(同仁化学研究所)和作为溶酶体染色剂的LysoTrackerYellowHCK-123(Invitrogen)将细胞染色,在荧光显微镜下(BZ9000,KEYENCE)观察。将被染色了的细胞与观察到荧光的细胞进行比较观察,将其结果示于图6。图6的(A)是吸收了抗体修饰了的Lactosome(HER2lactosome)的细胞的照片,图6的(B)是吸收了未被抗体修饰的Lactosome的细胞的照片,分别是观察明视野(BrightField)、Hoechst33342的荧光、LysoTrackerYellowHCK-123的荧光和Cy5的荧光而得到的结果。如图6所示,细胞内的Cy5的荧光的局部存在与LysoTracker的局部存在位置一致。因此,可以认为被吸收到细胞内的Lactosome被溶酶体吸收,由于溶酶体内的酶而被分解,从而荧光恢复。需要说明的是,揭示了Lactosome未被吸收到细胞核内。[实施例5-4:荧光强度的恢复4(生物体外;invitro)]分别以1x105细胞/孔向12孔板添加表达HER2的N87、BT-474和SK-BR-3细胞以及不表达HER2的MCF-7细胞,培养过夜后,用PBS清洗2次。分别以1mL/孔逐一加入内含20mol%的IC71-PLLA30且用HER2抗体修饰的Lactosome(antiHER2lactosome)(40μg/mLRPMI1640)、和内含IC71-PLLA30的抗体未修饰Lactosome(40μg/mLRPMI1640)。避光下在37℃、5%CO2下培养,在培养开始1小时、3小时、6小时和24小时后用PBS清洗细胞2次。用ClairvivoOPT(岛津制作所制造)对PBS清洗后的各细胞进行荧光摄像(激发:785nm、荧光:845nm、曝光时间:5秒)。对于表达HER2的N87、BT-474和SK-BR-3细胞,进而作为竞争抑制实验,单独加入抗体修饰Lactosome的100当量的抗HER2抗体,并进行了荧光摄像。将得到的荧光光谱测定结果示于图7。在图7中,横轴表示时间(时间(小时);Time(hr)),纵轴表示荧光强度(归一化强度/毫克蛋白质;Normalizedintensity/mgprotein)。归一化强度(Normalizedintensity)是细胞的荧光强度除以添加的溶液的荧光强度而获得的值。此外,“antiHER2lactosome”表示使用内含IC71-PLLA30的抗体修饰Lactosome的结果,“antiHER2lactosome(抑制)”表示竞争抑制实验的结果,以及“lactosome”表示使用内含IC71-PLLA30的抗体未修饰Lactosome的结果。如图7所示,在使用表达HER2的N87、BT-474和SK-BR-3细胞的情况下,HER2抗体修饰Lactosome的荧光强度恢复比例较高,在使用不表达HER2的MCF-7细胞的情况下,无论有无抗体标记,荧光强度的恢复比例都为相同水平。加入抗HER2抗体进行竞争抑制实验时,因为HER2抗体修饰Lactosome的荧光强度恢复比例变低,显示出HER2抗体修饰Lactosome通过与细胞表面所表达的HER2的相互作用而被吸收到细胞内。[实施例6:荧光强度的恢复(生物体内;invivo)]通过尾静脉对右下肢移植了N87细胞的Balb/c裸鼠(雌性,4周龄且移植3-4周后使用)给药0.1ml的1mol%或20mol%IC71-PLLA30抗HER2scFv-lactosome(2mg/mLPBS),在刚给药后的1、3、6、9、12和24小时后,用ClairvivoOPT(岛津制作所制造)进行摄像(激发:785nm,荧光:845nm、曝光时间10秒(1mol%)5秒(20mol%))。将上述荷瘤小鼠的荧光成像结果示于图8。荧光强度以肿瘤部位给药24小时后的荧光强度设为100%,显示为40-100%的范围。内含1mol%IC71-PLLA30时(图8的(A))和内含20mol%时(图8的(B)),给药后右下肢的肿瘤部位的荧光强度均缓慢上升。在该荧光强度范围内,内含1mol%IC71-PLLA30时,从刚给药后开始观察到荧光,但内含20mol%IC71-PLLA30时,至给药3小时后都观察不到荧光。可以认为该结果显示出在内含20mol%IC71-PLLA30时的给药初始阶段,内含的荧光剂更优选地猝灭。根据图8的荧光成像结果,图9的(A)和图9的(B)中分别示出肿瘤(Tumor)部位和背景(Background;具体而言为背部)的荧光强度的经时变化。在图9中,横轴表示时间(时间(小时)),纵轴表示荧光强度(Fluorescenceintensity(计数/秒;counts/sec))。结果,从刚给药后开始观测到荧光强度的上升。给药1mol%IC71-PLLA30抗HER2scFv-lactosome时和给药20mol%IC71-PLLA30抗HER2scFv-lactosome时相比,至给药1小时后两者的荧光强度没有不同,在后者的情况下,从给药3小时后开始至给药24小时后,肿瘤部位的荧光强度急剧增加。刚给药后肿瘤部位的荧光强度与24小时后的强度相比,内含1mol%IC71-PLLA30时和内含20mol%时分别为约49%和约5.7%。在任意情况下均显示出,随着在血中保持猝灭状态的关闭状态的纳米颗粒由于EPR效果而集聚于肿瘤,因与细胞接触而猝灭的荧光剂变为开启状态。图10中示出肿瘤部位与背景的荧光强度比(T/B比)的经时变化。在图10中,横轴表示时间(时间(小时)),纵轴表示肿瘤部位与背景的荧光强度比(Tumor/Backgroundratio)。结果确认到T/B比的上升。显示出,内含20mol%荧光剂与内含1mol%相比,T/B比的值较高。1mol%和20mol%的T/B比之差在给药3小时后达到最大,内含20mol%时与内含1mol%相比,T/B比约高1.4倍。可以认为,在任意情况下,T/B比的提高均是因为关闭状态的纳米颗粒由于EPR效果而集聚于肿瘤后因与细胞接触而猝灭的荧光剂变为开启状态。其中,在给药平常为开启状态的探针时,依赖于血中浓度,背景的荧光强度经时地减少,但如图9的(B)所示,在给药20mol%IC71-PLLA30抗HER2scFv-lactosome时,在背景中从给药3小时后开始也观察到荧光强度的增加。可以认为这是由于血中的Lactosome发生分解而引起的。但是,该分解花费时间,而且由于猝灭状态期间利用EPR等被输送至肿瘤而滞留在血中的成分减少,因此,结果可以认为与给药1mol%IC71-PLLA30抗HER2scFv-lactosome的情况相比,T/B比变高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1