重组人尿胰蛋白酶抑制剂的新用途的制作方法
本发明属于生物医药领域,涉及重组人尿胰蛋白酶抑制剂在新用途。
背景技术:
严重烧、创伤及手术的应激打击极易诱发脓毒症等感染并发症,进一步发展可导致脓毒性休克或多器官功能障碍是临床上烧、创伤和手术等危重病患者主要死亡原因。脓毒症因其高病死率及高花费一直是国内外研究的热点,现今虽然早期液体复苏、抗菌药物治疗、营养代谢及重要器官辅助支持已取得长足进步,但严重脓毒症病死率仍居高不下。因此,深化对脓毒症认识,进一步探究其可能的治疗靶点无疑具有重要理论及临床意义。
近年来随着针对脓毒症的内毒素单克隆抗体、特异性抗炎治疗、免疫刺激剂(干扰素、单核细胞或粒细胞克隆刺激因子、特别是炎症因子抑制剂)甚至TLR4抑制剂等相关药物的相继失败,人们开始认识到在未完全明确脓毒症发病机制的情况下,无论实施抗炎治疗或免疫刺激的单一治疗均不足以能有效改善免疫/炎症反应失调,在积极抗炎治疗的同时纠正免疫功能障碍等将是防治脓毒症和改善患者预后的重要发展方向。因此,进一步探索脓毒症的免疫功能紊乱机制及其可能调控环节,在关键环节进行精确干预将有助于恢复机体正常的免疫应答状态,防止严重并发症的发生与发展,对提高急危重症的整体救治水平具有重要的理论意义和潜在的应用价值。
乌司他丁是从人新鲜尿液中分离纯化的一种能抑制多种蛋白水解酶活力的酸性糖蛋白,为尿胰蛋白酶抑制剂(Ulinary trypsin inhibitor,UTI),分子量约67KDa,由核心蛋白(143个氨基酸)和两个糖苷侧链(O-糖苷及N-糖苷)构成,核心蛋白由两个串联的Kunitz型结构域组成。UTI前体是肝脏分泌的前-α-胰蛋白酶抑制剂(pre-α-trypsin inhibitor,PαI)和间-α-胰蛋白酶抑制剂(inter-trypsin inhibitor,IαI),前者由一条重链(H3)和一条轻链(双kunitz环结构)组成;后者由二条重链(H1和H2)和一条轻链(双kunitz环结构)构成。UTI抗炎活 性主要基于轻链中双kunitz环,而O端连接的硫酸软骨素链与UTI引起的钙离子变化相关。UTI因其强大的抗蛋白酶作用及源自人体,具有无免疫原性、不良反应罕见等优势,上市以来广泛用于急性胰腺炎治疗,且疗效显著。rhUTI是采用基因工程技术,并成功在酵母中实现对人UTI的高表达,从而获得rhUTI。
内质网(endoplasmic reticulum,ER)是真核细胞内重要的细胞器,其基本生理功能包括生物大分子的加工合成、Ca2+调节等。ER非常敏感,研究显示缺血、缺氧、Ca2+平衡紊乱、ATP耗竭、蛋白质合成异常增多亦或是加工、修饰、转运障碍等均可导致ER功能失调,即内质网应激(endoplasmic reticulum stress,ERS)。适当的ERS可提高ER处理未折叠蛋白反应的能力,减轻其负荷并促进ER恢复自稳态,从而增强细胞适应和抵抗应激能力,保护细胞及其功能状态和存活至关重要。然而,ERS持续存在或过强时将引起内质网相关性细胞凋亡的发生,从而引起组织器官的损害。
技术实现要素:
为了弥补现有技术的不足,本发明的目的在于提供一种可用于严重脓毒症治疗的药物。
为了实现上述目的,本发明采用如下技术方案:
本发明提供了重组人尿胰蛋白酶抑制剂在制备治疗脓毒症的药物组合物中的用途。
进一步,所述药物组合物为冻干粉针剂或注射液。
进一步,所述药物组合物还包括药学上可接受的载体。
本发明提供了一种治疗严重脓毒症的药物组合物,所述药物组合物包括有效量的重组人尿胰蛋白酶抑制剂。其中“有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。
进一步,所述药物组合物还包括药学上可接受的载体。这类载体指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。这类载体包括(但并不限于):稀释剂、赋形剂如乳糖、氯化钠、葡萄糖、尿素、淀粉、水等、填 充剂如淀粉、蔗糖等;粘合剂如单糖浆、葡萄糖溶液、淀粉溶液、纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油;崩解剂如干淀粉、海藻酸钠、海带多糖粉末、琼脂粉末、碳酸钙和碳酸氢钠;吸收促进剂季铵化合物、十二烷基硫酸钠等;表面活性剂如聚氧化乙烯山梨聚糖脂肪酸酯、十二烷基硫酸钠、硬脂酸单甘油酯、十六烷醇等;致湿剂如甘油、淀粉等;吸附载体如淀粉、乳糖、斑脱土、硅胶、高岭土和皂粘土等;润滑剂如滑石粉、硬脂酸钙和镁、聚乙二醇、硼酸粉末等。
所述的药物组合物可以使用不同的添加剂进行制备,例如缓冲剂、稳定剂、抑菌剂、等渗剂、螯合剂、pH控制剂及表面活性剂。
所述缓冲剂可以包括硼酸、磷酸、乙酸、柠檬酸、谷氨酸及相应的盐(它们的碱金属或碱性稀土金属盐,例如钠盐、钾盐、钙盐及镁盐)。
稳定剂包括人类血清蛋白、L-氨基酸、糖及纤维素衍生物。L-氨基酸还可以包括甘氨酸、半胱氨酸及谷氨酸中的任意一个。糖类包括单糖,例如葡萄糖、甘露糖、半乳糖、果糖等;糖醇,例如甘露醇、纤维醇、木糖醇等;二糖,例如蔗糖、麦芽糖、乳糖等;多聚糖,例如葡聚糖、羟丙基淀粉、硫化软骨素、透明质酸等及它们的衍生物。纤维素衍生物包括甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙甲基纤维素及羟甲基纤维素钠。
抑菌剂包括但不限于有效浓度(例如<1%w/v)的苄醇、苯酚、间甲酚、氯丁醇、对羟基苯甲酸甲酯和/或对羟基苯甲酸丙酯。
表面活性剂包括离子或非离子表面活性剂,例如聚氧化乙烯烷基酯、山梨聚糖单酰基酯、脂肪酸甘油酯。
等渗剂包括氯化钾、氯化钠、糖及甘油。螯合剂包括乙二胺四乙酸钠及柠檬酸。
本发明提供了一种改善DC分泌功能的方法,所述方法为促进DC的成熟分化。
进一步,促进DC成熟分化的方式为向生命体施用有效量的重组人尿胰蛋白酶抑制剂。
进一步,重组人尿胰蛋白酶抑制剂干预DC中内质网应激相关分子的表达或活化。
进一步,所述的内质网应激相关分子为CHOP蛋白或Caspase-12。施用有效量的重组人尿胰蛋白酶抑制剂可以降低CHOP蛋白的表达水平和Caspase-12的活化水平。
本发明还提供了一种减轻DC凋亡的方法,即向向生命体施用有效量的重组人尿胰蛋白酶抑制剂。
本发明药物组合物的单位剂型可以是多种形式,代表性的剂型包括固体剂型如片剂、丸剂、粉剂、干粉剂、颗粒、胶囊等;液态剂型如溶液、悬浮液、乳状液、糖浆、酏剂等。
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与赋形剂中的一种或多种形成微胶囊形式。
除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
本发明所述药物可以通过任何途径给予受体,只要能达到目标组织,其可通过口服、肠胃外或局部给药,如口服给药、鼻内给药、腹腔内给药、肌内给药、皮下给药、皮内给药、肺内给药、直肠内给药、静脉内给药。
本发明的药物组合物可以单独给药,或者与其他药学上可接受的化合物联合给药。其他治疗性化合物可以与主要的活性成分(例如,重组人尿胰蛋白酶抑制剂)同时给药,甚至在同一组合物中同时给药。还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。
在疾病治疗过程中,可以根据使用目的、疾病的严重程度、患者的年龄、体重、性别、既往病历,或是作为有效成分使用的物质的种类等来决定本发明的药物组合物的给药量。
在本发明中,术语“治疗”是指改善与疾病或病症相关的症状,包括阻止或延迟疾病症状的发作和/或减少疾病或病症的严重度或频率。术语“生命体”在本文定义为包括动物如哺乳动物,包括但不限于,灵长类动物、牛、绵羊、山羊、马、狗、猫、兔子、豚鼠、大鼠、小鼠或其它牛族动物、羊科动物、马科动物、犬科动物、猫科动物、啮齿类动物或鼠类物种。优选的,动物为人。
在本发明中,属于“重组人尿胰蛋白酶抑制剂”等同于rhUTI。
本发明的优点和有益效果:
(1)本发明首次发现了重组人尿胰蛋白酶抑制剂能够有效的治疗严重脓毒症。
(2)本发明首次发现了重组人尿胰蛋白酶抑制剂与内质网应激有关,即重组人尿胰蛋白酶抑制剂可以降低内质网应激相关分子的表达或活化。根据该发现可以开发重组人尿胰蛋白酶抑制剂作为治疗跟内质网应激过度相关的疾病的候选药物。
附图说明
图1显示严重脓毒症小鼠伤后7天的生存率,其中,图1中A显示了UTI处理对严重脓毒症小鼠伤后7天生存率的影响,图1中B显示rhUTI处理对严重脓毒症小鼠伤后7天生存率的影响,图1中C显示UTI和rhUTI处理对严重脓毒症小鼠伤后7天生存率的影响;
图2显示rhUTI处理对严重脓毒症小鼠脾脏DC中内质网应激相关分子表达/活化的影响,其中,图2中A显示使用蛋白免疫印迹检测内质网应激相关分子的表达,图2中B显示统计分析内质网应激相关分子的相对表达量;
图3显示rhUTI处理对严重脓毒症小鼠脾脏DC功能状态的影响,其中,图3中A显示rhUTI处理对CD80表达的影响,图3中B显示rhUTI处理对CD86表达的影响,图3中C显示rhUTI处理对MHC-II表达的影响,图3中D显示rhUTI处理对CD80、CD86和MHC-II表达的影响;
图4显示rhUTI处理对严重脓毒症小鼠脾脏DC分泌功能的影响,其中,图4中A显示rhUTI处理对严重脓毒症小鼠脾脏DC分泌TNF-α的影响,图4中B显示rhUTI处理对严重脓毒症小鼠脾脏DC分泌IL-12的影响;
图5显示rhUTI处理对效应T的免疫调节功能的影响;
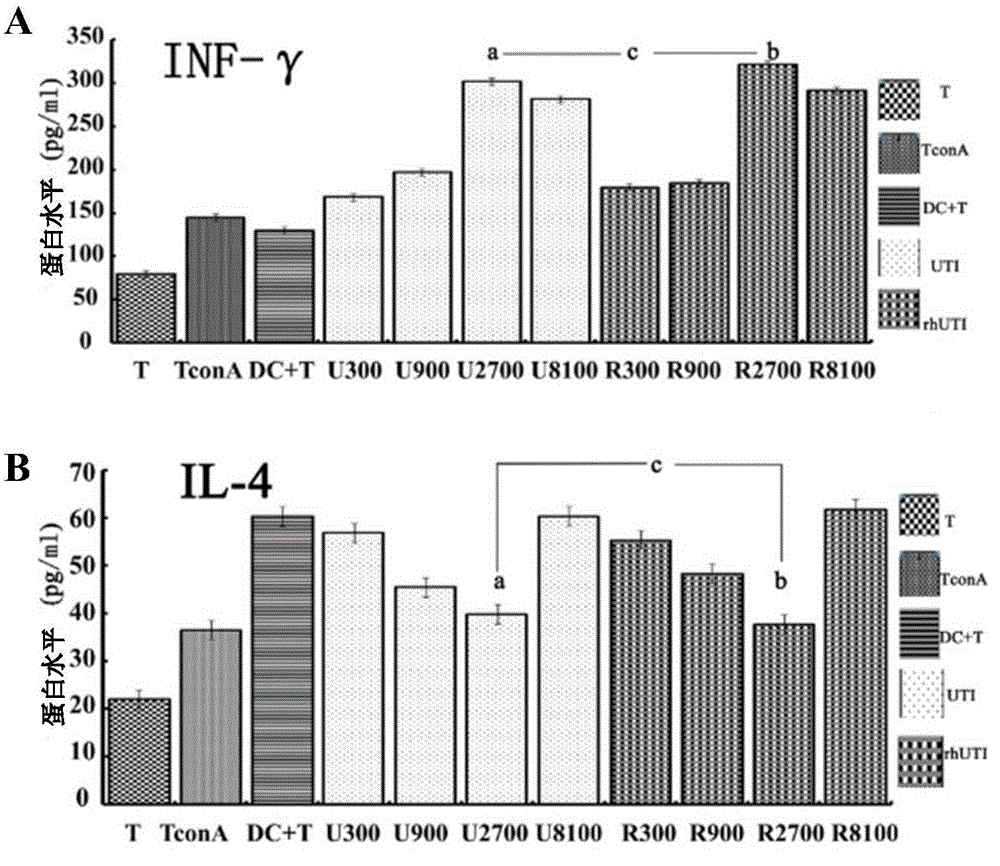
图6显示rhUTI处理对T细胞分化的影响,其中,图6中A显示rhUTI处理后INF-γ的表达水平;图6中B显示rhUTI处理后IL-4的表达水平;
图7显示rhUTI处理对严重烧脓毒症小鼠脾脏DC凋亡的影响。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring HarborLaboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。本发明实施例中所述的实验材料如无特殊说明均可从市售渠道获得。
实施例1:rhUTI对小鼠脓毒症模型生存率的影响
1、实验动物和主要试剂
雄性BALB/c小鼠,6-8w,20±2g,购自中国医学科学院实验动物研究所(动物合格证号:SCXK京2009-0007)。适应性饲养1周,自由进食水,室温25℃,昼夜节律为12h。
麻醉用药:盐酸氯胺酮注射液(上海第一生化药业公司,中国)、速眠新Ⅱ注射液(军事医学科学院军事兽医研究所研制,中国)与0.9%生理盐水(山东鲁欣药业集团,中国)按2:2.5:4.5体积比混合后使用。
rhUTI(上海万兴生物制药有限公司,中国):10万U/支,注射用乌司他丁(广东天普生化医药股份有限公司,中国):批号031211103,用之前以0.9%生理盐水稀释。
2、给药方法:
①麻醉药物按照2ml/kg方式后肢外侧肌肉麻醉。
②假伤组以及严重脓毒症伤小鼠模型均于造模完成后经耳后皮下注射0.9%NS(40ml/kg)进行补液。
③rhUTI及乌司他丁治疗组采用肌肉注射给药方式,按小鼠体重计算所用药物体积,分别于制模后0.5、12及24h进行肌肉注射给予不同剂量(10 000U/Kg, 50 000U/Kg,250 000U/Kg)。
3、实验步骤:
(1)严重脓毒症模型的构建
采用盲肠结扎穿孔术(CLP),于回盲瓣下方至盲肠根部的1/2处用3.0丝线结扎,并用22G穿刺针头贯穿末端盲肠1次,挤压盲肠使粪便溢出,然后将盲肠还纳腹腔,避免损伤回肠以及盲肠系膜血管,逐层缝合腹壁切口,轻揉腹部;假手术组(sham组)仅开腹游离盲肠后关腹,全部小鼠术后颈后皮肤常规消毒,立即颈后皮下注射生理盐水1ml,以补充术中体液丢失且抗休克并给予保暖。术后禁食12h,自由饮水,麻醉苏醒后单笼饲养。自由进食水,每12h昼夜交替一次,室内温度控制在22±2℃,湿度为40%~60%。
(2)分组及生存率观察
对242只小鼠行CLP手术后,按照随机数字表进行分组:
CLP组,n=30;
UTI+CLP组:根据UTI药浓度分为U1组(10 000U/Kg,n=33);U5组(50 000U/Kg,n=35)和U25组(250 000U/Kg,n=36);
rhUTI+CLP组:R1组(10 000U/Kg,n=36);R5组(50 000U/Kg,n=36);R25组(25 0000U/Kg,n=36)。
分别在术后0.5h、12h和24h,肌肉注射乌司他丁(10 000U/Kg,50 000U/Kg,250 000U/Kg)及rhUTI(10 000U/Kg,50 000U/Kg,250 000U/Kg),对照组在同一时间点,肌肉注射同体积生理盐水,每24h观察并对死亡小鼠进行计数。rhUTI对严重脓毒症小鼠7天生存率的影响。
4、数据统计
生存率观察实验重复5次,采用SPSS18.0统计软件对数据进行统计学分析,各组小鼠生存分析采用Log-rank检验方法进行检验,当P<0.05时具有统计学意义。
5、结果:
结果如图1所示,sham组小鼠术后状态较好,活动正常,无死亡,72h存 活率为100%。CLP组术后出现精神萎靡、反应迟钝、活动少、竖毛及腹泻等典型脓毒症症状,72h存活率不足30%。高剂量(250 000U/kg)rhUTI及UTI干预组脓毒症小鼠存活率约50%较CLP组明显提高(p<0.05)。严重脓毒症小鼠生存率改善上rhUTI与UTI无显著差异(p>0.05)。
实施例2 rhUTI处理对脓毒症小鼠脾脏DC功能状态的影响
1、实验动物和主要试剂
本实施例中所用小鼠及rhUTI同实施例1。
小鼠CD11c分离试剂盒、小鼠CD4+T分离试剂盒:Miltenyi Biltec GmbH公司,德国;小鼠ELISpot(IL-12、TNF-α)小鼠ELISPOT试剂盒(IL-4、IFN-γ):上海依科赛生物制品有限公司,中国;抗小鼠CD-86PE,CD-80APC Mouse:Miltenyi Biltec GmbH公司,德国;抗小鼠MHC-II,美国eBioscience公司;兔抗小鼠GRP78抗体,美国Epitomics公司;兔抗小鼠CHOP抗体,兔抗小鼠Caspase-12,美国Cell Signaling Technology公司。
2、实验步骤:
(1)严重脓毒症小鼠模型的构建及rhUTI用药同实施例1。
(2)小鼠脓毒症建模成功后分别于1天、2天、3天后断颈处死,留取脾脏组织,切碎研磨、200目钢筛过滤后淋巴细胞分离液分离单个核细胞,免疫磁珠法分离其中的DC,提取细胞内总蛋白,经高温变性后用于Western blotting分析。
(3)小鼠脓毒症建模成功后分别于1天、2天、3天后断颈处死,留取脾脏组织,分离获取其中的DC后,每组样本分为三份,每份约含5×105个细胞,分别与抗小鼠CD-86PE,CD-80APC MHC-II PE-cy5抗体共孵育,上流式细胞仪检测DC表面标志物表达水平。
(4)小鼠脓毒症建模成功1天后断颈处死,留取脾脏组织,分离获取其中的DC后,调整各组样本中细胞数达1×106个/mL,取细胞悬液接种于IL-12p70、TNF-αELISpot孔板(100μl/孔),各组设重复孔3个,37℃孵育24h后,按试剂盒说明进行显色及检测。
(5)免疫磁珠法提取正常小鼠脾脏CD4+T细胞,ConA刺激18h,调整细胞浓度为2×106个/mL,与脓毒症小鼠脾脏DC按150:1的比例混合均匀,接种于IL-4、IFN-γELISPOT板(100μl/孔),各组设重复孔3个,37℃孵育24h后,按试剂盒说明进行显色及检测。
3、统计学分析
实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用SPSS18.0统计软件进行统计学分析,组间比较采用两样本t检验,多组间比较采用单因素方差分析,计数资料比较采用χ2检验校正公式,当P<0.05时具有统计学意义。
4、结果
rhUTI对脓毒症小鼠脾脏DC中ERS相关分子表达/活化水平的影响如图2所示,rhUTI干预可减轻脓毒症诱导的ERS相关分子表达/活化水平的上调;rhUTI对脓毒症小鼠脾脏DC功能状态的影响如图3-6所示,rhUTI干预改善DC功能状态,促进DC成熟分化,使DC表面标志物分子表达上调(图3)、分泌功能增强(图4);增强效应T细胞的免疫调节能力、诱导T向Th1方向分化(图5、6)。
实施例3 rhUTI干预对脓毒症小鼠脾脏DC凋亡的影响
1、实验动物和主要试剂
本实施例中所用小鼠及rhUTI、小鼠CD11c分离试剂盒同实施例3。
Annexin V-PE/7-AAD凋亡检测试剂盒(100test,内含1ml Annexin-V-PE、500μl 7-AAD以及binding buffer 80ml)BD公司,美国。
2、实验步骤:
①严重脓毒症小鼠模型的构建及rhUTI用药同实施例1。
②CLP建模后1天断颈处死,留取脾脏组织,切碎研磨、200目钢筛过滤后淋巴细胞分离液分离单个核细胞,免疫磁珠法分离其中的DC,调整细胞浓度,与Annexin-V-PE、7-AAD室温下共孵育15min,上流式细胞仪检测DC凋亡情况。
3、统计学分析
实验都是按照重复3次来完成的,结果数据以平均值±标准差的方式来表示,采用SPSS18.0统计软件进行统计学分析,组间比较采用两样本t检验,多组间比较采用单因素方差分析,计数资料比较采用χ2检验校正公式,当P<0.05时具有统计学意义。
4、结果
结果如图7所示,rhUTI干预可减轻烧伤模型小鼠脾脏DC的凋亡水平,在伤后1天、2天、3天均可看到rhUTI减轻DC凋亡的所发挥的细胞保护效应。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!