一种制备层状生物降解高分子药物控释材料的方法与流程
本发明涉及一种结构形态可定构、性能可设计、可连续化生产、药物释放行为灵活可控的交替层状生物降解高分子药物缓释材料的制备,属于功能复合材料制备领域。
背景技术:
药物缓释制剂与传统给药系统相比,它们不需频繁给药,能在较长时间维持体内有效的药物浓度,减少频繁用药给病人带来的痛苦和不便,可大大提高药效并降低毒副作用。高分子药物缓释材料一般分不可生物降解材料和生物降解材料两类,其中生物降解高分子材料由于其良好的生物相容性、无毒性,不需要二次手术取出,代谢产物对人体无负担等优点,已成为药物缓释的主要研究方向之一。
近年来研制并临床应用的缓释、控释制剂种类有:1.经化学改性合成的包覆水溶性药物的溶胶凝胶、水分散体、胶乳等。 2.乳化溶剂挥发法、相分离法、喷雾干燥法、熔融法等制备的缓释微球,微胶囊等。 3.经直接压片法,热熔挤出制备的丸剂,片剂等[1]。这些传统均相缓释制剂存在很多的不足:部分制备方法的药物释放为非线性;制剂形态较为单一,用药剂量及给药方案难以灵活有效调控,增加复合给药的难度;部分制剂稳定性差,药效低。故而,复配给药技术尤其是多层缓释材料制备技术,正越来越受到学者们的重视。研究表明,把药物缓释材料设计成多层结构,能显著调控药物的释放行为。
Qiu 等人[2] 研究了布洛芬被壳聚糖和羧甲基纤维素钠包囊之后的透过性, 发现可以通过改变囊壁组成和调节囊壁厚度来控制药物的释放。Cuomo[3]等人以染料罗丹明B为模型药物,研究了罗丹明B被不同层数的壳聚糖和海藻酸盐包囊后的渗透性,发现相比于3层和5层结构而言,更高层数(7层)的囊壁结构使染料的渗透速率最慢。Chen等[4]将I型胶原与药物瑞帕霉素依次交替地喷涂于金属支架表面(I型胶原为紧贴金属表面),最外层喷涂I型胶原层以降低药物初始释放值,并通过京尼平(genipin)对I型胶原进行交联处理防止其溶解。实验制备的多层药物缓释材料的层数高达21层(11层I型胶原,10层瑞帕霉素),对药物释放行为进行表征,发现药物基本为恒速释放,无明显突释现象,药物释放持续时间与层数相关。Choi等[5]在磷脂和聚乙烯醇的自组装多层载药体系中,将紫杉醇负载于磷脂层,通过改变载药磷脂层的相对位置,研究药物抑制癌细胞增殖作用。研究发现当载药层在最顶层时,释药初期细胞增殖迅速被抑制,当载药层在底层药物释放受阻隔层阻碍时,细胞数量保持平稳。这种药物负载方式的调节对于药物释放行为有明显调控作用。
以上研究虽能克服传统均相载药材料带来的用药剂量及给药方案难以灵活有效调控等问题,但由于其多用溶液法进行制备,存在溶剂除去困难、基体及药物选择有较大局限性、工艺复杂,难以满足工业化大规模生产的需求。为解决这些问题,以期在一次熔融加工过程中制备多层药物缓释材料,实现药物的灵活有效释放和良好复配,控制生物降解高分子材料的层结构是关键。如何通过结构设计使材料具备合理的初始释放浓度和长期释放速率,达到既速效又长效的目的,增加药物缓释材料的用药剂量及给药方案的灵活可调性,满足对药物释放的不同需要是现阶段迫切需要解决的问题。
参考文献
[1] 朱兴年. 药物缓释、控释制剂的研究进展. 药学实践杂志, 2002, 20(3):155-157.
[2] Qiu X, Leporatti S, Donath E, et al. Studies on the drug release properties of polysaccharide multilayers encapsulated ibuprofen microparticles. Langmuir, 2001, 17(17): 5375-5380.
[3] Cuomo F, Lopez F, Piludu M, et al. Release of small hydrophilic molecules from polyelectrolyte capsules: Effect of the wall thickness. Journal of colloid and interface science, 2015, 447: 211-216.
[4] Chen M C, Liang H F, Chiu Y L, et al. A novel drug-eluting stent spray-coated with multi-layers of collagen and sirolimus. Journal of controlled release, 2005, 108(1): 178-189.
[5] Choi J, Konno T, Takai M, et al. Regulation of cell proliferation by multi-layered phospholipid polymer hydrogel coatings through controlled release of paclitaxel. Biomaterials, 2012, 33(3): 954-961。
技术实现要素:
针对传统溶液法制备层状生物降解高分子药物缓释材料的缺点及不足,本发明的目的旨在提出一种熔融共挤出制备结构形态可定构、性能可设计、可连续化生产、药物释放行为灵活可控的层状生物降解高分子药物控释材料的方法。该方法能通过结构设计和调控药物分布使材料具备合理的初始释放浓度和所需的长期释放速率,达到既速效又长效的目的,增加药物缓释材料的用药剂量及给药方案的灵活可调性,满足对药物释放的不同需要;通过对不同药效药物负载情况的设计,可实现不同药效药物的良好复配;并可实现药物释放性能和力学性能同时提高。该方法同时有生产连续性强、质量稳定、适宜大规模工业化生产的优点。
本发明的基本原理是,通过组分设计得到高分子基药物负载层物料和高分子基阻隔层物料,通过熔融共挤出的方式使高分子基药物负载层物料和高分子基阻隔层物料交替有序排布形成交替层状生物降解高分子药物控释材料,并通过交替层结构设计,灵活调控高分子基药物负载层形态结构,优化药物分散状态;利用层倍增器在多次层状叠合时的剪切、拉伸作用使高分子在挤出过程中得以变形及取向,调控高分子基阻隔层基体和分散相的形态结构,改善药物扩散及释放通道,使得到的交替层状生物降解高分子药物控释材料具备合理的初始释放浓度和所需的长期释放速率,达到既速效又长效的目的。同时由于不同药物对所获得释放通道具有不同的释放响应,故而可在高分子基药物负载层中同时负载不同药物,通过调节药物扩散及释放通道来调控不同药物的释放行为,实现不同药效药物的良好复配。本发明从这点出发,在加工方法上致力于实现不同释药行为的高分子基药物负载层和高分子基阻隔层的良好交替复配,并通过对材料单层结构和整体层结构的形态调控来控制药物释放周期,由此调控药物在交替层状生物降解高分子药物控释材料中的释放行为。具体来讲,本发明是通过组分比改变药物在高分子基药物负载层中的释放行为,采用熔融共挤出工艺在分层叠加力场作用下通过剪切拉伸作用调节药物的分散状态和高分子的取向,并通过调节高分子基药物负载层和高分子基阻隔层的单层结构、层数和相对厚度改变药物释放通道并调控药物释放周期,最终得到的交替层状生物降解高分子药物控释材料的药物释放行为灵活可调,力学性能也得到同步提高。
本发明基于上述原理,实现上述发明目的所采用的技术方案是:由以下高分子基药物负载层物料和高分子基阻隔层物料分别经挤出机熔融塑化挤出、并在汇流器出口处叠合在一起形成以下初始结构后,再经过与汇流器连接的若干层倍增器的多次层状叠合作用,形成具有两相交替排布多层结构的挤出物:
(1)所述的高分子基药物负载层中的高分子为较难溶解或降解的生物降解高分子材料(药物负载层的高分子基体)和易于溶解或降解的生物降解高分子材料(药物负载层的高分子分散相)按重量百分比为50~99.99%:50~0.01%进行混合的共混物;
(2) 所述的高分子基阻隔层中的高分子为较难溶解或降解的生物降解高分子材料(阻隔层的高分子基体)和易于溶解或降解的高分子材料(阻隔层的高分子分散相)按重量百分比为50~99%:50~1%进行混合的共混物。
在上述经过与汇流器连接的若干层倍增器的多次层状叠合作用的过程中,制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤装置,其特点是先分别制备高分子基药物负载层物料和高分子基阻隔层物料,然后将高分子基药物负载层物料和高分子基阻隔层物料分别投入微层共挤出装置的两台挤出机(A、B)中,熔融塑化后,使两股熔体在分配器(C)中叠合,经n个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过三辊压延机的压制和牵引机的牵引,得到2(n+1)层由高分子基药物负载层和高分子基阻隔层连续交替分布的交替层状生物降解高分子药物控释材料。
这样就可以通过多层共挤出的方法实现高分子基药物负载层和高分子基阻隔层的交替叠加,并通过构建复合材料的形态结构,实现交替层状生物降解高分子药物控释材料的结构优化,使材料具备合理的初始释放浓度和所需的长期释放速率,并使药物释放性能和力学性能同时得到提高。这种新型生物降解高分子药物缓释材料的制备方法一方面能灵活调控高分子材料的形态结构,从而调控药物在其中的释放行为,另一方面可避免溶剂的使用,从根本上解决了溶剂难以处理,污染环境等问题。
上述所得的交替层状生物降解高分子药物控释材料实际为片材型药物缓释复合材料,可再根据释药和应用需求裁剪成不同形状和尺寸的药物缓释复合材料,从而满足不同的释药需求。
上述所述的高分子基药物负载层中的高分子为生物降解高分子材料的共混物,其中较难溶解或降解的高分子材料为基体(即高分子基药物负载层的高分子基体),选自聚己内酯、聚乳酸、聚丁二酸丁二酯、羟丙基纤维素、乙基纤维素和醋酸纤维素中的一种;易于溶解或降解的高分子材料为分散相(即高分子基药物负载层的高分子分散相),选自聚氧化乙烯、聚乙二醇、热塑性淀粉和热塑性聚乙烯醇中的一种。
上述所述的高分子基药物负载层中的药物含量为该层高分子总重量的0.01~40%,选自布洛芬、酮洛芬、酒石酸美托洛尔、马来酸氯苯那敏、氢氯噻嗪和双氯芬酸钠中的一种或几种。
上述先制备高分子基药物负载层物料的方式是将该层中高分子和药物在高混机中进行混合。
上述先制备高分子基药物负载层物料的方式也可以是将该层中高分子和药物在挤出机中进行熔融混合。
上述先制备高分子基药物负载层物料的方式也可以是将该层中高分子和药物先在高混机中进行混合,再在挤出机中进行熔融混合。
上述所述的的高分子基阻隔层中的高分子基体选自聚己内酯、聚乳酸、聚丁二酸丁二酯、羟丙基纤维素、乙基纤维素和醋酸纤维素中的一种,高分子基阻隔层的高分子分散相选自聚氧化乙烯、聚乙二醇、热塑性淀粉和热塑性聚乙烯醇中的一种。
上述先制备高分子基阻隔层物料的方式是将该层中高分子共混物在高混机中进行混合。
上述先制备高分子基阻隔层物料的方式也可以是将该层中高分子共混物在挤出机中进行熔融混合。
上述先制备高分子基阻隔层物料的方式也可以是将该层中高分子共混物先在高混机中进行混合,再在挤出机中进行熔融混合。
上述所述挤出物是由两台挤出机(A、B)、汇流器(C)、若干层倍增器(D)、出口模(E)和冷却牵引装置(F)组成的多层挤出系统通过熔融挤出制备得到,其药物控释性能可通过总厚度、内部的总层数、高分子基药物负载层和高分子基阻隔层的厚度比进行调控,其中:挤出物的总厚度为0.01-10mm;挤出物内部的总层数数目为2-32769;所述高分子基药物负载层和高分子基阻隔层的厚度比为1:99-99:1。
上述所述挤出物初始结构的层数可以通过所述汇流器(C)中的切换器对流道数进行调控:2个流道得到的初始结构为2层、3个流道得到的初始结构为3层;挤出物的层数可通过初始结构层数和层倍增器个数按照以下方式进行调控:
(1) 当初始结构为2层,并使用n个层倍增器时,挤出物的层数为2(n+1)层,其中:n为0-14。
(2) 当初始结构为3层,并使用n个层倍增器时,挤出物的层数为2(n+1)+1层,其中:n为0-14。
本发明与现有技术的溶液法制备层状生物降解高分子药物缓释材料的方法相比,概括起来具有以下突出的优点:
1、本发明制备的交替层状生物降解高分子药物控释材料形成药物负载层和阻隔层交替排布的层状结构,组合层倍增器的楔形流道可细化分散相尺寸、改善相形态。选用不同数量的层倍增器,并通过调控挤出机转速比可设计层结构形态及高分子基药物负载层和高分子基阻隔层的厚度比,进而定构所需的释放通道,进而调控药物的释放周期,制备性能可控的材料,在实现高分子结构、形态和药物释放性能的智能化调控的同时同步提高材料力学性能。
2、该方法能实现药物的选择性分散,并能实现不同药物的良好复配,从而获得不同药效药物的可控复合释放行为。
3、能精确计算和控制药物负载量,克服由于药物负载量计量不准而导致的药物释放量难以精确控制的难题。同时药物加入量灵活可调,其占聚合物重量的0.01~40%之间,避免一般制备药物缓释体系时药物加入量局限性大的缺点。
4、本发明公开的熔融共挤出制备交替层状生物降解高分子药物控释材料的方法,制备过程一次成型,工艺简单,操作控制方便;生物相容性良好,对人体无毒害作用,不需添加其他对人体有负担的试剂,适用于大多数对热不敏感药物的可控释放。通过调节和控制两台挤出机的挤出转速比,可以调整载药层和阻隔层的厚度;通过控制增减层倍增器的数量,可灵活调节交替多层材料的层数,进而调控药物的释放行为。
5、该方法是一种连续生产过程,有利于生产效率的提高;工艺简单,不同批次之间的产品质量指标稳定,可大规模工业化生产,应用范围广,具有广阔的工业化和市场前景;实现了聚合物产品高性能化和功能化同一,提高了聚合物产品的附加价值,拓宽了聚合物产品的应用范围,在聚合物复合材料理论研究和应用开发等方面具有重要意义。
附图说明
下面结合附图进一步说明本发明。
图1为本发明所涉及的微层共挤装置的结构示意图:A,B为挤出机;C为分配器;D为层倍增器;E为冷却牵引装置。
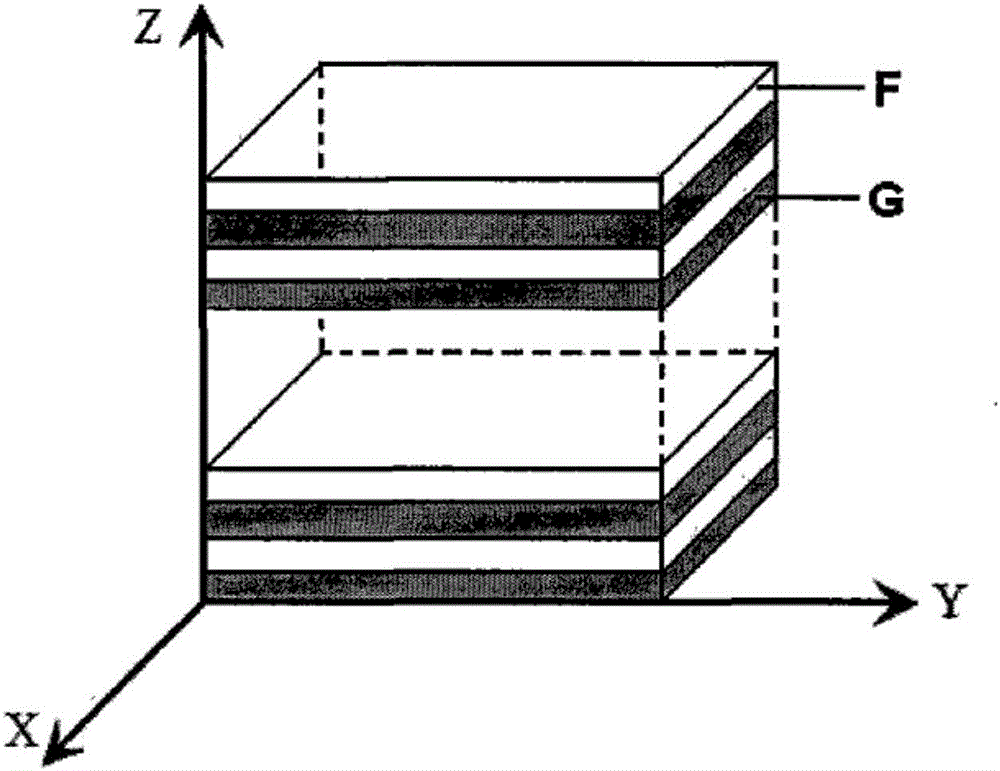
图2为本发明制备的多层生物降解高分子药物缓释材料的结构放大示意图。在图中,F:载药层,G:阻隔层。
具体实施方法:
以下通过实施例对本发明进行进一步的具体描述。在以下各实施例中,各组分的用量均为质量用量。有必要在此指出,下面实施例只是对本发明的进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本发明内容对本发明进行一些非本质的改进和调整。
实施例1
第一步,高分子基药物负载层(以下简称载药层)选用聚己内酯为载药层基体(分子量为80000),聚氧化乙烯为载药层分散相(分子量为100000),并以重量百分比90%:10%配料;酒石酸美托洛尔为载药层药物,按载药层高分子总重量的10%进行配料。将上述高分子和药物在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基药物负载层物料。
高分子基阻隔层(以下简称阻隔层)选用聚己内酯为阻隔层基体(分子量为80000),聚氧化乙烯为阻隔层分散相(分子量为100000),并以重量百分比70%:30%配料。将上述高分子在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基阻隔层物料。
第二步,将第一步制备的高分子基药物负载层物料和高分子基阻隔层物料分别投入在中国专利CN101439576A中公开的由挤出机A、B、分配器C、层倍增器D构成的微层共挤装置的挤出机A和挤出机B(见图1)中,调节载药层和阻隔层挤出机的转速比为1:1,当挤出机内的物料熔融塑化后,使两股熔体在分配器C中叠合,并经6个层倍增器的多次层状叠合时的剪切、拉伸作用,再经过三辊压延机的压制和牵引机的牵引,即可得到挤出的总层数为128层、其中载药层(共64层)和阻隔层(共64层)交替排布的宽40mm、厚1.8mm的复合材料(参见图2),其中,载药层和阻隔层的层厚比为1:1。挤出机A、B加料口、输送段、熔融段、均化段、口模、汇流器、层倍增器的温度分别为40℃、80℃、120℃、120℃、120℃、120℃、120℃。
将上述得到的交替层状生物降解高分子药物控释材料进行切粒、收集,并经过不采用微层共挤装置的普通挤出机进行挤出,再经过三辊压延机的压制和牵引机的牵引,得到宽40mm、厚1.8mm的均相生物降解高分子药物释放材料,其中挤出机加料口、输送段、熔融段、均化段、口模的温度分别为40℃、80℃、120℃、120℃、120℃。所得到的均相生物降解高分子药物释放材料具有和上述交替层状生物降解高分子药物控释材料相同的物料配比,但其非交替层状结构,而是均相复合结构。所得到的均相生物降解高分子药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放达50%的药物,5天释放量达85%,表现出明显的突释行为。
而由于本实施例采用了由6个层倍增器,其得到的药物酒石酸美托洛尔选择性分布于高分子基药物负载层的128层交替层状生物降解高分子药物控释材料24小时释放15%的药物,26天释放93%,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其拉伸强度也由原来的10.35 MPa提高到14.9 MPa。说明交替层状生物降解高分子药物控释材料的药物释放行为和拉伸强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物酒石酸美托洛尔的交替层状生物降解高分子药物控释材料功能化和高性能化得到统一。这主要是由于载药层和阻隔层的交替存在,使得材料在浸泡过程中,载药层受阻隔层空间限制作用,初始释放值降低,药物突释消失,显示出良好的初始释放行为;同时阻隔层的阻隔作用及层状结构带来的层厚度方向药物扩散和释放通道的改变使释放周期延长,显示出良好的长效释放行为(由于材料厚度远小于长度和宽度,药物释放速率的决定因素是厚度方向药物的释放行为)。而且,由于层倍增器的多次层状叠合时的剪切、拉伸作用,交替多层共混物中有成百层界面存在,层界面相容性好,粘接性强,界面作用力大,故而在受外界拉伸作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了交替多层共混复合材料更加优异的拉伸性能。故而材料在获得良好释放行为的同时,其强度也得到提升。可根据实际需要调整实施例1的配方、层厚比和层数,进而获得不同分散相含量的交替层状生物降解高分子药物控释材料。
实施例2
第一步,高分子基药物负载层(以下简称载药层)选用聚丁二酸丁二酯为载药层基体(分子量为100000),聚乙二醇为载药层分散相(分子量为6000),并以重量百分比90%:10%配料;布洛芬为载药层药物,按载药层高分子总重量的20%进行配料。将上述高分子和药物在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基药物负载层物料。
高分子基阻隔层(以下简称阻隔层)选用聚己内酯为阻隔层基体(分子量为80000),聚氧化乙烯为阻隔层分散相(分子量为100000),并以重量百分比80%:20%配料。将上述高分子在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基阻隔层物料。
第二步,将第一步制备的高分子基药物负载层物料和高分子基阻隔层物料分别投入在中国专利CN101439576A中公开的由挤出机A、B、分配器C、层倍增器D构成的微层共挤装置的挤出机A和挤出机B(见图1)中,调节载药层和阻隔层挤出机的转速比为1:2,当挤出机内的物料熔融塑化后,使两股熔体在分配器C中叠合,并经4个层倍增器的多次层状叠合时的剪切、拉伸作用,再经过三辊压延机的压制和牵引机的牵引,即可得到挤出的总层数为32层、其中载药层(共16层)和阻隔层(共16层)交替排布的宽40mm、厚1.8mm的复合材料(参见图2),其中,载药层和阻隔层的层厚比为1:2。挤出机A、B加料口、输送段、熔融段、均化段、口模、汇流器、层倍增器的温度分别为50℃、100℃、130℃、130℃、130℃、130℃、130℃。
将上述得到的交替层状生物降解高分子药物控释材料进行切粒、收集,并经过不采用微层共挤装置的普通挤出机进行挤出,再经过三辊压延机的压制和牵引机的牵引,得到宽40mm、厚1.8mm的均相生物降解高分子药物释放材料,其中挤出机加料口、输送段、熔融段、均化段、口模的温度分别为50℃、100℃、130℃、130℃、130℃。所得到的均相生物降解高分子药物释放材料具有和上述交替层状生物降解高分子药物控释材料相同的物料配比,但其非交替层状结构,而是均相复合结构。所得到的均相生物降解高分子药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放超过45%的药物,显示出明显的突释现象。
而由于本实施例采用了由4个层倍增器,其得到的药物布洛芬选择性分布于高分子基药物负载层的32层交替层状生物降解高分子药物控释材料24小时释放18%的药物,10天共释放89%的药物,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其拉伸强度也由原来的35.4 MPa提高到46.9 MPa。说明交替层状生物降解高分子药物控释材料的药物释放行为和拉伸强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物布洛芬的交替层状生物降解高分子药物控释材料功能化和高性能化得到统一。这主要是由于载药层和阻隔层的交替存在,使得材料在浸泡过程中,载药层受阻隔层空间限制作用,初始释放值降低,药物突释消失,显示出良好的初始释放行为;同时阻隔层的阻隔作用及层状结构带来的层厚度方向药物扩散和释放通道的改变使释放周期延长,显示出良好的长效释放行为(由于材料厚度远小于长度和宽度,药物释放速率的决定因素是厚度方向药物的释放行为)。而且,由于层倍增器的多次层状叠合时的剪切、拉伸作用,交替多层共混物中有成百层界面存在,层界面相容性好,粘接性强,界面作用力大,故而在受外界拉伸作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了交替多层共混复合材料更加优异的拉伸性能。故而材料在获得良好释放行为的同时,其强度也得到提升。可根据实际需要调整实施例2的配方、层厚比和层数,进而获得不同分散相含量的交替层状生物降解高分子药物控释材料。
实施例3
第一步,高分子基药物负载层(以下简称载药层)选用乙基纤维素为载药层基体(分子量为130000),聚乙二醇为载药层分散相(分子量为6000),并以重量百分比80%:20%配料;氢氯噻嗪为载药层药物1,酒石酸美托洛尔为载药层药物2,分别按载药层高分子总重量的20%和10%进行配料。将上述高分子和药物在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基药物负载层物料。
高分子基阻隔层(以下简称阻隔层)选用乙基纤维素为阻隔层基体(分子量为80000),聚乙二醇为阻隔层分散相(分子量为6000),并以重量百分比80%:20%配料。将上述高分子在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基阻隔层物料。
第二步,将第一步制备的高分子基药物负载层物料和高分子基阻隔层物料分别投入在中国专利CN101439576A中公开的由挤出机A、B、分配器C、层倍增器D构成的微层共挤装置的挤出机A和挤出机B(见图1)中,调节载药层和阻隔层挤出机的转速比为1:1,当挤出机内的物料熔融塑化后,使两股熔体在分配器C中叠合,并经3个层倍增器的多次层状叠合时的剪切、拉伸作用,再经过三辊压延机的压制和牵引机的牵引,即可得到挤出的总层数为16层、其中载药层(共8层)和阻隔层(共8层)交替排布的宽40mm、厚1.8mm的复合材料(参见图2),其中,载药层和阻隔层的层厚比为1:1。挤出机A、B加料口、输送段、熔融段、均化段、口模、汇流器、层倍增器的温度分别为50℃、100℃、140℃、140℃、140℃、140℃、140℃。
将上述得到的交替层状生物降解高分子药物控释材料进行切粒、收集,并经过不采用微层共挤装置的普通挤出机进行挤出,再经过三辊压延机的压制和牵引机的牵引,得到宽40mm、厚1.8mm的均相生物降解高分子药物释放材料,其中挤出机加料口、输送段、熔融段、均化段、口模的温度分别为50℃、100℃、140℃、140℃、140℃。所得到的均相生物降解高分子药物释放材料具有和上述交替层状生物降解高分子药物控释材料相同的物料配比,但其非交替层状结构,而是均相复合结构。所得到的均相生物降解高分子药物释放材料在磷酸盐缓冲液(PBS)中浸泡48小时氢氯噻嗪释放量约为45%,7天释放98%,24小时酒石酸美托洛尔释放量为30%,9天释放95%,均显示出明显的突释现象。
而由于本实施例采用了由3个层倍增器,其得到的药物氢氯噻嗪和酒石酸美托洛尔选择性分布于高分子基药物负载层的16层交替层状生物降解高分子药物控释材料48小时释放25%的氢氯噻嗪,之后27天的药物释放曲线基本为线性,24小时释放10%的酒石酸美托洛尔,29天共释放94%的药物,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其拉伸强度也由原来的5.4 MPa提高到10.9 MPa。说明交替层状生物降解高分子药物控释材料的药物释放行为和拉伸强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物氢氯噻嗪和酒石酸美托洛尔的交替层状生物降解高分子药物控释材料功能化和高性能化得到统一。这主要是由于载药层和阻隔层的交替存在,使得材料在浸泡过程中,载药层受阻隔层空间限制作用,初始释放值降低,药物突释消失,显示出良好的初始释放行为;同时阻隔层的阻隔作用及层状结构带来的层厚度方向药物扩散和释放通道的改变使释放周期延长,显示出良好的长效释放行为(由于材料厚度远小于长度和宽度,药物释放速率的决定因素是厚度方向药物的释放行为)。而且,由于层倍增器的多次层状叠合时的剪切、拉伸作用,交替多层共混物中有成百层界面存在,层界面相容性好,粘接性强,界面作用力大,故而在受外界拉伸作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了交替多层共混复合材料更加优异的拉伸性能。故而材料在获得良好释放行为的同时,其强度也得到提升。可根据实际需要调整实施例3的配方、层厚比和层数,进而获得不同分散相含量的交替层状生物降解高分子药物控释材料。
实施例4
第一步,高分子基药物负载层(以下简称载药层)选用聚乳酸为载药层基体(分子量为180000),热塑性淀粉为载药层分散相(分子量为50000),并以重量百分比85%:15%配料;双氯芬酸钠为载药层药物,按载药层高分子总重量的30%进行配料。将上述高分子和药物在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基药物负载层物料。
高分子基阻隔层(以下简称阻隔层)选用聚乳酸为阻隔层基体(分子量为180000),聚乙二醇为阻隔层分散相(分子量为60000),并以重量百分比60%:40%配料。将上述高分子在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基阻隔层物料。
第二步,将第一步制备的高分子基药物负载层物料和高分子基阻隔层物料分别投入在中国专利CN101439576A中公开的由挤出机A、B、分配器C、层倍增器D构成的微层共挤装置的挤出机A和挤出机B(见图1)中,调节载药层和阻隔层挤出机的转速比为1:1,当挤出机内的物料熔融塑化后,使两股熔体在分配器C中叠合,并经5个层倍增器的多次层状叠合时的剪切、拉伸作用,再经过三辊压延机的压制和牵引机的牵引,即可得到挤出的总层数为64层、其中载药层(共32层)和阻隔层(共32层)交替排布的宽40mm、厚1.8mm的复合材料(参见图2),其中,载药层和阻隔层的层厚比为1:1。挤出机A、B加料口、输送段、熔融段、均化段、口模、汇流器、层倍增器的温度分别为80℃、150℃、180℃、180℃、180℃、180℃、180℃。
将上述得到的交替层状生物降解高分子药物控释材料进行切粒、收集,并经过不采用微层共挤装置的普通挤出机进行挤出,再经过三辊压延机的压制和牵引机的牵引,得到宽40mm、厚1.8mm的均相生物降解高分子药物释放材料,其中挤出机加料口、输送段、熔融段、均化段、口模的温度分别为80℃、150℃、180℃、180℃、180℃。所得到的均相生物降解高分子药物释放材料具有和上述交替层状生物降解高分子药物控释材料相同的物料配比,但其非交替层状结构,而是均相复合结构。所得到的均相生物降解高分子药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放超过50%的双氯芬酸钠,显示出明显的突释现象。
而由于本实施例采用了由5个层倍增器,其得到的药物双氯芬酸钠选择性分布于高分子基药物负载层的64层交替层状生物降解高分子药物控释材料24小时释放20%的双氯芬酸钠,之后11天的药物释放曲线基本为线性,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其拉伸强度也由原来的40.4 MPa提高到73.9 MPa。说明交替层状生物降解高分子药物控释材料的药物释放行为和拉伸强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物双氯芬酸钠的交替层状生物降解高分子药物控释材料功能化和高性能化得到统一。这主要是由于载药层和阻隔层的交替存在,使得材料在浸泡过程中,载药层受阻隔层空间限制作用,初始释放值降低,药物突释消失,显示出良好的初始释放行为;同时阻隔层的阻隔作用及层状结构带来的层厚度方向药物扩散和释放通道的改变使释放周期延长,显示出良好的长效释放行为(由于材料厚度远小于长度和宽度,药物释放速率的决定因素是厚度方向药物的释放行为)。而且,由于层倍增器的多次层状叠合时的剪切、拉伸作用,交替多层共混物中有成百层界面存在,层界面相容性好,粘接性强,界面作用力大,故而在受外界拉伸作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了交替多层共混复合材料更加优异的拉伸性能。故而材料在获得良好释放行为的同时,其强度也得到提升。可根据实际需要调整实施例4的配方、层厚比和层数,进而获得不同分散相含量的交替层状生物降解高分子药物控释材料。
实施例5
第一步,高分子基药物负载层(以下简称载药层)选用羟丙基纤维素为载药层基体(分子量为1150000),聚乙二醇为增塑剂(分子量为400),并以重量百分比98%:2%配料;马来酸氯苯那敏为载药层药物,按载药层高分子总重量的5%进行配料。将上述高分子和药物在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基药物负载层物料。
高分子基阻隔层(以下简称阻隔层)选用聚丁二酸丁二酯为阻隔层基体,聚氧化乙烯为阻隔层分散相(分子量为1000000),并以重量百分比90%:10%配料。将上述高分子在高搅机中混合5 分钟,其转速为100转/分钟,得到高分子基阻隔层物料。
第二步,将第一步制备的高分子基药物负载层物料和高分子基阻隔层物料分别投入在中国专利CN101439576A中公开的由挤出机A、B、分配器C、层倍增器D构成的微层共挤装置的挤出机A和挤出机B(见图1)中,调节载药层和阻隔层挤出机的转速比为1:1,当挤出机内的物料熔融塑化后,使两股熔体在分配器C中叠合,并经2个层倍增器的多次层状叠合时的剪切、拉伸作用,再经过三辊压延机的压制和牵引机的牵引,即可得到挤出的总层数为8层、其中载药层(共4层)和阻隔层(共4层)交替排布的宽40mm、厚1.8mm的复合材料(参见图2),其中,载药层和阻隔层的层厚比为1:1。挤出机A、B加料口、输送段、熔融段、均化段、口模、汇流器、层倍增器的温度分别为80℃、150℃、180℃、180℃、180℃、180℃、180℃。
将上述得到的交替层状生物降解高分子药物控释材料进行切粒、收集,并经过不采用微层共挤装置的普通挤出机进行挤出,再经过三辊压延机的压制和牵引机的牵引,得到宽40mm、厚1.8mm的均相生物降解高分子药物释放材料,其中挤出机加料口、输送段、熔融段、均化段、口模的温度分别为80℃、150℃、180℃、180℃、180℃。所得到的均相生物降解高分子药物释放材料具有和上述交替层状生物降解高分子药物控释材料相同的物料配比,但其非交替层状结构,而是均相复合结构。所得到的均相生物降解高分子药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放超过60%的药物,之后3天释放接近完全,显示出释放初期有明显的突释。
而由于本实施例采用了由2个层倍增器,其得到的药物马来酸氯苯那敏选择性分布于高分子基药物负载层的8层交替层状生物降解高分子药物控释材料48小时释放20%的药物,到第17天药物释放量达95%,表明本实施例采用的方法能显著降低释放初期的突释行为,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其拉伸强度也由原来的25.68 MPa提高到37.89 MPa。说明交替层状生物降解高分子药物控释材料的药物释放行为和拉伸强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物马来酸氯苯那敏的交替层状生物降解高分子药物控释材料功能化和高性能化得到统一。这主要是由于载药层和阻隔层的交替存在,使得材料在浸泡过程中,载药层受阻隔层空间限制作用,初始释放值降低,药物突释消失,显示出良好的初始释放行为;同时阻隔层的阻隔作用及层状结构带来的层厚度方向药物扩散和释放通道的改变使释放周期延长,显示出良好的长效释放行为(由于材料厚度远小于长度和宽度,药物释放速率的决定因素是厚度方向药物的释放行为)。而且,由于层倍增器的多次层状叠合时的剪切、拉伸作用,交替多层共混物中有成百层界面存在,层界面相容性好,粘接性强,界面作用力大,故而在受外界拉伸作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了交替多层共混复合材料更加优异的拉伸性能。故而材料在获得良好释放行为的同时,其强度也得到提升。可根据实际需要调整实施例5的配方、层厚比和层数,进而获得不同分散相含量的交替层状生物降解高分子药物控释材料。
- 还没有人留言评论。精彩留言会获得点赞!