一种人SARDH多肽及其抗体制备方法与流程
本发明涉及一种多肽及其抗体制备方法,这种抗体主要用于天然蛋白抗原的检测。
2.
背景技术:
1)SARDH功能:肌氨酸脱氢酶SARDH位于线粒体基质中,由918个氨基酸组成。其表达基因位于人体9号染色体上。主要参与细胞内胺和多胺的降解过程。SARDH以黄素蛋白和FAD做为辅助因子,催化肌氨酸的氧化去甲基化作用,并形成甲醛和甘氨酸等产物。SARDH合成基因缺陷的人群罹患肌氨酸血症。此类疾病属于良性的代谢功能紊乱症,同时伴有血浆和尿液中肌氨酸水平的升高,在有些患者中还会出现智力迟钝和其他神经类疾病。
2)SARDH抗体产品信息:经检索,除我公司产品外,市场上没有其他Anti-SARDH多克隆抗体。
3)SARDH抗体的应用:
一组近期发表在Neoplasia杂志上的研究表明前列腺癌进展期病人细胞内肌氨酸(N-甲基化甘氨酸)的水平明显升高,并且伴有尿液中此类代谢产物浓度的显著升高(Khan et al.,2013,Neoplasia 15,491-501)。在此类恶性程度高的癌症病人中,肌氨酸合成酶,即甘氨酸N-甲基转移酶(GNMT)的水平在前列腺癌组织中的浓度明显升高,而两类肌氨酸代谢酶,即肌氨酸脱氢酶SARDH和哌啶酸氧化酶PIPOX的细胞浓度却显著下降。进一步研究表明GNMT通过促进肌氨酸的合成使得前列腺癌癌细胞的恶性程度提高,而SARDH则通过降低细胞内肌氨酸的水平使得癌细胞恶性程度下降。实验表明GNMT敲出或SARDH过表达的前列腺癌细胞的生长和转移都受到抑制。此项研究得出的结论与另外一组研究(Chen et al.,2011,J Biol Chem 286,16091-16100)得出的结果相类似,即SARDH很可能是前列腺癌分化,生长和转移的细胞抑制因子。因此,将来SARDH在前列腺癌的诊断,治疗和预后评估等方面很可能成为重要的生物标志物。
3.
技术实现要素:
本发明提供了一种SARDH多肽,其序列为:RERSHESYAKNYSV。用此多肽制备的抗SARDH抗体可以在免疫印迹(Western blot)及免疫组化(IHC) 分析中特异识别组织或细胞中的天然SARDH蛋白。
抗SARDH抗体是通过以下步骤获得的:
步骤一:多肽序列的分析和设计:利用DNAstar软件对SARDH蛋白的氨基酸序列进行抗原表位分析,主要评估亲水性,抗原性,表面可能性,柔性区等指数,再结合过去制备抗体的实际经验,最终确定SARDH蛋白457-470位14个氨基酸作为合成多肽氨基酸序列,序列为RERSHESYAKNYSV。
步骤二:多肽合成和交联:采用ACT396全自动多通道多肽合成仪合成目的多肽,并采用质谱进行鉴定;为增强多肽的抗原性,将SARDH多肽与载体蛋白KLH采用Sulfo-SMCC交联法进行交联。
步骤三:多肽免疫和抗血清制备:将交联后的SARDH-KLH与弗氏佐剂混合乳化,在新西兰兔背部进行皮内注射免疫,并反复加强免疫,至取血检测抗体效价达到标准时停止免疫。
步骤四:抗体纯化:实验兔抗体效价达到标准后,采用心脏取血,分离抗血清,采用Protein A纯化全抗体后,进一步采用肽亲和纯化,得到目标抗体。
抗SARDH抗体是通过以下步骤鉴定的:
步骤一:免疫印迹:将所获得的SARDH抗体作为一抗,采用标准的免疫印迹方法,确认该抗体能够与变性后的天然SARDH蛋白相互作用,可用于免疫印迹试验。
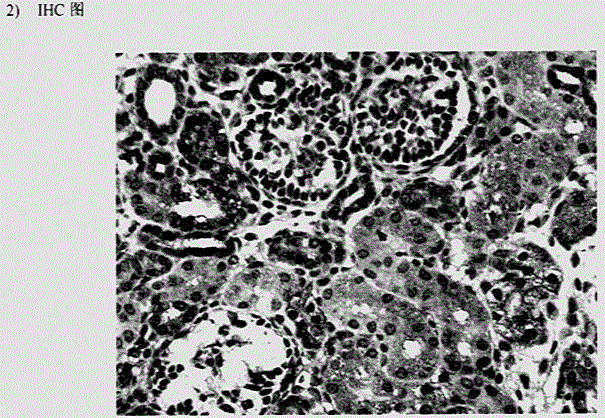
步骤二:免疫组化:将所获得的SARDH抗体作为一抗,采用标准的免疫组化方法,用于检测组织芯片(9种人体组织),确认该抗体能够与具有天然结构的SARDH蛋白相互作用,可用于免疫组化试验。
4.附图说明
图1为免疫印迹图(Western blot)
图2为免疫组化(IHC)图
5.具体实施方式
1.多肽序列的分析和设计
利用DNAstar软件对SARDH蛋白的氨基酸序列进行抗原表位分析,主要评估亲水性,抗原性,表面可能性,柔性区等指数,再结合过去制备抗体的实际经验,考虑氨基酸结构复杂程度,易氧化程度,合成难度,氨基酸类别和分布等,最终确定SARDH蛋白457-470位14个氨基酸作为合成多肽氨基酸 序列,序列为RERSHESYAKNYSV。同时,为保证后期多肽交联载体蛋白以及肽亲和纯化,在N末端增加一个半胱氨酸C,最终待合成多肽序列为C-RERSHESYAKNYSV。
2.多肽合成和交联
采用ACT396全自动多通道多肽合成仪,按照编制好的程序自动合成目的多肽,将合成后的多肽溶于50%乙腈,采用质谱仪进行鉴定,确认所获得的多肽为目的多肽。采用Sulfo-SMCC作为交联剂将载体蛋白KLH与合成多肽进行交联:取10mg KLH溶于0.5ml超纯水中;取3mg sulfo-SMCC溶于0.5ml超纯水中,用3M NaOH调pH值7左右。在混匀情况下,把sulfo-SMCC溶液逐滴缓慢加入KLH溶液中,室温下旋转混匀反应物30min。将反应好的sulfo-SMCC/KLH混合液上样到预先用平衡缓冲液(0.05M PB,pH6.0)平衡过30min的Sephadex G25柱中,收集浅灰色洗脱液,即活化的sulfo-SMCC/KLH溶液。用200ul PBS(pH7.3)溶解待2mg交联多肽,把0.2体积的sulfo-SMCC/KLH复合物溶液加入到多肽溶液中,调pH值到7.3,室温振摇4小时,-70冷冻后,用冻干机冻干24小时后备用。通过Ellman法检测交联前后多肽巯基确定多肽交联效率。
3.多肽免疫和抗血清制备
将交联好的KLH-多肽400μg溶于400μl磷酸缓冲液(0.01M PBS)中,加入等体积弗氏完全佐剂充分乳化(至在水中不扩散为准)。采用兔龄3个月,体重1.75-2.25Kg的健康新西兰兔进行免疫,进行背部皮内注射免疫,至少要注射20点以上。首次免疫3周后,将300μg多肽溶于300μl磷酸缓冲液(0.01M PBS)中,与等量的弗氏不完全佐剂充分乳化后进行皮内免疫,作为第一次加强免疫,要求背部皮内注射免疫,至少要注射15点以上。第二次免疫3周后,进行第二次加强免疫,方法和要求同第一次加强免疫。1周后,采用耳缘静脉微量取血,用未交联的合成多肽包被酶标板,间接ELISA法检测免疫血清效价。重复加强免疫和效价测定,直至血清效价达到1∶60000以上,采用心脏取血,标准方法获得抗血清。
4.抗体亲和纯化
(1)、TIgG纯化:用移液器将50%的Protein-A Sepharose混悬液10ml加到30ml层析柱中,去掉顶盖和底帽,液体流出后的柱床体积即为5ml,然后用25ml去离子水冲洗3遍。取出对应的血清10ml,与2ml PBS混合后加入30ml层析柱中,旋转混合器上室温(20-25℃)混旋1小时,让血清样品流出。再用15ml纯化洗液洗层析柱3次,加入10ml洗脱液进行洗脱。
(2)、肽亲和纯化:在层析柱中加入1ml Sulfo-link凝胶悬液(0.5ml凝胶),待柱内液体流干,用4ml偶联缓冲液冲洗层析柱。用1ml偶联缓冲液溶解合成的SARDH多肽,并加入层析柱,再加入1ml偶联缓冲液至层析柱中,室温颠倒混匀1小时。用6ml偶联缓冲液冲洗层析柱,然后加入3ml封闭液,室温混匀1小时。冲洗层析柱3次,然后向层析柱内加入6ml IgG及3ml PBS,室温颠倒混匀1小时。用PBS冲洗层析柱3次,然后用2ml洗脱液洗脱。将所获得的纯化抗体装入透析袋内4℃透析。透析过夜,然后4000rpm×35min离心除沉淀,收集上清。用间接ELISA法测定抗体效价并用Bradford法测定蛋白浓度。
抗SARDH抗体是通过以下步骤鉴定的:
1.免疫印迹分析
按照标准方法配制SDS-PAGE凝胶,将5μl蛋白浓度为5mg/ml的细胞或者组织裂解液依次加样,恒压80V约30分钟,待样品跑过浓缩胶基本呈一条直线时,改换160V电压,电泳至溴酚蓝指示剂完全跑出分离胶(约60分钟)时终止电泳,采用电转膜方法恒压100V电转80分钟转膜至PVDF膜。将所获得的SARDH抗体作为一抗,采用浓度为1μl/ml与上述转膜得到的抗原芯片在室温下杂交1小时,然后用HRP标记的羊抗兔抗体在室温下杂交1小时,采用ECL显色法进行显色,在暗室中用X片进行显色和曝光,得到免疫印迹结果。
2.免疫组织化学分析
将4%甲醛溶液固定的组织切成1.5mm×1.5mm×2.0-3.0mm的组织块,乙醇梯度脱水后二甲苯透明30分钟,62℃石蜡浸蜡2小时后,在组织包埋机上将9种组织按照3×3的排列方式用石蜡进行包埋。采用标准石蜡切片方法将切好的4-5μm厚的组织芯片蜡片贴附于APES处理过的载玻片上,在烤片机60℃烤片1小时,然后在烤箱中60℃烤片6小时。采用标准免疫组化方法,室温下用100μl 10%羊血清于湿盒中封闭切片30分钟,加入100μl浓度为2-4μg/ml的SARDH抗体,湿盒中4℃过夜,PBS清洗后加入生物素标记羊抗兔IgG于湿盒中37℃孵育30分钟,然后PBS清洗后加入HRP标记的链霉卵白素浓缩液,湿盒中37℃孵育30分钟,洗片后1%DAB显色,苏木素复染,复蓝,脱水,透明,封片,镜检,检查结果并拍照。
- 还没有人留言评论。精彩留言会获得点赞!