一种吡唑并喹啉衍生物及其制备方法和应用与流程
本发明涉及有机电致发光材料技术领域,尤其涉及一种吡唑并喹啉衍生物及其制备方法和应用。
背景技术:
随着显示技术的发展,对平板显示器件的要求越来越高。近年来出现了三种显示技术:等离子显示器、场发射显示器和有机电致发光显示器(OLED)。其中,OLED具有自主发光、低电压直流驱动、全固化、视角宽、颜色丰富等一系列的优点。与液晶显示器相比,OLED不需要背光源,视角大,功率低,其响应速度达到液晶显示器的1000倍,而制造成本却低于同等分辨率的液晶显示器,因此,OLED势必具有广阔的应用前景。
OLED的典型结构包括阴极层、阳极层和位于这两层之间的有机发光层,有机发光层中可包括电子传输层、空穴传输层和发光层中的一种或几种功能层。采用性能良好的传输材料是制备此类OLED器件的重要基础。
现在己发现吡唑并喹啉衍生物是一类比较适合作为有机电致发光材料的化合物。
万文,蒋元松等人在申请号200910050338.7,公开日2009年10月14,公开号CN101555247A中公开了“含三氟甲基的吡唑[3,4-B]并喹啉类化合物及其合成方法”,在惰性气氛下,将5-氯-1-苯基-3-三氟甲基-1H-吡唑-4-醛升温至140-150℃,再加入芳香胺,继续升温至180-200℃,搅拌反应0.5-1.5小时;降温到80-100℃,加入甲醇溶剂,回流1-1.5小时,过滤,滤渣用甲醇洗至浅黄色,用二氯甲烷和甲醇重结晶,得三氟甲基的吡唑[3,4-b]并喹啉类化合物。本发明的三氟甲基的吡唑[3,4-b]并喹啉类化合物的发光波长在蓝光波长范围内,荧光量子效率最高可达到0.74,不足之处在于,三氟甲基取代的吡唑[3,4-b]并喹啉在使用过程中容易分解。
技术实现要素:
为了解决现有技术中的问题,本发明的目的是提供一种吡唑并喹啉衍生物用于有机电致发光材料,本发明的吡唑并喹啉衍生物可作为电子/空穴传输材料,同时还可用作发光体,本发明的吡唑并喹啉衍生物在液体和固体膜中有较强的荧光,可以形成良好的无定型薄膜,同时具有相当好的热、光稳定性。
为了实现上述目的,本发明采用的技术方案:一种吡唑并喹啉衍生物,其特征在于,结构通式如下:
其中:
R1~R2选自取代或未取代的芳基、联芳基、稠环芳基,取代或未取代的含有氮原子的杂环芳基、苯并杂环芳基中的任意一种;X为碳原子或氮原子;n选自1~3的整数。
优选的是,所述的R1选自苯基或吡啶基,X为碳原子或氮原子。
优选的是,所述的n=1时,R1~R2选自如下结构:
优选的是,所述的吡唑并喹啉衍生物的结构式为:
优选的是,所述的n=2时,R2选自如下结构:
优选的是,所述吡唑并喹啉衍生物的结构式:
优选的是,所述的n=3时,R2选自如下结构:
优选的是,所述吡唑并喹啉衍生物的结构式:
一种制备吡唑并喹啉衍生物的方法,其特征在于,包括如下步骤:
S1:将a与碳酸二乙酯反应得到b;
S2:将b与取代肼反应得到c;
S3:将c与DMF/POCl3反应生成d;
S4:将d与4-溴苯胺反应生成e;
S5:将e与联硼酸酯反应生成f。
S6:将f与芳基溴反应,或e与芳基胺反应均可以生成;
其中:
R1~R2选自取代或未取代的芳基、联芳基、稠环芳基,取代或未取代的含有氮原子的杂环芳基、苯并杂环芳基中的任意一种;X为碳原子或氮原子;n选自1~3的整数。
与现有技术相比,本发明实现的有益效果:本发明的吡唑并喹啉衍生物将三氟甲基用苯环、取代苯环或含氮杂环取代后,改善了材料的稳定性问题,同时改善了电荷传输等性能和发光性能;本发明的吡唑并喹啉衍生物可以作为电子/空穴传输材料,同时还可用作发光体;本发明的吡唑并喹啉衍生物在液体和固体膜中都有较强的荧光,可以形成良好的无定型薄膜,同时又具有相当好的热、光稳定性。
附图说明
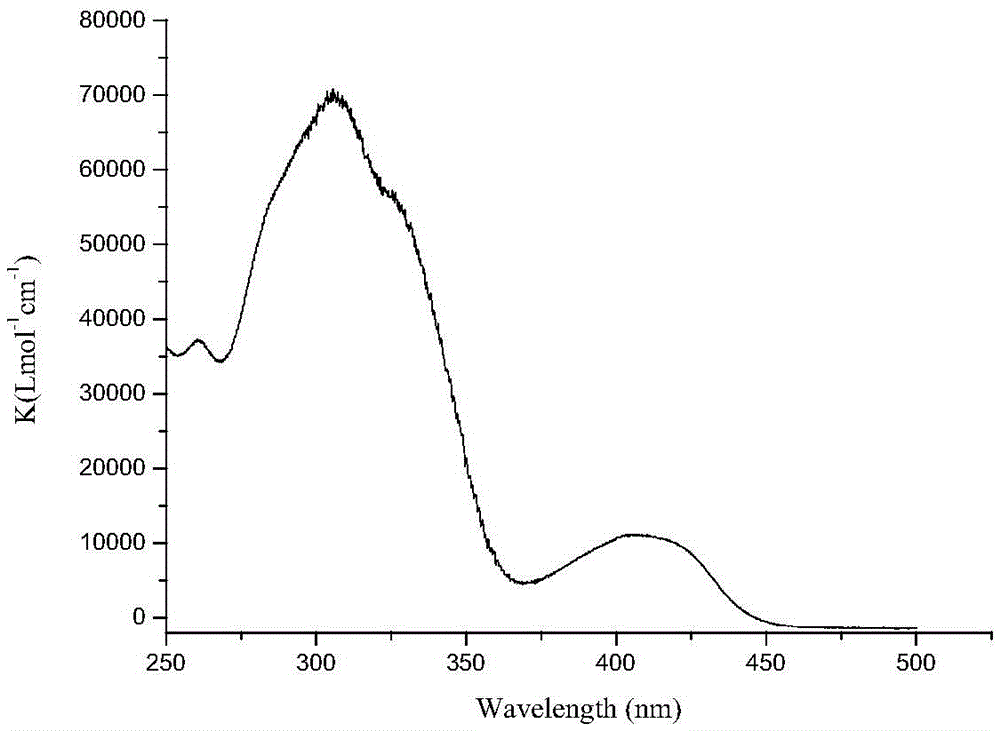
图1为化合物I-A14的紫外可见吸收光谱图
图2为化合物II-A14的紫外可见吸收光谱图
图3为化合物I-A14的荧光发射光谱图
图4为化合物II-A14的荧光发射光谱图
图5为化合物I-A14的TGA曲线图
图6为化合物II-A14的TGA曲线图
具体实施方式
实施例一、化合物2,6-二(1,3-二苯基-1H-吡唑[3,4-b]并喹啉-6-基)吡啶(I-B4)的合成
1)化合物苯甲酰乙酸乙酯的合成
取一只干燥洁净的250ml三口烧瓶,加入磁子;向烧瓶中分别加入59g碳酸二乙酯、50ml干燥四氢呋喃和24g氢化钠固体,通氮气保护;加热体系至回流,再分别称取30g苯乙酮和50mL的干燥四氢呋喃混合均匀,分批加入烧瓶中;至反应完全后,静置过夜;将反应后的体系倒入乙酸:冰水=1:5的体系中,用乙酸乙酯萃取,水洗,然后饱和食盐水洗,洗涤,干燥,浓缩,柱层析,得油状液体45g,产率95%;
1H NMR(CDCl3,500MHz):δ7.88(dd,J=8.4Hz,J=1.3Hz,2H),7.51(t,J=7.3Hz,1H),7.39(t,J=7.5Hz,2H),4.12(q,J=7.1Hz,2H),3.93(s,2H),1.18(t,J=7.21Hz,3H)。MS(m/z,EI):192.1
2)化合物2,5-二苯基-2,4-二氢-3H-吡唑-3-酮的合成
在装有搅拌子和冷凝装置的500ml三口瓶中倒入100ml无水乙醇和48gβ-羰基酯,边搅拌边加入4.3g对甲苯磺酸,在50℃下加热10分钟,再将27g苯肼逐滴加进入反应体系。搅拌回流24小时,停止加热。
将反应体冷却,抽滤,滤饼用乙醇重结晶得52g橙色固体,产率89%。
1H NMR(CDCl3,500MHz):δ7.98(dd,J=8.6Hz,J=1.2Hz,2H),7.78(m,3H),7.45(m,5H),3.85(s,2H)。MS(m/z,EI):236.1
3)化合物5-氯-1,3-二苯基-1H-吡唑-4-甲醛的合成
在装有磁力搅拌子、冷凝装置及尾气吸收装置的500ml三口烧瓶中,加入 108g POCl3,降温至0℃,滴入26g DMF,再将42g化合物c加入该三口瓶中,加热至110℃,反应6小时。
用减压蒸馏的方法,蒸去过剩的POCl3,冰浴下将饱和碳酸钠溶液,缓慢滴入烧瓶中,注意保持0-10℃,边滴加边搅拌,直到不再产生气泡。用乙酸乙酯萃取,有机层用无水硫酸钠干燥,过滤。减压蒸去溶剂,所得粗产物用乙醇重结晶得到41.5g棕色固体,产率为83%。
1H NMR(CDCl3,500MHz):δ10.07(s,1H),7.82(m,2H),7.63(m,2H),7.56(t,J=7.1Hz,2H),7.50(m,4H);MS(m/z,EI):282.06
4)化合物6-溴-1,3-二苯基-1H-吡唑[3,4-b]并喹啉的合成
向装有搅拌磁子和回流冷凝管的反应容器中加入41g化合物d;鼓入氮气并升温至140℃,边搅拌边将30g对溴苯胺一次性迅速加入到反应容器中;继续快速升温至180℃,搅拌30min;停止加热,等温度降到100℃时,加入甲醇,回流30min。过滤,滤渣用二氯甲烷和甲醇重结晶,产率为89%。1H NMR(CDCl3,500MHz):δ8.83(s,1H),8.57(d,J=7.7Hz,2H),8.18(d,J=2.2Hz,1H),8.13(d,J=7.1Hz,2H),8.07(d,J=9.0Hz,1H),7.83(dd,J=9.3Hz,J=2.2Hz,1H),7.60(m,4H),7.52(t,J=7.4Hz,1H),7.34(t,J=7.1Hz,1H);MS(m/z,EI):399.0
5)化合物1,3-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂己硼烷-2-基)-1H-吡唑[3,4-b]并喹啉的合成
向装有磁力搅拌子、冷凝装置及尾气吸收装置的250ml三口烧瓶中,依次加入30g化合物e、0.55g Pd(dppf)Cl2、23g二硼双频哪醇酯、11g醋酸钾和100ml二氧六环,氮气保护,TLC跟踪反应,反应24小时。冷却至室温,抽滤得黑色固体,用二氯甲烷重结晶得29g针状淡黄色固体,产率为85%。1H NMR(CDCl3,500MHz):δ8.99(s,1H),8.61(t,J=6.8Hz,3H),8.14(m,4H),7.59(m,4H),7.52(t,J=7.3Hz,1H),7.33(t,J=7.4Hz,1H),1.42(s,12H);MS(m/z,EI):447.21
6)化合物2,6-二(1,3-二苯基-1H-吡唑[3,4-b]并喹啉-6-基)吡啶(I-B4)的合成
在装有磁力搅拌子、冷凝装置及尾气吸收装置的100ml三口烧瓶中,依次加入2g 2,6-二溴吡啶、0.62g Pd(dppf)Cl2、8.3g化合物1,3-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂己硼烷-2-基)-1H-吡唑[3,4-b]并喹啉、13g碳酸钾和50ml二甲基亚砜,氮气保护下,TLC跟踪反应,反应12小时。冷却至室温,抽滤得黄色固体,黄色固体用氯仿加热,除去不溶物,浓缩后柱层析(二氯甲烷/甲醇),得荧光黄色固体4.5g,产率75%。MS(m/z,EI):717.3。
实施例二、化合物1,3-二苯基-6-(对甲苯基)-1H-吡唑[3,4-b]并喹啉(I-A1) 的合成
在装有搅拌子和冷凝装置的50ml三口瓶中依次加入1.49g化合物1,3-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂己硼烷-2-基)-1H-吡唑[3,4-b]并喹啉,0.5g的氯苯,71mg醋酸钯,166mg三苯基膦、2.19g碳酸钾和1,4-二氧六环/水,鼓入氮气,加热至100℃,反应搅拌过夜,TLC分析至原料反应完全。停止加热,将反应体系冷却至室温,抽滤,滤饼用二氯甲烷洗涤(15ml×3),母液用水洗涤,二氯甲烷萃取(20ml×3),合并有机相,干燥,过滤,浓缩,得粗产品用二氯甲烷/甲醇重结晶,得到黄色固体0.79g,产率60%。1H NMR(CDCl3,500MHz):δ8.98(1H),8.63(2H),8.26(1H),8.21(1H),8.16(2H),8.08(1H),7.76(2H),7.58-7.62(4H),7.52(3H),7.42(1H),7.34(1H)。MS(m/z,EI):397.10。
实施例三、化合物1,3-二苯基-6-对甲苯基-1H-吡唑[3,4-b]并喹啉(I-A2)的合成
合成方法如实施例二,其中以0.5g的对甲基溴苯为起始原料,产率63%。1H NMR(CDCl3,500MHz):δ8.95(1H),8.62(2H),8.24(1H),8.17-8.19(m,3H),8.06(1H),7.60(2H),7.58-7.62(4H),7.50(1H),7.33(3H),2.44(3H)。MS(m/z,EI):411.20。
实施例四、化合物6-(4-甲氧苯基)-1,3-二苯基-1H-吡唑[3,4-b]并喹啉(I-A3)的合成
合成方法如实施例二,其中以0.6g的对甲氧基溴苯为起始原料,产率66%。1H NMR(CDCl3,500MHz):δ8.95(1H),8.63(2H),8.24(1H),8.18(2H),8.15(1H),8.05(1H),7.70(2H),7.60(4H),7.52(1H),7.33(1H),7.05(2H),3.98(3H);MS(m/z,EI):427.10。
实施例五、化合物4-(1,3-二苯基-1H-吡唑[3,4-b]并喹啉-6-基)苯甲腈(I-A4)的合成
合成方法如实施例二,其中以0.6g的对氰基溴苯为起始原料,产率54%。1H NMR(CDCl3,500MHz):δ9.00(1H),8.61(2H),8.30(1H),8.24(1H),8.17(2H),8.04(1H),7.86(2H),7.80(2H)7.61(4H),7.53(1H),7.35(1H);MS(m/z,EI):422.10。
实施例六、化合物1,3-二苯基-6-(吡啶-2-基)-1H-吡唑[3,4-b]并喹啉(I-A5)的合成
合成方法如实施例二,其中以0.6g的2-溴吡啶为起始原料,产率71%。1H NMR(CDCl3,500MHz):δ9.02(1H),8.77(1H),8.69(1H),8.62(2H),8.46(1H),8.28(1H),8.17(2H),7.91(1H),7.82(1H),7.60(4H),7.52(1H),7.34(1H),7.28(1H);MS(m/z,EI):398.10。
实施例七、化合物1,3-二苯基-6-(吡啶-3-基)-1H-吡唑[3,4-b]并喹啉(I-A6)的合成
合成方法如实施例二,其中以0.6g的3-溴吡啶为起始原料,产率67%。1H NMR(CDCl3,500MHz):δ9.04(1H),9.02(1H),8.67(1H),8.62(2H),8.32(1H), 8.24(1H),8.18(2H),8.05(1H),8.03(1H),7.61(4H),7.53(1H),7.45(1H),7.35(1H);MS(m/z,EI):398.10。
实施例八、化合物1,3-二苯基-6-(吡啶-4-基)-1H-吡唑[3,4-b]并喹啉(I-A7)的合成
合成方法如实施例二,其中以0.6g的4-溴吡啶,产率61%。1H NMR(CDCl3,500MHz):δ8.98(1H),8.73(2H),8.60(2H),8.27(2H),8.15(2H),8.04(1H),7.65(2H),7.60(4H),7.53(1H),7.35(1H);MS(m/z,EI):398.10。
实施例九、化合物1,3-二苯基-6-(4-(1-苯基-1H-苯并咪唑-2-基)-1H-吡唑-[3,4-b])并喹啉(I-A14)的合成
合成方法如实施例二,其中以1.2g的2-(4-溴苯)-1-苯基苯并咪唑,产率79%。1H NMR(CDCl3,500MHz):δ9.02(1H),8.64(2H),8.29(1H),8.27(1H),8.20(2H),8.10(1H),7.95(1H),7.76(4H),7.71(6H),7.55(2H),7.42(2H),7.37(2H),7.32(2H);MS(m/z,EI):589.20.
实施例十、化合物1,6-二苯基-3-(吡啶-4-基)-1H-吡唑-[3,4-b]并喹啉(Ⅱ-A1)的合成
实施例一合成步骤1中以4-乙羰基吡啶替换为起始原料,经合成步骤2、3、4、5最终得到中间体1-苯基-3-(吡啶-4-基)-6-4,4,5,5-四甲基-1,3,2-二氧杂己硼 烷-2-基)-1H-吡唑[3,4-b]并喹啉。
在装有搅拌子和冷凝装置的50ml三口瓶中依次加入1.49g中间体1-苯基-3-(吡啶-4-基)-6-4,4,5,5-四甲基-1,3,2-二氧杂己硼烷-2-基)-1H-吡唑[3,4-b]并喹啉,0.5g的氯苯,71mg醋酸钯,166mg三苯基膦、2.19g碳酸钾和1,4-二氧六环/水,鼓入氮气,加热至100℃,反应搅拌过夜,TLC分析至原料反应完全。停止加热,将反应体系冷却至室温,抽滤,滤饼用二氯甲烷洗涤(15ml×3),母液用水洗涤,二氯甲烷萃取(20ml×3),合并有机相,干燥,过滤,浓缩,得粗产品用二氯甲烷/甲醇重结晶,得到黄色固体0.80g,产率61%。即可得最终产物Ⅱ-A1。1H NMR(CDCl3,500MHz):δ9.03(1H),8.85(2H),8.60(2H),8.28(1H),8.24(1H),8.11(3H),7.78(2H),7.62(2H),7.54(2H),7.44(1H),7.38(1H);MS(m/z,EI):398.10。
实施例十一、化合物1-苯基-3-(吡啶-4-基)-6-对甲苯基-1H-吡唑-[3,4-b]并喹啉(Ⅱ-A2)的合成
按照实施例十中的合成方法,其中以0.5g的对甲基溴苯为起始原料,产率56%。1H NMR(CDCl3,500MHz):δ8.81(1H),8.80(2H),8.54(2H),8.13(1H),8.07(1H),7.60(2H),7.57(2H),7.34(1H),7.31(2H),2.44(3H);MS(m/z,EI):412.20。
实施例十二、化合物6-(4-甲氧苯基)-1-苯基-3-(吡啶-4-基)-1H-吡唑-[3,4-b]并喹啉(Ⅱ-A3)的合成
按照实施例十中的合成方法,其中以0.6g的对甲氧基溴苯为起始原料,产率51%。1H NMR(CDCl3,500MHz):δ8.96(1H),8.84(2H),8.59(2H),8.23(1H),8.15(1H),8.08(3H),7.70(2H),7.60(2H),7.37(1H),7.06(2H),3.90(3H);MS (m/z,EI):428.20。
实施例十三、化合物4-(1-苯基-3-(吡啶-4-基)-1H-吡唑-[3,4-b]并喹啉-6-基)苯甲腈(Ⅱ-A4)的合成
按照实施例十中的合成方法,其中以0.6g的对氰基溴苯为起始原料,产率67%。1H NMR(CDCl3,500MHz):δ9.08(1H),8.86(2H),8.59(2H),8.33(1H),8.29(1H),8.11(2H),8.09(1H),7.85(4H),7.63(2H),7.40(1H);MS(m/z,EI):423.10。
实施例十四、化合物1-苯基-6-(吡啶-2-基)-3-(吡啶-4-基)-1H-吡唑-[3,4-b]并喹啉(Ⅱ-A5)的合成
按照实施例十中的合成方法,其中以0.5g的2-溴吡啶为起始原料,产率64%。1H NMR(CDCl3,500MHz):δ8.93(1H),8.80(2H),8.76(1H),8.62(1H),8.55(2H),8.42(1H),8.20(1H),8.02(2H),7.86(1H),7.80(1H),7.58(2H),7.35(1H),7.28(1H);MS(m/z,EI):399.00。
实施例十五、化合物1-苯基-6-(吡啶-3-基)-3-(吡啶-4-基)-1H-吡唑-[3,4-b]并喹啉(Ⅱ-A6)的合成
按照实施例十中的合成方法,其中以0.5g的3-溴吡啶为起始原料,产率 62%。1H NMR(CDCl3,500MHz):δ9.06(1H),9.03(1H),8.84(2H),8.66(1H),8.58(2H),8.31(1H),8.25(1H),8.06(4H),7.61(2H),7.45(1H),7.38(1H);MS(m/z,EI):399.10。
实施例十六、化合物1-苯基-3,6-二(吡啶-4-基)-1H-吡唑-[3,4-b]并喹啉(Ⅱ-A7)的合成
按照实施例十中的合成方法,其中以0.5g的4-溴吡啶为起始原料,产率63%1H NMR(CDCl3,500MHz):δ9.06(1H),8.85(2H),8.76(2H),8.58(2H),8.33(2H),8.10(3H),7.68(2H),7.62(2H),7.39(1H);MS(m/z,EI):399.10。
实施例十七、化合物1-苯基-6-(4-(1-苯基-1H-苯并咪唑-2-基)苯基)3-(吡啶-4-基)1H-吡唑-[3,4-b]并喹啉(Ⅱ-A14)
按照实施例十中的合成方法,其中以1.4g的2-(4-溴苯)-1-苯基苯并咪唑为起始原料,产率61%。1H NMR(CDCl3,500MHz):δ9.02(1H),8.84(2H),8.58(2H),8.26(2H),8.09(3H),7.93(1H),7.73(4H),7.61(2H),7.57(2H),7.52(1H),7.41(1H),7.38(3H),7.30(m,2H);MS(m/z,EI):590.10.
应用实例
将实施例制备的材料用于有机电致发光器件,这类器件的典型结构为:ITO/HIL/TCTA/EML/TPBI(10nm)/ETL(30nm)/LiF(1nm)/Al(80nm)。其中ITO为阳极,HIL为空穴注入材料,TCTA为空穴传输及电子阻挡层,EML为发光层,TPBI为空穴阻挡层,ETL为电子传输层,LiF/Al为阴极。为了提高阳极空穴的注入,被旋涂在净化处理后的ITO基板上从而形成一层空穴注入层HIL。空穴传输层HTL包括一层具有良好的传输能力TCTA。发光层包含本 发明的材料直接作为发光层、或本发明的材料掺杂在合适的主体材料中、或本发明的材料掺杂磷光材料。TPBI被用作空穴阻挡和电子的注入和传输。ETL层包含本发明的材料或其他常规材料,LiF和Al分别为电子注入层和阴极。
以I-A14和Ⅱ-A14分别作为主体材料制备有机电致发光器件D1和D2,测定结果如表一所示
上述的具体实施方式只是示例性的,是为了更好地使本领域技术人员能够理解本专利,不能理解为是对本专利包括范围的限制;只要是根据本专利所揭示精神的所作的任何等同变更或修饰,均落入本专利包括的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种4‑氨基安替比林产品的合成工艺及其试液的配备方法与制造工艺
- 一种吡唑酮生产工艺的制造方法与工艺
- 一类含呋喃的苯基联吡唑甲酰胺类衍生物及其制备方法和用图
- N’?5?(取代苯基)?2?呋喃甲酰基?5?丙基?1h?吡唑?3?甲酸乙酯类化合物及其制备方法和应用
- 吡唑啉酮化合物及其用图
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 含醚性氧原子的全氟烷基取代吡唑环化合物及其制造方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 含有色酮结构的吡唑类n‐对硝基苯基马来酰亚胺衍生物及其制备方法与应用
- 5-(4-氟苯基)-N,N-二甲基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 制备1-烷基-3-二氟甲基-5-氟-1h-吡唑-4-甲醛和1-烷基-3-二氟甲基-5-氟-1h-吡唑-4 ...的制作方法
- 三氟甲基吡唑基胍F<sub>1</sub>F<sub>0</sub>-ATP酶抑制剂及其治疗用图
- 3,5-二甲基-1h-吡唑-1-甲脒盐酸盐的制备方法
- 取代吡唑基吡唑衍生物及其作为除草剂的用图
- 取代吡唑基吡唑衍生物及其作为除草剂的用图
- 封端异氰酸酯、涂料组合物、粘接剂组合物和物品的制作方法
- 一种1-(3-甲基-1-苯基-1h-吡唑-5-基)哌嗪的制备方法
- 一种3-二氟甲基-1-甲基-1h-吡唑-4-羧酸乙酯的合成方法
- 一种1,3,5-三甲基-4-吡唑甲酸甲酯的合成方法