由干细胞分化肝细胞样细胞的制作方法
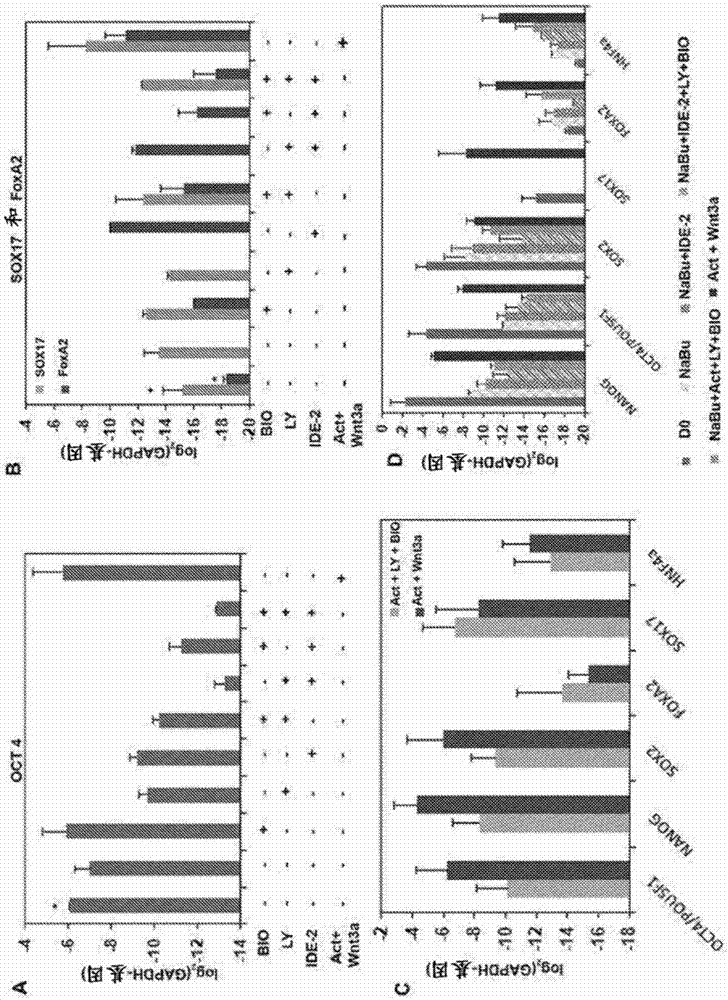
对相关申请的交叉引用本申请要求于2014年9月19日提交的新加坡临时申请号10201405916y的优先权权益,该申请的全部内容通过引用并入本文用于所有目的。本发明涉及发育生物学。具体地,本发明还涉及用于将干细胞分化成更多个肝细胞样细胞的组合物。本发明还涉及使用本发明的组合物将干细胞分化成更多个肝细胞样细胞的方法。
背景技术:
:人肝细胞是用于肝毒性筛选的有价值工具,所述肝毒性筛选是用于药物发现和开发的关键步骤。另外,肝细胞移植已经证明是原位肝移植的有前途的替代方式。目前选择用于药物筛选和细胞治疗的细胞系统是原代人肝细胞(ph)。然而,原代人肝细胞在临床或药学应用中的效用受它们的可用性、供体变异性、受限的增殖和在延长的培养期内功能衰退的限制。因此,已经将大量努力致力于衍生出功能性肝细胞的可替代的可扩充来源,所述可替代的可扩充来源可以克服与原代人肝细胞相关的缺点。人胚胎干细胞(hesc)由于它们的不受限制的增殖和多能性分化能力而提供了原代人肝细胞的有吸引力的可替代细胞来源。因此,需要用于获得和维持表现成人肝细胞表型的肝细胞样细胞的方法。技术实现要素:在一个方面,提供了使定形内胚层分化以便获得肝细胞样细胞的方法。在一个实施例中,所述方法包括以下步骤:a)使定形内胚层经受至少一种表观遗传调节剂以获得成肝细胞,b)使所述成肝细胞经受至少一种干细胞分化通路抑制剂以获得肝细胞样细胞;其中步骤a)和b)不包括使用生长因子。在另一个方面,提供了通过如本文所述的方法获得的或通过如本文所述的方法能获得的肝细胞样细胞。还在另一个方面,提供了如本文所述的肝细胞样细胞在选自由下列各项组成的组的应用中的用途:药物毒性筛选、药物细胞毒性评估细胞治疗、组织工程和组织再生。附图说明当结合非限制性实施例和附图考虑时将参照详细说明来更好地理解本发明,在附图中:图1示出了阐明用来使人胚胎干细胞(hesc)分化成肝细胞的三步骤方案的示意性图示。左列示出了如本文所述的方案的实施例。右列阐明了如本领域中所公知的基于生长因子的方案。如本领域中所公知的基于生长因子的方案用作用于分析用小分子代替生长因子的作用的对照。图2示出了条形图,所述条形图阐明了激活素a和wnt3a替换对定形内胚层诱导的qpcr分析的结果。在用不同组合中的小分子或用生长因子处理6天的人胚胎干细胞(hesc)中多能性标志物oct4(a)和定形内胚层标志物foxa2和sox17(b)的表达。*a和b中的第一个条表示在第0天时的标志物表达。第二个条表示在不利用任何小分子或生长因子处理的条件下在第6天时的标志物表达(用dmso作为小分子的媒介物对照处理细胞)。(c)与用激活素a和wnt3a处理的人胚胎干细胞(hesc)相比,hnf4α、多能性标志物oct4、nanog和sox2以及定形内胚层标志物foxa2和sox17在用激活素和小分子的组合处理的hesc中的表达(灰色条)。(d)利用与表观遗传调节剂组合的不同小分子处理的第6天分化的细胞的基因表达。表达水平与生长因子分化的细胞(深灰色条)和用生长因子、小分子和表观遗传调节剂分化的细胞(具有白色圆点的浅灰色条)相比较。结果相对于gapdh作图。条示出平均值±s.d(n=3)。在图2中,“nabu”是指丁酸钠;“ly”是指ly294002;“act”是指激活素a;“gapdh”是指甘油醛3-磷酸脱氢酶。因此,图2示出了用小分子与激活素a组合处理导致诱导定形内胚层(de)分化。图3示出了关于小分子是否有效地诱导由定形内胚层形成成肝细胞的分析中的结果。具体地,(a)示出了相衬图像,所述相衬图像示出了用小分子-丁酸钠和dmso(上部图)诱导另外6天或用生长因子-fgf-2、bmp-4以及相继地用fgf-1、fgf-4和fgf-8(下部图)诱导8天的定形内胚层期中的细胞的形态学。比例尺:250μm;(b)示出了条形图,其显示qpcr分析结果,所述结果表明在用小分子或生长因子处理的细胞中定形内胚层标志物foxa2和sox17下调。foxa2和sox17的表达水平相对于第6天进行表示。条示出平均值±s.d(n=3);(c)示出了条形图,所述条形图描绘了示出肝标志物afp、alb和hnf4α、ck18以及胆标志物ck19的qpcr分析结果,确认在用小分子或生长因子处理的细胞中生成了成肝细胞。结果相对于gapdh作图。条示出平均值±s.d(n=3)。因此,图3表明在分化过程期间生成了成肝细胞以及基于小分子的诱导(方法如本文所述)与基于生长因子的诱导(方法如本领域所公知)相当。图4示出了条形图,所述条形图描绘了示出在(利用图1中所述的任一种方法培养的)20天分化期结束时肝标志物基因表达的qpcr分析结果。图4示出了使用小分子衍生于hesc的肝细胞的肝标志物的相对表达。结果相对于对照酶gapdh(甘油醛3-磷酸脱氢酶)作图。在生成成肝细胞(图3)后,细胞用sb431542/dmso处理8天(标记为基于小分子的成熟)或用hgf和卵泡抑素处理6天(标记为基于生长因子的成熟)。用于基于小分子的方式和基于生长因子的方式两者的分化的总时间周期为20天(图1)。条示出平均值±s.d(n=3)。因此,图4表明由如图1中所示的任一种方法获得的肝细胞产生相似的肝标志物曲线。图5表明使用小分子(sm-hep)和生长因子(gf-hep)衍生于人胚胎干细胞(hesc)的肝细胞的功能性能。具体地,(a)示出了产生白蛋白的条形图;(b)示出了产生尿素的条形图;和(c)示出了使用小分子(sm-hep)或生长因子(gf-hep)获自hesc的肝细胞产生cyp1a2和cyp3a4特异性代谢物的条形图。简言之,使用小分子或生长因子分化细胞20天,然后在第20天时收集上清液用于测量白蛋白和尿素的产生。分化的细胞用cyp1a2和cyp3a4特异性底物处理用于量化代谢物的产生。产生的白蛋白、尿素和代谢物的量相对于细胞数目归一化。条示出平均值±s.d(n=3)。因此,图5示出了由如图1中所示的任一种方法获得的肝细胞可以产生白蛋白、尿素以及cyp1a2和cyp3a4。图6示出了描绘在用药物处理后细胞活力百分比的图。图6示出了由如本文所述的分化方法获得的细胞在药物测试中应用实施例的结果。小分子(sm-hep)、生长因子(gf-hep)和原代人肝细胞(ph)的细胞活力在暴露于不同浓度的测试化合物24小时后通过mts细胞活力测定进行评估。细胞活力表示为仅用溶剂处理的细胞的百分比。条示出平均值±s.d(n=3)。因此,图6表明小分子来源的肝细胞(sm-hep)的敏感性类似于生长因子来源的(gf-hep)肝细胞的敏感性。图7示出了如本文所述的方法中各个步骤的通用示意性图示。具体地,(a)示出了干细胞分化成定形内胚层;(b)示出了定形内胚层分化成成肝细胞/肝祖细胞;和(c)示出了肝祖细胞/成肝细胞分化成成熟的肝细胞或肝细胞样细胞。图8示出了qpcr分析的结果,其示出了激活素a和wnt3a替换对诱导定形内胚层的作用。具体地,(a)示出了与用激活素a和wnt3a处理的hesc(深灰色条)相比,多能性标志物oct4、nanog和sox2和定形内胚层标志物foxa2和sox17在用激活素和小分子的组合处理的hesc(浅灰色条)中的表达。(b)示出在用小分子或生长因子处理6天的hesc中多能性标志物oct4的表达和(c)示出在用小分子或生长因子处理6天的hesc中定形内胚层标志物foxa2和sox17的表达。结果相对于gapdh作图。数据表示为均值±sem(平均数的标准误)。(d)在使用激活素和小分子的组合产生的de中通过免疫荧光检测的foxa2和sox17的标志物蛋白质表达(上图),并与用激活素a和wnt3a处理(下图)相比较。细胞核用dapi染色。比例尺:50μm。ly:ly294002;act:激活素a;gapdh:甘油醛3-磷酸脱氢酶。因此,图8表明激活素a、ly294002和bio的组合能够诱导定形内胚层形成。图9示出了在用不同组合中的小分子或用生长因子处理6天的hesc中多能性标志物oct4(a)和定形内胚层标志物foxa2和sox17(b)的表达。*a和b中的第一个条表示在第0天时的标志物表达。第二个条表示在不利用任何小分子或生长因子处理的条件下在第6天时的标志物表达(用dmso作为小分子的媒介物对照处理细胞)。测试了ly294002和bio,以及小分子代替激活素a、ide-2对诱导hesc成为de的作用。还测试了单独ide-2、ly294002或bio或与仅其他因子的组合(组合列表于x轴上)。使用激活素a和wnt3a的基于生长因子的分化用作对照。用小分子(除用单独bio处理以外)处理在下调oct4表达方面更有效,特别是用ide-2和ly294002以及用ide-2、ly294002和bio组合的处理(与第0天相比分别下调143和126倍)。用这些化合物处理不以与激活素a和wnt3a处理相比的水平诱导表达de标志物(foxa2和sox17)。在小分子的组合之中,用ly294002和bio处理和用ide-2、ly294002和bio处理导致对sox17的最高诱导,但对于这两种组合foxa2的表达与激活素a和wnt3a处理的细胞相比明显较低。用ide-2处理和用ide-2和ly94002的组合处理诱导最高的foxa2表达(几乎与激活素a和wnt3a处理相当的水平)。然而,对于这些组合没有检测到sox17表达。(c)利用与表观遗传调节剂组合的不同的小分子处理,第6天分化细胞的基因表达。表达水平与生长因子分化的细胞(深灰色条)和用生长因子、小分子和表观遗传调节剂分化的细胞(带有白色圆点的浅灰色条)相比较。这些组合中没有一个导致de标志物、foxa2和sox17的表达达到与激活素a和wnt3a处理相当的水平。结果相对于gapdh作图。数据表示为均数±sem。nabu:丁酸钠;ly:ly294002;act:激活素a;gapdh:甘油醛3-磷酸脱氢酶。因此,图9显示所测试的组合没有一个有效地代替激活素a信号传导。图10示出小分子有效地诱导由定形内胚层形成成肝细胞。具体地,(a)示出相衬图像,所述相衬图像显示用小分子-丁酸钠和dmso(左图)诱导另外6天或用生长因子-fgf-2、bmp-4以及相继地用fgf-1、fgf-4和fgf-8(右图)诱导8天的定形内胚层期中的细胞的形态学。比例尺:25μm。(b)示出了qpcr分析,所述qpcr分析示出在用小分子(浅灰色条)或生长因子(深灰色条)处理的细胞中定形内胚层标志物sox17下调,foxa2没有下调(与第6天水平相比p值>0.1)。foxa2和sox17的表达水平相对于第6天表示。(c)qpcr分析示出肝标志物afp、alb和hnf4α、ck18以及胆标志物ck19,确认在用小分子(浅灰色条)或生长因子(深灰色条)处理的细胞中生成了成肝细胞。结果相对于gapdh作图。数据表示为均数±sem。(d)在使用小分子产生的成肝细胞中通过免疫荧光检测的afp的标志物蛋白质表达(上图),并与用生长因子对照处理(下图)相比较。细胞核用dapi染色。比例尺:100μm。sm:使用丁酸钠和dmso将de分化成成肝细胞;gf:使用fgf-2,bmp-4和fgf-1/4/8将de分化成成肝细胞。因此,图10示出小分子可以启动源自定形内胚层的肝分化,无需使用任何生长因子。图11示出对使用小分子来源于hesc的肝细胞样细胞的表征。具体地,(a)示出了小分子衍生的肝细胞样细胞的形态学,显示了多边形的形状和颗粒状细胞质。比例尺:50μm。(b)示出了在使用小分子产生的肝细胞中通过免疫荧光检测的alb的标志物蛋白质表达(上图),并与用生长因子对照处理(下图)相比较。比例尺:100μm。(c)示出与生长因子(深灰色条)相比,使用小分子(浅灰色条)来源于hesc的肝细胞的肝标志物的表达。结果相对于gapdh作图。数据表示为均数±sem。星号指示在肝祖细胞的基于小分子成熟和基于生长因子成熟的基因表达之间有显著性差异(*p-值<0.1,**p-值<0.05)。sm:使用sb431542/dmso将肝祖细胞分化为肝细胞;gf:使用hgf和卵泡抑素将肝祖细胞分化为肝细胞。因此,图11表明使用如本文所述的方法由肝祖细胞向肝细胞的分化。图12示出了使用小分子(sm-hep)和生长因子(gf-hep)来源于hesc的肝细胞的功能性能。sm-hep(浅灰色条)和gf-hep(深灰色条)引起的(a)白蛋白、(b)尿素产生、(c)cyp1a2和(d)cyp3a4特异性代谢物产生。使用小分子或生长因子分化细胞20天,并在第20天时收集上清液用于测量白蛋白和尿素的产生。分化的细胞用cyp1a2和cyp3a4特异性底物处理用于量化代谢物的产生。产生的白蛋白、尿素和代谢物的量相对于细胞数目归一化。星号指示sm-hep与gf-hep相比尿素产量之间存在显著性差异(*p-值<0.05)。(e)示出通过基因表达分析sm-hep中的cyp1a2和cyp3a4诱导。(f)示出通过lc-ms分析的cyp1a2、cyp3a4和cyp2b6诱导。数据表示为均数±sem。功能与从3个不同的供体获得的人原代肝细胞中的水平(虚线)相比较。因此,图12表明由如本文所述的方法得到的肝细胞在功能上与由本领域中公知的方法得到的肝细胞相当。图13示出应用sm-hep用于药物测试。在暴露于不同浓度的测试化合物24小时后通过mts测定评估gf-hep、sm-hep和人原代肝细胞(phh)的细胞活力。细胞活力表示为用单独溶剂处理的细胞的百分比。数据表示为均数±sem。因此,图13表明由如本文所述的方法获得的肝细胞可以用于药物测试。表格说明当结合非限制性实施例和所附表格考虑时将参照详细说明来更好地理解本发明,在表格中:表1示出了使用采用生长因子(gf)或小分子(sm)分化的肝细胞的肝毒性筛选的ic50值。表2示出了使用采用生长因子(gf)或小分子(sm)分化的肝细胞的肝毒性筛选的更新的ic50值。具体实施方式功能性人肝细胞具有广泛的应用,特别是在细胞治疗和肝毒性筛选中。由于受限的可用性以及与使用原代人肝细胞相关的挑战性,已经付出了大量努力来由干细胞生成肝细胞。因此,需要提供替代性方法将干细胞分化成肝细胞。开发了用于主要使用小分子(和激活素a作为仅有的生长因子)将人胚胎干细胞分化成功能肝细胞的逐步分化方案。如本文所用,术语“小分子”是指低分子量的分子,例如,900道尔顿和更小的分子量。此定义也可以指可以有助于调节生物过程、尺寸为大约10-9m的级别,即在纳米范围内的有机化合物。发现来自干细胞的肝细胞分化通常遵循至少三个步骤(i)干细胞分化成定形内胚层形式,(ii)定形内胚层分化为肝祖细胞/成肝细胞,和(iii)由肝祖细胞/成肝细胞分化功能肝细胞或肝细胞-样细胞。本发明人在小分子如何调控特定的信号传导通路的背景下研究了小分子的用途。例如,多种小分子基于它们对信号传导通路的作用被单独或与不同步骤组合被测试,所述测试针对它们由多能干细胞生成定形内胚层(即,步骤i)的能力。一旦鉴定到正确的组合,就类似地分析针对步骤ii和之后步骤iii)的小分子处理。因此,本公开的发明人已经发现了将干细胞分化为功能肝细胞/肝细胞样细胞的替代方法,所述方法解决上述的三步骤分化。因此,在一个实施例中,提供了分化定形内胚层以便获得肝细胞样细胞的方法。在一个实施例中,所述方法包括:步骤a)使定形内胚层经受至少一种表观遗传调节剂以获得成肝细胞。在一个实施例中,所述方法可以进一步包括步骤b)使所述成肝细胞经受至少一种干细胞分化通路抑制剂以获得肝细胞样细胞。在一个实施例中,在如本文所述的方法中,步骤a)和b)不包括使用生长因子。即,在一个实施例中,在如本文所述的方法中,步骤a)和b)不含生长因子。在一个实施例中,如本文所述的方法可以包括步骤a)使定形内胚层经受包含至少一种表观遗传调节剂的无生长因子的培养基以获得成肝细胞。在一个实施例中,所述方法可以进一步包括步骤b)使成肝细胞经受包含至少一种干细胞分化通路抑制剂的无生长因子的培养基以获得肝细胞样细胞。在一个实施例中,步骤a)指上面的分化步骤ii),其涉及定形内胚层分化为成肝细胞/肝祖细胞;步骤b)指上面的步骤iii),其涉及成肝细胞/肝祖细胞分化为肝细胞/肝细胞样细胞。在一个实施例中,提供了分化干细胞以便获得肝细胞样细胞的方法。在一个实施例中,如本文所述的分化干细胞的方法可以包括使干细胞经受至少一种化合物以获得定形内胚层细胞的步骤,所述化合物通过抑制激酶活性调节干细胞分化。在一个实施例中,所述方法可以进一步包括使定形内胚层细胞经受至少一种表观遗传调节剂以获得成肝细胞的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以进一步包括使成肝细胞经受至少一种干细胞分化通路抑制剂以获得肝细胞样细胞的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所提供的任一步骤可以按时间前后顺序进行或可以包括本领域中公知的额外步骤。在一个实施例中,提供分化干细胞以便获得肝细胞样细胞的方法,所述方法可以包括以下的步骤:使干细胞经受至少一种化合物以获得定形内胚层细胞,所述化合物通过抑制激酶活性调节干细胞分化;使定形内胚层细胞经受至少一种表观遗传调节剂以获得成肝细胞,并且其中此步骤不包括使用生长因子;和使成肝细胞经受至少一种干细胞分化通路抑制剂以获得肝细胞样细胞,并且其中此步骤不包括使用生长因子。如本文所用,术语“分化的”、“分化”、或它们的其他语法变换形式,是指非特化的(“未定型的”)或较少特化的细胞获得特化细胞的特征的过程,所述特化细胞诸如,例如,神经细胞、肝脏细胞(诸如肝细胞)或肌肉细胞。分化的细胞或分化诱导的细胞是在细胞谱系内呈现更特化(“定型”)位置的细胞。一旦细胞分化或定型,细胞将在分化通路中前进至一定的点,在所述点处在正常情况下其将继续分化成特定的细胞类型或细胞类型亚组,并且在正常情况下不能分化为不同的细胞类型或逆转为较少分化的细胞类型。谱系特异性标志物是指与目的谱系的细胞的表型特异性相关的特性,并且可以用来评估未定型细胞向目的谱系的分化。如本文所用,术语“干细胞”是指未分化细胞,所述未分化细胞由它们处于单细胞水平时自我更新和分化以产生后代细胞的能力来定义,所述后代细胞包括自我更新的祖细胞、非更新性祖细胞、和终末分化细胞。干细胞的特征还在于它们在体外由多个胚层(内胚层、中胚层和外胚层)分化成各种细胞谱系的功能细胞,以及在移植后产生多个胚层的组织并且在注射到胚泡后基本上促成大多数组织(如果不是全部的话)的能力。干细胞由它们的发育潜力归类为:(1)全能干细胞,意指能够产生所有胚胎细胞类型和胚外细胞类型;(2)多能干细胞,意指能够产生所有胚胎细胞类型;(3)专能干细胞(multipotent),意指能够产生细胞谱系亚组,但所有均在特定的组织、器官或生理系统内(例如,造血干细胞(hsc)可以产生的后代包括hsc(自我更新)、血细胞限制的寡能祖细胞、以及为血液的正常组分的所有细胞类型和成分(例如,血小板));(4)寡能干细胞,意指能够产生比专能干细胞限制更多的细胞谱系亚组;和(5)单能干细胞,意指能够产生单一细胞谱系(例如,精原干细胞)。在一个实施例中,如本文所用,术语“干细胞”不包括能产生所有胚胎和胚外细胞类型,其能随后续发育成为人的人胚胎干细胞。在一个实施例中,所述干细胞可以是多能干细胞或专能干细胞。多能干细胞可以表达一种或多种阶段特异性胚胎抗原(ssea)3和4,以及使用命名为tra-1-60和tra-1-81的抗体可检测到的标志物。多能干细胞在体外的分化导致ssea-4、tra-1-60、和tra-1-81表达(如果存在的话)的丧失和ssea-i的表达增加。未分化的多能干细胞典型地具有碱性磷酸酶活性,所述碱性磷酸酶活性可以通过本领域中已知的方法检测,例如通过用4%多聚甲醛固定细胞,然后用vectorred作为底物显色,如由制造商所述(vectorlaboratories,burlingamecalif.)。未分化的多能干细胞还典型地表达oct-4和tert,如通过rt-pcr检测。繁殖的多能干细胞的另一表型是分化成所有三种胚层的细胞的潜力:内胚层、中胚层和外胚层组织。因此,在一个实施例中,多能干细胞的多能性可以通过下述来确认:将细胞注射到严重联合免疫缺陷(scid)小鼠中,使用4%多聚甲醛固定形成的畸胎瘤,然后针对来自三个胚层的细胞类型的证据来组织学检验它们。或者,可以通过形成拟胚体并针对与三个胚层相关的标志物的存在来评估拟胚体来确定多能性。在一个实施例中,繁殖的多能干细胞系可以使用标准的g-显带技术来确定核型并与相应的灵长类物种的已发表的核型进行比较。期望的是获得具有“正常核型”的细胞,“正常核型”的细胞意指所述细胞是整倍体,其中所有人染色体均存在并没有被显著地改变。可以使用的多能干细胞的类型包括已建系的多能细胞,所述多能细胞源自妊娠后形成的组织,包括胚前组织(诸如,例如,胚泡)、胚胎组织、或在妊娠期间任何时间所取的胎儿组织,一般但不必须在大约10-12周妊娠之前。在一个实施例中,已建系的人胚胎干细胞或人胚胎生殖细胞可以包括,但不限于,人胚胎干细胞系h1、h7、和h9(wicelltm)。还预期在此类细胞的初始建立或稳定期间使用本公开的组合物,在这种情况下来源细胞将是从来源组织直接获取的原代多能细胞。还适合的是从已经在缺少饲养细胞的情况下培养的多能干细胞群获取的细胞。还适合的是突变的人胚胎干细胞系,诸如,例如,bgoiv(bresagen,athens,ga)。因此,在一个实施例中,多能干细胞可以是诱导的多能干细胞或天然多能干细胞。在一个实施例中,干细胞可以源自细胞诸如,但不限于,肝来源细胞、胰腺来源细胞、脐带来源细胞、脐带血来源细胞、脑来源细胞、脾来源细胞、骨髓来源细胞、心脏来源细胞、肺来源细胞、脂肪来源细胞、由ips技术获得的细胞、源自胚胎干细胞的细胞、基因工程细胞、多能细胞、专能细胞、神经细胞、星形胶质细胞、肝细胞、成纤维细胞、间充质细胞、周细胞、心肌细胞、心肌细胞祖细胞、造血细胞、内皮细胞、内皮祖细胞、平滑肌细胞、角质形成细胞、祖细胞、其细胞混合物和组合。在一个实施例中,干细胞可以是h9细胞。在一个实施例中,干细胞可以使用本领域中已知的方法生长。在一个实施例中,干细胞可以在无饲养细胞培养物中生长。在一个实施例中,干细胞可以作为贴壁细胞或悬浮的细胞(悬浮细胞)培养。在一个实施例中,在本公开中使用的干细胞可以是哺乳动物细胞。如本文所用,术语“定形内胚层”是指带有在原肠胚形成期间产生自外胚层的细胞的特征并且形成胃肠道及其衍生物的细胞。术语“定形内胚层”还可以指表达定形内胚层谱系特征性的标志物的细胞,所述标志物诸如,但不限于foxa2、hnf3β、gata4、sox17、cerberus、otx2、goosecoid、c-kit、cd99、gsc、cerl、nodal、fgf8、barchyury、mix-样同源盒蛋白(mixl1)、fgf4cd48、脱中胚蛋白(eomes)、dkk4、gata6、fgf17、和cxcr4。如本领域中所知,检查所有标志物以确认细胞是否可以被鉴定为定形内胚层可能是不实用的。因此,在一个实施例中,定形内胚层细胞可以至少表达标志物中的至少两种,所述标志物诸如,但不限于,foxa2、hnf3β、gata4、sox17、cerberus、otx2、goosecoid、c-kit、cd99、gsc、cerl、nodal、fgf8、barchyury、mix-样同源盒蛋白(mixl1)、fgf4cd48、脱中胚蛋白(eomes)、dkk4、gata6、fgf17、和cxcr4。在一个实施例中,如果细胞至少表达foxa2和sox17,则该细胞可以被确定为定形内胚层细胞。在一个实施例中,如果细胞正被朝向定形内胚层驱动时该细胞还具有较少的多能性标志物(与干细胞相比),则该细胞可以被确定为定形内胚层。如本文所用,术语“成肝细胞”指肝细胞样细胞或肝细胞的祖细胞。在一个实施例中,成肝细胞指表达与成肝细胞相关联的至少一种标志物的细胞,所述标志物诸如,但不限于,肝细胞核因子4α(hnf4α)、肝细胞核因子3β(hnf3-β)、细胞角蛋白18(ck18)、白蛋白、胆标志物ck19、和afp(α-甲胎蛋白)。在一个实施例中,成肝细胞可以进一步通过它们被驱动进一步成为肝细胞并且仍具有增殖能力的能力来表征。在一个实施例中,成肝细胞可以通过丧失一些(但不是全部)定形内胚层标志物诸如sox17而从定形内胚层状态分化。在一个实施例中,与肝细胞样细胞相比,成肝细胞可以具有较高的afp表达和较低的肝标志物(白蛋白、细胞色素p450酶)表达。在一个实施例中,成肝细胞可以具有一些成肝细胞标志物的组合,从而被鉴定为成肝细胞,所述成肝细胞标志物诸如,但不限于,hnf4α、afp、和ck18/ck19。如本文所用,术语“肝细胞样”指表达至少两种肝细胞标志物的细胞,诸如,但不限于,白蛋白、ccfp、肝细胞核因子4α(hnf4α)、肝细胞核因子3β(hnf3-β)、细胞角蛋白18(ck18)、谷氨酰胺合成酶(gs)、较紊乱型平滑肌肌动蛋白(sma)、和血管假性血友病因子(vwf)的表达。在一个实施例中,标志物还可以包括肝细胞可诱导基因诸如,但不限于,雄烷受体(car)、孕烷x受体(pxr)、过氧化物酶体增殖物激活受体y共激活剂mα(pgc-1)、磷酸烯醇式丙酮酸羧激酶(pepck)和过氧化物酶体增殖物激活受体-γ(ppar-y)(糖异生关键酶)、cyp3a4(对于内生代谢和异生物质代谢重要的细胞色素p450(cyp)第一相单加氧酶体系酶)。在一个实施例中,这些可诱导基因在分化的肝细胞样细胞中表达提高或可以在用pb、rif、8-br-camp或毛喉素处理后被诱导。可以被肝细胞样细胞表达的其他相关肝细胞标志物可以包括,但不限于,白蛋白产生;7-戊氧基试卤灵-o-脱烷基化(prod)的产物,其被cyp2b1/2特异性地催化;肝脏胆红素清除需要的酶,udp-葡萄糖醛酸基转移酶(ugt1a1);人羟基类固醇磺基转移酶(sult2a1),其催化内源性底物和异型生物质底物的磺化和解毒;转甲状腺素蛋白(ttr)1色氨酸-2,3-双加氧酶(tdo);α-1–抗胰蛋白酶(α-1-at)、肝特异性有机阴离子转运子(lst-1,也称为oatp2);和氨甲酰磷酸合酶1(cpsase-1)。在一个实施例中,肝细胞样细胞标志物可以包括,但不限于,形态学特征诸如,大多数单核和异质的,具有高核质比,较多的多边形至立方形的形状,表现出脂滴包含物,形成管型结构的能力,和发育成血窦的能力。在又另一个实施例中,肝细胞样细胞可以被表征为具有,诸如,但不限于以下的特征:糖原产生、合成血清蛋白质、血浆蛋白质、凝血因子、解毒功能、尿素产生、糖异生和脂质代谢。因此,在一个实施例中,肝细胞样细胞表现更成熟的肝细胞功能,诸如行使代谢通路。因此,在一个实施例中,肝细胞样细胞可以通过选择至少两种方法来表征,所述方法诸如,但不限于,形态学分析、对肝标志物的基因表达水平分析、转录因子分析、功能测定、细胞色素(cyp)分析、药物测试应用,等等。在一个实施例中,功能测定可以包括,但不限于,糖原摄取测定、ldl贮存测定、吲哚菁绿(icg)摄取测定和清除测定。在一个实施例中,肝细胞样细胞可以通过形态学分析和细胞色素(cyp)分析来表征。在一个实施例中,细胞色素(cyp)分析的靶标可以包括属于细胞色素p450超家族的蛋白质。如本领域专业技术人员将理解的,存在多种确定细胞是否可以被鉴定为肝细胞的方法。例如,现有技术使用本文所述的一些测定的组合来鉴定细胞为肝细胞。在一个实施例中,基因表达、白蛋白/尿素产生或糖原摄取,以及一些cyp活性是所需的最少测定。在一个实施例中,可以需要超过一种测定来确定细胞是否是肝细胞。在一个实施例中,如本文所述的测定的组合可以用来确认细胞是肝细胞。在一个实施例中,肝细胞样细胞可以是原代人肝细胞。如实施例部分以及图4和5中所示,使用肝标志物的基因表达、白蛋白和尿素的产生,以及主要细胞色素p450酶诸如cyp1a2和cyp3a4的基础和诱导水平来确认肝细胞/肝细胞样细胞的功能性。在一个实施例中,可以使用本领域中已知的至少一种、至少两种或所有方法,诸如肝标志物的基因表达、白蛋白和尿素的产生,以及主要细胞色素p450酶诸如cyp1a2和cyp3a4的基础和诱导水平来确认肝细胞样细胞。如本文所用,术语“表观遗传调节剂”指能够重新激活已经在细胞诸如干细胞中被阻遏的调节基因的分子或药剂。如本文所用,“表观遗传调节剂”在基因表达中引起减数分裂和有丝分裂可遗传的改变,这不是由于dna内的碱基变化引起的。实例是dna甲基化基因和它们的抑制剂、组蛋白修饰剂(诸如组蛋白脱乙酰化酶或组蛋白脱乙酰化酶抑制剂(hdaci)、染色质重塑、微小rna以及其他非编码调节rna。在一个实施例中,表观遗传调节剂可以称作染色质重塑剂,所述染色质重塑剂可以调节干细胞分化。在一个实施例中,表观遗传调节剂可以包括,但不限于,dna甲基化剂和它们的抑制剂、组蛋白修饰剂、染色质重构、微小rna和非编码调节rna。在一个实施例中,组蛋白修饰剂可以包括,但不限于组蛋白脱乙酰基酶和组蛋白脱乙酰基酶抑制剂(hdaci)。在一个实施例中,“表观遗传调节剂”可以以约100-200nm、或约200-400nm、或约400-600nm、或约600-800nm、或约800-1000nm、或约250-500nm、或约750-1000nm的浓度存在。在一个实施例中,“表观遗传调节剂”可以以约100-500nm、或约150-300nm,或约200-300nm、或约210-290nm、或约220-280nm、或约230-270nm、或约240-260nm、或约200nm、或约210nm、或约220nm或约230nm、或约240nm、或约250nm、或约260nm、或约270nm、或约280nm、或约290nm、或约300nm的浓度存在。在一个实施例中,表观遗传调节剂可以以总体积的约0.1-2%、或约0.1-1.5%、或约0.1-1%、或约0.25-0.75%、或约0.3-0.6%或约0.5%的浓度提供。如实施例部分中所示,如本文所述的方法可以使定形内胚层经受两种表观遗传调节剂。因此,在一个实施例中,如本文所述的方法的步骤a)可以包括两种表观遗传调节剂。不希望受理论约束,本公开的发明人发现两种表观遗传调节剂的组合出人意料地产生高水平的肝标志物表达和减少的细胞死亡。在一个实施例中,如本文所述的方法可以使成肝细胞经受两种干细胞分化通路抑制剂。因此,在一个实施例中,如本文所述的方法的步骤b)可以包括两种干细胞分化通路抑制剂。备选地,在一个实施例中,如本文所述的方法可以使成肝细胞经受干细胞分化通路抑制剂和表观遗传调节剂。因此,在一个实施例中,如本文所述的方法的步骤b)可以包括干细胞分化通路抑制剂和表观遗传调节剂。在一个实施例中,当所述方法的步骤b)包括干细胞分化通路抑制剂和表观遗传调节剂时,如本文所述的方法的步骤a)中的表观遗传调节剂可以比如本文所述的方法的步骤b)中少。因此,在其中表观遗传调节剂是组蛋白修饰剂的一个实施例中,如本文所述的方法的步骤a)中提供的所述组蛋白修饰剂可以比如本文所述的方法的步骤b)中少。在一个实施例中,当表观遗传调节剂是组蛋白脱乙酰基酶抑制剂时,如本文所述的方法的步骤a)中提供的组蛋白脱乙酰基酶抑制剂可以比如本文所述的方法的步骤b)中少。在一个实施例中,组蛋白脱乙酰基酶抑制剂可以包括,但不限于丁酸钠,二甲基亚砜(dmso),等。在一个实施例中,表观遗传调节剂可以是组蛋白脱乙酰基酶抑制剂,诸如丁酸钠和/或二甲基亚砜(dmso)。在一个实施例中,丁酸钠可以以约100-500nm、或约150-300nm、或约200-300nm、或约210-290nm、或约220-280nm、或约230-270nm、或约240-260nm、或约200nm、或约210nm、或约220nm、或约230nm、或约240nm、或约250nm、或约260nm、或约270nm、或约280nm、或约290nm、或约300nm的浓度提供。在一个实施例中,组蛋白脱乙酰基酶抑制剂的浓度可以以溶液总体积的百分比浓度提供。因此,在一个实施例中,步骤a)或b)中组蛋白脱乙酰基酶抑制剂的浓度可以是约0.1-2%、或约0.1-0.5%、或约0.5-0.1%、或约0.5-1%、或约1-1.5%或约1.5-2%。在一个实施例中,组蛋白脱乙酰基酶抑制剂可以是二甲基亚砜(dmso)并且步骤a)和/或步骤b)中的浓度可以是约0.1-2%、或约0.1-0.5%、或约0.5-0.1%、或约0.5-1%、或约1-1.5%或约1.5-2%。在一个实施例中,组蛋白脱乙酰基酶抑制剂可以二甲基亚砜(dmso)并且步骤a)和/或步骤b)中的浓度可以是约0.1-2%、或约0.1-1.5%、或约0.25-1.25%、或约0.3-1.1%、或约0.5-1%。在一个实施例中,组蛋白脱乙酰基酶抑制剂可以是二甲基亚砜(dmso)并且步骤a)和/或步骤b)中的浓度可以是约0.1%、或约0.2%、或约0.3%、或约0.4%、或约0.5%、或约0.6%、或约0.7%、或约0.8%、或约0.9%、或约1%、或约1.1%、或约1.2%、或约1.3%、或约1.4%、或约1.5%。在一个实施例中,组蛋白脱乙酰基酶抑制剂可以是二甲基亚砜(dmso)并且步骤a)中的浓度可以是约0.1%、或约0.2%、或约0.3%、或约0.4%、或约0.5%、或约0.6%。在一个实施例中,组蛋白脱乙酰基酶抑制剂可以是二甲基亚砜(dmso)并且步骤b)中的浓度可以是约0.6%、或约0.7%、或约0.8%、或约0.9%、或约1%、或约1.1%、或约1.2%、或约1.3%、或约1.4%、或约1.5%。如本文所用,术语“抑制”或“阻断”意指在用化合物(即,抑制剂)处理后细胞的特定信号传导通路的活性水平与没有用此类化合物处理或用对照处理的细胞的所述信号传导通路的活性相比减小。因此,如本文所用,术语“干细胞分化通路抑制剂”指与这样的分子(即,抑制剂),与没有用此类化合物处理或用对照处理的干细胞活性相比,所述分子可以减小干细胞的分化通路的分化活性或终止干细胞的所述分化通路。在一个实施例中,干细胞分化通路抑制剂可以影响本领域中已知的至少一种、至少两种、至少三种或所有分化通路,诸如,但不限于,notch通路、骨形态形成蛋白(bmp)通路、成纤维细胞生长因子(fgf)通路、转化生长因子β(tgfβ)通路,等。在一个实施例中,干细胞分化通路抑制剂可以包括,但不限于,肾上腺髓质素抑制剂、血管生成素抑制剂、自分泌运动因子抑制剂、骨形态形成蛋白抑制剂、脑衍生神经营养因子抑制剂、表皮生长因子抑制剂、红细胞生成素抑制剂、成纤维细胞生长因子抑制剂、神经胶质细胞系衍生神经营养因子抑制剂、粒细胞集落刺激因子抑制剂、粒细胞巨噬细胞集落刺激因子抑制剂、生长分化因子-9抑制剂、愈合因子抑制剂、肝细胞生长因子抑制剂、肝细胞瘤衍生生长因子抑制剂、胰岛素样生长因子抑制剂、角质形成细胞生长因子抑制剂、移动刺激因子抑制剂、肌生长抑制素抑制剂、神经生长因子抑制剂、神经营养因子抑制剂、血小板衍生生长因子抑制剂、促血小板生成素抑制剂、转化生长因子α抑制剂、转化生长因子β抑制剂、肿瘤坏死因子-α抑制剂、血管内皮生长因子抑制剂、wnt信号传导通路抑制剂、胎盘生长因子抑制剂、胎牛生长激素抑制剂、白介素抑制剂及其组合。在一个实施例中,干细胞分化通路抑制剂可以包括,但不限于,表皮生长因子抑制剂、肝细胞生长因子抑制剂、肝细胞瘤衍生生长因子抑制剂、胰岛素样生长因子抑制剂、促血小板生成素抑制剂、转化生长因子α抑制剂、转化生长因子β抑制剂、wnt信号传导通路抑制剂,和类似物。在一个实施例中,干细胞分化通路抑制剂可以在所述方法中以对本领域技术人员明显的浓度提供。在一个实施例中,干细胞分化通路抑制剂可以以约0.1-5μm、约5-10μm、或约10-25μm、或约25-50μm、或约8-16μm或约15-30μm的浓度存在。在一个实施例中,干细胞分化通路抑制剂可以以约0.1-5μm、或约0.2-4μm、或约0.3-3μm、或约0.4-2μm、或约0.5-1.75μm、或约0.6-1.5μm、或约0.7-1.25μm、或约0.8-1.1μm、或约0.9-1μm、或约0.1μm、或约0.2μm、或约0.3μm、或约0.4μm、或约0.5μm、或约0.6μm、或约0.7μm、或约0.8μm、或约0.9μm、或约1μm、或约1.1μm、或约1.2μm、或约1.3μm、或约1.4μm、或约1.5μm、或约1.6μm、或约1.7μm、或约1.8μm、或约1.9μm、或约2.0μm的浓度存在。在一个实施例中,干细胞分化通路抑制剂可以是转化生长因子β抑制剂(tgf-β抑制剂)。如本文所用,术语“生长因子抑制剂”指抑制、停止或减少(与对照或未处理相比)参与干细胞分化的通路的化合物。这可以包括notch通路、bmp、fgf通路和tgfβ通路。相似的tgfβ已知促进胆管上皮细胞分化并且因此tgfβ抑制具有被用作以减少胆管上皮细胞分化的代价来促进肝细胞分化的方法的潜力。在一个实施例中,转化生长因子β抑制剂可以包括,但不限于,二甲基亚砜(dmso)、4-(4-(苯并[d][1,3]二氧杂环戊烯-5-基)-5-(吡啶-2-基)-1h-咪唑并-2-基)苯甲酰胺(sb431542)、3-(6-甲基-2-吡啶基)-n-苯基-4-(4-喹啉基)-1h-吡唑-1-硫代甲酰胺(a83-01)、4-[4-(2,3-二氢-1,4-苯并二氧六环-6-基)-5-(2-吡啶基)-1h-咪唑并-2-基]苯甲酰胺(d4476)、4-[4-[3-(2-吡啶基)-1h-吡唑-4-基]-2-吡啶基]-n-(四氢-2h-吡喃-4-基)-苯甲酰胺(gw788388)、4-[3-(2-吡啶基)-1h-吡唑-4-基]-喹啉(ly364947)、2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-萘啶(repsox)、2-[4-(1,3-苯并二氧杂环戊烯-5-基)-2-(1,1-二甲基乙基)-1h-咪唑并-5-基]-6-甲基-吡啶(sb505124)、6-[2-(1,1-二甲基乙基)-5-(6-甲基-2-吡啶基)-1h-咪唑并-4-基]喹喔啉(sb525334)、2-(5-氯-2-氟苯基)-4-[(4-吡啶基)氨基]喋啶(sd208)、脱腺苷化核酸酶(dan),及其组合。如在实施例部分中所阐明,在此研究中使用sb431542。一种另外的抑制剂是脱腺苷化核酸酶(dan)。因此,在一个实施例中,干细胞分化通路抑制剂可以是sb431542和/或脱腺苷化核酸酶(dan)。如本文所用,术语“生长因子”指多核苷酸分子、多肽分子、或能够实现细胞分化的其他相关化学剂。例如,“生长因子”可以指刺激参与干细胞分化的通路的化合物。生长因子的实例可以包括,但不限于,细胞因子、激素、以及结合它们的靶标上的细胞表面受体的化合物,它们激活生长或分化相关的通路。生长因子的实例可以包括,但不限于,表皮生长因子(egf)、转化生长因子-α(tgf-α)、转化生长因子-β(tgf-β)、人内皮细胞生长因子(ecgf)、粒细胞巨噬细胞集落刺激因子(gm-csf)、骨形态形成蛋白(bmp)、神经生长因子(ngf)、血管内皮细胞生长因子(vegf)、成纤维细胞生长因子(fgf)、胰岛素样生长因子(igf)、和/或血小板衍生生长因子(pdgf)。在一个实施例中,生长因子可以包括,但不限于,表皮生长因子(egf)、转化生长因子-α(tgf-α)、转化生长因子-β(tgf-β)、骨形态形成蛋白(bmp)、成纤维细胞生长因子(fgf)、胰岛素样生长因子(igf),和类似物。在一个实施例中,生长因子可以是激活素。在一个实施例中,激活素可以是激活素a、激活素b或激活素a和b的二聚物(激活素ab)。如本文所用,短语“不包括”是指缺少外源添加的试剂或分子。因此,在本公开中,短语“不包括使用生长因子”是指在如本文所述的方法(诸如步骤a)和b))中不添加外源生长因子。在一个实施例中,如本文所述的方法的步骤a)可以包括使定形内胚层经受表观遗传调节剂诸如,但不限于,丁酸钠和二甲基亚砜(dmso)。如实施例部分所示,添加这些表观遗传调节剂证明成功地由定形内胚层产生了肝祖细胞/成肝细胞。在一个实施例中,如本文所述的方法的步骤b)可以包括使获自步骤b)的成肝细胞/肝祖细胞与至少一种细胞分化通路抑制剂诸如sb431542(转化生长因子β/tgf-β抑制剂)和dmso接触。如实施例部分所示,干细胞分化通路抑制剂的添加证明成功地产生了功能性肝细胞/肝细胞样细胞。如实施例部分、图1和图7中所示,为了提供定形内胚层,使人胚胎干细胞经受至少一种可以调节干细胞分化的化合物。因此,在一个实施例中,在如本文所述的方法中步骤a)之前,定形内胚层可以通过使干细胞经受至少一种通过抑制激酶活性来调节干细胞分化的化合物来获得。在一个实施例中,“先于”步骤a)或步骤a)“之前”的步骤是指上面讨论的分化步骤i),其涉及干细胞分化成定形内胚层。如本文所用,术语“激酶抑制剂”是指与不经受同一化合物(未处理)或对照的细胞相比,抑制、减少或停止细胞中的激酶-信号传导通路的分子。激酶抑制剂被归类为:1)酪氨酸激酶抑制剂(受体酪氨酸激酶抑制剂和非受体酪氨酸激酶抑制剂两者,2)丝氨酸/苏氨酸激酶抑制剂,和3)作用于所有3种残基-丝氨酸、苏氨酸和酪氨酸的激酶抑制剂。在此,激酶抑制剂是通过抑制激酶活性来调节干细胞分化的化合物。这样的激酶抑制剂的实例包括,但不限于:磷酸肌醇-3-激酶(pi3k)抑制剂ly294002、渥曼青霉素、px-866(oncothyreon)、sf1126;双重pi3k-mtor抑制剂:pi-103、gdc-0941、nvp-bez235(novartis)、gdc-0980(genentech)、xl-765(exelixis)、gsk2126458(glaxosmithkline)、pki-587/pf-05212384(wyeth)、pf-04691502(pfizer)y-27632(rho-相关激酶抑制剂);糖原合成酶3激酶抑制剂6-溴靛玉红-3’-肟(bio);和类似物。在一个实施例中,如本文所述的方法的步骤a)之前的步骤(其中定形内胚层可以获自干细胞的步骤)可以进一步包括生长因子用于(由干细胞)获得定形内胚层。在一个实施例中,生长因子可以是激活素,诸如激活素a、激活素ab或激活素b。在一个实施例中,在如本文所述的方法的步骤a)之前的步骤(其中定形内胚层可以获自干细胞的步骤)中,至少两种,或至少三种或至少四种,或更多种通过抑制激酶活性来调节干细胞分化的化合物可以用来获得定形内胚层。在一个实施例中,至少两种通过抑制激酶活性来调节干细胞分化的化合物可以用来获得定形内胚层。在一个实施例中,至少两种可以获得定形内胚层的化合物中的一种可以是通过抑制激酶活性来调节干细胞分化的化合物。在一个实施例中,可以用来获得定形内胚层的化合物可以是磷酸肌醇-3-激酶抑制剂。在一个实施例中,所述化合物可以是糖原合成酶3抑制剂。因此,在一个实施例中,在如本文所述的方法的步骤a)之前的步骤中,至少两种通过抑制激酶活性来调节干细胞分化的化合物可以用来获得定形内胚层,其中一种通过抑制激酶活性来调节干细胞分化的化合物可以是磷酸肌醇-3-激酶抑制剂。在一个实施例中,其中在如本文所述的方法的步骤a)之前的步骤中,所述至少两种通过抑制激酶活性来调节干细胞分化的化合物可以用来获得定形内胚层,其中一种化合物可以是糖原合成酶3抑制剂。在一个实施例中,所述通过抑制激酶活性来调节干细胞分化的化合物可以以约0.1-20μm、或约0.5-10μm、或约1-20μm、或约1.5-15μm或约1.75-12μm或约2-10μm的浓度存在。在一个实施例中,所述通过抑制激酶活性来调节干细胞分化的化合物可以以约0.1-20μm、约0.5-15μm、约0.75-10μm、或约0.1μm、或约0.2μm、或约0.3μm、或约0.4μm、或约0.5μm、或约0.6μm、或约0.7μm、或约0.8μm、或约0.9μm、或约1.0μm、或约1.1μm、或约1.2μm、或约1.3μm、或约1.4μm、或约1.5μm、或约1.6μm、或约1.7μm、或约1.8μm、或约1.9μm、或约2.0μm、或约2.1μm、或约2.2μm、或约2.3μm的浓度存在。在一个实施例中,所述通过抑制激酶活性来调节干细胞分化的化合物可以以约0.1-20μm、约5-15μm、约7.5-12.5μm、或约1μm、或约2μm、或约3μm、或约4μm、或约5μm、或约6μm、或约7μm、或约8μm、或约9μm、或约10μm、或约11μm、或约12μm、或约13μm、或约14μm、或约15μm、或约16μm、或约17μm、或约18μm、或约19μm、或约20μm的浓度存在。在一个实施例中,当通过抑制激酶活性来调节干细胞分化的化合物是6-溴靛玉红-3’-肟(bio)时,所述化合物可以以约0.1-20μm、约0.5-15μm、约0.75-10μm、或约0.1μm、或约0.2μm、或约0.3μm、或约0.4μm、或约0.5μm、或约0.6μm、或约0.7μm、或约0.8μm、或约0.9μm、或约1.0μm、或约1.1μm、或约1.2μm、或约1.3μm、或约1.4μm、或约1.5μm、或约1.6μm、或约1.7μm、或约1.8μm、或约1.9μm、或约2.0μm、或约2.1μm、或约2.2μm、或约2.3μm的浓度存在。在一个实施例中,当通过抑制激酶活性来调节干细胞分化的化合物是ly2947002时,所述化合物可以以约0.1-20μm、约5-15μm、约7.5-12.5μm、或约1μm、或约2μm、或约3μm、或约4μm、或约5μm、或约6μm、或约7μm、或约8μm、或约9μm、或约10μm、或约11μm、或约12μm、或约13μm、或约14μm、或约15μm、或约16μm、或约17μm、或约18μm、或约19μm、或约20μm的浓度存在。在一个实施例中,通过抑制激酶活性来调节干细胞分化的化合物可以作用于转化生长因子β(tgf-β)家族/smad信号传导通路/激活素和wnt信号传导通路/磷酸肌醇-3-激酶(pi3k)-akt信号传导通路。在一个实施例中,通过抑制激酶活性来调节干细胞分化的化合物可以包括,但不限于,2-吗啉-4-基-8-苯基苯丙吡喃-4-酮(ly294002)、(1α,11α)-11-(乙酰氧基)-1-(甲氧基甲基)-2-氧杂雄甾-5,8-二烯(6,5,4-bc)呋喃-3,7,17-三酮(渥曼青霉素)、(1e,4s,4ar,5r,6as,9ar)-5-(乙酰氧基)-1-[(二-2-丙烯-1-基氨基)亚甲基]-4,4a,5,6,6a,8,9,9a-八氢-11-羟基-4-(甲氧基甲基)-4a,6a-二甲基-环戊[5,6]萘并[1,2-c]吡喃-2,7,10(1h)-三酮(px-866)、(8s,14s,17s)-14-(羧甲基)-8-(3-胍基丙基)-17-(羟基甲基)-3,6,9,12,15-戊氧代-1-(4-(4-氧-8-苯基-4h-色烯-2-基)吗啉代-4-)-2-氧杂-7,10,13,16-四氮杂十八烷-18-酸盐(sf1126)、3-[4-(4-吗啉基)吡啶并[3’,2’:4,5]呋喃并[3,2-d]嘧啶-2-基]-苯酚(pi-103)、2-(1h-吲唑-4-基)-6-(4-甲磺酰基-哌嗪-1-基甲基)-4-吗啉-4-基-噻吩并[3,2-d]嘧啶(gdc-0941)、4-[2,3-二氢-3-甲基-2-氧-8-(3-喹啉基)-1h-咪唑并[4,5-c]喹啉-1-基]-α,α-二甲基-苯乙腈(nvp-bez235)、(s)-1-(4-((2-(2-氨基嘧啶-5-基)-7-甲基-4-吗啉代噻吩并[3,2-d]嘧啶-6-基)甲基)哌嗪-1-基)-2-羟基丙-1-酮(gdc-0980)、2-氨基-8-乙基-4-甲基-6-(1h-吡唑-3-基)吡啶并[2,3-d]嘧啶-7(8h)-酮(sar245409,xl-765)、2,4-二氟-n-{2-(甲基氧基)-5-[4-(4-哒嗪基)-6-喹啉基]-3-吡啶基}苯磺酰胺(gsk2126458)、1-(4-(4-(二甲基氨基)哌啶-1-羰基)苯基)-3-(4-(4,6-二吗啉代-1,3,5-三嗪-2-基)苯基)脲(pki-587/pf-05212384)、2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基-3-吡啶基)-4-甲基-吡啶并[2,3-d]嘧啶-7(8h)-酮(pf-04691502)、糖原合成酶-3-激酶抑制剂、磷酸肌醇-3-激酶抑制剂和6-溴靛玉红-3’-肟(bio)。在一个实施例中,糖原合成酶3激酶抑制剂可以包括,但不限于,丙戊酸(钠盐)、(5s,6r,7r,9r)-6-甲氧基-5-甲基-7-甲基氨基-6,7,8,9,15,16-六氢-5h,14h-5,9-环氧-4b,9a,15-三氮杂二苯并[b,h]环壬烷[1,2,3,4-jkl]环戊[e]-as-茚-14-酮(十字孢碱)、(9r,10s,12s)-2,3,9,10,11,12-六氢-10-羟基-9-甲基-1-氧-9,12-环氧-1h-二吲哚并[1,2,3-fg:3',2',1'-kl]吡咯并[3,4-i][1,6]苯并二氮芳辛-10-甲酸己酯(kt5720)、(2z,3e)-6’-溴-3-(羟基亚氨基)-[2,3’-双二氢亚吲哚基]-2’-酮(gsk-3抑制剂ix)、双吲哚马来酰亚胺ix(ro21-8220)、3-(2,4-二氯苯基)-4-(1-甲基-1h-吲哚-3-基)-1h-吡咯-2,5-二酮(sb-216763)、2,3,4,5-四氢-7-羟基-1h-苯并呋喃并[2,3-c]氮杂-1-酮(cid755673)、9-溴-7,12-二氢吲哚并[3,2-d][1]苯丙氮杂-6(5h)-酮(kenpaullone)、氯化锂、3-(6-(3-氨基苯基)-7h-吡咯并[2,3-d]嘧啶-4-基氧基)苯酚(gsk-3β抑制剂xii)、6-(2-(4-(2,4-二氯苯基)-5-(4-甲基-1h-咪唑-2-基)-嘧啶-2-基氨基)乙基-氨基)-烟腈(gsk-3抑制剂xvi)、4z)-4-(2-氨基-5-氧-3,5-二氢-4h-咪唑-4-亚基)-2-溴-4,5,6,7-四氢吡咯并[2,3-c]氮杂-8(1h)-酮(2,5-已炔二醇(10z-hymenialdisine))、2-(2-氧-1h-吲哚-3-亚基)-1h-吲哚-3-酮(靛玉红)、n6-[2-[[4-(2,4-二氯苯基)-5-(1h-咪唑-1-基)-2-嘧啶基]氨基]乙基]-3-硝基-2,6-吡啶二胺(chir-98014)、2-氯-1-(4,5-二溴-噻吩-2-基)-乙酮(gsk-3β抑制剂vi)、keramaminea(manzaminea)、3-[1,3-二氢-3-(羟基亚氨基)-2h-吲哚-2-亚基]-1,3-二氢-2h-吲哚-2-酮(靛玉红-3'-单肟)、6-溴靛玉红-3′-丙酮肟(gsk-3抑制剂x)、gsk-3抑制剂xv(c25h14brn3o6ru,)、3-[(3-氯-4-羟基苯基)氨基]-4-(2-硝基苯基)-1h-吡咯-2,5-二酮(sb-415286)、9-溴-7,12-二氢吡啶并[3',2':2,3]氮杂并[4,5-b]吲哚-6(5h)-酮(1-氮杂坎帕罗酮(1-azakenpaullone))、3-[6-(3-氨基-苯基)-7h-吡咯并[2,3-d]嘧啶-4-基氧基-苯酚(tws119双三氟乙酸盐)、5-吲哚靛玉红-3'-单肟、2,4'-二溴苯乙酮(gsk-3β抑制剂vii)、3-氨基-1h-吡唑并[3,4-b]喹喔啉(cdk1/5抑制剂)、2-debromooroidin(hymenidin)、双吲哚马来酰亚胺x盐酸盐、5-乙基-7,8-二甲氧基吡咯并[3,4-c]异喹啉-1,3-二酮(3f8)、咪唑并[1',5':1,6]吡咯并[3',4':4,5]吡啶并[2,3-b]吲哚-1,3(2h,8h)-二酮(isogranulatimide)、(2r)-2-({9-(1-甲基乙基)-6-[(4-吡啶-2-基苄基)氨基]-9h-嘌呤-2-基}氨基)丁-1-醇(cr8,r-异构体)、2-氯-5-(2-苯基-5-(吡啶-4-基)-1h-咪唑并-4-基)苯酚(raf激酶抑制剂iv)、靛玉红-3'-单肟-5-磺酸、2-硫代(3-碘苄基)-5-(1-吡啶基)-[1,3,4]-二唑(gsk-3抑制剂ii)、n-(4-甲氧基苄基)-n′-(5-硝基-1,3-噻唑-2-基)脲(gsk-3β抑制剂viii)、7-正丁基-6-(4'-羟基苯基)-5h-吡咯并(2,3b)吡嗪(aloisinea)、3-(1-(3-羟基丙基)-1h-吡咯并[2,3-b]吡啶-3-基]-4-吡嗪-2-基-吡咯-2,5-二酮(gsk-3β抑制剂xi)、1-甲基-bio(gsk-3抑制剂ix,controlmebio,cas710323-61-8)、3-(6-氧-9-硝基-5,6,7,12-四氢吲哚并[3,2-d][1]苯并氮杂-2-基)丙腈(alsterpaullone)、1,3,4-二唑、2-甲基-5-[3-[4-(甲基亚磺酰基)苯基]-5-苯并呋喃基]-(tcs2002)、3-[5-[4-(2-羟基-2-甲基-1-氧代丙基)-1-哌嗪基]-2-(三氟甲基)苯基]-4-(1h-吲哚-3-基)-1h-吡咯-2,5-二酮(tcs21311)、6-氧-7,12-二氢-5h-吲哚并[3,2-d][1]苯并氮杂-9-甲腈(9-cyanopaullone)、靛玉红-5-磺酸钠盐、4-苄基-2-甲基-1,2,4-噻二唑啉-3,5-二酮(gsk-3β抑制剂i)和1-(7-甲氧基喹啉-4-基)-3-[6-(三氟甲基)吡啶-2-基]脲(a1070722)。在一个实施例中,提供了分化干细胞以便获得肝细胞样细胞的方法。在一个实施例中,所述方法可以包括如下所述的步骤的实施例的任意组合。例如,在一个实施例中,所述方法可以包括如图7中所示的所有三个步骤。在另一个实施例中,所述方法可以仅包括将定形内胚层分化成肝细胞样细胞的方法。在一个实施例中,所述方法可以仅包括将成肝细胞分化成肝细胞样细胞的方法。在一个实施例中,所述方法可以仅包括将定形内胚层分化成成肝细胞的方法。在一个实施例中,如本文所述的分化干细胞的方法可以包括使干细胞经受至少一种通过抑制激酶活性来调节干细胞分化的化合物以获得定形内胚层细胞的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受激酶抑制剂和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受激酶抑制剂和激活素的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受磷酸肌醇-3-激酶抑制剂和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受糖原合成酶3抑制剂和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受糖原合成酶3抑制剂、磷酸肌醇-3-激酶抑制剂和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受糖原合成酶3抑制剂、磷酸肌醇-3-激酶抑制剂和激活素的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受糖原合成酶3抑制剂、磷酸肌醇-3-激酶抑制剂和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受作用于转化生长因子β(tgf-β)家族/smad信号传导通路/激活素和wnt信号传导通路/磷酸肌醇-3-激酶-akt信号传导通路的化合物的步骤。在一个实施例中,将干细胞分化成定形内胚层的方可以包括使干细胞经受溴-靛玉红-3’-肟(bio)、磷酸肌醇-3-激酶抑制剂和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受糖原合成酶3抑制剂、ly294002和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受溴-靛玉红-3’-肟(bio)、ly294002和生长因子的步骤。在一个实施例中,将干细胞分化成定形内胚层的方法可以包括使干细胞经受溴-靛玉红-3’-肟(bio)、ly294002和激活素的步骤。在一个实施例中,所述方法可以包括将定形内胚层分化为成肝细胞的步骤,其中所述方法包括使定形内胚层经受至少一种表观遗传调节剂的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括将定形内胚层分化为成肝细胞的步骤,所述方法包括使定形内胚层经受dna甲基化剂的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括将定形内胚层分化为成肝细胞的步骤,其中所述方法包括使定形内胚层经受组蛋白修饰剂的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括将定形内胚层分化为成肝细胞的步骤,其中所述方法包括使定形内胚层经受能够使染色质重塑的试剂,其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括将定形内胚层分化为成肝细胞的步骤,其中所述方法包括使定形内胚层经受组蛋白脱乙酰基酶和/或组蛋白脱乙酰基酶抑制剂(hdaci)的步骤,其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括将定形内胚层分化为成肝细胞的步骤,其中所述方法包括使定形内胚层经受二甲基亚砜和/或丁酸钠的步骤,其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括使成肝细胞分化为肝细胞样细胞的步骤,其中所述方法包括使成肝细胞经受至少一种干细胞分化通路抑制剂以获得肝细胞样细胞的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括使成肝细胞分化为肝细胞样细胞的步骤,其中所述方法包括使成肝细胞经受转化生长因子β抑制剂以获得肝细胞样细胞的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,所述方法可以包括使成肝细胞分化为肝细胞样细胞的步骤,其中所述方法包括使成肝细胞经受二甲基亚砜(dmso)和/或sb431542以获得肝细胞样细胞的步骤,并且其中此步骤不包括使用生长因子。在一个实施例中,如本文所使用的任一种化合物可以是天然的(分离自天然存在的来源)、合成的或半合成的。在一个实施例中,表观遗传调节剂和/或干细胞分化通路抑制剂可以是天然的(分离自天然存在的来源,除了用于分离目的以外不需要通过人工操作)、合成的或半合成的。如图6中所示,使用如本文所述的方法产生的肝细胞可以用作用于大规模应用的低成本工具,所述大规模应用诸如肝毒性筛选。因此,在一个实施例中,提供了通过如本文所述的方法或可通过如本文所述的方法获得的肝细胞样细胞。在进一步的实施例中,提供了由如本文所述的方法获得的肝细胞样细胞在应用中的用途,所述应用诸如,但不限于,药物毒性筛选、药物细胞毒性评估细胞治疗、组织工程、组织再生,和类似物。在一个实施例中,提供了筛选药物的方法。在一个实施例中,所述筛选药物的方法可以包括使根据权利要求19所述的肝细胞样细胞经受测试样品。在一个实施例中,所述筛选药物的方法可以进一步包括测量肝细胞样细胞的活力和/或测量肝细胞样细胞的功能表型。在一个实施例中,药物筛选可以用于诸如,但不限于下列的应用:药物毒性筛选、药物细胞毒性评估细胞治疗、组织工程、组织再生,和类似物。在一个实施例中,提供了试剂盒,所述试剂盒包含用于将干细胞分化成定形内胚层(即,步骤i,或先于如本文所述的方法的步骤a的步骤或如本文所述的方法的步骤a之前的步骤)的组合物,和/或用于将定形内胚层分化为成肝细胞/肝祖细胞(即,步骤ii,或如本文所述的方法的步骤a)的组合物,和/或用于将成肝细胞/肝祖细胞分化为肝细胞-样/肝细胞(即,步骤iii,或如本文所述的方法的步骤b)的组合物。用于特定分化步骤的组合物是如本文所述的方法中使用的那些。在一个实施例中,提供了药物筛选试剂盒,所述药物筛选试剂盒包含如通过如本文所述的方法获得的肝细胞样细胞。在一个实施例中,所述药物筛选试剂盒可以进一步包含用于药物筛选的试剂,包括,但不限于,培养基;用于检测白蛋白、肝细胞功能的试剂,和类似物。在一个实施例中,定形内胚层可以通过使人胚胎干细胞经受激活素a、ly294002(一种磷酸肌醇3激酶抑制剂)和溴-靛玉红-3’-靛玉红(bio,一种糖原合成酶激酶3抑制剂)中的至少一种、或至少两种、或至少所有来获得。在一个实施例中,如本文所述的方可以通过如图1中所概述的方法(左列)来执行。在一个实施例中,如实施例部分(如图1中所概述(左列))中所用的化合物可以包括,在下表中所列举的组分并且可以以下表中所提供的浓度提供:小分子浓度范围ly294002约5-50μmbio约1-20μm丁酸钠约100-1000nmdmso约0.1%-2%sb431542约0.1-20μm在一个实施例中,如本文所述的方法可以通过如图1中所概述的方法(左列)来执行。在一个实施例中,如实施例部分(如图1中所概述(左列))中所用的化合物可以包括,下表中所列举的组分并且可以以下表中所提供的量提供:小分子所用的总量+(ng)激活素a约100-600ly294002约10,000-15,000bio约1000-4000丁酸钠约50-200dmso*约50-150sb431542约200-500*使用的dmso的量的单位为μl。+所用的每种因子的量可以基于所用的因子的浓度(详见上面的材料和方法部分)和对于6孔板来说1ml或2ml的体积来计算,取决于是否执行全或半-培养基更换。例如,在第0天,激活素a以在2ml培养基中100ng/ml的浓度添加(即,使用的激活素a的量=200ng)。在第2天和第4天,1ml培养基用含激活素a的新鲜培养基更换,因此在这些天中的每一天使用100ng激活素。因此激活素a的总用量为400ng。在一个实施例中,如本文所述的方法可以通过如图1中所概述的方法(左列)来执行。在一个实施例中,如实施例部分(如图1中所概述(左列))中所用的化合物可以包括,在下表中所列举的组分并且可以以下表中所提供的量提供:小分子使用的总量+(ng)激活素a约400ly294002约12,300bio约2580丁酸钠约110dmso*约70sb431542约384*使用的dmso的量的单位为μl。+所用的每种因子的量可以基于所用的因子的浓度(详见上面的材料和方法部分)和对于6孔板来说1ml或2ml的体积来计算,取决于是否执行全或半-培养基更换。例如,在第0天,激活素a以在2ml培养基中100ng/ml的浓度添加(即,使用的激活素a的量=200ng)。在第2天和第4天,1ml培养基用含激活素a的新鲜培养基更换,因此在这些天中的每一天使用100ng激活素。因此激活素a的总用量为400ng。在一个实施例中,为了确认诱导的细胞是肝细胞-样的,可以使用下列表征的组合:1)形态学分析:典型的肝细胞形态特征诸如多边形的形状、颗粒状胞质和清楚的核;2)肝标志物诸如α甲胎蛋白(afp)白蛋白(alb)以及细胞色素p450酶(cyp)的基因表达水平;3)功能测定:白蛋白和尿素产生;4)cyp的功能活性;和/或5)药物测试应用。本文中举例说明的本发明可以适当地在缺少没有在本文中具体公开的任一种或多种要素、一种限制或多种限制的情况下实施。因此,例如,术语"包含"、"包括"、"含有",等应当宽泛地理解而没有限制。另外,本文所采用的术语和表述用作描述的术语并且没有限制,并且在这些术语和表述的使用中没有意图排除所显示和所描述的特征的任何等效形式或部分,而是要认识到在所要求保护的发明的范围内各种改型都是可能的。因此,应当理解尽管本发明已经通过优选的实施方案和任选的特征来具体地公开,但可以依靠本领域技术人员对在本文中所体现的各个发明做出改动和变化形式,并且此类改动和变化形式要被认为在本发明的范围内。在本文中已经对本发明进行了广义地和一般性地描述。落在一般性公开范围内的每一个较窄范围的类和亚类分组也形成本发明的一部分。这包括带有从一般性描述中去除任何主题的附带条件或负面限制的对本发明的一般性描述,无论被去除的内容是否在本文中被具体叙述。其他实施方案在下面的权利要求和非限制性实施例中。另外,在本发明的特征或实施例以马库什组的形式描述的情况下,本领域技术人员将认识到本发明因此还以马库什组的任何单个成员或亚组成员的形式描述。试验部分材料和方法hesc细胞培养hesc细胞系,h9(wicellresearchinstitute,madison,wi)在包被有基质胶(bdbiosciences,sanjose,ca,usa)的组织培养板上在mtesrtm1培养基(stemcelltechnologies,vancouver,bc,加拿大)中培养和繁殖。通过用1mg/ml中性蛋白酶(dispase)(stemcelltechnologies)在37℃孵育5分钟每隔5-7天将培养物传代。在显微镜指导下挑出克隆并以1:3至1:6分流比的重新接种。phh培养冻存的phh获自lifetechnologies(carlsbad,ca,usa)和bdbiosciences(franklinlakes,nj,usa)。细胞在37℃水浴中解冻并重新悬浮在预先温热的invitrogroht解冻培养基(celsis,invitrotechnologies,baltimore,md,usa)。将细胞在4℃以800rpm离心,并将细胞沉淀物重新悬浮在invitrogrocp平板接种培养基(含有0.02%torpedo抗生素混合物)中。将细胞计数并将50,000细胞接种到预先用中和的1.5mg/ml牛1型胶原蛋白溶液(advancedbiomatrix,sandiego,ca,usa)包被的96孔板(nunc,naperville,il,usa)的每个孔中。在允许细胞贴壁4小时后,将培养基更换为william培养基e(sigma-aldrich,新加坡),所述william培养基e补充有1mg/ml牛血清白蛋白(sigma)、1x胰岛素-转铁蛋白-硒和1xmem非必需氨基酸(gibco,carlsbad,ca,usa)、100nm地塞米松(sigma)、0.3mg/mll-谷氨酰胺(lonza,basel,瑞士)、100u/ml青霉素和100μg/ml链霉素(cellgro,manassas,va)。培养基每天更换一次。三个不同批次的肝细胞用于实验。所有测定在培养2天后进行。体外分化当hesc达到大约80%的汇合水平时启动分化。所有分化在预先包被有在杜尔贝科改良伊格尔培养基:营养素混合物f-12(dmem/f12,gibco)中稀释的基质胶的24或48孔板(nunc,naperville,il,usa)中在37℃在5%co2气氛中持续1–2h完成。为了诱导分化,将扩增培养基变换为基础分化培养基持续20天,所述基础分化培养基相继地用如图1中所述的生长因子或小分子鸡尾酒(cocktail)补充。在第1-6天培养基含有2%胎牛血清(fbs,hyclone,thermoscientific,logan,犹他州),在第6-20天含有0.5%fbs。基于生长因子的分化采用由roelandt等,plosone5(2010)e12101(其内容通过引用合并于此)开发的方案。简言之,基础分化培养基由60%dmem-低葡萄糖(gibco,carlsbad,ca,usa)、40%mcdb-201-水(sigma)、0.25x亚油酸–牛血清白蛋白(la-bsa)(sigma)、0.25x胰岛素-转铁蛋白-硒(its)(sigma)、100u/ml青霉素和100μg/ml链霉素(cellgro)、0.1mml-抗坏血酸(sigma)、1μm地塞米松(sigma)和110μm2-巯基乙醇(gibco)构成。下列的细胞因子和生长因子(全部获自r&dsystems,minneapolis,mn,usa)在不同的步骤时加入用于分化:rh/m/r激活素-a(100ng/ml)、rmwnt3a(50ng/ml)、rhfgf2(10ng/ml)、rhbmp4(50ng/ml)、rhfgf1(50ng/ml)、rmfgf8b(25ng/ml)、rhfgf4(10ng/ml)、rm卵泡抑素-288(100ng/ml)、rh抑瘤素m(100ng/ml)、rhhgf(20ng/ml)。下列的小分子在不同的步骤时加入至分化培养基:5μmide-2(stemgent,cambridge,ma,usa)、10μmly294002(sigma)、2μm溴-靛玉红-3’-肟(bio,sigma)、250nm丁酸钠(sigma)和1μmsb431542(calbiochemdarmstadt,德国)。另外,dmso(sigma)与分别处于0.5%和1%的丁酸钠和sb431542组合地加入(图1)。每隔一天更换培养基,并且在同一步骤内一半培养基用含有生长因子/小分子的新鲜培养基更换。定量实时pcr(qpcr)rneasy微量试剂盒(qiagen,hilden,德国)用于rna分离。rna的总量使用nanodroptmnd-1000分光光度计确定。cdna合成由1μgrna使用iscriptcdna合成试剂盒(bio-radlaboratories,hercules,ca,usa)进行。使用7000快速实时pcr系统(appliedbiosystems,fostercity,ca,usa)进行qpcr。引物商购自genecopoeia,inc.(rockville,md,usa)。所有标志物基因的表达水平对甘油醛3-磷酸脱氢酶(gapdh)的表达水平进行归一化以说明细胞数目的差异。免疫荧光如以前在n.sadoni等,j.cellbiol146(1999);1211-1226(其内容通过引用合并于此)中所述进行免疫染色。使用下面的一抗:鼠抗-afp(sigma)、羊抗-白蛋白(alb;abcam,cambridge,uk)、鼠抗-sox17(abcam)和兔抗-foxa2(abcam)。应用alexafluor488-缀合的抗兔(invitrogen)和alexafluor555-缀合的抗鼠(invitrogen)二抗。细胞核用dapi染色,并利用olympusbx-dsu显微镜(olympus,东京,日本)进行成像。白蛋白分泌和尿素产生使用人白蛋白酶联免疫吸附测定(elisa)定量试剂盒(bethyllaboratories,inc.,montgomery,tx,usa)根据生产商的方案测量白蛋白分泌。使用直接尿素氮显色试剂和直接尿素氮酸试剂(standbiolaboratory,boerne,tx,usa)测量尿素产生。简言之,来自细胞培养基的上清液与酸试剂:显色试剂的2:1混合物在90℃加热30分钟。通过在冰上冷却终止反应并在520nm测量光密度。所有功能数据对使用quant-itpicogreendsdna测定试剂盒(invitrogen,新加坡)量化的接种细胞的数目归一化。细胞色素p450活性cyp450酶的基础和诱导活性使用特异性诱导物(cyp1a2:40μmβ-萘黄酮(β-naphthaflavone)、cyp3a4:20μm利福平、cyp2b6:200μm苯巴比妥)和底物(cyp1a2:200μm非那西汀、cyp3a4:5μm咪达唑仑、cyp2b6:1000μm安非他酮)进行测定。诱导物和底物获自sigma。为了测量基础活性,在20天分化期结束时,去除培养基,并将细胞与含有特异性cyp底物的krebs-henseleit碳酸氢盐(khb)缓冲液在37℃孵育2h。上清液中的药物代谢产物通过液相色谱法-质谱法(lc-msfinniganlcqdecaxpmax,agilent1100系列)根据以前在b.nugraha等,biomaterials32(2011),6982-6994(其内容通过引用合并于此)中所述的程序进行分析。对于诱导研究,在20天分化期结束时,将细胞在含有cyp-特异性诱导物的培养基中培养48小时。通过诱导前和诱导后的基因表达水平来测量诱导倍数。通过lc-ms确认诱导水平。细胞活力测定在用药物处理后24小时后使用celltiter非放射性细胞增殖测定(mtt)(promega,madison,wi,usa)根据生产商的说明书测量分化肝细胞的细胞活力。下列的药物用于细胞活力测定:对乙酰氨基酚、双氯芬酸、地高辛、氯丙嗪、曲格列酮和奎尼丁(所有药物获自sigma)。在dmso中制备药物的贮备溶液,然后在培养基中稀释以获得所需的工作浓度。对照用单独dmso(在缺少测试化合物的情况下)处理并被认为是100%活力值。统计分析对hesc衍生的肝细胞使用3个独立的分化批次,对phh使用3个独立的批(供体)。在每个独立的实验中,一式两份地重复处理。使用非配对学生t检验进行统计学比较。结果表示为3次独立实验的均数±平均数的标准误(sem)。实施例1–初步结果基于小分子的3-步骤分化策略概述在图1(左列)中。来自分化阶段的结果与本领域已知的基于生长因子的4-步骤分化策略(图1,右列)进行比较。hesc分化成定形内胚层在人胚胎干细胞(hesc)中,对nodal和wnt信号传导的操作已经被利用来指引朝向定形内胚层(de)的分化。激活素a激活nodal通路并指引定形内胚层形成,同时对nodal和wnt-β连环蛋白信号传导的协同激活促进由人胚胎干细胞(hesc)更有效地产生定形内胚层(de)。因此,为了使用小分子诱导hesc分化成定形内胚层,本研究分析了可以替代激活素a或/和wnt信号传导的化合物的效果。这些化合物包括1)ide-2,已经被报道诱导人胚胎干细胞(hesc)的定形内胚层(de)分化的小分子,2)溴-靛玉红-3’-肟(bio),一种糖原合成酶激酶3(gsk-3)抑制剂(gsk-3抑制模拟wnt信号传导的激活),3)ly294002,其已经被报道抑制胰岛素、胰岛素生长因子和fgf-介导的磷酸肌醇3激酶(pi3k)-akt信号传导通路,所述通路起作用以维持多能性并且已经证明促进向定形内胚层(de)的分化。细胞在这三种化合物的不同组合的存在下培养6天,并且使用qpcr分析多能性标志物(oct4)和定形内胚层标志物(sox17和foxa2)的表达。使用激活素a和wnt3a的基于生长因子的分化用作对照。显示用激活素a和wnt3a处理的细胞诱导内胚层标志物foxa2和sox17的表达,但多能性标志物oct4维持表达(图2a,b)。相反,用小分子处理(除了仅用bio处理以外)更有效地下调多能性标志物(图2a)的表达,尤其是用ide-2和ly294002以及ide-2、ly294002和bio的组合处理。然而,用这些化合物处理不诱导定形内胚层标志物(诸如foxa2和sox17)以与激活素a和wnt3a处理相当的水平表达(参见图2b)。在小分子的组合当中,用ly294002和bio处理和用ide-2、ly294002和bio处理导致对sox17的最高诱导,而用ide-2处理诱导最高的foxa2表达。总之,这些结果表明在不存在激活素a的情况下用小分子处理有助于遏制多能性但不足以诱导de的分化。由于用ide-2、ly294002和bio的组合处理显示与小分子的其他组合相比oct4的下调以及相当的sox17表达,测试用激活素a代替ide-2是否可以比用激活素a和wnt3a处理更有效地下调多能性标志物,并且还诱导定形内胚层分化。在本研究中观察到激活素a、ly294002和bio的组合显示与激活素a和wnt3a处理的细胞相比多能性标志物oct4、nanog和sox2的较低表达以及foxa2、sox17和hnf4α的相似表达(图2c)。除了上述化合物以外,还研究了表观遗传调节对人胚胎干细胞(hesc)的定形内胚层(de)分化的作用。已经报道丁酸钠是组蛋白脱乙酰基酶抑制剂,而组蛋白脱乙酰基酶抑制剂已知诱导许多细胞类型的分化。然而,丁酸钠在肝细胞分化方案中的作用是有争议的。已经报道丁酸钠能促成更均一的肝细胞分化,尽管其他报道表明单独的丁酸钠不足以用于de诱导或肝细胞分化。因此,在此研究单独丁酸钠或与ide-2组合对hesc的内胚层分化的作用。另外,还测试ide-2和丁酸钠与ly294002和bio组合的作用。由于在初步筛选中ly294002、bio和激活素a的组合显示最佳的多能标志物的下调和de标志物的表达,因此也包括此条件。本文显示了除了激活素a与ly294002和bio组合(图2c)以外,这些组合中没有一种导致定形内胚层(de)标志物诸如foxa2和sox17的表达(图2d)。这表明激活素a对于hesc分化成定形内胚层是必不可少的。这些发现与之前报道是一致的,在之前报道中甚至当其他因子诸如ly294002或丁酸钠用于人胚胎干细胞(hesc)分化成定形内胚层(de)时,激活素也是绝对的需要。总之,在不添加激活素a的情况下,用小分子处理有效地更有效下调多能性标志物但不足以诱导de诱导。激活素a与小分子ly294002和bio的组合导致多能性标志物的下调和定形内胚层(de)标志物的上调。另外,与生长因子(激活素a和wnt3a)处理相比,此组合可以由于多能性的更有效下调而是定形内胚层(de)诱导的更有前途的条件。因此,对于随后生成成肝细胞和肝细胞的基于小分子的步骤,激活素a、ly294002和bio的组合用于定形内胚层诱导的第一阶段(图1)。启动从定形内胚层的肝分化在如本文所述的分化方法之一的第二阶段中,分析丁酸钠和dmso对肝分化启动的作用。在丁酸钠和dmso处理6天后,定形内胚层(de)细胞的形态类似肝细胞所典型的立方形的形状(图3a,上图)。此形态在生长因子(用fgf-2和bmp-4诱导4天并用fgf-1、4和8连续诱导另外4天,图1)和小分子分化的细胞(图3a,下图)两者中是一致的。为了监测细胞从定形内胚层(de)转变成肝祖细胞,通过qpcr定量定形内胚层(de)标志物(诸如foxa2和sox17)和肝标志物α甲胎蛋白(afp)、白蛋白(alb)和肝细胞核因子(hnf)4α的基因表达水平。在生长因子和小分子诱导的肝分化两者中,与在定形内胚层(de)阶段中定量的水平相比,存在定形内胚层标志物(诸如foxa2和sox17)的下降(图3b)。另外,用丁酸钠和dmso处理的细胞的肝标志物表达与基于生长因子的分化相当(图3c)。在afp、alb和hnf4α的水平之间观察不到显著的差异。在此阶段,没有检测到白蛋白产生,指示这些细胞中的大多数是早期的肝细胞(数据未显示)。在肝发育期间,肝细胞和胆管上皮细胞已经表明来源于共同的祖先,即,成肝细胞。qpcr结果显示肝细胞标志物诸如白蛋白和细胞角蛋白18(ck18)以及胆管上皮细胞标志物ck19的表达(图3c)。这适用于基于生长因子的肝分化启动以及基于小分子的肝分化启动,尽管在基于小分子的分化中ck18和ck19的水平较低。总而言之,这些结果表明在分化过程期间已经产生了成肝细胞并且基于小分子的诱导与基于生长因子的诱导相当。肝细胞的成熟在第三阶段中,sb431542(一种tgfβ抑制剂)和dmso用来促进早期肝细胞的成熟(图1)。已经报道dmso促进胎肝细胞的成熟。然而,使用dmso成熟是否可以指引成肝细胞成熟为肝细胞而没有使细胞朝向胆管上皮细胞分化的任何倾向还没有被充分证明。另一方面,已经显示tgfβ信号传导梯度促进胆分化。因此,观察到dmso和tgfβ抑制剂处理的组合对肝成熟的作用以及同时防止胆系的成熟。在用sb431542(tgfβ抑制剂)和dmso处理8天后,肝细胞标志物的表达通过qpcr分析。小分子诱导的成熟的结果与由生长因子诱导的成熟过程(用hgf和卵泡抑素处理6天)相比较。使用两种方式成熟的细胞显示以前已经证明在分化的第二阶段表达的肝标志物(包括afp、alb、ck18和hnf4α)的表达(图4a)。与分化第二阶段相比afp水平的减小和alb水平的增加证实肝细胞的成熟(图4a和3c)。此外,细胞还表达成熟的肝细胞标志物hnf4α、α-1-抗胰蛋白酶(aat)、无唾液酸糖蛋白受体(asgpr)和多药耐药蛋白2(mrp2)以及细胞色素p450酶、cyp3a4、cyp1a1和cyp1a2(图4a)。主要使用基于小分子的方式生成的肝细胞在下文中被称作小分子衍生的肝细胞(或sm-hep),使用生长因子方式生成的肝细胞被称作生长因子衍生的肝细胞(或gf-hep)。分化的肝细胞的功能活性为了测试使用小分子方式生成的肝细胞是否拥有肝特异性功能,测量这些细胞的尿素和白蛋白产生(图5a,b)。小分子衍生的肝细胞(sm-hep)产生0.15pg/48小时/细胞的白蛋白,尽管稍低,但其类似于生长因子衍生的肝细胞(gf-hep)的白蛋白产量(图5a)。相反,小分子衍生的肝细胞(sm-hep)中的尿素产量高于生长因子衍生的肝细胞(gf-hep)的尿素产量(图5b)。根据cyp1a2和cyp3a4底物的代谢将小分子衍生的肝细胞(sm-hep)中cyp酶的活性水平与生长因子衍生的肝细胞(gf-hep)进行比较(图5c)。cyp1a2和cyp3a4的活性水平在使用两种方式分化的肝细胞中是相当的(图5)。分化的肝细胞的药物诱导的细胞毒性肝细胞的主要应用之一是毒性筛选以便辅助药物开发和发现。研究人员已经尝试使用hepg2、heparg原代人肝细胞(ph)以及hesc/hipsc衍生的肝细胞样细胞在体外预测药物诱导的细胞毒性。尽管原代人肝细胞(ph)被认为是体外药物代谢和毒性的金标准,但诸如hepg2和heparg的细胞系比原代人肝细胞(ph)廉价并且比利用原代人肝细胞(ph)更容易进行可重复的试验。然而,30%的化合物错误地被归类为无毒性的。为了克服这些问题,如果hesc/hipsc衍生的肝细胞可以用来预测药物诱导的毒性则将是非常有利的。为了检验其在药物筛选中的应用性,用导致肝毒性的多种药物处理小分子衍生的肝细胞(sm-hep)。使用mtt测定评估的细胞活力与生长因子衍生的肝细胞(gf-hep)以及原代人肝细胞(ph)进行比较。小分子衍生的肝细胞(sm-hep)对所有所测试药物的易感性类似于生长因子衍生的肝细胞(gf-hep)(图6)。对于小分子衍生的肝细胞(sm-hep)和生长因子衍生的肝细胞(gf-hep)比较药物的估计ic50。如表1中所示,当比较生长因子衍生的肝细胞(gf-hep)和小分子衍生的肝细胞(sm-hep)时,在药物的ic50方面不存在显著差异。这表明使用基于小分子的方式分化不影响细胞对范例肝毒物的敏感性。因此,小分子衍生的肝细胞(sm-hep)可以充当用于药物筛选的有价值工具。还比较了分化的肝细胞对药物的易感性与原代人肝细胞(ph)对药物的易感性。当用对乙酰氨基酚、双氯芬酸和氯丙嗪处理时,在分化的肝细胞(sm-hep和gf-hep两者)中药物诱导的毒性与原代人肝细胞(ph)相似(图6)。当比较小分子衍生的肝细胞(sm-hep)和原代人肝细胞(ph)时,这些药物的ic50没有统计学显著的差异(表1)。在生长因子衍生的肝细胞(gf-hep)、小分子衍生的肝细胞(sm-hep)和原代人肝细胞(ph)中地高辛的ic50是相似的(表1)。然而,当原代人肝细胞(ph)用地高辛处理时的剂量反应曲线与生长因子衍生的肝细胞(gf-hep)或小分子衍生的肝细胞(sm-hep)的剂量反应曲线稍有不同(图6)。当用奎尼丁处理时,原代人肝细胞(ph)的活力低于生长因子衍生的肝细胞(gf-hep)或小分子衍生的肝细胞(sm-hep)的活力,如剂量反应曲线以及ic50值所示(图6,表1)。相反,与生长因子衍生的肝细胞(gf-hep)或小分子衍生的肝细胞(sm-hep)相比,用曲格列酮处理导致较高的原代人肝细胞(ph)活力。表1:使用采用生长因子(gf)或小分子(sm)分化的肝细胞用于肝毒性筛选的ic50值。ic50值与原代肝细胞(ph)比较。p-值a指示gf-hep和sm-hep的ic50值间的显著统计学差异。p-值b指示sm-hep和ph的ic50值间的显著统计学差异。总之,本数据提供了主要使用小分子用于使hesc分化成功能肝细胞的逐步方案的实例。如前所述,对于细胞治疗和肝毒性筛选中的肝细胞应用需要大量的细胞。因此,生成功能肝细胞的低成本方式可以对工业产生有价值的影响。在一个实施例中,与常规的生长因子方式相比,本方式在生成肝细胞的成本方面减少了67%。当与原代人肝细胞比较时成本的减少甚至更明显(81%)。基于这些计算,在用于其中对化合物的大规模筛选将需要成百个孔板的药物测试的药学环境下,成本节省可以是巨大的。例如,如果要使用100个平板(384孔板形式),如果使用我们的方式,则相对于生长因子方式的成本节省将为每组实验大约7500美元。如果在这些背景下要使用原代人肝细胞,使用我们的方式由hesc得到肝细胞的成本节省将是显著的。实施例2–实施例1的更新结果a.hesc分化成定形内胚层在人胚胎干细胞(hesc)中,对nodal和wnt信号传导的操作已经被利用来指引朝向de的分化。激活素a激活nodal通路并指引定形内胚层(de)形成,同时对nodal和wnt-β连环蛋白信号传导的协同激活促进由hesc更有效地产生定形内胚层(de)。因此,为了使用小分子诱导hesc分化成定形内胚层(de),分析了可以替代激活素a或/和wnt信号传导的化合物的效果。这些化合物包括1)ide-2,已经被报道诱导hesc的定形内胚层(de)分化的小分子,2)bio,一种糖原合成酶激酶3(gsk-3)抑制剂(gsk-3抑制模拟wnt信号传导的激活),3)ly294002,其已经被报道抑制起作用以维持多能性的胰岛素、胰岛素生长因子和fgf-介导的磷酸肌醇3激酶(pi3k)-akt信号传导通路,并且已经证明促进向定形内胚层(de)的分化。首先研究wnt3a可以被小分子替代的可能性。由于ly294002抑制多能性的维持且bio模拟wnt信号传导,因此这两种化合物将有可能具有代替wnt信号传导的最高潜力。使用激活素a、ly294002和bio的组合持续6天将hesc分化成de。使用qpcr分析多能性标志物(oct4、nanog和sox2)和定形内胚层(de)标志物(sox17和foxa2)的表达。使用激活素a和wnt3a的基于生长因子的分化用作对照。我们的结果显示利用激活素a、ly294002和bio处理多能性标志物oct4、nanog和sox2的表达水平与激活素a和wnt3a处理的细胞相比分别低15、16和11倍(图8a)。结果还显示与激活素a和wnt3a处理的细胞相比,激活素a、ly294002和bio处理诱导de标志物foxa2和sox17的相似表达(图8a)。这些结果表明ly294002和bio的组合可以代替wnt信号传导。另外,用这些化合物处理比用wnt3a处理更有效地抑制多能性。下一步,还检验了ly294002和bio是否还可以代替激活素a用于诱导hesc成为定形内胚层(de)的可能性。使用激活素a和wnt3a的基于生长因子的分化用作对照。结果显示用激活素a和wnt3a处理的细胞诱导内胚层标志物foxa2和sox17的表达,而多能性标志物oct4维持表达(图8b,c)。相反,用小分子处理更有效地下调oct4的表达(图8b)。然而,用这些化合物处理不以与激活素a和wnt3a处理相当的水平诱导定形内胚层(de)标志物(foxa2和sox17)的表达(图8c)。为了探究代替激活素a信号传导的其他方法,测试了下列化合物的效果:1)ide-2,激活素a的小分子激动剂和2)丁酸钠,一种组蛋白脱乙酰基酶抑制剂,已知其诱导许多细胞类型的分化。这两种因子单独测试或与ly294002和bio(图9中列表的组合)组合测试。结果(图9中详述)显示这些组合中没有一个能有效地代替激活素a信号传导。总之,结果显示在不添加激活素a的情况下,单独用小分子处理有助于抑制多能性,并且可以代替wnt信号传导但不足以诱导定形内胚层(de)分化。ly294002和bio仅与激活素a组合可以引起定形内胚层(de)诱导(图8a)。定形内胚层(de)分化的效率通过foxa2和sox17的标志物蛋白质表达来确认(图8d)。结果显示当使用激活素a、ly294002和bio(上图)诱导定形内胚层(de)时,大多数细胞对于foxa2和sox17两者是阳性的,并且这些结果与激活素a和wnt3a处理的细胞相当(下图)。这证实了显示用激活素a、ly294002和bio处理与激活素a和wnt3a处理相比在诱导定形内胚层(de)方面同样有效的基因表达数据。与生长因子(激活素a和wnt3a)处理相比,激活素a、ly294002和bio的组合可以由于多能性的更有效下调而是de诱导的更有前途的条件。因此,对于随后生成成肝细胞和肝细胞的基于小分子的步骤,激活素a、ly294002和bio的组合用于de诱导的第一阶段(图1)。b.启动从定形内胚层的肝分化丁酸钠,尤其是与二甲基亚砜(dmso)组合已经被报道用于促进肝细胞分化。在我们的分化方法的第二阶段,分析了丁酸钠和dmso对启动成肝细胞分化的作用。在丁酸钠和dmso处理6天后,细胞的形态类似于肝细胞前体细胞典型的立方形形状(图10a,左图)。此形态在生长因子(用fgf-2和bmp-4诱导4天并用fgf-1、4和8连续诱导另外4天,图1)和小分子分化的细胞(图10a)两者中是一致的。为了监测细胞从定形内胚层(de)转变成肝祖细胞,通过qpcr定量定形内胚层(de)标志物foxa2和sox17以及肝标志物foxa2、afp、alb和肝细胞核因子(hnf)4α的基因表达水平。在生长因子和小分子诱导的肝分化两者中,与在定形内胚层(de)阶段中定量的水平相比,存在de标志物sox17的减少(图10b)。与生长因子诱导的肝分化(55倍)相比,在小分子诱导的肝分化中sox17的减少倍数较高(440倍)。由于foxa2在de细胞以及肝细胞中表达,foxa2表达没有显著的减少,这是被预料的。用丁酸钠和dmso处理的细胞的肝标志物表达与基于生长因子的分化相当(图10c)。在afp、alb和hnf4α的水平之间没有观察到显著的差异。在此阶段,没有检测到白蛋白产生,指示这些细胞中的大多数是早期肝细胞(数据未显示)。在肝发育期间,肝细胞和胆管上皮细胞已经表明来源于共同的祖先,即,成肝细胞。qpcr结果显示肝细胞标志物诸如细胞角蛋白18(ck18)以及胆管上皮细胞标志物ck19(图10c)的表达。这适用于基于生长因子的肝分化启动以及基于小分子的肝分化启动。这表明定形内胚层(de)细胞分化成成肝细胞,成肝细胞由肝细胞和胆管上皮细胞两者组成。成肝细胞分化的效率通过afp标志物蛋白质表达来检验(图10d)。结果显示生长因子和小分子两者均诱导成肝细胞分化产生的细胞以相当的水平表达afp,证实小分子有效产生成肝细胞的能力。这些结果一起表明在不使用任何生长因子的条件下,使用丁酸钠和dmso,定形内胚层(de)阶段中的细胞可以分化成肝祖细胞。c.由肝祖细胞分化肝细胞在第三阶段中,sb431542(为tgfβ抑制剂)和dmso用来促进肝祖细胞向肝细胞的分化。已经报道dmso能促进胎肝细胞的生成但dmso是否可以指引成肝细胞成为肝细胞而细胞没有任何朝向胆管上皮细胞分化的倾向还尚未充分知晓。已经证明tgfβ信号传导梯度促进胆分化。因此,本发明人相信dmso和tgfβ抑制剂处理的组合将允许分化成肝细胞并且同时阻止分化成胆系。用sb431542(tgfβ抑制剂)和dmso处理8天后,细胞用形态学表征,并通过qpcr分析肝细胞标志物的表达。在分化期结束时,小分子分化的肝细胞样细胞显示特征性的肝细胞形态:多边形的形状,大核和颗粒状胞质(图11a)。如本领域中已知,已经在生长因子分化的肝细胞样细胞中观察到这些特征。使用alb标志物蛋白质表达定量肝细胞分化的效率(图11b)。小分子诱导和生长因子诱导(用hgf和卵泡抑素处理6天)二者的肝细胞生成显示相当水平的alb表达。使用qpcr定量alb以及以前已经证明在分化的第二阶段表达的其他肝标志物(afp,ck18和hnf4α)的表达(图11c)。在小分子分化的细胞中这些标志物的水平类似于生长因子分化的细胞。在两种方式中,与分化的第二阶段相比afp水平的降低和alb水平的升高证实由肝祖细胞分化了肝细胞(图11c和10c)。此外,所述细胞还表达肝细胞标志物α-1-抗胰蛋白酶(aat)、无唾液酸糖蛋白受体(asgpr)和多药耐药蛋白2(mrp2),以及细胞色素p450酶,cyp3a4、cyp1a1和cyp1a2(图4b)。在小分子和生长因子分化的细胞中asgpr、cyp3a4、和cyp1a1的表达是相似的,而在小分子分化的细胞中aat、mrp2和cyp1a2的表达较高。与胎肝细胞相比,成体肝表达较高的cyp1a2和较低的cyp1a1,并且因此在小分子成熟的细胞中cyp1a2的9倍增加的表达可能提示在肝祖细胞的生成中小分子更有效。使用主要基于小分子的方式生成的肝细胞下文中称作sm-hep,使用生长因子方式生成的肝细胞称作gf-hep。d.hesc衍生的肝细胞的功能活性为了测试使用小分子方式生成的肝细胞是否拥有肝细胞特异性功能,研究了这些细胞的白蛋白和尿素产生;cyp活性和诱导。所述功能与由三个不同的肝细胞供体生成的原代人肝细胞(phh)数据进行比较。sm-hep产生0.21±0.067pg/细胞/48小时的白蛋白,与gf-hep类似(图12a),为由原代人肝细胞(phh)产生的水平的约20%。sm-hep中的尿素产量为62±11pg/细胞/48小时,显著高于gf-hep(15±0.36pg/细胞/48小时),且为原代人肝细胞(phh)(110pg/细胞/48小时)的57%(图12b)。根据cyp1a2和cyp3a4底物的代谢来比较sm-hep中cyp酶的活性水平与gf-hep的活性水平(图12c,d)。对于sm-hep和gf-hep通过cyp1a2的代谢物产生分别为0.26±0.12和0.30±0.091pmol/百万个细胞/分钟。对于sm-hep和gf-hep通过cyp3a4的代谢物产生分别为0.029±0.0074和0.041±0.020pmol/百万个细胞/分钟。这些值为经由原代人肝细胞(phh)的代谢物产生(cyp1a2活性为3.75pmol/百万个细胞/分钟,cyp3a4的活性为0.21pmol/百万个细胞/分钟;3个供体的平均值)的约8-10%。sm-hep显示cyp1a2和cyp3a4的mrna诱导倍数分别为7±2.8和27±3.3(图12e)。cyp1a2的诱导倍数,尽管低于对于cyp1a2的gf-hep(21±1.8倍),但为原代人肝细胞(phh)(phh诱导倍数=20;3个供体的平均值,本领域中已知的数据)的大约35%。与gf-hep(2.8±1.8倍)相比,在sm-hep中cyp3a4的诱导倍数较高(27倍±3.3),并且为原代人肝细胞(phh)(phh诱导倍数=50;3批的平均值)的大约54%。通过mrna水平测量的诱导倍数通过功能活性被确认(通过lcms量化基础样品和诱导样品中的代谢物产生)。gf-hep显示低水平的cyp1a2、cyp3a4和cyp2b6诱导(图12f)。在sm-hep中所有三种cyp的诱导水平均是较高的(cyp1a2和cyp2b6为大约1.5倍,cyp3a4为3.5倍)。重要的是,通过基因表达分析在sm-hep中观察到的较高cyp3a4诱导通过功能数据被确认。原代人肝细胞(phh)中的cyp1a2、cyp3a4和cyp2b6诱导分别为5.0、6.2和8.9(3批的平均值),因此与原代人肝细胞(phh)相比,sm-hep对cyp1a2、cyp3a4和cyp2b6分别显示大约30%、56%和17%的诱导。总而言之,结果证明使用基于小分子的分化方式可以产生功能肝细胞。e.分化的肝细胞的药物诱导毒性和在毒性筛选中的应用为了检验sm-hep对药物筛选的应用性,用已知导致肝毒性的药物处理sm-hep(表2)。表2:使用采用生长因子(gf)或小分子(sm)分化的肝细胞用于肝毒性筛选的ic50值。ic50值与原代人肝细胞(phh)比较。p-值a指示gf-hep和sm-hep的ic50值间的显著统计学差异。p-值b指示sm-hep和phh的ic50值间的显著统计学差异。这些药物包括对乙酰氨基酚、双氯芬酸、地高辛、氯丙嗪、奎尼丁和曲格列酮。使用mtt测定评估的细胞活力与gf-hep比较以及与原代人肝细胞(phh)比较。结果显示对于测试的所有6种药物,gf-hep和sm-hep的ic50值是相当的(图13)。sm-hep和gf-hep两者显示非常相似的剂量反应曲线,具有始终相似的ic50,如表2中所示。当比较gf-hep和sm-hep时,药物的ic50没有显著差异(p-值a,表2)。这提示使用基于小分子的方式分化不影响细胞对范例肝毒物的敏感性。还比较了分化的肝细胞对药物的易感性与原代人肝细胞(phh)对药物的易感性。当用所有6种药物处理时,就剂量反应曲线和ic50值而言,在分化的肝细胞(sm-hep和gf-hep两者)中药物诱导的毒性类似于原代人肝细胞(phh)(图13,表2)。当sm-hep和原代人肝细胞(phh)比较p-值b时,这些药物的ic50在统计学上没有显著差异(表2)。因此,sm-hep可以充当用于药物筛选的原代肝细胞的替代物。在一个实施例中,提供了用于由hesc有效分化功能肝细胞的方案。在一个实施例中,除了激活素a以外,所述方案不需要添加重组生长因子。在一个实施例中,所述方案具有第二步骤。在一个实施例中,在所述方案的第二步骤中,使用丁酸钠和dmso产生肝前体细胞。在一个实施例中,所述方案具有第三步骤。在一个实施例中,在所述方案的第三步骤中,在用tgfβ抑制剂sb431542和dmso处理后,肝祖细胞可以被指引朝向肝细胞。在中期胎肝中,tgfβ促进肝祖细胞经历胆分化。在本研究中,sb431542,与dmso组合可以用来在不添加生长因子的条件下由肝细胞样细胞的祖细胞阶段生成肝细胞样细胞。在分化20天后,肝细胞样细胞保留一些不成熟的特性,诸如afp的表达。在一个实施例中,在本研究中生成的sm-hep可以用于肝毒性筛选应用。具体地,由于小分子比生长因子更廉价且更稳定,因此sm-hep与gf-hep相比且特别地与原代人肝细胞(phh)相比将更廉价。在一个实施例中,sm-hep可以用于药物环境中用于其中对化合物的大规模筛选将需要成百个孔板和几百万个细胞的药物测试。在一个实施例中,sm-hep还可以用来减少与不同批的生长因子和不同批的原代人肝细胞(phh)相关的批间变异性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1