用于检测猪源性成分的LAMP引物及其设计方法与流程
本发明涉及猪源性成分的检测,具体是涉及一种用于检测猪源性成分的LAMP引物及其设计方法。
背景技术:
目前,据国内的平面媒体和网络媒体等新闻报道,认为国内某些动物源性产品存在严重的肉类掺假问题,报道中描述的可能存在的掺假有,猪、鸡、鸭肉以及皮毛类的狐狸、水貂、海狸鼠、貉等肉充当牛羊肉,仍至还有鼠肉充当羊肉的报道。这些报道在国内外造成了强烈的社会影响,对我国动物源性产品的生产、加工和销售产生了严重的挑战,让各类消费者和相关产品的使用者对动物源性产品的使用和消费产生了一定的困惑。尽管国外的食品生产有较严格的可追溯程序(即每份产品中的所有成分都可以追溯来自某个养殖场出产,所有中间环节产品处理也可以追溯相关的供应商),国外也有类似的肉类掺假报道,2012年12月在欧洲报道出马肉充当牛肉的丑闻,2013年1月在一项针对英国和爱尔兰国内的汉堡包内肉类进行DNA检测,发现27个声称是牛肉汉堡包内检测出23个样品有猪肉的DNA。肉类掺假的问题是动物源性产品检测中的一大难题,同时这个问题又是国家检测部门必须解决的重要课题。
人为财死鸟为食亡,有些不法商贩为了获取巨大的经济利益,以次充好,以经济价值低的充当价值高的,以病死动物肉充当健康肉,以鼠肉等极易传播疫病的动物肉类充当其他动物肉,等等。市场上的牛肉制品,价格高昂,是纯牛肉的却甚少,经常出现掺杂猪肉等便宜的肉类。
近年检测动物源性掺假的技术主要是针对动物特异性核酸或蛋白,有蛋白印迹、ELISA、核酸探针、PCR和荧光PCR等,目前使用最为广泛的是PCR和荧光PCR。PCR方法由于其具有较高的灵敏度而能够在动物源性成分检测中得到广泛的应用。但在实际运用中,还是存在一些难以难以克服的问题,如假阴性、假阳性、非特异性扩增以及片状拖带、涂抹带等等。
环介导等温扩增(Loop-mediated isothermal amplification,LAMP),是一种新型的核酸扩增方法,其特点是针对靶基因的6个区域设计4种特异引物,在链置换DNA聚合酶(Bst DNA polymerase)的作用下,60~65℃恒温扩增,15~60min左右即可实现109~1010倍的核酸扩增,具有操作简单、特异性强、产物易检测等特点。在DNA合成时,从脱氧核糖核酸三磷酸底物(dNTPs)中析出的焦磷酸离子与反应溶液中的镁离子反应,产生大量焦磷酸镁沉淀,呈现白色。因此,可以把浑浊度作为反应的指标,只用肉眼观察白色浑浊沉淀,就能鉴定扩增与否,而不需要繁琐的电泳和紫外观察。由于环介导等温扩增反应不需要PCR仪和昂贵的试剂,有着广泛的应用前景。
Genie II等温扩增荧光检测系统是开放的检测平台,应用“等温扩增技术”原理,结合荧光检测技术,可用于各类等温扩增反应在分子水平基础上进行快速检测工作。
猪源性成分检测常用PCR和荧光定量PCR方法,常规PCR方法需要2h左右的PCR反应时间,30min左右的电泳时间以及配置凝胶和染色的时间;荧光定量PCR方法,大概需要1h左右的时间,且荧光探针和仪器都较昂贵。
中国专利CN104789692A公开一种鉴别牛羊猪源性成分的引物组及试剂盒,包含有牛羊猪通用下游引物Seq1、牛羊通用上游引物Seq2和猪特异性上游引物Seq3。可以在一次PCR反应中检测牛、羊、猪三个物种。
中国专利CN103243165A公开一种实时荧光LAMP法快速检测牛羊肉中猪源性成分的方法,该方法采用环介导恒温扩增技术(LAMP)结合实时荧光的方法检测牛肉、羊肉中猪特异性细胞色素b基因。其检测方法是通过提取待检肉类的基因组DNA,采用6条特异性引物及具有链置换活性的Bst DNA聚合酶大片段,于60-65℃扩增45-60分钟,反应体系中加入SYBR GREEN I,可实时检测样品模版的扩增情况,从而判断牛肉、羊肉样品中是否含有猪源性成分。
技术实现要素:
本发明的目的在于为了解决快速检测进出口及市场上的猪源性成分,打击猪源性成分掺假问题,提供一种用于检测猪源性成分的LAMP引物及其设计方法,该LAMP引物组合在具有简单、灵敏、快速、特异的优点。
所述用于检测猪源性成分的LAMP引物,其扩增片段大小为221bp,具体引物序列如下:
D-loop F3:5’-tcttacttca ggaccatctc a-3’
D-loop B3:5’-ccggatcatg agttccatg-3’
D-loop FIP:5’-atgtgtgagc atgggctgat taaatcgccc actctttcc-3’
D-loop BIP:5’-gggatgctta gactcagcca tggtccagct acaattgatt tgac-3’
D-loop LoopF:5’-agtcattagt ccatcgagat gt-3’
D-loop LoopB:5’-ccgtcaaagg ccctaaca-3’。
所述用于检测猪源性成分的LAMP引物的设计方法,包括以下步骤:
步骤1,登陆NCBI网站,查找猪、羊、牛等动物的D-loop基因序列;
步骤2,用DNAman软件对各种动物的D-loop基因序列进行比对,找出猪D-loop基因的特异性序列;
步骤3,设计引物,引物的设计原则包括Tm值、引物末端的安定性、GC含量、引物之间的距离、二级结构;
步骤4,建立LAMP检测方法,优化引物工作浓度、内外引物浓度比和反应温度。
在步骤2中,所述用DNAman软件对各种动物的D-loop基因序列进行比对,因COⅠ、COⅡ、ATPase6、ATPase8等基因序列无特异性,D-loop特异性较好,故选择D-loop基因作为猪源性成分的检测基因。
在步骤3中,所述设计引物的软件可采用Primer Explorer V3,设计引物最好筛选最优的引物组合;各条引物的具体参数如下:F1c/B1c,64~66℃;F2/B2/F3/B3LoopF/LoopB,59~61℃;所述引物F1c和B1c比其余几条引物的Tm值高5℃左右;
所述引物末端的安定性:引物F1c/B1c的5‘端的△G值≤-4Kcal/mol,引物F2/B2/F3/B3 LoopF/LoopB的3’端的△G值≤-4Kcal/mol,引物末端不能含有互补序列,如cccggg或gaattc;也不能含有相同的核苷酸,如ccgggg或aatttt;
所述GC含量的设定范围在40%~65%之间;
所述引物之间的距离:从F2 5‘端到B2 5‘端在120~180bp之间,从F2的5’端到F1c的3‘端在40-60bp之间,从F2的5’端到F3的3‘端在0~20bp之间;
关于二级结构,引物自身不能形成二级结构。
在步骤4中,所述优化引物工作浓度为:FIP、BIP、F3、B3分别为3.2~12.8μM、3.2~12.8μM、0.8~3.2μM、0.8~3.2μM;所述内外引物浓度比为4︰1;所述反应温度为65℃;25μL反应体系如下:IMM试剂15μL,20μM FIP 2μL、20μM BIP 2μL、10μM F3 1μL、10μM B3 1μL,模板1μL,补水至25μL;反应条件如下:扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
本发明检测时间只需30min,且试验中途即可观察结果、判定结果,不需要配置凝胶、电泳、染色等过程,极大缩短了检测时间,且有与荧光定量PCR类似的曲线、判定原则和标准,具有快速、特异、敏感、节约费用等优点,适应于口岸快速检测的需要,是一种准确、可靠、科学的分子生物学方法。这对于加强产品猪源性成分快速检验检疫、整顿制售掺假产品、维护消费者权益、打击违法牟取暴利等方面都具有十分重要的意义。
本发明的有益效果如下:
采用本发明建立的检测猪源性成分的LAMP方法,具有操作简便、快速,特异性强,灵敏度高等优点,只需不到30min,就可检测出动物源性成分,通过应用该方法对市场上牛肉干等100份样品的检测,同时与常规方法检测进行比较。LAMP方法检测出3份样品阳性,与荧光定量PCR鉴定结果完全吻合。该方法的成功研制,大大加快了猪源性成分的检测。
采用本发明的检测猪源性成分的LAMP技术,具有简单、灵敏、快速、特异等优点,能大大方便口岸进出口货物的通关速度。这对于预防和控制我国动物源性成分掺假具有重要的现实意义。目前未见国内外利用该Genie II操作平台检测猪源性成分的报道,该技术有望为猪源性成分的检测提供一种快速灵敏、简便可靠的方法。
附图说明
图1为LAMP技术检测猪源性成分的反应体系优化结果1。在图1中,曲线1.FIP/BIP与F3/B3的浓度比1︰1;曲线2.FIP/BIP与F3/B3的浓度比2︰1;曲线3.FIP/BIP与F3/B3的浓度比3︰1;曲线4.FIP/BIP与F3/B3的浓度比4︰1;曲线5.FIP/BIP与F3/B3的浓度比5︰1;曲线6.FIP/BIP与F3/B3的浓度比6︰1;曲线7.FIP/BIP与F3/B3的浓度比7︰1;曲线8.空白对照。
图2为LAMP技术检测猪源性成分的反应体系优化结果2。在图2中,曲线1.FIP、BIP、F3、B3的工作浓度分别为0.4μM、0.4μM、0.1μM、0.1μM;曲线2.FIP、BIP、F3、B3的工作浓度分别为0.8μM、0.8μM、0.2μM、0.2μM;曲线3.FIP、BIP、F3、B3的工作浓度分别为1.6μM、1.6μM、0.4μM、0.4μM;曲线4.FIP、BIP、F3、B3的工作浓度分别为3.2μM、3.2μM、0.8μM、0.8μM;曲线5.FIP、BIP、F3、B3的工作浓度分别为6.4μM、6.4μM、1.6μM、1.6μM;曲线6.FIP、BIP、F3、B3的工作浓度分别为12.8μM、12.8μM、3.2μM、3.2μM。
图3为LAMP技术检测猪源性成分的LoopF、LoopB的优化结果。在图3中,曲线1.LoopF、LoopB的工作浓度均为0.6μM;曲线2.LoopF、LoopB的工作浓度均为0.4μM;曲线3.LoopF、LoopB的工作浓度均为0.2μM;曲线4.LoopF、LoopB的工作浓度均为0;曲线5.空白对照;曲线6.空白对照。
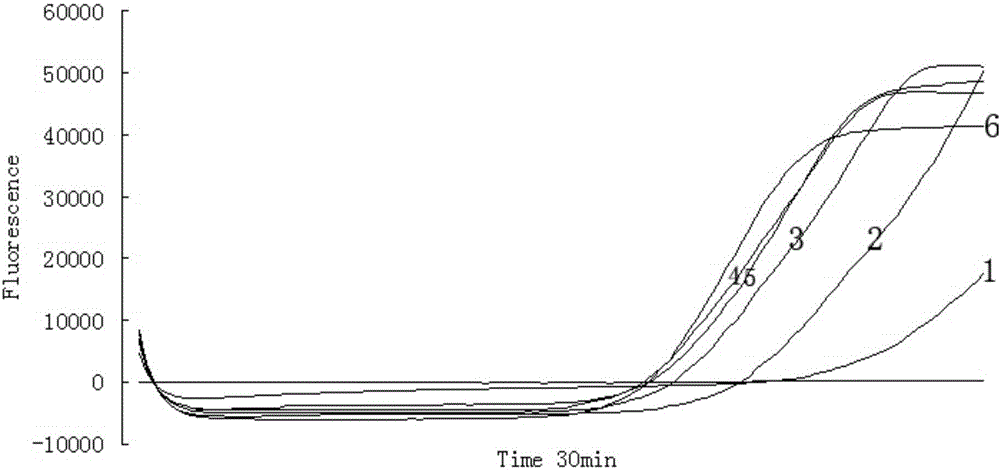
图4为LAMP技术检测猪源性成分的反应条件优化结果。在图4中,曲线1:扩增温度59℃;曲线2:为扩增温度60℃;曲线3:扩增温度61℃;曲线4:扩增温度62℃;曲线5:扩增温度63℃;曲线6:扩增温度64℃;曲线7:扩增温度65℃;曲线8:扩增温度66℃。
图5为LAMP技术检测猪源性成分的敏感性试验结果。在图5中,曲线1:猪源性成分核酸浓度1.76μg/μL;曲线2:猪源性成分核酸浓度1.76×10-1μg/μL;曲线3:猪源性成分核酸浓度1.76×10-2μg/μL;曲线4:猪源性成分核酸浓度1.76×10-3μg/μL;曲线5:猪源性成分核酸浓度1.76×10-4μg/μL;曲线6:猪源性成分核酸浓度1.76×10-5μg/μL。
图6为LAMP技术检测猪源性成分的特异性试验结果1。在图6中,曲线1:猪源性成分核酸;曲线2:Takara猪源性成分核酸;曲线3:Takara牛核酸;曲线4:Takara马核酸;曲线5:Takara羊核酸;曲线6:Takara鸡核酸;曲线7:Takara兔核酸;曲线8:空白对照。
图7为LAMP技术检测猪源性成分的特异性试验结果2。在图7中,曲线9:猪源性成分核酸;曲线10:狐狸核酸;曲线11:鼠核酸;曲线12:鸭核酸;曲线13:鸽核酸;曲线14:犬核酸;曲线15:空白对照。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步的详细描述。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
组织DNA提取试剂盒:LabServ公司,产品编号KFR-802096。
等温扩增荧光检测系统:OptiGene公司,Genie II系统。
IMM试剂:北京晟泰勃科技有限公司。
LAMP试验反应条件如无特殊说明,均为Genie II等温扩增荧光检测系统默认的反应条件:扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
FIP:20μM
BIP:20μM
F3:10μM
B3:10μM
LoopB:10μM
loopF:10μM
猪源性成分核酸浓度:8.8×102μg/μL
Takara猪源性成分核酸、Takara牛核酸、Takara马核酸、Takara羊核酸、Takara鸡核酸、Takara兔核酸:宝生物工程(大连)有限公司产品,其产品目录号为CY218。
猪源性成分核酸、狐狸核酸浓度、鼠核酸、鸭核酸、鸽核酸、犬核酸等,均为实验室自行提取的核酸。
以下给出具体实施例
实施例1检测猪源性成分的LAMP引物的设计
用登陆NCBI网站,查找猪、羊、牛等动物的D-loop及线粒体上其他的基因序列;用DNAman软件对各种动物的D-loop基因序列进行比对,找出猪D-loop基因的特异性序列;根据引物设计原则(包括Tm值、引物末端的安定性、GC含量、引物之间的距离、二级结构),用软件Primer Explorer V3设计引物;从设计的不同引物组合中,筛选最优的引物组合。
实施例2用于检测猪源性成分的LAMP方法的建立及内外引物浓度比的优化
(1)取8个反应管中,每管反应体系25μL。各管分别加入IMM 15μL、F3 1μL、B3 1μL、0.5μL猪源性成分核酸,第1个反应管中加入FIP 0.5μL、BIP 0.5μL;第2个反应管中加入FIP 1μL、BIP 1μL;第3个反应管中加入FIP 1.5μL、BIP 1.5μL;第4个反应管中加入FIP 2μL、BIP 2μL;第5个反应管中加入FIP 2.5μL、BIP 2.5μL;第6个反应管中加入FIP 3μL、BIP 3μL;第7个反应管中加入FIP 3.5μL、BIP 3.5μL;第8个反应管中加入FIP 2μL、BIP 2μL。各管补充水至25μL。第8个反应管以水代替猪源性成分核酸作为空白对照。
(2)扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
(3)试验结果如图1所示,均能出现S型扩增曲线,第1至第7个反应的Tm值(mm︰ss)分别为28︰15、27︰00、25︰45、22︰30、24︰15、22︰30、25︰15,扩增曲线结合Tm值,最佳反应为第4管,最佳内外引物(FIP、BIP为内引物,F3、B3为外引物)工作浓度比为4︰1。
实施例3用于检测猪源性成分的LAMP方法引物工作浓度的优化
(1)取6个反应管中,每管反应体系25μL。各管分别加入IMM 15μL、0.5μL猪源性成分核酸,第1个反应管中加入FIP 0.5μL、BIP 0.5μL、F3 0.25μL、B3 0.25μL;第2个反应管中加入FIP 1μL、BIP 1μL、F3 0.5μL、B3 0.5μL;第3个反应管中加入FIP 1.5μL、BIP 1.5μL、F3 0.75μL、B3 0.75μL;第4个反应管中加入FIP 2μL、BIP 2μL、F3 1μL、B3 1μL;第5个反应管中加入FIP 2.5μL、BIP 2.5μL、F3 1.25μL、B3 1.25μL;第6个反应管中加入FIP 3μL、BIP 3μL、F3 1.5μL、B3 1.5。反应体系不足25μL的用水补足。
(2)扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
(3)试验结果如图2所示,均能出现S型扩增曲线,第1至第6个反应的TM值(mm︰ss)分别为28︰00、28︰45、21︰00、20︰30、21︰45、20︰15,扩增曲线结合TM值,第4~6管较好,考虑经济因素,选择第4管即可达到,FIP、BIP、F3、B3的工作浓度分别为3.2μM、3.2μM、0.8μM、0.8μM。
实施例4用于检测猪源性成分的LAMP方法的LoopF、LoopB的优化结果
(1)取4个反应管中,每管反应体系25μL。各管分别加入IMM 15μL、0.5μL猪源性成分核酸、FIP 2μL、BIP 2μL、F3 1μL、B3 1μL,第1个反应管中加入LoopF 1.5μL、LoopB 1.5μL;第2个反应管中加入LoopF 1μL、LoopB 1μL;第3个反应管中加入LoopF 0.5μL、LoopB 0.5μL;第4个反应管中加入LoopF 0μL、LoopB 0μL;第5、6个反应管以水代替猪源性成分核酸作为空白对照,反应体系不足25μL的用水补足。
(2)扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
(3)试验结果如图3所示,第1至第4个反应均能出现S型扩增曲线,对应的TM值(mm︰ss)分别为9︰15、8︰30、8︰30、20︰30。当加入LoopF、LoopB后,大大加快了LAMP反应速度,随着LoopF、LoopB浓度的增加,LAMP反应速度已达到平台期,不会再加快。结合扩增曲线和TM值,最佳反应为第2管,LoopF、LoopB最佳反应浓度均为0.4μM。
实施例5用于检测猪源性成分的LAMP方法的反应条件优化结果
(1)取8个反应管中,每管反应体系25μL。各管分别加入IMM 15μL、0.5μL猪源性成分核酸、FIP 2μL、BIP 2μL、F3 1μL、B3 1μL,补充水至25μL。
(2)第1至第8管扩增温度分别为59℃、60℃、61℃、62℃、63℃、64℃、65℃、66℃,时间30min;退火从98℃到80℃,0.05℃/s。
(3)试验结果如图4所示,均能出现S型扩增曲线,第1、2个反应管在30min反应结束后未出现TM值(mm︰ss),第3至第8个反应的TM值(mm︰ss)分别为25︰30、24︰00、22︰45、22︰00、21︰45、22︰15。扩增曲线结合TM值综合判定,第6、7、8管的反应温度均优于其他反应温度,这3管的反应温度均可采用,等温扩增荧光检测系统默认反应温度为65℃,因此选择65℃为最佳反应温度。
实施例6 LAMP技术检测猪源性成分的敏感性试验
(1)取6个反应管中,每管反应体系25μL。各管分别加入IMM 15μL、FIP 2μL、BIP 2μL、F3 1μL、B3 1μL,第1至第6管加入的猪源性成分核酸终浓度分别为1.76μg/μL、1.76×10-1μg/μL、1.76×10-2μg/μL、1.76×10-3μg/μL、1.76×10-4μg/μL、1.76×10-5μg/μL,补充水至25μL。第8个反应管以水代替猪源性成分核酸作为空白对照。
(2)扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
(3)试验结果如图5所示,第1至4个反应均出现S型扩增曲线,第1至第3个管反应的TM值(mm︰ss)分别为19︰45、22︰45、25︰45。第4至第6管30min内无TM值。LAMP方法检测猪源性成分最低限量为1.76×10-2μg/μL。
实施例7 LAMP技术检测猪源性成分的特异性试验
(1)取15个反应管中,每管反应体系25μL。各管分别加入IMM 15μL、FIP 2μL、BIP 2μL、F3 1μL、B3 1μL,第1至15管分别加入猪源性成分核酸0.5μL;Takara猪源性成分核酸0.5μL;Takara牛核酸0.5μL;Takara马核酸0.5μL;Takara羊核酸0.5μL;Takara鸡核酸0.5μL;Takara兔核酸0.5μL;H2O 0.5μL;猪源性成分核酸0.5μL;狐狸核酸0.5μL;鼠核酸0.5μL;鸭核酸0.5μL;鸽核酸0.5μL;犬核酸0.5μL;H2O 0.5μL。各管补充水至25μL。
(2)扩增65℃,30min;退火从98℃到80℃,0.05℃/s。
(3)试验结果如图6、7所示,只有Takara猪源性成分核酸、猪源性成分核酸出现S型扩增曲线,其余动物成分核酸均无扩增曲线。表明本试验具有特异性。
本发明利用引物设计软件设计一系列扩增猪源性成分LAMP引物组合;对一系列引物对进行筛选,选择扩增效果最佳的引物组合;对选择好的最佳引物组合进行反应条件摸索;对建立的方法进行特异性、重复性和稳定性等摸索。猪源性成分检测常用PCR和荧光定量PCR方法,常规PCR方法需要2h左右的PCR反应时间,30min左右的电泳时间以及配置凝胶和染色的时间;荧光定量PCR方法,大概需要1h左右的时间,且荧光探针和仪器都较昂贵;本发明检测时间只需30min,且试验中途即可观察结果、判定结果,不需要配置凝胶、电泳、染色等过程,极大的缩短了检测时间,且有与荧光定量PCR类似的判定原则和标准,具有快速、特异、敏感、节约费用等优点。
- 还没有人留言评论。精彩留言会获得点赞!