一种软骨细胞无血清培养基及其制备方法与流程
本发明涉及生物医学材料
技术领域:
,具体涉及一种软骨细胞无血清培养基及其制备方法。
背景技术:
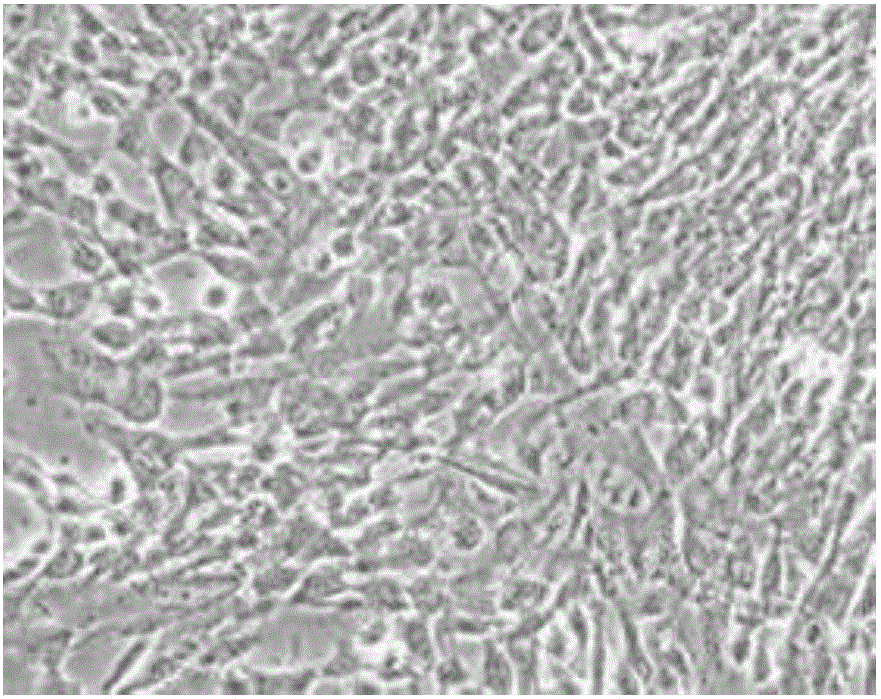
:软骨是由软骨细胞和细胞外基质组成的无血管组织,软骨细胞是关节软骨中唯一的细胞类型,其主要功能是通过分泌II型胶原(typeIIcollagen)及蛋白多糖(aggrecan,Acan)等保持关节软骨的功能。在正常生理条件下,软骨细胞的合成和分解代谢维持着动态平衡;而软骨细胞主要依靠关节的运动和挤压吸收营养物质,所以软骨损伤后自我修复能力比较弱,其损伤后的修复一直以来都是医学界的难题之一。经过十多年的临床应用及技术发展,字体软骨细胞移植技术已成为临床治疗软骨损伤最有效的方法。大多数动物细胞都不同程度地依赖血清才能在体外生长增殖。常规的软骨细胞培养是在含有10%的血清的DMEM培养基条件下进行的。血清可以提供细胞生长所需的营养物质,同时血清中含有各类生长因子,可促进细胞的增殖。但血清成分复杂,在对细胞产物进行分析或者提纯时会受到血清成分的干扰,而且不同批次血清的质量难以保持一致,另外,血清中还含有一定量的细胞毒性物质和抑制物质,对细胞有去分化作用,影响某些细胞功能的表达。在有血清的培养条件下,随着传代次数增加,软骨细胞很容易去分化生成纤维细胞状态,无法分泌软骨细胞分泌的软骨特异性Ⅱ型胶原蛋白及蛋白聚糖,失去正常软骨细胞表型。而无血清培养基能很好地解决血清带来的一些问题,例如公开号为CN104630138A的发明专利公开了一种无血清软骨细胞培养液,但是,由于软骨细胞属于贴壁生长类细胞,上述专利各类组分中缺乏促贴壁相关蛋白以及蛋白酶抑制剂,易造成细胞生长贴壁不稳固等问题,另外,存在延缓软骨细胞去分化效率低的问题,软骨细胞体外培养易出现去分化,导致胶原蛋白表达发生变化。技术实现要素:本发明针对现有技术中存在的问题,提供一种软骨细胞无血清培养基,不仅解决了现有技术中的血清培养基带来的问题,而且软骨细胞生长过程中很好的贴壁并增值速度更快,有利于获得更多细胞量,同时在软骨细胞增殖的同时能够保持软骨细胞的特性,未出现明显的去分化现象。本发明的另一目的在于提供一种软骨细胞无血清培养基的制备方法。本发明通过以下技术方案实现该目的:一种软骨细胞无血清培养基,由基础培养基、血清替代物以及生长因子组成,其中:所述基础培养基为DMEM培养基、F12培养基或者二者的混合物;所述血清替代物包括:葡聚糖5-20g/L、脂类浓缩剂0.1-1ml/L、丙酮酸钠50-100mg/L、三碘甲状腺氨酸0.01-2uM、氢化可的松0.05-5mg/L、地塞米松0.1-10ug/L、亚硒酸钠1-5ug/L、β-巯基乙醇25-50uM、维生素C10-100mg/L、谷氨酰胺50-500ug/ml、转铁蛋白1-20mg/L、胰岛素或胰岛素样生长因子5-100ug/L、生长激素10-200ug/L、孕酮5-20nM、丁二胺20-100uM、氯化胆碱2.5-3.2mg/L、层粘连蛋白5-30ug/L、大豆蛋白酶抑制剂2-10mg/L;L-精氨酸250.0-320.0mg/L、L-门冬氨酸12.00-25.00mg/L、L-谷氨酸15.0-25.0mg/L、甘氨酸8.0-12.0mg/L、L-组氨酸13.0-16.0mg/L、L-羟脯氨酸18.0-22.0mg/L、L-异亮氨酸35.0-55.0mg/L、L-亮氨酸40.0-60.0mg/L、L-甲硫氨酸12.0-18.0mg/L、L-苯丙氨酸12.0-18.0mg/L、L-脯氨酸18.0-22.0mg/L、L-丝氨酸25.0-32.0mg/L、L-苏氨酸18.0-22.0mg/L、L-色氨酸2.0-6.0mg/L、L-酪氨酸20.19-25.89mg/L、L-缬氨酸18.0-22.0mg/L;所述生长因子包括:碱性成纤维生长因子5-60ug/L、表皮生长因子0.5-30ug/L、转化生长因子1-25ug/L、骨形成蛋白1-20ug/L、血小板衍生生长因子1-18ug/L、bHLH转录因子0.2-5ug/L、转录因子E2F-10.01-2ug/L。作为优选的,软骨细胞无血清培养基,由基础培养基、血清替代物以及生长因子组成,其中:所述基础培养基为DMEM培养基、F12培养基或者二者的混合物;所述血清替代物包括:葡聚糖10g/L、脂类浓缩剂0.5ml/L、丙酮酸钠80mg/L、三碘甲状腺氨酸0.2uM、氢化可的松2mg/L、地塞米松0.2ug/L、亚硒酸钠2ug/L、β-巯基乙醇25uM、维生素C50mg/L、谷氨酰胺200ug/mL、转铁蛋白5mg/L、胰岛素或胰岛素样生长因子40ug/L、生长激素20ug/L、孕酮10nM、丁二胺50uM、氯化胆碱2.5mg/L、层粘连蛋白12ug/L、大豆蛋白酶抑制剂6mg/L;L-精氨酸300mg/L、L-门冬氨酸20mg/L、L-谷氨酸20mg/L、甘氨酸10mg/L、L-组氨酸15mg/L、L-羟脯氨酸20mg/L、L-异亮氨酸40mg/L、L-亮氨酸60mg/L、L-甲硫氨酸15mg/L、L-苯丙氨酸15mg/L、L-脯氨酸20mg/L、L-丝氨酸30mg/L、L-苏氨酸20mg/L、L-色氨酸5mg/L、L-酪氨酸22mg/L、L-缬氨酸20mg/L;碱性成纤维生长因子20ug/L、表皮生长因子5ug/L、转化生长因子10ug/L、骨形成蛋白5ug/L、血小板衍生生长因子18ug/L、bHLH转录因子0.2ug/L、转录因子E2F-10.05ug/L。一种软骨细胞无血清培养基的制备方法,包括如下步骤:选取基础培养基,DMEM培养基、F12培养基或者二者的混合物;常温无菌环境下,向基础培养基中添加血清替代物和相关生长因子;0.22um滤膜过滤除菌,得到软骨细胞无血清培养基。相对于现有技术,本发明的有益效果为:本发明的软骨细胞无血清培养基,由基础培养基、血清替代物以及生长因子组成,不仅解决了现有技术中的血清培养基带来的问题,而且软骨细胞生长过程中很好的贴壁并增值速度更快,有利于获得更多细胞量,同时在软骨细胞增殖的同时能够保持软骨细胞的特性,未出现明显的去分化现象。附图说明图1为对比例1的细胞形态图。图2为对比例2的细胞形态图。图3为实施例1的细胞形态图。图4为实施例2的细胞形态图。图5为实施例3的细胞形态图。图6为5组细胞培养增殖曲线图。其中,组1表示对比例1,组2表示对比例2,组3表示实施例1,组4表示实施例2,组5表示实施例3。具体实施方式以下结合附图及具体实施例对本发明进行详细描述。实施例1。一种软骨细胞无血清培养基,由基础培养基、血清替代物以及生长因子组成,其中:所述基础培养基为DMEM培养基;所述血清替代物包括:葡聚糖5g/L、脂类浓缩剂0.1ml/L、丙酮酸钠50mg/L、三碘甲状腺氨酸0.01uM、氢化可的松0.05mg/L、地塞米松0.1ug/L、亚硒酸钠1ug/L、β-巯基乙醇25uM、维生素C10mg/L、谷氨酰胺50ug/ml、转铁蛋白1mg/L、胰岛素或胰岛素样生长因子5ug/L、生长激素10ug/L、孕酮5nM、丁二胺20uM、氯化胆碱2.5mg/L、层粘连蛋白5ug/L、大豆蛋白酶抑制剂2mg/L;L-精氨酸250.0mg/L、L-门冬氨酸12.00mg/L、L-谷氨酸15.0mg/L、甘氨酸8.0mg/L、L-组氨酸13.0mg/L、L-羟脯氨酸18.0mg/L、L-异亮氨酸35.0mg/L、L-亮氨酸40.0mg/L、L-甲硫氨酸12.0mg/L、L-苯丙氨酸12.0mg/L、L-脯氨酸18.0mg/L、L-丝氨酸25.0mg/L、L-苏氨酸18.0mg/L、L-色氨酸2.0mg/L、L-酪氨酸20.19mg/L、L-缬氨酸18.0mg/L;所述生长因子包括:碱性成纤维生长因子5ug/L、表皮生长因子0.5ug/L、转化生长因子1ug/L、骨形成蛋白1ug/L、血小板衍生生长因子1ug/L、bHLH转录因子0.2ug/L、转录因子E2F-10.01ug/L。实施例2。软骨细胞无血清培养基,由基础培养基、血清替代物以及生长因子组成,其中:所述基础培养基为F12培养基;所述血清替代物包括:葡聚糖10g/L、脂类浓缩剂0.5ml/L、丙酮酸钠80mg/L、三碘甲状腺氨酸0.2uM、氢化可的松2mg/L、地塞米松0.2ug/L、亚硒酸钠2ug/L、β-巯基乙醇25uM、维生素C50mg/L、谷氨酰胺200ug/mL、转铁蛋白5mg/L、胰岛素或胰岛素样生长因子40ug/L、生长激素20ug/L、孕酮10nM、丁二胺50uM、氯化胆碱2.5mg/L、层粘连蛋白12ug/L、大豆蛋白酶抑制剂6mg/L;L-精氨酸300mg/L、L-门冬氨酸20mg/L、L-谷氨酸20mg/L、甘氨酸10mg/L、L-组氨酸15mg/L、L-羟脯氨酸20mg/L、L-异亮氨酸40mg/L、L-亮氨酸60mg/L、L-甲硫氨酸15mg/L、L-苯丙氨酸15mg/L、L-脯氨酸20mg/L、L-丝氨酸30mg/L、L-苏氨酸20mg/L、L-色氨酸5mg/L、L-酪氨酸22mg/L、L-缬氨酸20mg/L;碱性成纤维生长因子20ug/L、表皮生长因子5ug/L、转化生长因子10ug/L、骨形成蛋白5ug/L、血小板衍生生长因子18ug/L、bHLH转录因子0.2ug/L、转录因子E2F-10.05ug/L实施例3。一种软骨细胞无血清培养基,由基础培养基、血清替代物以及生长因子组成,其中:所述基础培养基为DMEM培养基与F12培养基按照1:1的比例混合的的混合物;所述血清替代物包括:葡聚糖20g/L、脂类浓缩剂1ml/L、丙酮酸钠100mg/L、三碘甲状腺氨酸2uM、氢化可的松5mg/L、地塞米松10ug/L、亚硒酸钠5ug/L、β-巯基乙醇50uM、维生素C100mg/L、谷氨酰胺500ug/ml、转铁蛋白20mg/L、胰岛素或胰岛素样生长因子100ug/L、生长激素200ug/L、孕酮20nM、丁二胺100uM、氯化胆碱3.2mg/L、层粘连蛋白30ug/L、大豆蛋白酶抑制剂10mg/L;L-精氨酸320.0mg/L、L-门冬氨酸25.00mg/L、L-谷氨酸25.0mg/L、甘氨酸12.0mg/L、L-组氨酸16.0mg/L、L-羟脯氨酸22.0mg/L、L-异亮氨酸55.0mg/L、L-亮氨酸60.0mg/L、L-甲硫氨酸18.0mg/L、L-苯丙氨酸18.0mg/L、L-脯氨酸22.0mg/L、L-丝氨酸32.0mg/L、L-苏氨酸22.0mg/L、L-色氨酸6.0mg/L、L-酪氨酸25.89mg/L、L-缬氨酸122.0mg/L;所述生长因子包括:碱性成纤维生长因子60ug/L、表皮生长因子30ug/L、转化生长因子25ug/L、骨形成蛋白20ug/L、血小板衍生生长因子18ug/L、bHLH转录因子5ug/L、转录因子E2F-12ug/L。对比例1。添加10%胎牛血清的DMEM培养基。对比例2。公开号为CN104630138A的发明专利公开的无血清软骨细胞培养液。效果对比验证试验:1、分别取兔软骨组织若干,经PBS清洗2-3遍,剪碎至1mm3,加入Ⅱ型胶原酶,于37℃摇床消化2-4h;2、过滤,滤液离心收集下层软骨细胞,计数;3、根据计数结果,取1×107细胞量,平均分成5组分别利用实施例1~3,以及对比例1、2制备的培养基进行培养实验。4、以上5组试验的细胞接种密度均为2×105/mL,细胞生长至80%时进行传代培养,培养至6天和10天分别计数,计数结果如表1所示,细胞形态如图1~5所示,根据细胞计数结果绘制的细胞增值曲线如图6所示:表15组培养试验细胞计数结果组别接种细胞量(105)6天后细胞量(105)10天后细胞量(105)对比例123.8610.21对比例224.2811.85实施例126.8817.29实施例226.8918.35实施例327.1217.89结果分析:由表1以及图1~6的数据可知,实施例1~3获得的细胞量及增殖速度明显优于对比例1、2,且细胞形态轮廓清晰,传代至P9代依然呈“铺路石”状,而对比例1的细胞于P5代细胞出现成纤维细胞状;对比例2的细胞于P7出现成纤维细胞状,说明本发明的软骨细胞无血清培养基在维持软骨细胞特性方面最佳,增殖速度也明显最优。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1