一种培养基及细胞培养方法与流程
本发明涉及细胞领域,特别涉及一种培养基及细胞培养方法。
背景技术:
间充质干细胞是一类具有自我更新、增殖和多向分化潜能的干细胞,在1966年首先由Friedenstein等从骨髓中发现的。大量研究发现,间充质干细胞不仅可以分化为多种间质组织的细胞,如骨、脂肪、软骨、肌肉、肌腱和韧带等。同时在一定的诱导条件下还可以横向分化为外胚层和内胚层细胞。如上皮细胞、神经元细胞、神经胶质细胞、血管内皮细胞、表皮干细胞等。目前研究表明,间充质干细胞来源十分广泛,除骨髓外,脂肪、脐带华通胶、胎盘、羊膜、肌肉、韧带等均已分离培养出。近年来大量研究证明人体和动物的颅颌面部,特别是牙源性组织中存在具有特殊分化和再生功能的间充质干细胞。近年来因其在组织工程和细胞替代治疗的临床前研究而备受关注。
人牙龈间充质干细胞(gingiva-derived mesenchymal stem cells,GMSCs)是组成牙龈结缔组织的主要间充质细胞。它是来源于中胚层的纤维母细胞,不仅具有活跃的自我更新的能力,并且还具有合成和降解胶原等细胞外基质的功能:I型和Ⅲ型胶原、纤维粘连蛋白等。因此GF在许多生理和病理过程中都起着十分重要的作用,可以维持胶原动态平衡,调节细胞相互作用,保护和修复牙龈组织,维持牙龈组织自身稳定性。
牙周病造成了牙齿周围支持组织的不可逆性损坏,而目前广泛用于牙周再生的治疗方法都没能完全实现牙周组织的生理性和功能性再生。牙周组织工程技术的发展为牙周缺损组织的修复和再生提供了新的思路和空间。牙周膜干细胞自被发现以来,其良好的干细胞性就已经得到了广泛认可,但其来源有限,需拔牙才能获取牙周膜组织,使其临床应用的潜能受到限制。而在组织工程学研究中,寻求来源广泛、取材方便的种子细胞一直是研究的重点和核心。同是牙周组织来源的牙龈组织,则具有取材方便、组织愈合能力强并且能够无疤愈合的特点。因此,来源于牙龈组织的牙龈间充质干细胞近几年受到了高度关注。
GMSCs目前体外扩增采用的培养方法大多为体积分数为10%胎牛血清+DMEM/F12或体积分数为10%胎牛血清+低糖DMEM培养基,但由于胎牛血清增加了病毒感染及异种蛋白所导致异基因免疫应答的可能,从而在临床应用时存在潜在的风险。
技术实现要素:
有鉴于此,本发明提供一种培养基及细胞培养方法。本发明公开一种更为有效的GMSCs体外扩增方法,在采用间充质干细胞无血清培养基的基础上,添加适当比例的bFGF和EGF两种生长因子,既避免了动物源血清所带来的风险,且更有效的提高GMSCs体外扩增能力。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种培养基,包括无血清培养基、bFGF和EGF。
碱性成纤维细胞生长因子(Basic Fibroblast Growth Factor,bFGF)是含155个氨基酸的促有丝分裂的阳离子多肽,分子量为16~18.5KD。bFGF具有广泛的生物学作用,对多种细胞的生长、分化及功能有影响,在正常生理和病理过程中发挥作用,其主要生物学作用有:(1)作为血管生长因子;(2)促进创伤愈合与组织修复;(3)促进组织再生;(4)参与神经再生等。表皮生长因子(Epidermal Growth Factor,EGF)是一种小肽,由53个氨基酸残基组成,EGF是一种多功能的生长因子,在体内体外都对多种组织细胞有强烈的促分裂作用。
在本发明的一些具体实施方案中,所述培养基中所述bFGF的浓度为5~25ng/ml。
在本发明的一些具体实施方案中,所述培养基中所述培养基中所述bFGF的浓度为10ng/ml。
在本发明的一些具体实施方案中,所述培养基中所述EGF的浓度为5~25ng/ml。
在本发明的一些具体实施方案中,所述培养基中所述EGF的浓度为10ng/ml。
本发明还提供了所述培养基在培养细胞中的应用。
在本发明的一些具体实施方案中,所述应用中所述细胞为间充质干细胞。
在本发明的一些具体实施方案中,所述应用中所述细胞为牙龈间充质干细胞。
此外,本发明还提供了一种细胞培养方法,包括如下步骤:
步骤1:获得冻存的细胞;
步骤2:取步骤1获得的细胞与无血清培养基混合后洗涤,弃上清,再与本发明提供的培养基混合复苏,继续培养。
在本发明的一些具体实施方案中,所述细胞培养方法中本发明提供的培养基的加入量为每5×104个细胞加入1mL所述培养基。
在本发明的一些具体实施方案中,所述细胞培养方法中所述复苏为取所述冻存的细胞于37℃水浴中溶解,1~2min液体融化后,用10mL无血清培养基稀释细胞悬液,1000r/min离心5min,弃上清;10mL本发明提供的培养基重悬细胞,按5×104个/mL密度细胞接种,在5%CO2的条件下37℃培养。
在本发明的一些具体实施方案中,所述细胞培养方法中所述继续培养为待细胞长满80~90%,弃去培养液,加入0.25%胰蛋白酶,消化1~3min,镜下观察细胞收缩变圆时,加入本发明提供的培养基终止消化,收集细胞。
本发明公开一种更为有效的GMSCs体外扩增培养基及培养方法,在采用间充质干细胞无血清培养基的基础上,添加bFGF和EGF两种生长因子,尤其是10ng/mLbFGF和10ng/mL EGF两种生长因子,既避免了动物源血清所带来的风险,且更有效的提高GMSCs体外扩增能力。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示对比例与实施例3GMSCs形态图;
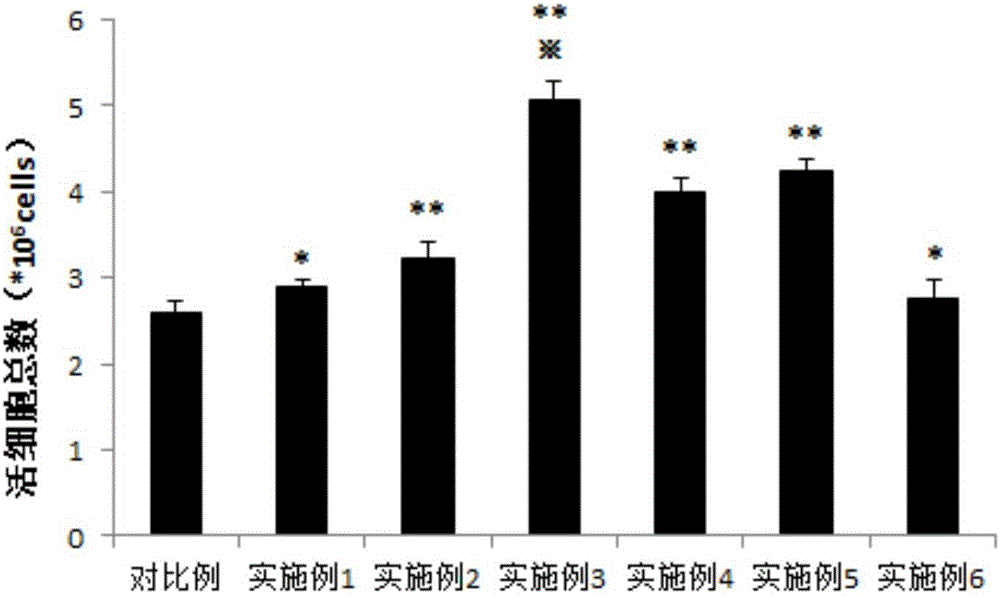
图2示各组活细胞总数均值比较;
图3示各组细胞活率均值比较;
图4示对比例GMSCs生长曲线图;
图5示实施例3GMSCs生长曲线图。
具体实施方式
本发明公开了一种培养基及细胞培养方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明的GMSCs体外有效扩增方法所使用的培养基不含有动物源血清,避免了引入污染和过敏原的风险,与常规细胞培养方法相比具有更高的临床安全性。
本发明的GMSCs有效扩增方法更有效的提高GMSCs体外扩增能力。
本发明提供的培养基及细胞培养方法中所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL间充质干细胞无血清培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/mL密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL 0.25%胰蛋白酶,消化1~3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:5ng/mLbFGF+5ng/mL EGF+间充质干细胞无血清培养基。(其中,5n g/mL的意思为:每毫升间充质干细胞无血清培养基中含有5ng生长因子,下同。)
实施例2
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL间充质干细胞无血清培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/mL密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL 0.25%胰蛋白酶,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:10ng/mLbFGF+5ng/mLEGF+间充质干细胞无血清培养基。
实施例3
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL间充质干细胞无血清培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/mL密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL0.25%胰蛋白酶,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:10ng/mLbFGF+10ng/mLEGF+间充质干细胞无血清培养基。
实施例4
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL间充质干细胞无血清培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/mL密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL0.25%胰蛋白酶,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:15ng/mLbFGF+10ng/mL EGF+间充质干细胞无血清培养基。
实施例5
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL间充质干细胞无血清培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/mL密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL 0.25%胰蛋白酶,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:10ng/mLbFGF+15ng/mL EGF+间充质干细胞无血清培养基。
实施例6
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL间充质干细胞无血清培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/mL密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL 0.25%胰蛋白酶,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:25ng/mLbFGF+25ng/mL EGF+间充质干细胞无血清培养基。
对比例
取第3代冻存的GMSCs,冻存管取出立即放入37℃水浴锅中溶解,溶解过程中需不断摇晃冻存管。1-2min液体融化后,用10mL DMEM/F12基础培养基稀释细胞悬液(用培养基把冻存管洗一遍),1000r/min离心5min,弃上清。10mL完全培养基重悬细胞,按5×104个/ml密度细胞接种于10cm培养皿中,放入5%CO2培养箱37℃培养。待细胞长满80-90%,用吸管吸弃旧培养液,加入2~3mL0.25%胰蛋白酶,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入5mL完全培养基终止消化,收集细胞,进行细胞计数。
完全培养基配方为:10%胎牛血清+DMEM/F12基础培养基。
实施例8
把对比例与各个实施例的统计数据进行比较。结果表明,实施例1、实施例6与对比例有显著性差异(*,p<0.05);其余实施例与对比例有极显著性差异(**,p<0.01);实施例3与其他实施例有极显著性差异(※,p<0.01)。
结果如表1和图2所示:
表1各实验组细胞计数结果
注:*表示p<0.05;**,※表示p<0.01。
表2各实验组细胞活率平均值
注:*,※表示p<0.01。
表2和图3结果表明,实施例1、实施例6细胞活率与对比例无显著性差异;实施例2、4、5与对比例、实施例1、6有极显著性差异(*,p<0.01);实施例3与其余各组皆有极显著性差异(※,p<0.01)。
实施例9
取P3代GMSCs,分别采用对比例和实施例3中的培养基配方,细胞按1×104个/mL密度接种于24孔板中,第四天换液一次。每天收集细胞进行细胞计数,每次收集计算3孔,连续7天。绘制细胞生长曲线。
实验结果如图1~图3、表3~表4所示。
表3对比例GMSCs每天计数结果
表4实施例3 GMSCs每天计数结果
注:*表示p<0.01。
将对比例与实施例3细胞计数得到的数据制作生长曲线,结果表明(表3、表4,图4、图5),采用本发明的间充质干细胞无血清培养基培养的GMSCs生长曲线符合间充质干细胞“S”型的增殖规律;细胞培养第5、6、7天,实验组3的GMSCs增殖活性(同样的初始接种密度,培养到了5、6、7天,细胞计数比较可知。)比对比例的GMSCs显著增强(*,p<0.01),说明了本发明中使用的培养基配方更适用于GMSCs常规培养。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!