卵泡抑素样蛋白1对肺动脉高压的保护作用的制作方法
本发明属于生物技术领域,涉及卵泡抑素样蛋白1(fstl1)对肺动脉高压发挥保护作用中的用途。
背景技术:
肺动脉高压(pulmonaryhypertension,ph)是由多种病因导致的,以肺血管阻力和肺动脉压力进行性升高为特征,最终将导致右心衰竭和死亡的慢性致死性疾病(mclaughlinvv,etal.circulation.2009;119:2250-2294.)。who依据肺动脉高压的病因学将肺动脉高压分为五类:动脉性肺动脉高压;左心疾病所致的肺动脉高压;肺部疾病和/或低氧所致的肺动脉高压;慢性血栓栓塞性肺动脉高压;原因不明和/或多种机制所致的肺动脉高压(simonneaug,etal.journaloftheamericancollegeofcardiology.2013;62:d34-41.)。近十余年来,有关ph的研究取得了长足进步,但其发生发展的病理生理学机制尚不完全清楚。目前,针对ph治疗的三条途径(内皮素途径、一氧化氮途径以及前列环素途径),仅能发挥缓解症状,改善运动耐量的作用(seegerw,etal.journaloftheamericancollegeofcardiology.2013;62:d109-116.)。ph的死亡率和住院率仍呈逐年增长的趋势(meharia,etal.pulmonarymedicine.2014;2014:105864.)。因此,阐明ph发生发展的分子机制并探寻可能的治疗靶点,将为ph基础研究增添新的理论内容并为临床治疗提供实验依据,具有重要的社会意义和医学价值。
fstl1(follistatin-like1)基因是1993年由shibanumam等从tgf-β1诱导的小鼠成骨细胞系mc3t3-e1中克隆得到的。该基因编码卵泡抑素样蛋白1(fstl1),又称为转化生长因子β1诱导蛋白36(tgf-β1-stimulatedclone36,tsc-36),或卵泡抑素相关蛋白(follistatinrelatedprotein,frp)。fstl1属于fsl-sparc家族,是该家族中最小的分泌型糖蛋白(chalyy,etal.immunologicresearch.2014;59:266-272.)。其调控作用和分子机制尚不十分清楚。
在肺泡的发育中,fstl1可促进肺泡上皮的分化与成熟,纯合缺失fstl1将导致肺泡结构和功能发育不良(gengy,etal.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica.2011;108:7058-7063.)。在肺纤维化的形成中,fstl1亦可促进上皮细胞损伤以及成纤维细胞活化。单倍缺失fstl1或采用anti-fstl1中和fstl1则可减轻肺纤维化(dongy,etal.thejournalofexperimentalmedicine.2015;212:235-252.)。此外,fstl1具有抗心血管壁细胞损伤的作用。终末期心衰患者的心肌细胞、内皮细胞和平滑肌细胞,以及急性冠脉综合征患者循环血中fstl1表达上调(lara-pezzie,etal.endocrinology.2008;149:5822-5827.widerac,etal.clinicalchemistry.2012;58:1233-1241.)。外源性过表达fstl1后可保护心脏功能,减轻心肌损伤(weik,etal.nature.2015;525:479-485.chenw,etal.biochemicalandbiophysicalresearchcommunications.2016;469:418-423.)。此外,fstl1可抑制人脐静脉内皮细胞凋亡(lius,etal.americanjournalofphysiology.endocrinologyandmetabolism.2010;299:e351-363.)。fstl1亦可抑制人主动脉平滑肌细胞增殖和迁移(miyabem,etal.cardiovascularresearch.2014;103:111-120.)。fstl1在肺血管平滑肌细胞中呈高表达(adamsd,etal.geneexpressionpatterns.2007;7:491-500.)。然而,其在ph的研究中未见任何报道。
技术实现要素:
本发明的主要目的在于提供fstl1对肺动脉高压的保护作用,从而用于治疗、缓解或改善肺动脉高压中的用途。
本发明涉及一种fstl1在制备保护肺动脉高压的组合物上的应用。
本发明涉及一种fstl1对肺动脉高压的保护作用的试剂盒,其特征在于:
该引物为下列引物:
小鼠
fstl1:sense:5’-tccaagatccaggttgattatgatg-3’;
anti-sense:5’-tcgcggttagcttgatagcaga-3’.
gapdh:sense:5’-cggagtcaacggatttggtcgtat-3’;
anti-sense:5’-agccttctccatggtggtgaagac-3’.
人
fstl1:sense:5’-tctgtgccaatgtgttttgtgg-3’;
anti-sense:5’-tgaggtaggtcttgccattactg-3’.
gapdh:5’-gggtgtgaaccatgagaagtatga-3’;
anti-sense:5’-tgctaagcagttggtggtgc-3’.
本发明提供一种辅助检测肺组织和细胞中fstl1基因水平的试剂盒,包括rna提取,反转录、real-timepcr反应常用的酶和试剂,如oligo(dt)18引物、rna酶抑制剂、dntpmix、逆转录酶、reactionbuffer、ddh2o、sybrgreen等。
本发明解决问题的技术方案包括:
(1)建立统一标准的标本库和数据库:收集符合标准的样本及组织,系统收集完整的人口学资料和临床资料;
(2)fstl1差异表达分析,确定辅助判断肺动脉高压和辅助判断试剂盒的研制;
(3)根据fstl1的差异表达开发辅助诊断肺动脉高压的试剂盒。
本发明的实验方法主要包括以下几个部分:
1.研究样本的选择
(1)收集血清、肺组织、细胞样本;
(2)本研究首先采用人体血清样本进行研究;
(3)本研究进一步采用小鼠肺组织样本进行研究;
(4)本研究进一步采用人肺动脉平滑肌细胞进行研究。
2.利用rna提取试剂盒提取肺组织、细胞样本组织的rna并反转录为cdna,使用特异的引物进行pcr反应,扩增目标片段,检测fstl1的基因表达情况。
3.采用trizol法,按说明书方法操作,得到的总rna通过测量a260/a280比值鉴定其纯度与完整性。
4.总rna通过反转录获得样本的cdna与real-timepcr方法
(1)总rna作为模板,使oligo(dt)18引物选择性地与mrna中的poly(a)尾结合。
(2)逆转录酶催化引物与dntpmix以mrna为模板,合成全长的第一链cdna。
(3)转录得到的cdna作为模板,使用特异的引物进行pcr反应,扩增目标片段。荧光染料sybrgreen嵌入双链dna并发出荧光,通过检测每个循环后的荧光强度对未知模板进行定量分析。(4)检测正常对照和肺动脉高压患者、动物及细胞样本中、组织中fstl1表达量的相对变化。
5.辅助判断fstl1检测试剂盒的制备方法通过real-timepcr技术确定对照组织与肺动脉高压患者、动物及细胞组织中的表达差异,作为判断辅助肺动脉高压发生的指标。该试剂盒包括fstl1特异的引物、oligo(dt)18引物、逆转录酶等试剂。
5.统计分析方法
运用student'st检验比较fstl1在正常对照和肺动脉高压患者、动物及细胞中的平均表达水平的差异。
我们在探索性样本人群血清中发现fstl1在copd合并肺动脉高压患者的血清样本中表达水平显著增加;
在肺动脉高压小鼠肺组织样本相较于正常对照样本中fstl1的表达水平显著升高。
检测的不同表达水平以2-δδct表示,
其中δct=ctmir(样本/对照)-ct内参(样本/对照),δδct=δct样本-δct对照。
我们在每一个样本pcr扩增时,使用gapdh作为内参,计算相对表达量。
统计学分析通过专门的统计学分析软件spss18.0完成。统计学显著水平p值设为0.05,所有统计学检验均为双侧检验。
根据上述实验结果,本发明人制备了一种能用于辅助判断肺动脉高压的试剂盒,包含测定fstl1的引物和其他检测试剂。
为了解决上述问题,本发明采取的技术方案为:
根据本发明,将人肺动脉平滑肌细胞(hpasmcs)(p4-p8)接种于完全培养基中,置于o2浓度维持在21%、co2浓度维持在5%、温度维持在37℃的细胞培养箱内。取对数生长期的细胞,经胰酶消化后,用完全培养基重悬细胞。将细胞悬液接种于培养皿中贴壁24h后,换无血清培养基继续培养24h,使细胞生长同步化。之后将细胞置于含重组人fstl1蛋白(100ng/ml)或fs蛋白(100ng/ml)的2%fbs基础培养基中,并分别置于低氧(3%o2)的环境中。
根据本发明,血标本的采集是收集北京朝阳医院就诊的copd患者、copd合并肺动脉高压患者及其健康对照的静脉血,室温环境中静置2h,3000rpm离心15min,取血清,贮存于-80℃的冰箱中。
根据本发明,采用常压持续低氧法复制低氧性肺动脉高压小鼠模型。选取8-10周龄,体重20-25g的雄性c57bl/6小鼠,fstl1单倍杂合缺失的小鼠(fstl1+/-小鼠)及其对照小鼠适应环境3天后用于实验。低氧组小鼠置于o2浓度维持在10%,除每隔3天更换垫料、喂食水、注射药物时打开舱门约30min外,余时紧闭舱门。舱内水蒸气用无水氯化钙吸收。每天给予小鼠12h光照/12h黑暗。舱内温度维持在22-24℃。
根据本发明,于低氧前,采用尾静脉注射的方法给c57bl/6小鼠注射重组人fstl1蛋白(100ng/g),每隔2天注射一次,直至实验结束。
根据本发明,分别于低氧0周、2周和4周后,采用腹腔注射2%的戊巴比妥钠(50mg/kg)将各实验组动物进行麻醉。运用闭胸心脏穿刺技术,检测各组小鼠右心室收缩压(rvsp)。之后开胸,在心尖部采集各组小鼠的全血,按前述方法收集血清,贮存于-80℃的冰箱中。
根据本发明,分离出小鼠心脏并剪掉心房和心耳,沿室间隔将右心室剪下,分别称取右心室(rv)、左心室加室间隔(lv+s)的重量,并依据公式rv/(lv+s)计算右心室肥厚指数(rvhi),以反映右心室肥厚程度。
根据本发明,分别于低氧0周、2周和4周后,麻醉后放血处死小鼠,并用生理盐水灌洗。取小鼠的左侧肺组织,将其放入4%甲醛缓冲液中固定24h;梯度酒精脱水,透明,石蜡包埋;做连续4μm/张的切片,展片,烤片;脱蜡,梯度酒精水化;苏木精染色,蒸馏水清洗多余染液;分色,蒸馏水洗;伊红染色,蒸馏水洗;梯度酒精脱水,透明,封片;普通光学显微镜下观察h&e染色结果。
根据本发明,分别于低氧0周、2周和4周后,麻醉后放血处死小鼠,并用生理盐水灌洗。取小鼠的左侧肺组织,将其放入4%甲醛缓冲液中固定24h;梯度酒精脱水,透明,石蜡包埋;做连续4μm/张的切片,展片,烤片;脱蜡,梯度酒精水化;微波抗原修复20min;0.3%tritonx-100破膜10min,pbs清洗;10%的羊血清封闭1h;一抗孵育,4℃过夜;室温复温30min,pbs清洗;免疫荧光标记的二抗孵育1h,pbs清洗;用含dapi的防淬灭封片剂封片;荧光显微镜下观察免疫荧光染色结果。
根据本发明,通过nis-elements成像软件,分析肺小动脉重构情况。测量各实验组肺小动脉血管壁的外周长(外弹力板以内)和血管内周长(内弹力板以内)。依据公式:血管壁中层厚度占外径的百分比(mt%)=[(血管外周长/π-血管内周长/π)/(血管外周长/π)]×100,计算外径在100μm以内的mt%。采用α-sma免疫组织化学染色,观察完全肌化的血管数量。
根据本发明,将人肺动脉平滑肌细胞(hpasmcs)(p4-p8)接种于完全培养基中,置于o2浓度维持在21%、co2浓度维持在5%、温度维持在37℃的细胞培养箱内。取对数生长期的细胞,经胰酶消化后,用完全培养基重悬细胞。将细胞悬液接种于培养皿中贴壁24h后,换无血清培养基继续培养24h,使细胞生长同步化。之后将细胞置于含或不含重组人fstl1蛋白(100ng/ml、250ng/ml)的2%fbs基础培养基中,并分别置于常氧或低氧(3%o2)的环境中。
根据本发明,采用mtt检测细胞的活力,具体如下:将hpasmcs以每孔5×103个的密度接种于96孔板,并设置复孔;贴壁24h后,换无血清培养基继续培养24h,使细胞生长同步化;将细胞置于含2%fbs的基础培养基中,培养48h之后,移去培养基,加入150μlmtt(0.5mg/ml)工作液,继续培养4-6h;移去上清,每孔加入150μl的dmso,37℃摇床避光孵育15min;用酶标仪于490nm处检测吸光度。
根据本发明,采用brdu标记的方法检测dna的合成水平,具体如下:将hpasmcs以每孔1×106个的密度接种于培养皿中,加入brdu(10μm),37℃孵育1h;收集细胞固定、破膜,dna酶(300μg)37℃孵育1h;采用荧光标记的anti-brdu抗体室温孵育20min;加入7-aad(20μl)为dna着色;采用流式细胞仪检测在s期(p4),g0/g1期(p3),g2期(p5)和凋亡期(p6)的细胞数量。依据公式:p4/(p3+p4+p5),计算处于s期细胞的比例。
根据本发明,将hpasmcs接种于96孔板或6孔板中,待细胞长至60%的密度时饥饿24h;取rnaimax和sirna分别加至opti-mem转染管中,边加边摇晃,轻混,室温静置5min后,混合后室温静置5min;向培养皿中加入混合液,96孔板每孔加入sirna的总量为1pmol,6孔板每孔加入sirna的总量为25pmol,转染6h;更换为2%fbs的基础培养基用于实验。
所需sirna序列(详见下)
fstl1sirna:sense:5’-gaaacugccaucaauauuatt-3’;
anti-sense:5’-uaauauugauggcaguuuctt-3’.
n.c.sirna:sense:5’-uucuccgaacgugucacgutt-3’;
anti-sense:5’-acgugacacguucggagaatt-3’.
根据本发明,将血清饥饿的hpasmcs以1×105/孔的密度接种于放置在24孔板中的小室中,静置6h;用棉签拭去上室细胞,清洗后固定;切下小室膜,下面朝上,置于载玻片上;用dapi染色,荧光显微镜下观察迁移细胞的数量。
根据本发明,取小鼠的右侧肺组织,提取蛋白肺组织蛋白。具体如下:取10-20mg小鼠肺组织,以及不锈钢研磨珠,放入盛有150-200μl含蛋白酶抑制剂和磷酸酶抑制剂的ripa裂解液的ep管中,用研磨仪对肺组织进行破碎;用超声粉碎机进一步破碎肺组织,并在冰上裂解30min;4℃下,12000rpm离心15min;加入5×上样缓冲液,95℃,5min变性,待样本冷却后贮存于-80℃的冰箱中。
根据本发明,提取hpasmcs蛋白,具体如下:将培养皿中的培养基弃去,用pbs清洗;将含蛋白酶抑制剂和磷酸酶抑制剂的ripa裂解液,加入培养皿中,用细胞刷进行刮取;将刮取的细胞转移至ep管中;用超声粉碎机破碎hpasmcs,并在冰上裂解30min;4℃下,12000rpm离心15min;加入5×上样缓冲液,95℃,5min变性,待样本冷却后贮存于-80℃的冰箱中。
根据本发明,提取血清蛋白,具体如下:取90μl血清至ep管中,加入10μltca混合后冰上放置30min;4℃下,12000rpm离心30min,弃上清;加入100μl丙酮混匀后,4℃下,12000rpm离心5min,吸干丙酮;重复前述步骤;吸干丙酮,通风厨吹10min;加入10μl1×上样缓冲液混匀后,95℃,5min变性,待样本冷却后贮存于-80℃的冰箱中。
根据本发明,采用聚丙烯酰胺凝胶电泳,具体如下:电泳;电转;封闭1h;一抗孵育,4℃过夜;室温复温30min;二抗室温孵育1h;洗膜;采用odyssey发光成像。
根据本发明,采用trizol法提取小鼠肺组织以及hpasmcs的总rna,具体方法如下。取50mg肺组织于ep管中,加入1mltrizol,振荡匀浆。细胞实验则加入1mltrizol于1×106个细胞中,反复吹打,细胞悬液移至ep管中;先在冰上5min,其后于4℃下离心12000r/min,15min;加氯仿200μl,上下颠倒混匀,冰上5min;4℃下离心12000r/min,15min,转移上清液至另一ep管,勿吸到中间层的蛋白;加等体积的异丙醇,混匀后置于-80℃,20min;4℃下离心12000r/min,10min,丢弃上清液;加入预冷的75%酒精1ml,4℃下离心7500r/min,5min;弃上清,加入预冷的75%酒精1ml,4℃下离心7500r/min,5min;弃上清,将样品放入超净工作台内,使其在风机下干燥;加入20μldepc水溶解样本,超微量分光光度计测定rna浓度;立刻开始合成cdna或冻入-80℃冰箱长期保存。
反转录过程如下。
(1)样品及试剂置于冰上,按顺序于pcr管中加入以下各成分
总rna5μl
oligo(dt)18引物1μl
ddh2o6μl
轻轻混匀,短暂离心后置入65℃金属浴约5min;
(2)pcr管置于冰上,按顺序加入以下各成分
轻轻混匀,短暂离心;
(3)pcr管移至热循环仪中,开始逆转录,参数设置如下
45℃1h
70℃5min
反应终止后直接进行rt-pcr,或放入-80℃冰箱长期保存。
real-timepcr过程如下。
(1)实验组:于八连管中分别加入以下产物或试剂,每组设两个复孔。
(2)阴性对照组:于八连管中分别加入以下产物或试剂,每组设两个复孔。
(3)八连管短暂离心后放入pcr仪中开始检测,参数设置如下
95℃10min
95℃15s
60℃60s
40个循环,显示溶解曲线
gapdh作为内参。各基因引物详见下。
fstl1:sense:5’-tccaagatccaggttgattatgatg-3’;
anti-sense:5’-tcgcggttagcttgatagcaga-3’.
gapdh:sense:5’-cggagtcaacggatttggtcgtat-3’;
anti-sense:5’-agccttctccatggtggtgaagac-3’.
fstl1:sense:5’-tctgtgccaatgtgttttgtgg-3’;
anti-sense:5’-tgaggtaggtcttgccattactg-3’.
gapdh:5’-gggtgtgaaccatgagaagtatga-3’;
anti-sense:5’-tgctaagcagttggtggtgc-3’.
根据本发明,按照elisa试剂盒的说明书,检测血清中fstl1的水平。从-80℃取出患者血清样本,按照人fstl1酶联免疫吸附试剂盒的说明检测蛋白浓度。具体方法如下。
样本和试剂在室温下缓慢融化、平衡;
酶标板上分为标准孔和样品孔。
标准孔内分别加入100μl不同浓度的标准液,即2000pg/ml、1000pg/ml、500pg/ml、250pg/ml、125pg/ml、62.5pg/ml、31.2pg/ml和0pg/ml。样品孔加入用pbs稀释了50倍的血清样品。
各孔各设一个复孔;酶标板覆膜,37℃,孵育1h后弃去液体,甩干;
稀释检测溶液a(1:100),加入稀释液a100μl/孔,覆膜,37℃,孵育1h;弃去液体,自动洗板机上清洗酶标板,参数设置为洗涤液350μl/孔,浸泡2min,重复3次;
将酶标板倒扣在吸水纸上,使残液排干;
稀释检测溶液b(1:100),加入稀释液b100μl/孔,覆膜,37℃,孵育30min;弃去液体,自动洗板机上清洗酶标板,参数设置为洗涤液350μl/孔,浸泡2min,重复5次;
将酶标板倒扣在吸水纸上,使残液排干;
加入tmb底物90μl/孔,覆膜,37℃避光孵育约15min,待浓度较大的标准孔变色后即可停止孵育;
加入终止液50μl/孔,孔内不能出现气泡,酶标板底部不能有水滴或杂质;
即刻在酶标仪上测量吸光度(450nm);
各组取平均值,标准品及样品的吸光度减去空白孔(0pg/ml)的吸光度后,作标准曲线并推算样品的浓度。
根据本发明,实验数据以均数±标准误
使用graphpadprism5.0统计软件,进行分析。
多组数据采用one-wayanova单因素方差分析然后用tukey方法进行两两比较。两组数据间差异用student’st检验进行分析。p<0.05为有统计学差异。
本发明首次揭示了fstl1对肺动脉高压的保护作用,从而提供了一种fstl1作为药物筛选靶点用于治疗、缓解或改善肺动脉高压中的用途。
附图说明
图1采用mtt观察fstl1和fs对hpasmcs活力的影响
图2fstl1在copd合并肺动脉高压患者以及低氧诱导的肺动脉高压小鼠中表达上调
图3fstl1单倍杂合缺失小鼠低氧后肺动脉高压表型较其对照小鼠明显加重
图4外源性给予fstl1可减轻小鼠低氧性肺动脉高压的严重程度
图5外源性给予fstl1抑制低氧所诱导的人肺动脉平滑肌细胞(hpasmcs)的异常增殖和迁移
图6敲低fstl1则促进hpasmcs的增殖和迁移
图7fstl1通过降低erk的磷酸化水平抑制低氧所诱导的hpasmcs的增殖和迁移
具体实施方式
以下结合实施例进一步阐述本发明,但并不限制本发明的内容。
实施例1:
为检测fstl1对肺动脉高压的作用。首先采用体外实验对比fstl1和fs对hpasmcs的增殖的影响效果。分别观察外源性fstl1和fs对hpasmcs增殖能力的影响。于低氧前采用重组人fstl1蛋白或fs蛋白提前孵育hpasmcs。运用mtt检测hpasmcs的活力。外源性给予重组人fstl1蛋白(100ng/ml)较fs(100ng/ml)抑制低氧所促进的hpasmcs的增殖作用略强(图1)。
图1采用mtt观察fstl1和fs对hpasmcs活力的影响(n=3)。
实施例2:
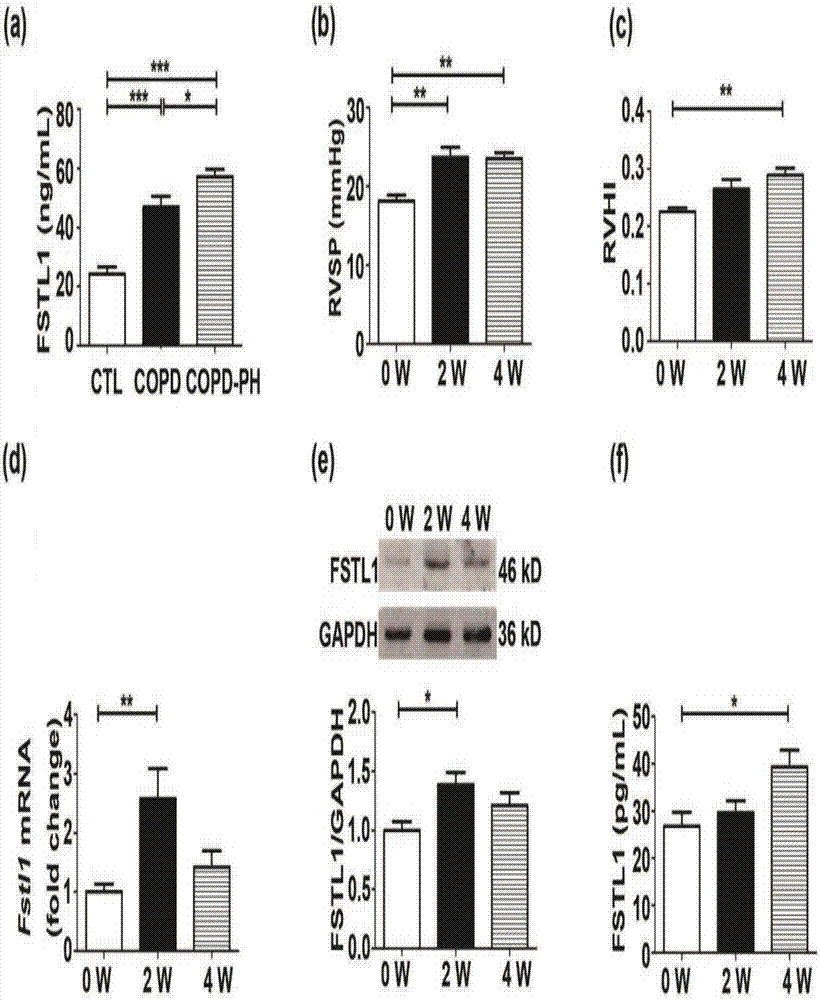
为检测fstl1在肺动脉高压中的变化情况,首先收集copd患者、copd合并肺动脉高压患者及其健康对照(ctl)的静脉血,并采用elisa检测copd患者、copd合并肺动脉高压患者及其ctl血清中fstl1的水平。与对照组相比,copd合并肺动脉高压患者血清中fstl1水平上调(***p<0.001)(图2a)。
为进一步检测fstl1在肺动脉高压中的变化情况,检测被广泛研究的低氧性肺动脉高压小鼠模型中fstl1的水平。首先制备低氧性肺动脉高压小鼠模型并检测右心室收缩压(rvsp)和右心室肥厚指数(rvhi)。采用闭胸心脏穿刺技术检测低氧性肺动脉高压小鼠的rvsp。分别于低氧后0周、2周和4周后检测小鼠的rvsp,与0周相比,低氧2周和4周,小鼠的rvsp均显著增加(**p<0.01)(图2b)。测定低氧性肺动脉高压小鼠的rvhi。分别于低氧后0周、2周和4周后检测小鼠的rvhi,与0周相比,低氧4周,小鼠的rvhi显著升高(**p<0.01)(图2c)。
接下来检测低氧性肺动脉高压小鼠模型中fstl1的水平。首先采用qrt-pcr检测低氧性肺动脉高压小鼠肺组织中fstl1的基因水平,以gapdh作为内参。分别于低氧后0周、2周和4周后检测小鼠肺组织中fstl1的基因水平,低氧2周小鼠肺组织中fstl1的基因水平较0周相比,显著增加至2.6倍(**p<0.01)(图2d)。采用westernblots进一步检测低氧性肺动脉高压小鼠肺组织中fstl1的蛋白表达水平,以gapdh作为内参。分别于低氧后0周、2周和4周后检测小鼠肺组织中fstl1的蛋白表达水平,与0周相比,低氧2周,小鼠肺组织中fstl1的蛋白表达水平显著升高至1.4倍(*p<0.05)(图2e)。为进一步检测fstl1在低氧性肺动脉高压小鼠中的改变情况,采用elisa检测低氧性肺动脉高压小鼠血清中fstl1的水平。分别于低氧0周、2周和4周后检测小鼠血清中fstl1的水平,与0周相比,低氧4周小鼠血清中fstl1的水平显著上调至1.5倍(*p<0.05)(图2f)。
图2fstl1在copd合并肺动脉高压患者以及低氧诱导的肺动脉高压(hph)小鼠中表达上调
采用elisa检测copd患者(n=8)、copd合并肺动脉高压患者(n=8)及其ctl(n=7)血清中fstl1的水平(a)。检测慢性低氧后小鼠(n=8)的右心室收缩压(rvsp)(b)和右心室肥厚指数(rvhi)(n=8)(c)。采用qrt-pcr检测低氧性肺动脉高压小鼠肺组织中fstl1的基因水平,以gapdh作为内参(n=10)(d)。采用westernblots检测低氧性肺动脉高压小鼠肺组织中fstl1的蛋白表达水平,以gapdh作为内参(n=10)(e)。采用elisa检测低氧性肺动脉高压小鼠血清中fstl1的水平(n=7-11)。
以上数据表明,fstl1可能与肺动脉高压相关,并在其发病机制中发挥一定的作用。
实施例3:
为检测fstl1是否参与肺动脉高压的调节,建立低氧诱导的fstl1基因工程小鼠进行肺动脉高压研究。由于fstl1缺失的纯合子小鼠(fstl1-/-小鼠)出生后死于呼吸窘迫,因此采用fstl1单倍杂合缺失的小鼠(fstl1+/-小鼠)进行研究。首先采用westernblots检测fstl1+/-小鼠及其对照(wt)小鼠fstl1的蛋白表达水平,以gapdh作为内参。fstl1+/-小鼠较其wt小鼠相比,肺组织中fstl1的蛋白表达水平降低59%,血清中fstl1的水平降低80%(图3a)。
将fstl1+/-小鼠及其wt小鼠置于低氧的环境后,检测各组小鼠的rvsp和rvhi,以观察fstl1对肺动脉高压形成的影响。低氧4周后,fstl1+/-小鼠及其wt小鼠较0周相比,rvsp均升高(***p<0.001),而fstl1+/-小鼠较其wt小鼠的rvsp升高更为显著(**p<0.01)(图3b)。低氧4周后,fstl1+/-小鼠及其wt小鼠较0周相比,rvhi均升高(**p<0.01),而fstl1+/-小鼠较其wt小鼠的rvhi升高更为显著(*p<0.05)(图3c)。
低氧性肺动脉高压的病理改变主要为肺血管壁的重构。将fstl1+/-小鼠及其wt小鼠置于低氧的环境后,检测其肺血管壁的重构程度,以观察fstl1对肺血管病理改变的影响。采用h&e染色,观察低氧4周后,fstl1+/-小鼠及其wt小鼠的肺血管重构情况。fstl1+/-小鼠较其wt小鼠相比,小肺动脉的重构更为明显著(图3d)。采用α-sma免疫荧光染色,观察低氧4周后,fstl1+/-小鼠及其wt小鼠的肺血管重构情况。fstl1+/-小鼠较其wt小鼠相比,α-sma阳性的细胞增多(图3e)。统计外径<100μm的fstl1+/-小鼠及其wt小鼠的小肺动脉的中膜厚度。低氧4周后,fstl1+/-小鼠及其wt小鼠较0周相比,外径在50-100μm的小肺动脉,中膜厚度均明显增厚(**p<0.01);外径<50μm的小肺动脉,中膜厚度均增加更为显著(***p<0.001)。fstl1+/-小鼠与其wt小鼠相比,外径<50μm的小肺动脉的中膜显著增厚(**p<0.01)(图3f)。统计外径<50μm的fstl1+/-小鼠及其wt小鼠的小肺动脉的肌化程度。低氧4周后,fstl1+/-小鼠及其wt小鼠较0周相比,小肺动脉的肌化程度均明显增加(***p<0.001)。fstl1+/--小鼠与其wt小鼠相比,完全肌化的血管数量明显增加(*p<0.05)(图3g)。
图3fstl1单倍杂合缺失小鼠低氧后肺动脉高压表型较其对照小鼠明显加重
采用westernblots检测fstl1+/-小鼠及其wt小鼠肺组织及血清中fstl1的蛋白表达水平(n=6)(a)。将fstl1+/-小鼠及其wt小鼠置于低氧的环境4周后,检测各组小鼠的rvsp(n=7-12)(b)和rvhi(n=8-10)(c)。采用h&e染色,观察低氧4周后,fstl1+/-小鼠及其wt小鼠的肺血管重构情况。标尺:20μm(d)。采用α-sma免疫荧光染色,观察低氧4周后,fstl1+/-小鼠及其wt小鼠的肺血管重构情况。标尺:50μm(d)。统计外径<100μm的fstl1+/-小鼠及其wt小鼠的小肺动脉的中膜厚度(n=5)。统计外径<50μm的fstl1+/-小鼠及其wt小鼠的小肺动脉的肌化程度(n=5)。
以上在体数据表明,降低fstl1将加重肺动脉高压的严重程度。
实施例4:
为进一步证实fstl1可参与肺动脉高压的调节,采用外源性给予fstl1蛋白,观察低氧后肺动脉高压的程度。首先于低氧前采用鼠尾静脉给小鼠注射重组人fstl1蛋白(100ng/g)或其等体积的溶剂对照(pbs),之后将小鼠置于低氧舱内,每隔2d注射一次,共注射9次(图4a)。于低氧4周后,采用elisa检测两组小鼠血清中fstl1的水平。与pbs组相比,鼠尾静脉注射重组人fstl1组血清中fstl1水平增加至2.4倍(*p<0.05)(图4b)。
检测各组小鼠的rvsp和rvhi,以观察外源性fstl1对肺动脉高压形成的影响。低氧4周后,鼠尾静脉注射重组人fstl1与pbs组相比,低氧诱导的rvsp明显降低(*p<0.05)(图4c)。低氧4周后,鼠尾静脉注射重组人fstl1与pbs组相比,低氧诱导的rvhi显著减小(*p<0.05)(图4d)。
检测各组小鼠的肺血管壁重构情况,以观察外源性fstl1对肺血管壁重构的影响。采用h&e染色,观察低氧4周后,鼠尾静脉注射重组人fstl1与pbs组小肺动脉的重构情况。鼠尾静脉注射重组人fstl1较pbs组相比,小肺动脉的重构减轻(图4e)。采用α-sma免疫荧光染色,观察低氧4周后,鼠尾静脉注射重组人fstl1与pbs组小肺动脉的重构情况。鼠尾静脉注射重组人fstl1与pbs组相比,α-sma阳性的细胞减少(图4f)。统计外径<100μm的鼠尾静脉注射重组人fstl1与pbs的小肺动脉的中膜厚度。低氧4周后,鼠尾静脉注射重组人fstl1与pbs组相比,外径<50μm的小肺动脉的中膜厚度明显改善(**p<0.01)(图4g)。统计外径<50μm的鼠尾静脉注射重组人fstl1与pbs的小肺动脉的肌化程度。低氧4周后,鼠尾静脉注射重组人fstl1较pbs组相比,小肺动脉的肌化程度得以缓解(*p<0.05)(图4h)。
图4外源性给予fstl1可减轻小鼠低氧性肺动脉高压的严重程度
通过鼠尾静脉注射外源性重组人fstl1蛋白或其对照pbs的时间流程图(a)。
于低氧4周后,采用elisa检测两组小鼠血清中fstl1的水平(n=4)(b)。
检测各组小鼠的rvsp(n=5)(c)和rvhi(d)(n=5)。采用h&e染色,观察低氧4周后,鼠尾静脉注射重组人fstl1与pbs组小肺动脉的重构情况。标尺:20μm(e)。
采用α-sma免疫荧光染色,观察低氧4周后,鼠尾静脉注射重组人fstl1与pbs组小肺动脉的重构情况。标尺:50μm(f)。
统计外径<100μm的鼠尾静脉注射重组人fstl1与pbs的小肺动脉的中膜厚度(n=5)(g)。
统计外径<50μm的鼠尾静脉注射重组人fstl1与pbs的小肺动脉的肌化程度(n=5)(h)。
以上在体数据表明,升高fstl1可改善肺动脉高压的严重程度。
实施例5:
肺血管重构最主要的病理机制为肺动脉平滑肌细胞的异常增殖和迁移。为进一步研究fstl1在肺动脉高压调节中的作用机制,采用体外实验进行研究。首先观察外源性fstl1对肺动脉平滑肌细胞增殖能力的影响。于低氧前采用重组人fstl1蛋白或其等体积的溶剂对照(pbs)提前孵育人肺动脉平滑肌细胞(hpasmcs)。采用mtt检测hpasmcs的活力。低氧48h可显著促进hpasmcs的增殖(***p<0.001),而采用外源性给予重组人fstl1蛋白(100ng/ml,*p<0.05或250ng/ml,**p<0.01)可显著抑制hpasmcs的增殖(图5a)。采用brdu染色通过流式细胞仪进一步检测hpasmcs的dna合成情况。低氧48h后,处于合成期的hpasmcs显著增多(*p<0.05),而外源性给予重组人fstl1蛋白(250ng/ml,*p<0.05)可显著抑制hpasmcs的dna合成(图5b)。
然后观察外源性fstl1对肺动脉平滑肌细胞迁移能力的影响。采用迁移小室观察hpasmcs的迁移水平。低氧后hpasmcs的迁移能力显著增强(***p<0.001),而外源性给予重组人fstl1蛋白(100ng/ml,*p<0.05或250ng/ml,***p<0.001)可显著抑制hpasmcs的迁移(图5c)。
图5fstl1可抑制低氧所诱导的人肺动脉平滑肌细胞异常的增殖和迁移
采用mtt检测fstl1对hpasmcs活力的影响(n=3)(a)。采用brdu染色通过流式细胞仪进一步检测fstl1对hpasmcs的dna合成的影响。计算s期(p4),g0/g1期(p3),g2期(p5)和凋亡期(p6)的细胞数量。依据公式:p4/(p3+p4+p5),计算处于s期细胞的比例(n=3)(b)。采用迁移小室观察fstl1对hpasmcs迁移水平的影响(n=3)标尺:50μm(c)。
以上体外实验数据表明,fstl1可抑制低氧所诱导的人肺动脉平滑肌细胞的异常增殖和迁移。
实施例6:
为进一步证实fstl1对肺动脉平滑肌增殖和迁移功能的调节,采用体外实验进一步进行研究。观察sirnafstl1对肺动脉平滑肌细胞增殖和迁移能力的影响。采用sirnafstl1敲低hpasmcs中fstl1的水平。首先运用qrt-pcr的方法,检测hpasmcs中fstl1的基因水平。sirnafstl1与其对照组(n.c.)相比,fstl1的基因水平显著降低(**p<0.01)(图6a)。采用westernblots的方法,进一步检测hpasmcs中fstl1的蛋白水平。sirnafstl1与n.c.相比,fstl1在hpasmcs及其上清中的蛋白水平均显著降低(图6b)。
采用mtt检测sirnafstl1对hpasmcs活力的影响。sirnafstl1与n.c.相比,在常氧和低氧的环境中,sirnafstl1均可显著加强hpasmcs的增殖(***p<0.001)(图6c)。采用brdu染色通过流式细胞仪检测sirnafstl1对hpasmcs的dna合成的影响。sirnafstl1与n.c.相比,在常氧和低氧的环境中,sirnafstl1均可显著加强hpasmcs的dna合成(*p<0.05)(图6d)。
然后观察sirnafstl1对肺动脉平滑肌细胞迁移能力的影响。采用迁移小室观察hpasmcs的迁移水平。sirnafstl1与n.c.相比,在常氧(**p<0.01)和低氧(*p<0.05)的环境中,sirnafstl1均可显著加强hpasmcs的迁移(图6e)。
图6sirnafstl1可促进低氧所诱导的hpasmcs的增殖和迁移
采用qrt-pcr的方法,检测转染sirnafstl1或其对照组(n.c.)的hpasmcs中fstl1的基因水平,以gapdh作为内参(n=4)(a)。采用westernblots进一步检测两组细胞中fstl1的蛋白表达水平,以gapdh作为内参(n=3)(b)。采用mtt观察sirnafstl1对hpasmcs活力的影响(n=3)(c)。采用brdu染色通过流式细胞仪检测sirnafstl1对hpasmcs的dna合成的影响(n=3)(d)。采用迁移小室观察sirnafstl1对hpasmcs的迁移水平的影响(n=3)。标尺:50μm(e)。
以上体外实验数据表明,敲低fstl1可促进低氧所诱导的人肺动脉平滑肌细胞的异常增殖和迁移。
实施例7:
ampk以及erk信号通路在低氧性肺动脉高压的发生发展中起着重要的调节作用。为进一步探索fstl1在改善肺动脉高压中的分子机制,首先在体研究,fstl1可否影响ampk以及erk信号通路。采用westernblots检测fstl1+/-小鼠及其wt小鼠低氧0周和4周后,肺组织中ampk以及erk的磷酸化和总蛋白的水平。低氧后,fstl1+/-(**p<0.01)小鼠及其wt(*p<0.05)小鼠肺组织中ampk的磷酸化水平降低,且fstl1+/-小鼠较wt小鼠肺组织中ampk的磷酸化降低更显著(**p<0.01)。而低氧可促进fstl1+/-(***p<0.001)小鼠及其wt(**p<0.01)小鼠肺组织中erk的磷酸化,且fstl1+/-小鼠较wt小鼠肺组织中erk的磷酸化升高(*p<0.05)(图7a)。于低氧0周和4周后,采用westernblots检测鼠尾静脉给小鼠注射重组人fstl1蛋白或其等体积的pbs组小鼠肺组织中erk以及ampk的磷酸化和总蛋白的水平。fstl1可抑制低氧诱导的erk的磷酸化(*p<0.05),可促进低氧抑制的ampk磷酸化(*p<0.05)(图7b)。
然后体外研究,fstl1对ampk以及erk信号通路的影响。采用westernblots检测提前孵育重组人fstl1蛋白或其等体积的pbs的hpasmcs,在常氧和低氧环境中erk以及ampk的磷酸化和总蛋白的水平。低氧可促进hpasmcs中erk的磷酸化(**p<0.01),而fstl1则可抑制erk的磷酸化水平(*p<0.05)(图7c)。然而,低氧可抑制hpasmcs中ampk的磷酸化(*p<0.05),而fstl1对低氧抑制的ampk的磷酸化水平无影响(图7d)。
进一步体外研究,fstl1可否通过抑制erk信号通路抑制hpasmcs的增殖。采用mtt观察erk的阻断剂u0126与重组人fstl1蛋白或其等体积的pbs共孵育后hpasmcs的活力。fstl1单独孵育(*p<0.05)或u0126单独孵育(*p<0.05),均可抑制hpasmcs的活力。u0126与fstl1共孵育较分别单独孵育抑制作用更为显著(**p<0.01)(图7e)。采用brdu染色通过流式细胞仪观察erk的阻断剂u0126与重组人fstl1蛋白或其等体积的pbs共孵育后hpasmcs的dna合成水平。fstl1单独孵育(**p<0.01)或u0126单独孵育(**p<0.01),均可抑制hpasmcs的dna合成水平。u0126与fstl1共孵育较分别单独孵育抑制作用更为显著(*p<0.05)(图7f)。
探索fstl1可否通过抑制erk信号通路抑制hpasmcs的迁移。采用迁移小室观察erk的阻断剂u0126与重组人fstl1蛋白或其等体积的pbs共孵育后hpasmcs的迁移情况。fstl1单独孵育(***p<0.001)或u0126单独孵育(***p<0.001),均可抑制hpasmcs的迁移。u0126与fstl1共孵育分别较分别u0126单独孵育(**p<0.01)和fstl1单独孵育(*p<0.05)抑制作用更为显著(图7g)。
图7fstl1通过降低erk的磷酸化水平抑制低氧所诱导的hpasmcs的增殖和迁移
低氧0周和4周后,采用westernblots检测fstl1+/-小鼠及其wt小鼠的肺组织中ampk(n=5)以及erk(n=6)的磷酸化以及总蛋白的水平,以gapdh为内参(a)。低氧0周和4周后,采用westernblots检测鼠尾静脉给予小鼠注射重组人fstl1蛋白或其等体积的pbs组肺组织中ampk(n=5)以及erk(n=5)的磷酸化以及总蛋白的水平(b)。采用westernblots检测提前孵育重组人fstl1蛋白或其等体积的pbs的hpasmcs,在常氧和低氧环境中erk的磷酸化以及总蛋白的水平(c),ampk的磷酸化以及总蛋白的水平(d)。采用mtt观察erk的阻断剂u0126与重组人fstl1蛋白或其等体积的pbs共孵育后hpasmcs的活力(n=3)(e)。采用brdu染色通过流式细胞仪观察erk的阻断剂u0126与重组人fstl1蛋白或其等体积的pbs共孵育后hpasmcs的dna合成水平(n=3)(f)。采用迁移小室观察erk的阻断剂u0126与重组人fstl1蛋白或其等体积的pbs共孵育后hpasmcs的迁移情况(n=3)标尺:50μm(g)。
以上数据表明,fstl1通过降低erk的磷酸化水平抑制低氧所诱导的hpasmcs的增殖和迁移。
实施例8.实施用于检测肺组织、细胞中的fstl1试剂盒制作
(1)试剂盒的制作和操作流程是基于总rna提取、反转录、和real-timepcr等技术。
试剂盒包括:
试剂盒包括:
该引物为下列引物中的一种或多种:
小鼠
fstl1:sense:5’-tccaagatccaggttgattatgatg-3’;
anti-sense:5’-tcgcggttagcttgatagcaga-3’.
gapdh:sense:5’-cggagtcaacggatttggtcgtat-3’;
anti-sense:5’-agccttctccatggtggtgaagac-3’.
人
fstl1:sense:5’-tctgtgccaatgtgttttgtgg-3’;
anti-sense:5’-tgaggtaggtcttgccattactg-3’.
gapdh:5’-gggtgtgaaccatgagaagtatga-3’;
anti-sense:5’-tgctaagcagttggtggtgc-3’。
rna分离液;所述rna分离液由吐温20、三羟甲基氨基甲烷、乙二胺四乙酸、牛血清白蛋白和水组成,其中,浓度如下:吐温20:2.5%;三羟甲基氨基甲烷:50mmol/l;乙二胺四乙酸:1mmol/l;牛血清白蛋白:1%;
pcr反应液,pcr反应液由sybergreenⅰ荧光染料、dna聚合酶、dntps、三羟甲基氨基甲烷盐酸盐、氯化钾、氯化镁和水组成,其中,各物质的浓度如下:dna聚合酶:100u/ml,dntps:0.2mm;氯化镁:6mm;三羟甲基氨基甲烷盐酸盐:16.5mm;氯化钾:89.3mm;
poly(u)聚合酶:100u/ml
逆转录酶:10000u/ml
通用逆转录引物(poly(a):250um/ml
此试剂盒的价值在于:通过fstl1的试剂盒检测,为肺动脉高压的发现及治疗提供参考依据。本发明的创新点在于,发现卵泡抑素样蛋白1对肺动脉高压的保护作用。
sequencelisting
<110>首都医科大学
<120>卵泡抑素样蛋白1对肺动脉高压的保护作用
<130>
<160>8
<170>patentinversion3.3
<210>1
<211>25
<212>dna
<213>人工序列
<400>1
tccaagatccaggttgattatgatg25
<210>2
<211>22
<212>dna
<213>人工序列
<400>2
tcgcggttagcttgatagcaga22
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
cggagtcaacggatttggtcgtat24
<210>4
<211>24
<212>dna
<213>人工序列
<400>4
agccttctccatggtggtgaagac24
<210>5
<211>22
<212>dna
<213>人工序列
<400>5
tctgtgccaatgtgttttgtgg22
<210>6
<211>23
<212>dna
<213>人工序列
<400>6
tgaggtaggtcttgccattactg23
<210>7
<211>24
<212>dna
<213>人工序列
<400>7
gggtgtgaaccatgagaagtatga24
<210>8
<211>20
<212>dna
<213>人工序列
<400>8
tgctaagcagttggtggtgc20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺