1,2,4‑噁二嗪‑5‑酮类化合物以及制备方法与流程
本发明涉及有机合成及医药领域,特别涉及1,2,4-噁二嗪-5-酮类化合物以及制备方法
背景技术:
1,2,4-噁二嗪-5-酮类化合物是一类重要的含氮氧原子的六元杂环化合物,广泛应用于医药领域。研究表明,这类化合物具有很好的生物活性,例如抗菌、杀虫、消炎、抗疟疾、抗结核等。因此,寻找简单便捷的方法来合成1,2,4-噁二嗪-5-酮类化合物不仅可以为新药的研发以及药物的筛选提供更多新的候选分子,也可以为此类药物的合成提供新的方法。
另外,目前合成1,2,4-噁二嗪-5-酮类化合物的方法很少,主要包括氨基肟和α-卤代酰氯(heteiocycles1987,26,163)或者α-卤代羧酸酯(uspatent4154598,1979)的反应,以及α-氨基酰肼和醛的反应(org.lett.2016,18,4210)。但是,这些方法都存在一定的局限性,比如适用范围窄,反应时间长,反应步骤长,操作繁琐,产物收率低,环境污染大等等。因此开发高效,高收率的合成1,2,4-噁二嗪-5-酮类化合物的方法具有很重要的意义。
技术实现要素:
本发明的目的之一,就在于提供一类新的1,2,4-噁二嗪-5-酮类化合物,以便于为新药筛选提供候选分子。
为了实现上述目的,本发明采用的技术方案是这样的:1,2,4-噁二嗪-5-酮类衍生物,其特征在于,所述1,2,4-噁二嗪-5-酮类衍生物具有式(3)的结构:
式(3)中,r选自不同取代基的芳基、杂芳基或烷基,r1选自h、芳基或者烷基,r2选自h、芳基或者烷基,r3为烷基,r4选自烷基或各种不同取代基的芳基。
本发明公开了一类新的1,2,4-噁二嗪-5-酮类衍生物,并且该类化合物通过下述的结构修饰,就可以合成具有抗血管舒张活性的化合物ii,化合物ii活性优于exp-7711(氯沙坦)。
作为优选的技术方案:所述r选自苯基、邻甲基苯基、间甲基苯基、对甲基苯基、邻氯苯基、间氯苯基、对氯苯基、邻溴苯基、间溴苯基、对溴苯基、邻氟苯基、1-萘基、环己基中的一种;优选所述r1、r2选自h、me、et、苯基中的一种;进一步优选所述r3选自苄基,甲基,乙基,叔丁基中的一种;更进一步优选所述r4为苯基。
本发明的目的之二在于:提供一种合成1,2,4-噁二嗪-5-酮类化合物的新方法,以解决上述合成方法中适用范围窄、反应时间、步骤长、操作繁琐、收率低、不环保的问题。
采用的技术路线为:分别称取如式(1)的α-卤代酰胺类化合物、式(2)的硝酮类化合物,然后加入溶剂,置于反应容器中,在0℃~50℃下搅拌反应,最后加入碱,继续搅拌,反应完全后分离纯化得到如下述式(3)的1,2,4-噁二嗪-5-酮类化合物,反应通式如下:
其中,r选自不同取代基的芳基、杂芳基或烷基,r1选自h、芳基或者烷基,r2选自h、芳基或者烷基,r3为烷基,r4选自烷基或各种不同取代基的芳基。
作为优选的技术方案:所述式(1)的α-卤代酰胺类化合物与式(2)的硝酮类化合物的摩尔比为1:1~4:1,进一步优选1.5:1,因为摩尔比小于1.5:1时,收率降低,而摩尔比大于1.5:1时,收率没有提高,且浪费试剂。
作为优选的技术方案:所述(2)的硝酮类化合物的浓度为0.1~0.02mol/l,进一步优选0.05mlo/l,因为在该浓度下反应,收率最高,溶剂用量最少。
作为优选的技术方案,所述反应的温度为室温(25℃左右),因为操作方便。
作为优选的技术方案,所述反应的碱可以为无机碱如碳酸钠,碳酸钾,碳酸铯,磷酸钾,磷酸钠等,也可以为有机碱,如三乙胺,dabco,dbu,二乙胺,二异丙基乙基胺等,进一步优选三乙胺,因为收率最高,且便宜。
作为优选的技术方案,所述反应的碱的用量为硝酮化合物的1~4摩尔当量,进一步优选2摩尔当量,因为收率最高,成本最低。
作为优选的技术方案,所述反应的溶剂选自二氯甲烷、甲苯、乙腈、1,4-二氧六烷、氯仿、三氟乙醇及六氟异丙醇中的一种,进一步优选六氟异丙醇,因为在该溶剂下反应,反应的时间最短,收率最高。
作为优选的方案技术,所述反应的时间为1~15h,进一步优选2h,反应的能耗最低,且收率最高。
与现有技术相比,本发明的优点在于:本发明首次公开了一类新的1,2,4-噁二嗪-5-酮类衍生物及其合成方法,且该类化合物经过简单的结构修饰,就可以得到具有生物活性的药物;并且本合成方法具有反应新颖、合成简捷、操作简单、反应条件温和,收率高,具有原子经济性等优点。
说明书附图
图1为化合物3a的氢谱图;
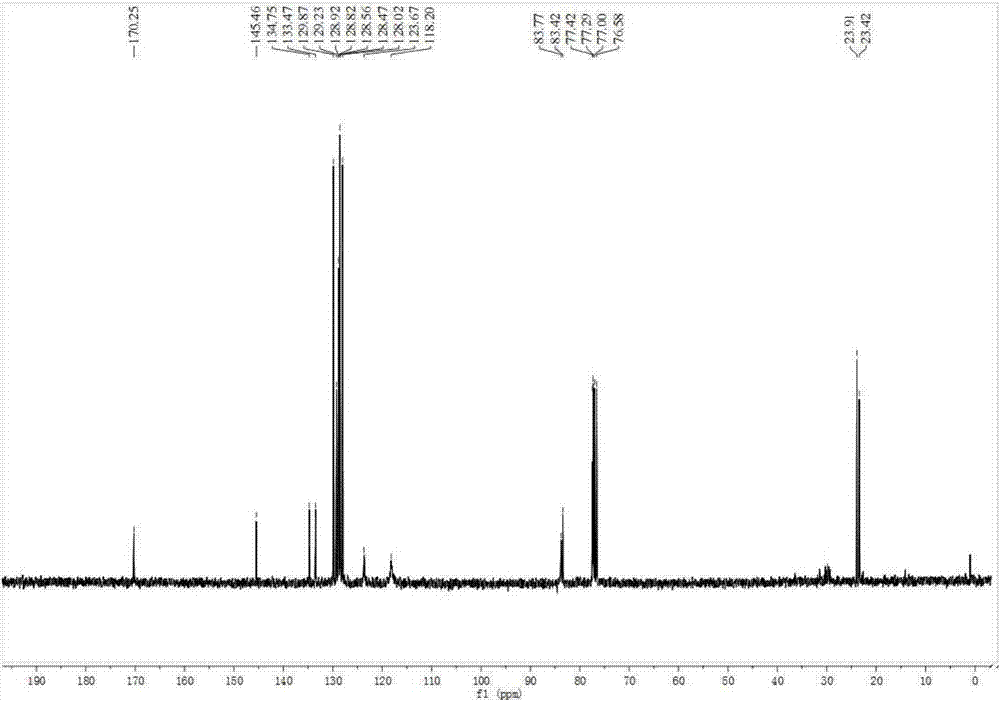
图2为化合物3a的碳谱图;
图3为化合物3a的高分辨质谱图。
具体实施方式
为了充分说明本发明,下面结合施例对本发明进行进一步的说明,但本发明的保护范围并不限于此。
实施例一:合成化合物3a
在一个硬质玻璃管中加入n-(苄氧基)-2-溴-2-甲基丙酰胺(1)(0.12mmol,32.7mg),n-α-二苯硝酮(2)(0.1mmol,19.7mg),以及2ml溶剂,然后加入碱(0.3mmol),反应混合物在室温下搅拌相应时间(tlc监测)。分离纯化得到白色固体3a,其部分反应的结果如表1所示:
表1合成化合物3a反应条件的筛选
所得化合物3a的氢谱(如图1所示)、碳谱(如图2所示)以及质谱(如图3所示)数据如下:
1hnmr(300mhz,cdcl3)δ7.44–7.36(m,3h),7.36–7.23(m,7h),7.19(t,j=7.7hz,2h),6.98(t,j=7.3hz,1h),6.83(d,j=8.2hz,2h),5.65(s,1h),5.18(d,j=10.0hz,1h),4.65(d,j=10.0hz,1h),1.75(s,3h),1.69(s,3h);
13cnmr(75mhz,cdcl3)δ170.25,145.46,134.75,133.47,129.87,129.23,128.92,128.82,128.56,128.47,128.02,123.67,118.20,83.76,83.42,77.29,23.91,23.42;
hrms(esi)calcd.forc24h24n2nao3[m+na]+:411.1679;found:411.1671。
实施例二:合成化合物3b
在一个硬质玻璃管中加入n-(苄氧基)-2-溴-2-甲基丙酰胺(1)(0.12mmol),n-苯基α-4-甲基苯基硝酮(2)(0.1mmol),以及2mlhfip,然后加入三乙胺(0.3mmol),反应混合物在室温下搅拌相应2h(tlc监测),分离纯化得到白色固体3b,收率为97%。
所得化合物3b的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ7.43–7.28(m,5h),7.21–7.08(m,4h),7.05(d,j=8.0hz,2h),6.94(t,j=7.4hz,1h),6.80(d,j=7.8hz,2h),5.59(s,1h),5.14(d,j=10.1hz,1h),4.63(d,j=10.1hz,1h),2.29(s,3h),1.71(s,3h),1.65(s,3h);13cnmr(75mhz,cdcl3)δ170.17,145.53,139.06,134.81,130.46,129.89,128.87,128.75,128.68,128.54,128.44,123.47,117.99,83.47,83.35,77.23,23.89,23.41,21.17;hrms(esi)calcd.forc25h26n2nao3[m+na]+:425.1836;found:425.1830。
实施例三:合成化合物3c
在一个硬质玻璃管中加入n-(苄氧基)-2-溴-2-甲基丙酰胺(1)(4.5mmol),n-苯基α-4-溴代苯基硝酮(2)(3.0mmol),以及2mlhfip,然后加入三乙胺(9.0mmol),反应混合物在室温下搅拌相应2h(tlc监测),分离纯化得到白色固体3c,收率为97%。
所得化合物3c的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ7.55–7.21(m,7h),7.17(t,j=7.9hz,2h),7.07–6.89(m,3h),6.75(d,j=7.8hz,2h),5.52(s,1h),5.14(d,j=10.3hz,1h),4.69(d,j=10.3hz,1h),1.68(s,3h),1.64(s,3h);13cnmr(75mhz,cdcl3)δ170.37,145.17,134.68,132.43,131.20,130.26,129.88,129.01,128.70,128.54,123.84,123.41,117.95,83.58,83.23,77.30,23.88,23.36;hrms(esi)calcd.forc24h23brn2nao3[m+na]+:489.0784;found:489.0773。
实施例四:合成化合物3d
在一个硬质玻璃管中加入n-(苄氧基)-2-溴-2-甲基丙酰胺(1)(0.15mmol),n-苯基α-2-呋喃硝酮(2)(0.1mmol),以及2mlhfip,然后加入三乙胺(0.2mmol),反应混合物在室温下搅拌相应2h(tlc监测),分离纯化得到白色固体3d,收率为98%。
所得化合物3d的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ7.38(s,5h),7.33(s,1h),7.27–7.17(m,2h),6.99(t,j=7.4hz,1h),6.91–6.77(m,2h),6.36–6.21(m,2h),5.73(s,1h),5.17(d,j=10.1hz,1h),4.73(d,j=10.1hz,1h),1.65(s,3h),1.64(s,3h);13cnmr(75mhz,cdcl3)δ169.81,147.66,145.37,142.94,134.65,129.82,128.95,128.64,128.52,123.40,116.79,110.94,110.44,83.42,77.57,76.57,23.69,23.29;hrms(esi)calcd.forc22h22n2nao4[m+na]+:401.1472;found:401.1467。
实施例五:合成化合物3e
在一个硬质玻璃管中加入n-(苄氧基)-2-溴-2-甲基丙酰胺(1)(0.15mmol),n-苯基α-1-萘硝酮(2)(0.1mmol),以及2mlhfip,然后加入碳酸钠(0.2mmol),反应混合物在室温下搅拌相应2h(tlc监测),分离纯化得到白色固体3e,收率为90%。
所得化合物3e的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ7.82(d,j=9.0hz,3h),7.60–7.36(m,3h),7.39–7.16(m,4h),7.08–6.93(m,4h),6.94–6.77(m,3h),6.39(s,1h),5.03(d,j=10.0hz,1h),4.32(d,j=9.9hz,1h),1.87(s,3h),1.66(s,3h);13cnmr(75mhz,cdcl3)δ170.51,145.48,134.59,133.45,132.00,130.12,129.88,129.07,128.73,128.69,128.36,128.25,126.36,125.57,124.86,123.00,121.22,83.27,77.15,23.98;hrms(esi)calcd.forc28h26n2nao3[m+na]+:461.1836;found:461.1818。
实施例六:合成化合物3f
在一个硬质玻璃管中加入n-(苄氧基)-2-溴-2-甲基丙酰胺(1)(0.15mmol),n-苯基α-1-环己基硝酮(2)(0.1mmol),以及2mlhfip,然后加入三乙胺(0.2mmol),反应混合物在室温下搅拌相应2h(tlc监测),分离纯化得到白色固体3f,收率为95%。
所得化合物3f的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ7.54–7.46(m,2h),7.45–7.38(m,3h),7.25–7.16(m,2h),6.91(t,j=7.4hz,1h),6.64(d,j=7.7hz,2h),5.17(d,j=10.7hz,1h),5.03(d,j=10.7hz,1h),4.55(d,j=2.6hz,1h),1.91–1.84(m,2h),1.67–1.61(m,2h),1.55(s,3h),1.53(s,3h),1.51–1.34(m,2h),1.32–1.22(m,j=2.9hz,1h),1.19–0.95(m,4h);13cnmr(75mhz,cdcl3)δ169.45,146.06,135.00,130.10,128.98,128.79,128.64,121.31,114.33,83.23,82.46,76.04,40.35,31.68,29.55,26.50,25.94,25.81,23.66,23.33;hrms(esi)calcd.forc24h30n2nao3[m+na]+:417.2149;found:417.2135。
实施例七:合成化合物3g
在一个硬质玻璃管中加入n-(甲氧基)-2-溴-2-甲基丙酰胺(1)(0.15mmol),n-苯基α苯基基硝酮(2)(0.1mmol),以及2mlhfip,然后加入碳酸钾(0.2mmol),反应混合物在室温下搅拌相应2h(tlc监测),分离纯化得到白色固体3g,收率为90%。
所得化合物3g的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ7.39–7.24(m,5h),7.23–7.13(m,2h),7.01–6.83(m,3h),5.95(s,1h),3.64(s,3h),1.69(s,3h),1.63(s,3h);13cnmr(75mhz,cdcl3)δ170.13,145.42,133.68,129.28,128.85,128.62,128.04,123.67,118.08,83.48,82.83,63.03,24.03,23.15;hrms(esi)calcd.forc18h20n2nao3[m+na]+:335.1366;found:335.1350。
实施例八:合成化合物3h
在一个硬质玻璃管中加入n-(苄氧基)-2-溴(2-氯)丙酰胺(1)(0.15mmol),n-苯基α苯基基硝酮(2)(0.1mmol),以及2mlhfip,然后加入三乙胺(0.2mmol),反应混合物在室温下搅拌相应28h(tlc监测),分离纯化得到白色固体3h,>99:1dr,收率为80%。
所得化合物3h的氢谱、碳谱以及质谱数据如下:
1hnmr(300mhz,cdcl3)δ8.28–8.06(m,1h),7.94(s,1h),7.56–7.28(m,7h),7.21–7.08(m,2h),6.99(t,j=7.4hz,1h),6.73–6.60(m,2h),5.69(s,1h),5.17(d,j=11.1hz,1h),4.94(d,j=11.1hz,1h),4.81(q,j=6.9hz,1h),1.64(d,j=6.9hz,3h);13cnmr(75mhz,cdcl3)δ167.81,147.83,144.30,135.97,134.88,133.99,129.71,129.15,129.09,129.00,128.73,124.30,123.96,123.30,117.29,81.38,77.49,77.48,15.37;hrms(esi)calcd.forc23h21n3nao5[m+na]+:442.1373;found:442.1376。
- 还没有人留言评论。精彩留言会获得点赞!