一种用于房颤易感基因检测的SNP分型试剂盒及其应用的制作方法
本发明涉及一种用于房颤易感基因检测的snp分型试剂盒及其应用,属于生物学领域。
背景技术:
心房颤动(atrialfibrillation,af,简称房颤)是指规则有序的心房电活动丧失,代之以快速无序的颤动波,是当今最常见的持续性心律失常,在人群中的发病率约为1%~2%。目前,全球房颤患病人数达3350万,我国现患病人数已达1000万以上,预计到2060年将增加2倍。房颤严重危害人类健康,有较高的致残率和致死率,可引起脑卒中、心力衰竭、心动过速性心肌病、室性心律失常、血栓栓塞、死亡等严重后果,是二十一世纪亟待解决的心脏疾病领域重大课题之一。
自房颤被发现以来,关于房颤的研究就从未停止过,近十年来,科学界则将研究重心转移到对房颤的遗传学发病机制上来,这些研究为证明房颤为遗传疾病提供了重要的依据,尤其是以大样本研究为依据的全基因组关联分析(gwas)为心房颤动的遗传机制提供了新的思路。在关联分析方面,各研究中心发表了很多与房颤相关的位点,其中与房颤显著相关的主要有染色体4q25上的rs2200733和rs10033464两个位点、kcnn3基因上的rs13376333位点、zfhx3基因上的rs7193343位点、cav1基因上的rs3807989位点、tbx5基因上的rs3825214位点等。
单核苷酸多态性(singlenucleotidepolynorphism,snp)是人类基因组dna序列变异的主要形式,是决定人类疾病(尤其是多基因疾病)易感性和药物反应性差异的核心信息。arms-pcr是newton等首先建立用来检测已知突变的方法。其原理是在dna序列一端的突变处设计两个引物,突变位点位于引物的3'末端,一个相应于正常等位基因序列引物,一个相应于突变基因序列引物,再在dna另一端设计一个共用引物,从而用pcr对突变基因进行检测。目前,用于房颤易感基因检测的方法主要有测序法以及基因芯片法,存在操作复杂、耗时长、成本高等缺点。例如:申请号为201210184474.7,名称为房颤易感基因基因无创检测试剂盒的中国专利,具体涉及dna测序技术,该方法操作步骤繁琐、耗时长、不利于批量检测;申请号为201110338262.5,名称为用于预测迷宫手术治疗房颤疗效的基因芯片的中国专利,具体涉及基因芯片技术,该方法虽能检测多个房颤相关snp位点,但涉及dna提取及多次pcr扩增,操作步骤较多。
房颤,尤其是孤立性房颤的发病存在明显的家族聚集性。除了家族性房颤外,人群中散发的房颤患者存在一定的遗传易感性。因此,深入了解房颤的分子遗传学机制将有助于对这一疾病的预防和诊治。房颤给患者和社会带来的巨大健康和经济负担,使得我们越来越意识到对房颤前期筛查、早期预防和有效治疗的重要性和迫切性;越来越意识到只有从发生机制上深入认识房颤,才能更好地防治房颤。
技术实现要素:
本发明提供一种用于房颤易感基因检测的snp分型试剂盒及其应用,该试剂盒具有特异性强、灵敏度高、操作简单、耗时短、通量高可实现批量检测等诸多优点;该试剂盒不仅可以快速检测出待测者的房颤易感基因型,还可以从基因水平上评估待测者的房颤遗传易感性,为房颤的预防提供一定的指导意见。
为解决上述技术问题,本发明所采用的技术方案如下:
一种用于房颤易感基因检测的snp分型试剂盒,包括如下易感基因的6个snp位点的引物:kcnn3基因上的rs13376333位点、zfhx3基因上的rs7193343位点、cav1基因上的rs3807989位点、tbx5基因上的rs3825214位点、4q25上的rs2200733和rs10033464两个位点。
该试剂盒在基因水平上评估待测人群对于房颤的易感性,可用于评估健康人群患房颤的风险,并为房颤患者的诊断和治疗提供一定的指导意见。
为了简化操作,同时保证检测的准确性,所有的引物是作为一组进行标记的。
上述引物中每个位点都包含两条非标记引物和一条共用引物,其中共用引物是有荧光标记的。
为了提高检测的灵敏度,6个snp位点的引物序列是:
rs13376333,非标记引物seqidno.1-2,共用引物,seqidno.3;
rs7193343,非标记引物seqidno.4-5,共用引物,seqidno.6;
rs2200733,非标记引物seqidno.7-8,共用引物,seqidno.9;
rs3807989,非标记引物seqidno.10-11,共用引物,seqidno.12;
rs3825214,非标记引物seqidno.13-14,共用引物,seqidno.15;
rs10033464,非标记引物seqidno.16-17,共用引物,seqidno.18;
seqidno.1引物序列为:atatgagaacttaaatggcattgtcatata;
seqidno.2引物序列为:agaacttaaatggcattgtcagagg;
seqidno.3引物序列为:gctgagtgtgtgcagatgg;
seqidno.4引物序列为:atatggaaagtttgaacagcttgttga;
seqidno.5引物序列为:ggaaagtttgaacagcttgtgtg;
seqidno.6引物序列为:agtccagagtccagggca;
seqidno.7引物序列为:ggtacttgggttttgattttgagc;
seqidno.8引物序列为:atatggtacttgggttttgattttgctt;
seqidno.9引物序列为:attcacaggcttccctctacca;
seqidno.10引物序列为:gtttggtaacactcaacatccaca;
seqidno.11引物序列为:atatatttggtaacactcaacatcatcg;
seqidno.12引物序列为:ccatctctcgcgtccaca;
seqidno.13引物序列为:ggctaacaccaccagtcca;
seqidno.14引物序列为:atatgggctaacaccaccagtaag;
seqidno.15引物序列为:tagaaagagacagaaagatgaggaaaga;
seqidno.16引物序列为:tctttttttacattgttagagtcaagaagg;
seqidno.17引物序列为:atattctttttttacattgttagagtcaaggaat;
seqidno.18引物序列为:tttttgttgtgcttttttatacaagggtta。
为了简化操作,同时保证检测的准确性和效率,所有的共用引物是有荧光标记的。
上述引物中,共用引物均采用同色(fam、hex、tamra或rox)荧光素进行标记,且荧光标记的引物之间留有14个碱基以上的间隔,避免未知大小等位基因造成的扩增越界。
进一步优选,共用引物的荧光标记为fam色标记、hex色标记、rox色标记或tamra色标记。
为了保证检测的灵敏度,引物在扩增体系中的终浓度分别为:seqidno.1为0.25μm,seqidno.2为0.28μm,seqidno.3为0.3μm,seqidno.4为0.5μm,seqidno.5为0.6μm,seqidno.6为0.55μm,seqidno.7为0.35μm,seqidno.8为0.45μm,seqidno.9为0.4μm,seqidno.10为0.8μm,seqidno.11为0.75μm,seqidno.12为0.9μm,seqidno.13为0.3μm,seqidno.14为0.35μm,seqidno.15为0.5μm,seqidno.16为0.55μm,seqidno.17为0.35μm,seqidno.1为0.5μm。
上述用于房颤易感基因检测的snp分型试剂盒的应用,包括如下步骤:
(1)从生物检材提取基因组dna,作为dna模板;或直接以血滤纸或唾液卡为模板,无需提取;
(2)配制pcr反应液,加入反应混合物、热启动taq酶、引物混合物、dna模板和超纯水,采用三步扩增法,对待检测的多态性snp位点进行pcr扩增;
(3)对扩增产物进行荧光凝胶电泳检测和基因分型。
上述将arms-pcr与毛细管电泳技术相结合运用于房颤易感基因的检测,具有特异性强、灵敏度高、操作简单快速、通量高、可进行批量检测等诸多优点。
为了进一步提高检测的灵敏性和准确性,步骤(2)中,pcr的扩增包括:(1)预变性:95℃,3min;(2)热循环:94℃,15s,60℃,1min,共30个循环;(3)终延伸:72℃,10min;(4)保温4℃。
上述步骤(1)中,基因组dna的提取方法可以为磁珠法或chelex-100法。
步骤(1)中,提取后的dna溶液经简单定量后稀释到合适的浓度;步骤(1)中,生物检材为血液、毛发、唾液或脱落细胞;步骤(2)中,采用将6个snp位点的引物混合物混于一管中进行pcr扩增。
上述步骤(3)中,可以在管中加入去离子甲酰胺、分子量内标;内标的作用是用于电泳过程中的内标指示。
本发明未提及的技术均参照现有技术。
本发明的用于房颤易感基因检测的snp分型试剂盒,首次将多个房颤易感基因进行集中检测,且初次将arms-pcr技术和荧光凝胶电泳技术相结合运用该检测中,检测结果即是房颤易感基因的分型结果;一次实验即可同时检测6个房颤相关的snp位点,并同时得到分型结果;操作方法简单、准确性强、灵敏度高,可将非特异性扩增产物、引物二聚体等产物分离,最大程度降低假阳性;可将样本检测时间缩短至2.5个小时以内,且利于大批量检测;应用本发明的试剂盒对相关人群进行房颤易感基因的检测,检测结果不仅可以评估待测者的房颤易感性,而且可以为房颤的预防提供一定的指导意见。
附图说明
图1:基因分型标准物的电泳图谱;
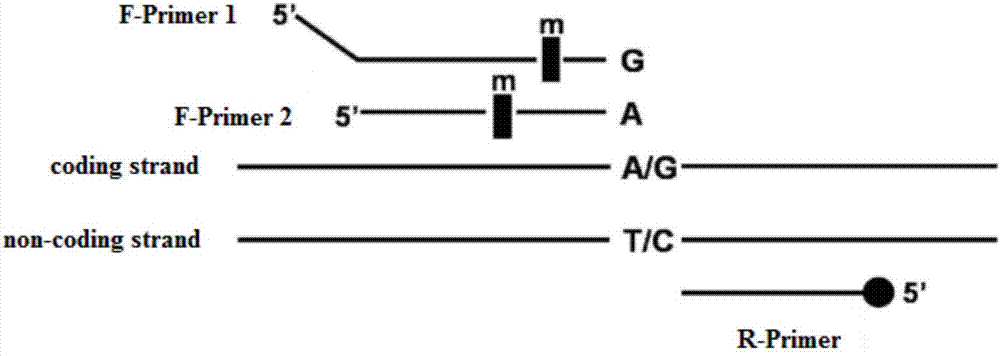
图2:多态性位点对应引物设计示意图(f-primer1:正向引物1;f-primer2:正向引物2;codingstrand:编码链;non-codingstrand非编码链);
图3:实施例中患者1、患者2和患者3的电泳图;
图4:实施例中患者4、患者5和患者6的电泳图。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。
实施例1:
引物的设计、浓度的优化以及反应体系的建立:
1.引物的设计及筛选
1.1序列下载
本发明所述的6个snp位点的基因序列均下载自ncbigenebank,具体的序列信息见下表(表1)。其中rs13376333位点的等位基因t为野生型,等位基因c为突变型(易感型);rs7193343位点的等位基因t为野生型,等位基因c为突变型(易感型);rs2200733位点的等位基因c为野生型,等位基因t为突变型(易感型);rs3807989位点的等位基因a为野生型,等位基因g为突变型(易感型);rs3825214位点的等位基因a为野生型,g为突变型(易感型);rs10033464位点的等位基因g为野生型,等位基因t为突变型(易感型)。
表1snp序列信息
1.2引物设计
确定好各snp位点的基因序列和等位基因类型后,利用oligo6.0进行引物的设计。每个snp共设计三条引物,pcr产物大小均在270bp以内,其中一条共用引物的5’端用荧光素标记(实施例中选用的是fam色荧光素),另外两条非标记引物的3’端最后一个碱基对等位基因模板进行特异识别,两条非标记引物的其中任一条5’端引入4~6个和模板不配对核苷酸(实施例中使用atat或atatat,对引物tm值影响较小)用于指示等位基因,由于两条非标记引物长度不同导致扩增产物长度不同,电泳迁移率不同,最终达到检测的目的。
引物设计的原理如图2所示,除遵循普通引物的设计原则外,为增加两条非标记引物的特异性,在距离引物3’端2~5个碱基处人为地引入错配碱基,引入错配的原则为:若3’端为弱错配(a-c,g-t),则引入强错配(a-g,c-t);若3’端为中错配(a-a,g-g,c-c,t-t),则引入中错配;若3’端为强错配,则引入弱错配。本发明所用引物均按此规则进行设计,为了后续引物浓度的优化,在此设计的引物tm值均在58~62℃之间。
1.3引物筛选
实施例中所有引物均由生工生物工程(上海)有限公司合成,筛选引物所用的模板均为经子渊司法鉴定所医学检验部测序成功并确定基因型的个体。
在筛选引物的过程中发现:若严格按照引物的设计原则来引入错配碱基,引物的扩增效果并一定如愿,甚至会出现特异性过强而得不到扩增结果的情况,例如,rs3807989位点的易感型引物在3’端的第三位引入强错配时会出现特异性过强而扩增不出模板的情况,而将3’端第二位的强错配碱基改为中错配时扩增效果却很好。另外,本发明经过多次实验反复摸索还发现:人为引入错配碱基距离3'端的位置不同引物的特异性也不同,所以人为引入错配碱基的类型和位置要视具体情况而定,不能完全按照引入错配原则,且必须经过多次试验验证才行。
本发明引物筛选的具体方法如下:
(1)引物的单基因座扩增
将合成好的每对引物(一条标记引物和两条非标记引物)稀释成1μm进行扩增试验,观察有无非特异性扩增峰,以及扩增效率如何。若有非特异性扩增峰则进行缺失排查实验,找出产生非特异性扩增峰的引物并更改。
(2)引物的单色复合扩增
将确定好的单基因座引物组成复合引物进行扩增实验,观察有无非特异性扩增峰,以及引物混合后扩增效率如何。若有非特异性扩增峰则进行缺失排查实验,找出产生非特异性扩增峰的引物并更改。
实施中引物单基因座扩增测试结果较好,均无非特异性扩增峰出现。而在引物单色复合扩增测试时发现:当6个snp位点的引物组成引物混合物时扩增会出现一条非特异性峰,大小为150bp左右,故对fam色的引物依次进行去缺失实验。结果表明:当fam色所有引物均加而缺失rs10033464位点的标记引物时,非特异性扩增峰消失,故更改了rs10033464位点的标记引物,后测试发现非特异性扩增峰消失。
本发明对这6组引物进行了多次更改和反复测试,在保证引物的特异性和扩增效率的情况下最终确定了各snp位点的引物序列,具体的引物信息见表2。
表2各snp位点引物序列
表2中“f1-primer”均指等位基因特异性引物扩增时相应位点的野生型,“f2-primer”均指等位基因特异性引物扩增时具体位点的突变型(易感型),“r-primer”均指相应位点5’末端荧光素标记的共用引物。在上述引物中,每个snp位点均有两条等位基因特异性非标记引物(非标记引物近3'端的小写字母为人为引入的错配碱基),分别用于扩增野生型和突变型(易感型)碱基序列,而每个位点的共用引物,用于和等位基因特异性非标记引物形成配对,使目标碱基序列能够得到扩增。
在确定两色荧光组合方案的基础上,通过大量试验,确定了上述6个snp位点的组合方式和荧光标记类型。结合生产成本、荧光效率以及产物扩增百分比等因素后,将6个snp位点的引物组成一组,各位点的共用引物均用fam荧光素进行标记,分子量内标使用橙色的荧光染料(美国应用生物系统公司生产的liz500)进行标记。
1.4引物浓度的优化
为了使各snp位点在扩增时达到基本一致的扩增峰值,在确定各位点的引物序列后,对引物的浓度进行了优化。具体方法如下:(1)首先将所有的引物组成引物混合物使其在扩增体系中的终浓度为0.2μm,然后对人基因组dna进行pcr扩增;(2)将步骤(1)中的扩增产物进行荧光凝胶电泳检测,根据检测的峰高比例调整各引物的加量,选择峰高在2000rfu左右的引物浓度做为优选。经过多次引物浓度微调实验,最终确定了各位点引物在复合扩增体系中的最适浓度,具体的引物浓度见表3:
表3各snp位点引物在扩增体系中的终浓度
1.5扩增及产物检测的实验过程
(1)扩增体系
首先在冰上完成除模板外的pcr反应体系的配制,最后加入扩增模板;提取基因组dna时,先用紫外分光光度计nanodrop(美国热电公司)测量浓度,再稀释使其终浓度在0.5~1ng/μl左右,在实际操作中,一般取1~2μl的dna模板进行扩增。体系中各组分的加样量如下表所示。
表4试剂盒扩增体系
其中所述的反应混合物(reactionmix)为mgcl27.5mm,tris-hclbuffer125mm,kcl125mm,dntps7.5mm,bsa2mg/ml,热启动taq酶为宝生物工程(大连)有限公司的hstaqdna聚合酶。
(2)扩增程序
上述体系配制好后立即用掌式离心机离心,后将其置于热循环仪上,选择表5的程序进行扩增,扩增后的产物应立即进行荧光凝胶电泳检测或是避光保存。
表5试剂盒扩增程序
(3)扩增产物在遗传分析仪上荧光检测
由去离子甲酰胺与试剂盒中分子量内标liz-500(美国应用生物系统公司)组成上样混合物(按体积比9.5:0.5混合)。将10μl上样混合物与1μl扩增产物混合,离心,避免产生气泡。95℃变性3分钟,冰浴3分钟,用遗传分析仪3100(美国应用生物系统公司)检测分析。
实施例2:
等位基因分型标准物的制备:
本实施例中选取经子渊司法鉴定所医学检验部测序成功并确定基因型的患者,选出各snp位点不同基因型的个体,分别用rs13376333、rs7193343、rs2200733、rs3807989、rs3825214和rs10033464位点的引物进行扩增,其中,野生型的个体用野生型的引物,突变型的个体用突变型的引物进行扩增。引物序列见表2。
(1)扩增体系
首先完成除模板外的pcr反应体系的配制,最后加入扩增模板;提取基因组dna时,先用紫外分光光度计测量浓度,再稀释使其终浓度在0.5~1ng/μl左右,在实际操作中,一般取1~2μl的dna模板进行扩增。体系中各组分的加样量如表4所示。
(2)扩增程序
上述体系配置好后立即用掌式离心机离心,后将pcr管置于热循环仪上,选择表5的程序进行扩增,扩增后的产物应立即进行荧光凝胶电泳检测或是避光保存。
(3)扩增产物在遗传分析仪上荧光检测
由去离子甲酰胺与试剂盒中分子量内标liz-500(美国应用生物系统公司)组成上样混合物(按体积比9.5:0.5混合)。将10μl上样混合物与1μl扩增产物混合,离心,避免产生气泡。95℃变性3分钟,冰浴3分钟,用遗传分析仪3100(美国应用生物系统公司)检测分析。
(4)分型分析
用片段分析软件
(5)等位基因分型标准物的组配
根据各snp位点的等位基因扩增峰高比例,峰高的少加,峰低的多加,把各等位基因扩增产物混合,组成等位基因分型标准物。再次电泳检测,检测图如附图1。各snp位点的等位基因组成见下表。
表6各snp位点等位基因的组成
实施例3:
试剂盒的使用及验证
本实施例选取6例经子渊司法鉴定所医学检验部测序成功并确定基因型的患者。运用本发明的试剂盒对上述6例患者进行snp基因型的检测。6例患者的编号分别为c1、c2、c3、c4、c5和c6,具体的检测方法如下:
(1)扩增体系
首先完成除模板外的pcr反应体系的配制,最后加入扩增模板;提取基因组dna时,先用紫外分光光度计测量浓度,再稀释使其终浓度在0.5~1ng/μl左右,在实际操作中,一般取1~2μl的dna模板进行扩增。体系中各组分的加样量如表4所示。
(2)扩增程序
上述体系配置好后立即用掌式离心机离心,后将pcr管置于热循环仪上,选择表5的程序进行扩增,扩增后的产物应立即进行荧光凝胶电泳检测或是避光保存。
(3)扩增产物在遗传分析仪上荧光检测
由去离子甲酰胺与试剂盒中分子量内标liz-500(美国应用生物系统公司)组成上样混合物(按体积比9.5:0.5混合)。将10μl上样混合物与1μl扩增产物混合,离心,避免产生气泡。95℃变性3分钟,冰浴3分钟,用遗传分析仪3100(美国应用生物系统公司)检测分析。
(4)分型分析
用片段分析软件
表7本试剂盒对6例患者检测的基因型
根据上述实施例的结果,我们可以看出运用本发明的试剂盒可以准确的检测出患者的房颤易感基因型,且检测结果准确可靠、操作方法简单、一次实验即可完成6个snp位点的检测,同时得到相应位点的基因型。目前,国内外对于房颤治疗药物方面的研究较多,鲜少有从基因水平上去探讨房颤的产生机制及致病机理的,本发明从基因水平上去分析房颤的遗传易感性,检测结果不仅可以评估健康人群患房颤的风险,还可以为房颤患者的治疗提供一定的指导意见。
- 还没有人留言评论。精彩留言会获得点赞!