人FSH的重组表达载体、重组细胞株及重组人FSH的制备方法与流程
本发明涉及生物技术领域,特别涉及人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法。
背景技术:
促卵泡激素(fsh)是一种由脑垂体合成并分泌的激素,属于糖基化蛋白质激素,因最早发现其对女性卵泡成熟的促进作用而得名。后来的研究表明,促卵泡激素在男女两性体内都是很重要的激素之一,调控着发育、生长、青春期性成熟、以及生殖相关的一系列生理过程。促卵泡激素和黄体生成素在生殖相关的生理过程中协同发挥着至关重要的作用。
促卵泡激素(fsh),分子量约为42kda,由二个非共价结合的具有高度亲和力的多肽亚单位组成。在一定条件下,fsh可解离为α亚单位和β亚单位。fsh的α亚单位与其他促性腺激素具有相同的氨基酸序列,而β亚单位的氨基酸序列却是fsh所特有的与之不同,具决定fsh有独特的生物学及免疫学活性。因此,fsh所呈现的活性形式是由β亚单位所决定的。
fsh按来源不同分为三大类,第一类从绝经妇女的尿液中提取出来的尿源促卵泡激素;第二类是从下丘脑垂体中纯化得到的垂体促卵泡激素;第三类是通过dna重组技术,用真核细胞表达的重组人促卵泡激素(rhfsh)。人促卵泡激素最初是从垂体腺细胞中提取获得,但因为人脑组织极不容易获得,所以无法用于药品。后来在1993年经由绝经妇女尿液提取的尿源促卵泡激素作为药品上市,用于辅助治疗不孕不育(u-fshhp,商品名:metrodin-hp,serno)。但尿源促卵泡激素一般含有黄体生成素(lh)杂质,并且杂质含量越高药品副作用越大。由于黄体生成素和促卵泡激素的蛋白性质高度相似,尿源促卵泡激素很难去除黄体生成素或控制其含量。再加上尿源质量难以控制,尿源蛋白本身生物活性不高,纯化工艺难度大,尿源促卵泡激素一直存在着批间差大、质量不稳定的问题。1998年瑞士serno公司首先推出了重组人促卵泡激素。后来2004年荷兰organon公司也推出了重组人促卵泡激素。重组人促卵泡素(rhfsh)通过基因工程方法构造出可以持续分泌表达重组人促卵泡素的中国仓鼠卵巢细胞(cho)细胞系,并通过大规模发酵培养这种细胞生产重组人促卵泡素。由于用于生产重组人促卵泡素的细胞系具有良好的均一性,细胞发酵工艺高度可控,而且工艺流程中完全不含有尿源中黄体生成素(lh),大大提高了药品质量,降低了副作用,提高了安全性。
国内厂家促卵泡激素已上市的产品,除2015年长春金赛推出的重组促卵泡激素外均为尿源产品,且目前国内产品市场占有率较高的是丽珠制药所生产的尿源产品。丽珠集团在2005年推出之后增势迅猛,进口尿源产品metrodin-hp在2009年之后完全退出该市场。近几年伊伯萨(ibsa)的尿促卵泡素抢占了部分丽珠的份额。2015年长春金赛新推出的重组产品目前市场状况未知。
在设计和构造重组人fsh细胞系时,能正确的表达fshα和β两条多肽,并使它们形成正确的异源二聚体是构造其细胞系的核心和技术难点。一般生产重组异源二聚体蛋白的方法有如下几种:
1)构建两条细胞株分别表达α和β两条多肽并在细胞外使它们形成异源二聚体。理论上这种方法通过单独表达和纯化α和β两条多肽,能精准的调整它们的摩尔比例,有可能在质控条件下使它们形成异源二聚体。但因为分开表达的蛋白一般不能正确折叠,或者稳定性不佳,所以在现实中这种方法一般难以实现。
2)在细胞的基因组中同时插入两个表达载体或在同一载体中使用两个启动子分别表达α和β两个亚基。使用这种方法α和β两个亚基将在同一个细胞内表达,并通过宿主细胞内的辅助蛋白形成正确的异源二聚体。目前已经上市的重组促卵泡激素药物都是使用这种方法生产的。但是因为这种方法使用两个启动子分别表达α和β两个亚基,难以控制两个亚基在细胞内的表达量的完全一致,并且在构建时如果使用两个质粒,会进一步降低细胞的稳定性甚至出现单一链不表达的情况。在生产时,表达量高的亚基不能形成异源二聚体,游离在样品原液中,因其性质相似不容易通过纯化手段去除,影响药品质量。
3)通过使用内部核糖体进入位点(internalribosomeentrysite,ires)序列构建单一载体,使α和β两个亚基受同一个启动子控制在共同转录在同一个mrna分子上,并通过ires片段启动翻译第二个蛋白。但ires序列本身的生物学特性使得它在启动翻译mrna第二个蛋白的效率要远低于第一个蛋白。已发表的文献测得第二个蛋白的翻译效率只有第一个蛋白的20%。
4)使α和β两个亚基以融合蛋白的形式表达。这种方法解决了其它方法α和β两个亚基表达不均匀的问题,也能大量表达有生物活性的促卵泡激素。但主要问题是连接两个亚基的连接蛋白序列(linker)通常具有免疫源性。在进入人体内后,人可能产生针对此段链接序列的中和抗体,并最终产生耐药性,影响药品的重复使用。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法,本发明提供的重组人促卵泡激素(rhfsh)表达载体为分泌型表达载体,该载体进入细胞可稳定、高效表达具有天然活性的重组人fsh。
本发明提供了一种表达人fsh的重组表达载体,包括以下元件:启动子、β球蛋白基因内含子、alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因;所述自体切割肽序列包括蛋白切割酶furin识别位点和2a序列。
本发明实施例中,
所述启动子为cmv启动子、pgk启动子、rsv启动子或sv40启动子;
所述alpha链的分泌信号肽为signalhmm34分泌信号肽、人或鼠igkappa链分泌信号肽或人白介素2的分泌信号肽;
所述beta链的分泌信号肽为signalcystatins分泌信号肽、人或鼠igkappa链分泌信号肽或人白介素2的分泌信号肽;
所述2a序列为p2a序列、e2a序列、f2a序列或t2a序列。
所述筛选标记基因为二氢叶酸还原酶基因、谷氨酰胺合成酶基因、新霉素抗性基因、博来霉素抗性基因或潮霉素抗性基因。
一些具体实施例中,所述自体切割肽序列如seqidno.4所示,包括蛋白切割酶furin识别位点和p2a序列。
一些具体实施例中,所述alpha链的分泌信号肽为signalhmm34分泌信号肽,序列如seqidno.2所示;
所述人fshα基因序列如seqidno.3所示;
所述beta链的分泌信号肽为signalcystatins分泌信号肽,序列如seqidno.5所示;
所述人fshβ基因序列如seqidno.6所示。
一些具体实施例中,所述启动子为cmv启动子;
所述β球蛋白基因内含子序列如seqidno.1所示,
所述内部核糖体进入位点序列如seqidno.7所示。
所述筛选标记基因为二氢叶酸还原酶基因。
一些具体实施例中,所述元件的连接顺序为:
启动子—β球蛋白基因内含子—alpha链的分泌信号肽—人fshα基因—自体切割肽序列(furin-p2a)—beta链的分泌信号肽—人fshβ基因—内部核糖体进入位点序列—筛选标记基因;或
启动子—β球蛋白基因内含子—beta链的分泌信号肽—人fshβ基因—自体切割肽序列(furin-p2a)—alpha链的分泌信号肽—人fshα基因—内部核糖体进入位点序列—筛选标记基因。
上述重组表达载体中,所述启动子驱动人fsh基因和筛选标记基因的共表达;所述β球蛋白基因内含子,简称bgi,可增强人fsh基因的转录效率,还可促进mrna从细胞核转移到内质网;所述furin-p2adna序列,可以将先以融合蛋白形式表达的fshα链和β链蛋白切割成两条多肽,并且基于furin位点剪切掉剩余的p2a序列;所述内部核糖体进入位点,简称ires,可招募核糖体对mrna进行翻译,因此可调控其下游筛选标记基因的表达。
本发明提供的重组表达载体的构建方法,其特征在于,在含有启动子和β球蛋白基因内含子的起始构建载体上插入:alpha链的分泌信号肽、人fshα基因、自体切割肽序列(furin-p2a)、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因;所述自体切割肽序列包括蛋白切割酶furin识别位点和2a序列。
一些具体实施例中,所述含有启动子和β球蛋白基因内含子的起始构建载体为pcmv-mcs载体。
一些具体实施例中,所述“alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因”的插入位点为pcmv-mcs载体的bamhi酶切位点与bglii酶切位点之间。
本发明还提供了一种重组细胞,所述细胞内含有本发明提供的重组表达载体;或者所述细胞的基因组中整合有以下元件:启动子、β球蛋白基因内含子、alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因;所述自体切割肽序列包括蛋白切割酶furin识别位点和2a序列。
本发明中,真核细胞为人hek293细胞、中国仓鼠cho细胞、cos细胞、mdck细胞或vero细胞。
一些实施例中,真核细胞为人hek293细胞。
本发明提供的重组细胞的构建方法为:以本发明提供的重组载体转染hek293细胞。
所述转染采用磷酸钙共沉淀法。
转染细胞后,以mtx进行筛选,然后使阳性细胞适应无血清培养基。
本发明还提供了一种重组人fsh的制备方法,培养本发明提供的重组细胞获得含有重组人fsh的培养上清液。
本发明实施例中,培养的培养基为无血清培养基。
所述无血清培养基为freestyle293无血清培养基。
本发明实施例中,所述培养的条件为摇瓶培养。
所述培养的细胞起始密度为0.5×106细胞/ml。
所述培养的温度为37℃,条件为5%co2浓度80%饱和湿度,时间为7天。
本发明制备的重组人fsh,其氨基酸序列如seqidno.8所示;其中,fshα链序列如seqidno.9所示,fshβ链序列如seqidno.10所示。
本发明提供了人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法,该表达载体为分泌型表达载体,与宿主细胞基因组的整合效率较高,包含该重组表达载体的重组细胞株分泌表达fsh蛋白的效率也较高,其分泌效率大于10pg/细胞/天;
另外,本发明重组表达载体hcga-furin-p2a-fshb融合蛋白设计,再通过p2a序列自切割以及宿主细胞furin酶对融合蛋白中furin位点的修饰,最后形成hcga和fshb的异质二聚体,使两个蛋白亚基在理论上以摩尔数1比1表达。
并且本发明表达载体用采用一个启动子同时诱导fsh基因和筛选标记基因转录、并使用ires启动后者翻译的方式,使得细胞耐药性和表达量高度统一,因此,当使用该重组表达载体转染宿主细胞时,筛选出阳性表达细胞株的概率较大,所得重组表达细胞株在筛选条件下可持续、稳定表达fsh蛋白,细胞系经多次传代后,仍能高效表达fsh蛋白。
附图说明
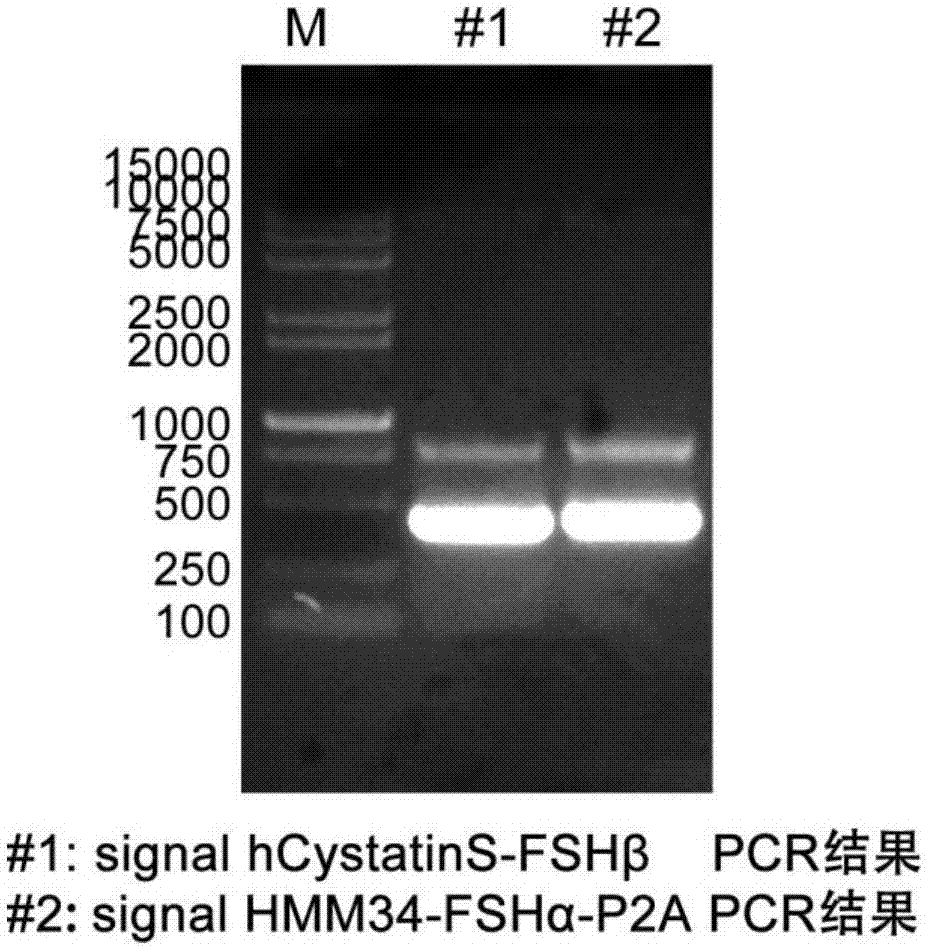
图1示fshα及fshβpcr结果胶图;
图2示fshα及fshβ添加signalpcr结果胶图;
图3示重组质粒pcmv-fsh的结构示意图;
图4示重组质粒pcmv-fsh的酶切鉴定图;
图5示重组质粒pcmv-fsh-ires-dhfr的结构示意图;
图6示本发明fsh重组细胞株westernblot图,可以看出存在fshα、β两条链;
图7示本发明fsh重组细胞株考马斯亮蓝染胶图,fsh两条条带分别在大约23kd的位置。
具体实施方式
本发明提供了人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供了一种表达人fsh的重组表达载体,包括以下元件:启动子、β球蛋白基因内含子、alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因;所述自体切割肽序列包括蛋白切割酶furin识别位点和2a序列。
本发明实施例中,
所述启动子为cmv启动子、pgk启动子、rsv启动子、sv40及其他已经在文献发表的或常用于生物实验的启动子中的任意一种。
所述fshalpha蛋白链(cga)使用的分泌效率更高的分泌信号肽包括但不限于本例中使用的signalhmm34分泌信号肽以及其它已经在文献发表的或常用于生物实验的分泌信号肽,如人或鼠igkappa链分泌信号肽、人白介素2的分泌信号肽。
所述fshbeta链(fshb)使用的分泌效率更高的分泌信号肽包括但不限于本例中使用的signalcystatins分泌信号肽以及其它已经在文献发表的或常用于生物实验的分泌信号肽,如人或鼠igkappa链分泌信号肽、人白介素2的分泌信号肽。
所述用于连接fshalpha链(cga)和fshbeta链(fshb)基因序列的furin-p2adna序列包括但不限于furin-p2a、furin-t2a、furin-e2a、furin-f2a中的任意一种。
所述筛选标记基因为二氢叶酸还原酶基因、谷氨酰胺合成酶基因、谷氨酰胺合成酶基因、新霉素抗性基因、博来霉素抗性基因、潮霉素抗性基因、多色霉素抗性基因或其他常用于细胞筛选的抗性基因中的任意一种。
本发明在一个载体上通过特殊设计的自体切割肽序列(记为furin-2a)使α和β先以融合蛋白的形式被翻译出来。这个融合蛋白中的α和β亚基此时会按照正确异源二聚体结构折叠。之后连接α和β两个亚基的含有蛋白水解酶位点的furin-2a通过自我剪切和细胞内的蛋白水解酶修饰后被切开成α和β两个亚基,变成独立的两个多肽。此种方法表达的重组fsh拥有高度一致的亚基表达量。
本发明中使用的连接肽链furin-2a由两部分构成:1)2a肽链和2)furin蛋白酶切割位点(rakr)。
furin蛋白酶是一种外泌途径中主要的蛋白质水解酶,定位于高尔基体外侧的囊泡中。furin催化切割原蛋白中的arg-xaa-yaa-arg羧基端肽键(xaa为任意一种氨基酸,yaa为arg或lys)产生成熟的蛋白质。本例中连接在p2a序列前插入的furin酶切位点可以使工程细胞系中的furin蛋白切除fshalpha亚基c端残留的2a序列,避免了2a序列在体内可能引起的免疫源性。
一些具体实施例中,所述自体切割肽序列如seqidno.4所示,包括蛋白切割酶furin识别位点和p2a序列。
p2a肽(2apeptide)是一种可“自我剪切”的短小肽链,最初在手足口病毒(foot-and-mouthdiseasevirus,fmdv)中发现,平均长度为18-22个氨基酸。p2a肽可在蛋白翻译时通过核糖体跳跃从自身最后2个氨基酸间c末端断裂(defelipeetal.2003)。甘氨酸和脯氨酸之间的肽链结合群在2a位点是受损的,能引发核糖体跳跃而从第2个密码子开始翻译,从而使1个转录单元里2个蛋白独立表达。这种2a介导的剪切广泛存在于所有的真核动物细胞当中。因此,利用2a肽较高的剪切效率及促使上下游基因平衡表达的能力,可以改进异源多聚蛋白,如细胞表面受体、细胞因子、免疫球蛋白等的表达效率。
为提高蛋白分泌的效率,本发明改变了fshα链和β链的分泌信号肽,α链的分泌信号肽为signalhmm34,β链的分泌信号肽为signalcystatins。另外在β链上添加的分泌信号肽,可以使β亚基在从mrna翻译成蛋白时,通过检测分泌信号肽去除残留的2a氨基酸,使最后表达出的β亚基和天然蛋白一致。
一些具体实施例中,所述alpha链的分泌信号肽为signalhmm34分泌信号肽,序列如seqidno.2所示;
所述人fshα基因序列如seqidno.3所示;
所述beta链的分泌信号肽为signalcystatins分泌信号肽,序列如seqidno.5所示;
所述人fshβ基因序列如seqidno.6所示。
一些具体实施例中,所述启动子为cmv启动子;
所述β球蛋白基因内含子序列如seqidno.1所示,
所述内部核糖体进入位点序列如seqidno.7所示。
所述筛选标记基因为二氢叶酸还原酶基因。
所述cmv启动子的核苷酸序列如seqidno.23所示;二氢叶酸还原酶基因(dhfr基因)的核苷酸序列如seqidno.24所示。
一些具体实施例中,所述元件的连接顺序为:
启动子—β球蛋白基因内含子—alpha链的分泌信号肽—人fshα基因—自体切割肽序列furin-p2a—beta链的分泌信号肽—人fshβ基因—内部核糖体进入位点序列—筛选标记基因;或
启动子—β球蛋白基因内含子—beta链的分泌信号肽—人fshβ基因—自体切割肽序列furin-p2a—alpha链的分泌信号肽—人fshα基因—内部核糖体进入位点序列—筛选标记基因。
上述重组表达载体中,所述启动子驱动人fsh基因和筛选标记基因的共表达;所述β球蛋白基因内含子,简称bgi,可增强人fsh基因的转录效率,还可促进mrna从细胞核转移到内质网;所述furin-p2adna序列,可以将先以融合蛋白形式表达的fshα链和β链蛋白切割成两条多肽;所述内部核糖体进入位点,简称ires,可招募核糖体对mrna进行翻译,因此可调控其下游筛选标记基因的表达。
上述重组表达载体适用的起始构建载体不限,如在哺乳动物细胞中表达用的疫苗病毒载体、逆转录病毒载体、腺病毒载体或腺伴病毒载体。
本发明实施例中,采用的起始构建载体为pcmv-mcs载体。
一些具体实施例中,本发明提供的重组表达载体为在pcmv-mcs载体的bamhi酶切位点与bglii酶切位点之间插入依次连接的以下片段:
如seqidno.2所示的signalhmm34分泌信号肽;
如seqidno.3所示的人fshα基因序列;
如seqidno.4所示的自体切割肽序列;
如seqidno.5所示的signalcystatins分泌信号肽;
如seqidno.6所示的人fshβ基因序列;
如seqidno.7所示的内部核糖体进入位点序列;
如seqidno.24所示的二氢叶酸还原酶基因。
本发明提供的重组表达载体的构建方法,其特征在于,在含有启动子和β球蛋白基因内含子的起始构建载体上插入:alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因;所述自体切割肽序列包括蛋白切割酶furin识别位点和2a序列。
一些具体实施例中,所述含有启动子和β球蛋白基因内含子的起始构建载体为pcmv-mcs载体。
一些具体实施例中,所述“alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因”的插入位点为pcmv-mcs载体的bamhi酶切位点与bglii酶切位点之间。
所述“alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因”片段的获得包括:
①以人胎盘cdna为模板,以上游引物c1f及下游引物c2r进行扩增获得片段一。其中,上游引物c1f包括了与信号肽hmm34重叠的部分及fshα的前20bp,下游引物c2r包括了与furin蛋白p2a重叠的部分及fshα的后26bp。
②以人胎盘cdna为模板以上游引物c5f及下游引物c6r进行扩增获得片段二。上游引物c5f包括了与信号肽hcystatins的重叠部分及fshβ前端21bp,下游引物c6r包括了与fshβ末端重叠的22bp,两个终止码(tgataa)及xhoi酶切位点。
③以片段一为模板,以上游引物u1f及下游引物u3r进行扩增从而获得顺序连接的signalhmm34分泌信号肽序列,人fshα基因序列、自体切割肽序列,记为片段三。上游引物u1f包括了bamhi的酶切位点、kozak序列(gccaccatg)及信号肽hmm34序列;下游引物u3r上包含了与引物c2r重叠的12bp、p2a序列及信号肽hcystatins5’端的前3个bp。
④以片段二为模板,以上游引物u4f及下游引物c6r进行扩增从而获得相连的signalhcystatins分泌信号肽序列,人fshβ基因序列,记为片段四。上游引物包括了p2a3’端25bp序列及信号肽hcystatins序列;下游引物包括了与fshβ末端重叠的22bp,两个终止码(tgataa)及xhoi酶切位点。
⑤以正向引物u2f和反向引物c6r对片段三和片段四进行融合扩增,获得顺序连接的“alpha链的分泌信号肽、人fshα基因、自体切割肽序列、beta链的分泌信号肽、人fshβ基因”片段(记为fsh片段)。
所述“内部核糖体进入位点序列和筛选标记基因”片段的制备包括:
①以市售pires2-egfp质粒为模板,以ires正向引物和ires-dhfr反向融合引物进行扩增,获得片段a;
②以psv2-dhfr为模板,ires-dhfr正向融合引物和dhfr反向引物,获得片段b;
③以ires正向引物和dhfr反向引物对片段a和片段b进行融合扩增,获得“内部核糖体进入位点序列和筛选标记基因”片段。(记为ires-dhfr片段)
在pcmv-mcs载体的酶切位点bamhi和xhoi之间插入fsh片段获得重组质粒pcmv-fsh;
再在pcmv-fsh的酶切位点xhoi和bglii之间插入ires-dhfr片段获得重组质粒pcmv-fsh-ires-dhfr(即为本申请提供的人fsh的重组表达载体)。
本发明还提供了一种重组细胞,所述细胞内含有本发明提供的重组表达载体;或者所述细胞的基因组中整合有以下元件:启动子、β球蛋白基因内含子、alpha链的分泌信号肽、人fshα基因、自体切割肽序列furin-p2a、beta链的分泌信号肽、人fshβ基因、内部核糖体进入位点序列和筛选标记基因;所述自体切割肽序列包括蛋白切割酶furin识别位点和2a序列。
上述重组真核细胞中,所述真核细胞为人hek293细胞、中国仓鼠cho细胞、cos细胞、mdck细胞、vero细胞及其他已经在文献发表的或常用于生物实验的细胞。
一些实施例中,真核细胞为人hek293细胞。
本发明提供的重组细胞的构建方法为:以本发明提供的重组载体转染hek293细胞。
所述转染采用磷酸钙共沉淀法。
转染细胞后,以mtx进行筛选,然后使阳性细胞适应无血清培养基。
所述mtx筛选首先以50nm的mtx进行筛选。当细胞适应选择压力后,逐次递增mtx的浓度,依次为100nm,200nm,400nm和800nm。当细胞适应800nm的mtx后,进一步提升mtx浓度至1000nm。
本发明筛选获得的细胞株经试验证明皆能够稳定表达重组fsh,不同细胞株间表达量及所获得的的重组fsh活性相似,不存在显著性差异。
筛选后,通过逐步降低血清培养的方式,使其先适应了含1%fbs的dmem培养基,接着在转瓶培养的方式下,逐步用freestyle293无血清培养基替换dmem培养基,最终完全替换,使其完全适应freestyle293无血清培养基。
本发明还提供了一种重组人fsh的制备方法,培养本发明提供的重组细胞获得含有重组人fsh的培养上清液。
本发明实施例中,培养的培养基为无血清培养基。
所述无血清培养基为freestyle293无血清培养基。
本发明实施例中,所述培养的条件为摇瓶培养。
所述培养的细胞起始密度为0.5×106细胞/ml。
所述培养的温度为37℃,条件为5%co2浓度80%饱和湿度,时间为7天。
本发明制备的重组人fsh,其氨基酸序列如seqidno.8所示;其中,fshα链序列如seqidno.9所示,fshβ链序列如seqidno.10所示。
本发明提供了人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法,该表达载体为分泌型表达载体,与宿主细胞基因组的整合效率较高,包含该重组表达载体的重组细胞株分泌表达fsh蛋白的效率也较高,其分泌效率大于10pg/细胞/天;另外,本发明重组表达载体采用一个启动子同时诱导fsh基因和筛选标记基因转录、并使用ires启动后者翻译的方式,使得细胞耐药性和表达量高度统一,因此,当使用该重组表达载体转染宿主细胞时,筛选出阳性表达细胞株的概率较大,所得重组表达细胞株在筛选条件下可持续、稳定表达fsh蛋白,细胞系经多次传代后,仍能高效表达fsh蛋白。
本发明采用的仪器和试材皆为普通市售品,皆可于市场购得。
其中,
trizol试剂,superscriptiii逆转录,pfxdna聚合酶,freestyle293培养基,所用引物均购自invitrogen公司。
kapahifidna聚合酶购自广州艾嘉生物有限公司。
pcmv-mcs载体、pires2-egfp、质粒来自addgene公司。
psv2-dhfr载体来自atcc公司
所采用的引物序列为:
下面结合实施例,进一步阐述本发明:
实施例1本发明fsh重组表达质粒的构建
一、人fsh基因的克隆及pcmv-fsh重组载体的构建
(1)pcr扩增片段1——fshα,长度为308bp。
使用trizol提取人胎盘细胞总rna,以所得总rna为模板,使用superscriptiii逆转录酶逆转录合成cdna库。
以逆转录合成cdna库为模板使用特异性扩增fshα基因全长的上游引物c1f及下游引物c2r,在kapahifidna聚合酶的催化下进行pcr扩增;pcr反应条件为:95℃预变性3min;98℃变性20s,55℃退火30s,72℃延伸30s,进行30个循环,收集并纯化pcr扩增产物。pcr结果跑胶胶图如图1所示。
特异性扩增fshα基因全长的上、下游引物c1f、c2r分别如seqidno.11、seqidno.12所示,上游引物包括了与信号肽hmm34重叠的部分及fshα的前20bp,下游引物包括了与furin蛋白p2a重叠的部分及fshα的后26bp。
(2)pcr扩增片段2——fshβ,长度为365bp。
以购自金斯瑞生物科技有限公司,货号ohu15566的质粒为模板使用特异性扩增fshβ基因全长的上游引物c5f及下游引物c6r,在kapahifidna聚合酶的催化下进行pcr扩增;pcr反应条件为:95℃预变性3min;98℃变性20s,55℃退火30s,72℃延伸30s,进行30个循环,收集并纯化pcr扩增产物。pcr结果跑胶胶图如图1所示。
特异性扩增fshβ基因全长的上、下游引物c5f、c6r分别如seqidno.13、seqidno.14所示,上游引物包括了与信号肽hcystatins的重叠部分及fshβ前端21bp,下游引物包括了与fshβ末端重叠的22bp,两个终止码(tgataa)及xhoi酶切位点。
(3)pcr扩增片段3——signalhmm34-fshα-p2a,长度为436bp。
以步骤(1)所得fshαpcr片段为模板,使用特异性引物扩增片段sighmm34-fshα-p2a,在kapahifidna聚合酶的催化下进行pcr扩增;pcr反应条件为:95℃预变性3min;98℃变性20s,55℃退火30s,72℃延伸30s,进行30个循环,收集并纯化pcr扩增产物。pcr结果跑胶胶图如图2所示。
特异性扩增signalhmm34-fshα-p2a的上、下游引物u1f、u3r分别如seqidno.15、seqidno.16所示,上游引物包括了bamhi的酶切位点、kozak序列(gccaccatg)及信号肽hmm34序列;下游引物上包含了与引物c2r重叠的12bp、p2a序列及信号肽hcystatins5’端的前3个bp。
(4)pcr扩增片段4——signalhcystatins-fshβ,长度为429bp。
以步骤(2)所得fshβpcr片段为模板,使用特异性引物扩增片段signalhcystatins-fshβ,在kapahifidna聚合酶的催化下进行pcr扩增;pcr反应条件为:95℃预变性3min;98℃变性20s,55℃退火30s,72℃延伸30s,进行30个循环,收集并纯化pcr扩增产物。pcr结果跑胶胶图如图2所示。
特异性扩增signalhcystatins-fshβ基因的上、下游引物u4f、c6r分别如seqidno.17、seqidno.14所示,上游引物包括了p2a3’端25bp序列及信号肽hcystatins序列;下游引物包括了与fshβ末端重叠的22bp,两个终止码(tgataa)及xhoi酶切位点。
(5)步骤(3)与步骤(4)所得的片段进行融合扩增。
以上述pcr扩增片段3和片段4为模板,以片段3正向引物u2f和片段4反向引物c6r用pfxdna聚合酶进行pcr扩增,pcr反应条件为:94℃预变性3min;94℃变性30s,48℃退火30s,68℃延伸45s,进行5个循环;94℃变性30s,55℃退火30s,68℃延伸1min20s,进行55个循环,得到片段3和片段4的融合片段,片段长度为842bp,收集并纯化该融合片段。
特异性扩增该融合片段的上游引物u2f如seqidno.18,包括了bamhi的酶切位点、kozak序列(gccaccatg)。
(6)利用步骤(5)所得融合片段上、下游引物上的酶切位点——bamhi和xhoi将扩增片段构建到pcmv-mcs载体(包含cmv启动子和seqidno.1所示β球蛋白基因内含子序列)上,即得重组质粒pcmv-fsh,其质粒图谱如图3所示。
(7)将步骤(6)所得重组质粒进行ncoi酶切电泳及测序分析,结果显示其含有与genebank公开的人fshα基因及fshβ基因序列完全相同的序列。ncoi酶切电泳结果如图4所示。
二、重组质粒pcmv-fsh-ires-dhfr的构建
(1)pcr扩增片段1——ires
以市售pires2-egfp质粒为模板,以ires正向引物(其核苷酸序列如seqidno.19所示,包含xhoi酶切位点)和ires-dhfr反向融合引物(其核苷酸序列如seqidno.20所示)为引物对进行pcr扩增,pcr反应条件为:95℃预变性3min;98℃变性20s,55℃退火30s,72℃延伸30s,进行30个循环,得到长度为612bp的扩增片段1,收集并纯化pcr扩增片段1。
(2)pcr扩增片段2——dhfr
以人hek293细胞总rna逆转录合成的cdna为模板,以ires-dhfr正向融合引物(其核苷酸序列如seqidno.21所示)和dhfr反向引物(其核苷酸序列如seqidno.22所示,包含bglii酶切位点)为引物对进行pcr扩增,pcr反应条件为:95℃预变性3min;98℃变性20s,55℃退火30s,72℃延伸30s,进行30个循环,得到长度为592bp的扩增片段2,收集并纯化pcr扩增片段2。
(3)pcr扩增片段3——ires-dhfr融合片段
以上述pcr扩增片段1和2为模板,以ires正向引物和dhfr反向引物进行pcr扩增,pcr反应条件为:94℃预变性3min;94℃变性30s,48℃退火30s,68℃延伸45s,进行5个循环;94℃变性30s,55℃退火30s,68℃延伸1min20s,进行55个循环,得到ires与dhfr的融合片段,片段长度为1170bp,收集并纯化ires-dhfr融合片段。
(4)将ires-dhfr融合片段构建到pcmv-fsh重组载体上
将上述ires-dhfr融合片段用xhoi和bglii进行双酶切,所得酶切产物与经过xhoi和bglii酶切处理的pcmv-fsh重组载体连接,即得pcmv-fsh-ires-dhfr重组质粒,其质粒图谱如图5所示;对pcmv-fsh-ires-dhfr重组质粒进行酶切电泳及测序分析,测序结果显示:该重组质粒包含cmv启动子(序列如seqidno.23所示)、β球蛋白基因内含子(序列如seqidno.1所示)、人fshα基因序列如seqidno.3所示,furin-p2adna序列如seqidno.4所示,人fshβ基因序列如seqidno.6所示,ires序列(如seqidno.7所示)和dhfr基因(序列如seqidno.24所示)。
实施例2本发明fsh重组细胞株的构建
一、hek293细胞的转染、初步鉴定及筛选。
(1)质粒纯化:实施例1所制备的重组质粒使用氯化铯密度梯度离心法纯化,备用。
(2)转染与蛋白鉴定:用deme完全培养基(含10%小牛血清),在37℃、5%co2的环境下培养hek293细胞至60%单层,用磷酸钙共沉淀方法转染上述纯化后的重组质粒至hek293细胞中;24h后将样品回收,并进行westernblot鉴定。样品分别使用fshα及fshβ抗体进行westernblot鉴定,所得结果如图6所示。结果显示确实存在fshα,fshβ两条链。样品进行考马斯亮蓝染色胶图鉴定,如图7所示,结果显示其两条链大概在23kd左右的位置。
(3)转染与重组细胞株筛选:用deme完全培养基(含10%小牛血清),在37℃、5%co2的环境下培养hek293细胞至60%单层,用磷酸钙共沉淀方法转染上述纯化后的重组质粒至hek293细胞中;24h后更换培养基,并加入50nm的mtx进行筛选。当细胞适应选择压力后,逐次递增mtx的浓度,依次为100nm,200nm,400nm和800nm。当细胞适应800nm的mtx后,进一步提升mtx浓度至1000nm,并使用有限稀释法选择表达fsh的单克隆细胞株,即为fsh重组细胞株。发明人通过此方法筛选出10株可稳定表达fsh的重组细胞株。
二、重组细胞株与无血清培养基适应
在上述10株fsh重组细胞株依据细胞形态、生长状态等性质选取6株细胞分别通过逐步降低血清培养的方式,使其先适应了含1%fbs的dmem培养基,接着在转瓶培养的方式下,逐步用freestyle293无血清培养基替换dmem培养基,最终完全替换,使其完全适应freestyle293无血清培养基。
将筛选出的已适应freestyle293无血清培养基的fsh重组细胞按1×106细胞/ml的起始密度置于装有freestyle293无血清培养基的摇瓶中连续培养7天,其细胞增殖数据如表1:
表1细胞增殖
结果表明,各菌株的皆可高效稳定的增殖。
实施例3本发明fsh重组细胞株所分泌fsh的活性检测
一、fsh的活性检测采用常规的大鼠卵巢增重法,具体步骤如下:
取出生21天左右的sprague-dawley雌鼠,分为阴性对照组、阳性对照组、实验组,按照中国药典附录121的实验方案进行操作,72小时后进行卵巢称重,运用《中检所药典生物检定统计bs2000程序3.3法》计算,得出样品的比活。
活性检测试验分以下几组进行:
(1)阴性对照组:不加fsh;
(2)实验组:加入系列浓度的实施例2制得的含有实施例1重组质粒的重组细胞株所分泌的fsh。
(3)阳性对照组:who生物活性标准品96/642;
二、同时进行了利用fsh能刺激人卵巢颗粒细胞肿瘤细胞(kgn)分泌孕酮的量增加的方法进行体外生物学活性的检测。
活性检测试验分以下几组进行:
(1)阴性对照组:不加fsh;
(2)实验组:加入系列浓度的实施例2制得的含有实施例1重组质粒的重组细胞株所分泌的fsh。
(3)阳性对照组:who生物活性标准品96/642;
测活方法步骤为:1)kgn细胞复苏及传代2)细胞铺板3)标准品及供试品制备和上样4)测定孕酮含量
测定孕酮含量方法为按照孕酮elisa试剂盒的操作步骤,在包被好的96孔板中加入孕酮标准品、供试品各25~50μl,加入100~200μl/孔hrpconjugate,室温孵育60min;洗液洗涤3遍后,加入tmbsubstrate,100~200μl/孔,室温孵育20min后,每孔加入50~100μl的终止液;用酶标仪测定450nm处吸光度。结果如表2:
表2重组fsh活性
结果显示,显示阴性对照无活性,实验组与阳性对照组活性相当。说明本发明提供的重组细胞能正确的表达fshα和β两条多肽,并使它们形成正确的异源二聚体。
实施例4本发明fsh重组细胞株分泌fsh的效率检测
fsh的含量检测:依照细胞形态、生长状态等标准从实例3中选择#1b11、#1d10、2b8和#2c11细胞株进行后续实验。先将4条细胞株置于摇瓶中培养,48-72小时后,离心收集细胞,并用新鲜培养基悬浮,调整细胞密度为0.5×106个细胞/毫升,连续培养120小时,每天收集培养基,用elisa试剂盒测试上清液中fsh的浓度,其中四个细胞株的fsh表达量如表3所示:
表3重组fsh表达量
结果表明,各菌株皆可高效稳定的表达重组fsh,#1b11分泌效率最高。
实施例5本发明fsh重组细胞的细胞系稳定性试验
将实施例2所得fsh重组细胞株在无mtx低血清的培养基(含1%fbs)中传代30次,40次,50次和60次后,各取5×106个细胞种植在60mm培养皿里,更换新鲜培养基培养24小时后,收集培养基进行表达量检测。结果如表4:
表4重组fsh表达量
结果表明,各细胞系经历30次,40次,50次和60次传代后仍能表达fsh,且表达效率稳定。且经检测,各菌株传代后表达出的fsh的活性未见明显降低。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>深圳市港科深研生物科技有限公司
<120>人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法
<130>mp1700901
<160>24
<170>siposequencelisting1.0
<210>1
<211>493
<212>dna
<213>人工序列(artificialsequence)
<400>1
tcgaatcccggccgggaacggtgcattggaacgcggattccccgtgccaagagtgacgta60
agtaccgcctatagagtctataggcccacaaaaaatgctttcttcttttaatatactttt120
ttgtttatcttatttctaatactttccctaatctctttctttcagggcaataatgataca180
atgtatcatgcctctttgcaccattctaaagaataacagtgataatttctgggttaaggc240
aatagcaatatttctgcatataaatatttctgcatataaattgtaactgatgtaagaggt300
ttcatattgctaatagcagctacaatccagctaccattctgcttttattttatggttggg360
ataaggctggattattctgagtccaagctaggcccttttgctaatcatgttcatacctct420
tatcttcctcccacagctcctgggcaacgtgctggtctgtgtgctggcccatcactttgg480
caaagaattggga493
<210>2
<211>69
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgcggcccacctgggcctggtggctgttcctggtgctgctgctggccctgtgggcccct60
gccagaggc69
<210>3
<211>276
<212>dna
<213>人工序列(artificialsequence)
<400>3
gctcctgatgtgcaggattgcccagaatgcacgctacaggaaaacccattcttctcccag60
ccgggtgccccaatacttcagtgcatgggctgctgcttctctagagcatatcccactcca120
ctaaggtccaagaagacgatgttggtccaaaagaacgtcacctcagagtccacttgctgt180
gtagctaaatcatataacagggtcacagtaatggggggtttcaaagtggagaaccacacg240
gcgtgccactgcagtacttgttattatcacaaatct276
<210>4
<211>77
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgggccaagcggggcagcggcgccaccaacttcagcctgctgaagcaggccggcgacgtg60
gaggagaaccctggacc77
<210>5
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>5
agcccggcccctgtgcaccctgctgctgctgatggccaccctggccggcgccctggcc58
<210>6
<211>333
<212>dna
<213>人工序列(artificialsequence)
<400>6
aatagctgtgagctgaccaacatcaccattgcaatagagaaagaagaatgtcgtttctgc60
ataagcatcaacaccacttggtgtgctggctactgctacaccagggatctggtgtataag120
gacccagccaggcccaaaatccagaaaacatgtaccttcaaggaactggtatacgaaaca180
gtgagagtgcccggctgtgctcaccatgcagattccttgtatacatacccagtggccacc240
cagtgtcactgtggcaagtgtgacagcgacagcactgattgtactgtgcgaggcctgggg300
cccagctactgctcctttggtgaaatgaaagaa333
<210>7
<211>584
<212>dna
<213>人工序列(artificialsequence)
<400>7
gcccctctccctcccccccccctaacgttactggccgaagccgcttggaataaggccggt60
gtgcgtttgtctatatgttattttccaccatattgccgtcttttggcaatgtgagggccc120
ggaaacctggccctgtcttcttgacgagcattcctaggggtctttcccctctcgccaaag180
gaatgcaaggtctgttgaatgtcgtgaaggaagcagttcctctggaagcttcttgaagac240
aaacaacgtctgtagcgaccctttgcaggcagcggaaccccccacctggcgacaggtgcc300
tctgcggccaaaagccacgtgtataagatacacctgcaaaggcggcacaaccccagtgcc360
acgttgtgagttggatagttgtggaaagagtcaaatggctctcctcaagcgtattcaaca420
aggggctgaaggatgcccagaaggtaccccattgtatgggatctgatctggggcctcggt480
gcacatgctttacatgtgtttagtcgaggttaaaaaaacgtctaggccccccgaaccacg540
gggacgtggttttcctttgaaaaacacgatgataatatggccac584
<210>8
<211>248
<212>prt
<213>人工序列(artificialsequence)
<400>8
alaproaspvalglnaspcysproglucysthrleuglngluasnpro
151015
phepheserglnproglyalaproileleuglncysmetglycyscys
202530
pheserargalatyrprothrproleuargserlyslysthrmetleu
354045
valglnlysasnvalthrsergluserthrcyscysvalalalysser
505560
tyrasnargvalthrvalmetglyglyphelysvalgluasnhisthr
65707580
alacyshiscysserthrcystyrtyrhislysserargalalysarg
859095
glyserglyalathrasnpheserleuleulysglnalaglyaspval
100105110
glugluasnproglyproalaargproleucysthrleuleuleuleu
115120125
metalathrleualaglyalaleualaasnsercysgluleuthrasn
130135140
ilethrilealaileglulysgluglucysargphecysileserile
145150155160
asnthrthrtrpcysalaglytyrcystyrthrargaspleuvaltyr
165170175
lysaspproalaargprolysileglnlysthrcysthrphelysglu
180185190
leuvaltyrgluthrvalargvalproglycysalahishisalaasp
195200205
serleutyrthrtyrprovalalathrglncyshiscysglylyscys
210215220
aspseraspserthraspcysthrvalargglyleuglyprosertyr
225230235240
cysserpheglyglumetlysglu
245
<210>9
<211>94
<212>prt
<213>人工序列(artificialsequence)
<400>9
alaproaspvalglnaspcysproglucysthrleuglngluasnpro
151015
phepheserglnproglyalaproileleuglncysmetglycyscys
202530
pheserargalatyrprothrproleuargserlyslysthrmetleu
354045
valglnlysasnvalthrsergluserthrcyscysvalalalysser
505560
tyrasnargvalthrvalmetglyglyphelysvalgluasnhisthr
65707580
alacyshiscysserthrcystyrtyrhislysserargala
8590
<210>10
<211>111
<212>prt
<213>人工序列(artificialsequence)
<400>10
asnsercysgluleuthrasnilethrilealaileglulysgluglu
151015
cysargphecysileserileasnthrthrtrpcysalaglytyrcys
202530
tyrthrargaspleuvaltyrlysaspproalaargprolysilegln
354045
lysthrcysthrphelysgluleuvaltyrgluthrvalargvalpro
505560
glycysalahishisalaaspserleutyrthrtyrprovalalathr
65707580
glncyshiscysglylyscysaspseraspserthraspcysthrval
859095
argglyleuglyprosertyrcysserpheglyglumetlysglu
100105110
<210>11
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>11
ggcccctgccagaggcgctcctgatgtgcaggattg36
<210>12
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>12
tgccccgcttggcccgagatttgtgataataacaagtactgc42
<210>13
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>13
tggccggcgccctggccaatagctgtgagctgaccaac38
<210>14
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>14
ccgctcgagttatcattctttcatttcaccaaaggag37
<210>15
<211>83
<212>dna
<213>人工序列(artificialsequence)
<400>15
cgggatccgccaccatgcggcccacctgggcctggtggctgttcctggtgctgctgctgg60
ccctgtgggcccctgccagaggc83
<210>16
<211>79
<212>dna
<213>人工序列(artificialsequence)
<400>16
ctggtccagggttctcctccacgtcgccggcctgcttcagcaggctgaagttggtggcgc60
cgctgccccgcttggcccg79
<210>17
<211>81
<212>dna
<213>人工序列(artificialsequence)
<400>17
gacgtggaggagaaccctggaccagcccggcccctgtgcaccctgctgctgctgatggcc60
accctggccggcgccctggcc81
<210>18
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>18
cgggatccgccaccatg17
<210>19
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>19
gccctcgaggcccctctccctccccccccccta33
<210>20
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>20
caatggtcgaaccatggttgtggccatattatca34
<210>21
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>21
tgataatatggccacaaccatggttcgaccattg34
<210>22
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>22
cccagatctttagtctttcttctcgtag28
<210>23
<211>659
<212>dna
<213>人工序列(artificialsequence)
<400>23
acgcgtctagttattaatagtaatcaattacggggtcattagttcatagcccatatatgg60
agttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgaccccc120
gcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccatt180
gacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatc240
atatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatg300
cccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcg360
ctattaccatggtgatgcggttttggcagtacatcaatgggcgtggatagcggtttgact420
cacggggatttccaagtctccaccccattgacgtcaatgggagtttgttttggcaccaaa480
atcaacgggactttccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggta540
ggcgtgtacggtgggaggtctatataagcagagctcgtttagtgaaccgtcagatcgcct600
ggagacgccatccacgctgttttgacctccatagaagacaccgggaccgatccagcctc659
<210>24
<211>564
<212>dna
<213>人工序列(artificialsequence)
<400>24
atggttcgaccattgaactgcatcgtcgccgtgtcccaagatatggggattggcaagaac60
ggagacctaccctggcctccgctcaggaacgagttcaagtacttccaaagaatgaccaca120
acctcttcagtggaaggtaaacagaatctggtgattatgggtaggaaaacctggttctcc180
attcctgagaagaatcgacctttaaaggacagaattaatatagttctcagtagagaactc240
aaagaaccaccacgaggagctcattttcttgccaaaagtttggatgatgccttaagactt300
attgaacaaccggaattggcaagtaaagtagacatggtttggatagtcggaggcagttct360
gtttaccaggaagccatgaatcaaccaggccacctcagactctttgtgacaaggatcatg420
caggaatttgaaagtgacacgtttttcccagaaattgatttggggaaatataaacttctc480
ccagaatacccaggcgtcctctctgaggtccaggaggaaaaaggcatcaagtataagttt540
gaagtctacgagaagaaagactaa564
- 还没有人留言评论。精彩留言会获得点赞!