N-磺酰基吡咯衍生物的制作方法
本发明涉及(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,其在制药工业中用于药物组合物的制备。
技术背景
细胞中的转录调节是复杂的生物过程。一个基本的原理是通过组蛋白即形成八聚体组蛋白核心复合体的组蛋白H2A/B、H3和H4的翻译后修饰的调节。这些通过乙酰化或甲基化作用在赖氨酸残基上及通过磷酸化作用在丝氨酸残基上进行的复杂的N-末端修饰构成了所谓的“组蛋白编码”的一部分(Strahl&Ellis,Nature 403,41-45,2000)。在简单的模型中,带正电荷的赖氨酸残基的乙酰化作用降低了对带负电荷的DNA的亲和力,所述DNA就变得容易让转录因子进入。
组蛋白的乙酰化作用和脱乙酰化作用是由组蛋白乙酰基转移酶 (HAT)和组蛋白脱乙酰酶(HDAC)催化的。HDAC与转录抑制复合物缔合,将染色质转变成无转录活性的沉默结构(Marks et al.Nature Cancer Rev 1,194-202,2001)。对立面适用于与转录激活因子复合物缔合的 HAT。迄今为止已经描述了三种不同类型的HDAC,即Mr=42-55kDa 的I型(HDAC 1-3,8),主要位于细胞核中,并且对曲古霉素A(TSA) 的抑制敏感,Mr=120-130kDa且对TSA敏感的II型(HDAC 4-7,9, 10),和III型(Sir2同源物),其以对NAD+的依赖性和TSA的不敏感性而显得非常特别(Ruijter et al.Biochem.J.370,737-749,2003; Khochbin et al.Curr Opin Gen Dev 11,162-166,2001;Verdin et al. Trends Gen 19,286-293,2003)。最近克隆了Mr=39kDa的HDAC 11,其显示出与I型和II型家族成员的同源性(Gao et al.J Biol Chem 277,25748-25755,2002)。HAT和HDAC与细胞中的转录因子和平台蛋白一起出现在大复合物中(Fischle et al.Mol Cell 9,45-47,2002)。出人意料地,基于对340种基因和作为参照HDI的TSA的差异显示分析,估计所有基因中只有约2%通过组蛋白乙酰化作用调节(von Lint et al. Gene Expression 5,245-253,1996)。用SAHA对多发性骨髓瘤细胞进行的新研究显示,能够将这些转录变化分成对例如细胞凋亡或增殖的调节起到重要作用的截然不同的功能基因种类(Mitsiades et at.Proc Natl Acad Sci 101,pp540,2004)。
存在不同于组蛋白的物质。对于HDAC,这些物质包括诸如p53 和TFII E/的转录因子或诸如Hsp90的伴侣分子(Johnstone&Licht, Cancer Cell 4,13-18,2003)。因此HDAC的正确名称会是赖氨酸特异性蛋白脱乙酰酶。由于这些发现,HDAC的抑制剂通过总体上调节蛋白乙酰化作用不仅影响染色质结构和基因转录,还影响蛋白功能和稳定性。HDAC在蛋白乙酰化作用中的这种功能可能对理解用HDI处理而引起的即刻基因抑制也很重要(von Lint et al.Gene Expression 5, 245-253,1996)。在这点上,致癌性转化、细胞凋亡调节和恶性细胞生长中涉及的蛋白都特别重要。
不同的出版物都强调了组蛋白乙酰化作用对于癌症发展的重要性 (综述见Kramer et al.Trends Endocrin Metabol 12,294-300,2001;Marks et al.Nature Cancer Rev 1,194-202,2001)。这些疾病包括
(i)与鲁宾斯坦-泰比综合征、癌症易染病体质相关的HAT cAMP应答元件结合蛋白(CBP)的突变(Murata et al.Hum MoI Genet 10,1071-1076,2001),
(ii)急性前髓细胞性白血病(APL)中的PML-视磺酸受体α融合基因表达的转录因子引起的HDAC1活性的异常募集 (He et al.Nat genet 18,126-135,1998),
(iii)非何杰金淋巴瘤中的过量表达的BCL6蛋白引起的HDAC 活性的异常募集(Dhordain et al.Nuceic Acid Res 26,4645- 4651,1998),并且最终
(iv)急性粒细胞性白血病中的AML-ETO融合蛋白引起的HDAC活性的异常募集(AML M2亚型;Wang et al.Proc Natl Acad Sci USA 95,10860-10865,1998)。在这种AML 亚型中,HDAC1活性的募集因此导致基因沉默、分化受阻和致癌性转化。
(v)小鼠中的HDAC1基因敲除显示,HDAC1通过抑制细胞周期蛋白依赖性激酶抑制剂p21waf1和p27kip1在胚胎干细胞增殖方面具有强大功能(Lagger et al.Embo J.21, 2672-2681,2002)。由于在许多癌细胞系中p21waf1由HDI 诱导,因此HDAC1可能也是癌细胞增殖中的决定性组分。以初始的siRNA为基础的在HeLa细胞中进行的基因敲低试验支持这种假说(Glaser et al.310,529-536,2003)。
(vi)Zhu等人最近报道,当功能性结肠腺瘤样息肉(APC)蛋白的损失造成wnt/β-连接素/TCF信号通路的组成性活化时, HDAC2在结肠癌中过量表达(Cancer cell 5,455-463, 2004)。
在分子水平上,许多与诸如曲古霉素A(TSA)的各种HDAC抑制剂相关的公开数据显示,许多癌症相关基因被上调或下调。这些包括被上调的p21waf1、细胞周期蛋白E、转化生长因子β(TGFβ)、p53或希佩尔-林道(VHL)肿瘤抑制基因,而Bcl-XL、bcl2、缺氧诱导因子 (HIF)1α、血管内皮细胞生长因子(VEGF)和细胞周期蛋白A/D通过 HDAC的抑制被下调(综述见Kramer et al.Trends Endocrin Metabol 12, 294-300,2001)。HDAC抑制剂在细胞周期内的G1和G2/M处阻滞细胞并使S期细胞耗竭,如作为实例的缩酚酸肽所示(Sandor et al.,British J Cancer 83,817-825,2000)。抑制HDAC的化合物诱导不依赖p53和半胱氨酸天冬氨酸蛋白酶3/8的细胞凋亡并具有广谱抗肿瘤活性。还描述了抗血管形成活性,其可能与VEGF和HIF1α的下调有关。总之, HDAC抑制在不同的分子水平上影响肿瘤细胞,并靶向多种细胞蛋白。
有意思的是,发现HDAC抑制剂诱导细胞分化并且该药理活性还可能导致其具有抗癌活性。例如,最近显示,辛二酰苯胺异羟肟酸 (SAHA)诱导乳腺癌细胞系的分化,例如乳脂肪膜球蛋白(MFMG)、乳脂肪球蛋白和脂质的再合成(Munster et al.Cancer Res.61,8492, 2001)。
HDAC抑制剂越来越显示出与化学治疗以及靶向特异性的癌症药物具有合理的协同作用。例如,SAHA与激酶/cdk抑制剂夫拉平度 (Alemenara et al.Leukemia 16,1331-1343,2002)、LAQ-824与bcr-abl 激酶抑制剂格列卫(Glivec)在CML细胞中(Nimmanapalli et al.Cancer Res.63,5126-5135,2003)、SAHA和曲古霉素A(TSA)与依托泊苷 (VP16)、顺铂和多柔比星(Kim et al.Cancer Res.63,7291-7300,2003),以及LBH589与hsp90抑制剂17-烯丙基-氨基-脱甲氧基-格尔德霉素 (17-AAG;George et al.Blood online,Oct.28,2004)显示出协同作用。还显示出HDAC抑制引起雌激素或雄激素受体在乳腺癌和前列腺癌细胞中的再表达,具有使这些肿瘤对抗激素疗法再敏感的可能性(Yang et al. Cancer Res.60,6890-6894,2000;Nakayama et al.Lab Invest 80, 1789-1796,2000)。
文献中描述的各种化学类型的HDAC抑制剂有四个最重要的类型,即(i)异羟肟酸类似物、(ii)苯甲酰胺类似物、(iii)环肽/酯肽类和(iv)脂肪酸类似物。最近Miller等人公开发表了已知的HDAC抑制剂的全面总结(J Med Chem 46,5097-5116,2003)。关于这些组蛋白脱乙酰酶抑制剂的特异性只公开了有限的数据。通常大多数基于HDI的异羟肟酸盐对HDAC酶I型和II型没有特异性。例如,TSA抑制HDAC 1、3、4、6和10的IC50值为约20nM,而抑制HDAC8的的IC50=0.49 μM(Tatamiya et al,AACR Annual Meeting 2004,Abstract#2451)。但也有例外,如试验性HDI Tubacin对II型酶HDAC6具有选择性(Haggarty et al.Proc natl Acad Sci USA 100,4389-4394,2003)。此外,出现了苯甲酰胺HDI对I型的选择性的数据。MS-275抑制I型HDAC1和3的IC50分别为0.51μM和1.7μM。相反,其抑制II型HDAC 4、6、8和10 的IC50值分别为>100μM、82.5μM和94.7μM(Tatamiya et al,AACR Annual Meeting 2004,Abstract#2451)。迄今为止还不清楚对HDAC I 型或II型酶或者特定的单一同工酶的特异性是否应该在治疗效果和指数上更优异。
用HDAC抑制剂对癌症的临床研究正在进行中,即用SAHA (Merck Inc.)、丙戊酸、FK228/缩酚酸肽(Gloucester Pharmaceuticals/NCI)、MS275(Berlex-Schering)、NVP LBH-589 (Novartis)、PXD-101(Topotarget/Curagen)、MGCD0103(Methylgene Inc)和新戊酰氧基甲基丁酸酯/Pivanex(Titan Pharmaceuticals)。这些研究显示了临床效果的第一手证据,最近用FK228/缩酚酸肽治疗患外周 T-细胞淋巴瘤的患者(Plekarz et al.Blood,98,2865-2868,2001)以及用 SAHA治疗患弥漫性大B-细胞淋巴瘤的患者(Kelly et al.J.Clin.Oncol. 23,3923-3931,2005)具有部分或完全响应,突出了所述临床效果。
最近的出版物还显示了HDAC抑制剂在与癌症不同的疾病中的可能的医药用途。这些疾病包括系统性红斑狼疮(Mishra et al.J Clin Invest 111,539-552,2003,Reilly et al.J.Immunol.173,4171-4178, 2004)、风湿性关节炎(Chung et al.Mol Therapy 8,707-717,2003; Nishida et al.Arthritis&Rheumatology 50,3365-3376,2004)、炎性疾病 (Leoni et al.Proc Natl Acad Sci USA 99,2995-3000,2002)和神经变性疾病如杭廷顿舞蹈病(Steffan et al.Nature 413,739-743,2001,Hockly et al.Proc Natl Acad Sci USA 100(4):2041-6,2003)。
癌症的化学疗法是基于这样的构想建立的:优先杀死增殖不受控制并且有高比例的细胞处于有丝分裂期的癌细胞。标准癌症化学治疗药物通过靶向基础细胞过程和分子即RNA/DNA(烷基化和氨甲酰化剂、铂类似物和拓扑异构酶抑制剂)、新陈代谢(这种类型的药物被称为抗代谢药)以及有丝分裂纺锤体(稳定和去稳定微管蛋白抑制剂),在诱导程序性细胞死亡(“细胞凋亡”)后最终杀死癌细胞。组蛋白脱乙酰酶抑制剂(HDI)构成了一类新的具有分化和细胞凋亡诱导活性的抗癌药物。通过靶向组蛋白脱乙酰酶,HDI影响组蛋白(蛋白)乙酰化和染色质结构,诱导复杂的转录重编程,例如肿瘤抑制基因的再活化和致癌基因的抑制。除了影响核心组蛋白中N-末端赖氨酸残基的乙酰化作用外,还存在对癌细胞生物学非常重要的非组蛋白靶点,如热休克蛋白 90(Hsp90)或p53肿瘤抑制蛋白。HDI的医药用途可能不限于癌症治疗,因为其显示出了对炎性疾病、风湿性关节炎和神经退行性变的模型的功效。
苯甲酰基或乙酰基取代的吡咯基丙烯酰胺在公开文献中被描述为 HDAC抑制剂,其中酰基连接在吡咯骨架的2或3位(Mai et.al.,Journal Med.Chem.2004,Vol.47,No.5,1098-1109;或Ragno et ai.,Journal Med.Chem.2004,VoL 47,No.5,1351-1359)。其它吡咯基取代的异羟肟酸衍生物在US4960787中被描述为脂氧合酶抑制剂或在US6432999 中被描述为环加氧酶抑制剂。
WO 01/38322;Journal Med.Chem.2003,Vol.46,No.24, 5097-5116;Journal Med.Chem.2003,Vol.46,No.4,512-524;Journal Med.Chem.2003,Vol.46,No.5,820-830;和Current Opinion Drug Discovery 2002,Vol.5,487-499中报道了据称为HDAC抑制剂的各种化合物。
为了满足本领域仍然需要的新型、耐受良好的和更有效的HDAC 抑制剂,WO 2006/097474描述了新的N-磺酰基吡咯衍生物,其与现有技术的化合物有很大不同并且是组蛋白脱乙酰酶的有效抑制剂,其具有出人意料的和特别有利的性质。
其中的实例是(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的盐酸盐。
然而,WO 2006/097474中公开的化合物仍然具有相对低的溶解性和/或高吸湿性。
发明描述
依照本发明的第一方面,现在已经合成了(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的新盐,其在下文中被更详细地描述并且出人意料地显示出比游离碱更好的溶解行为和比WO 2006/097474公开的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的盐酸盐更高的稳定性。这些盐显示出不同的多晶型,这还可以导致药用物质具有更好的生物利用度。
因此,本发明的第一个总的方面涉及(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的某些盐,其特征在于与已知盐酸盐相比,改良的溶解行为和较低的吸湿性。
本发明的另一方面涉及(E)N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的盐,所述盐选自氢溴酸盐、甲磺酸盐、半乙基-1,2--二磺酸盐(hemi ethane-1,2-disulfonate)、苯磺酸盐、甲苯磺酸盐和2-萘磺酸盐。
本发明的特别优选的方面为(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的甲苯磺酸盐。意外地发现了与已知盐酸盐相比,这种盐除了高溶解性外具有特别高的溶解速度,以及增强的稳定性,并因此期望其能在体内表现出优异的药代动力学性质。
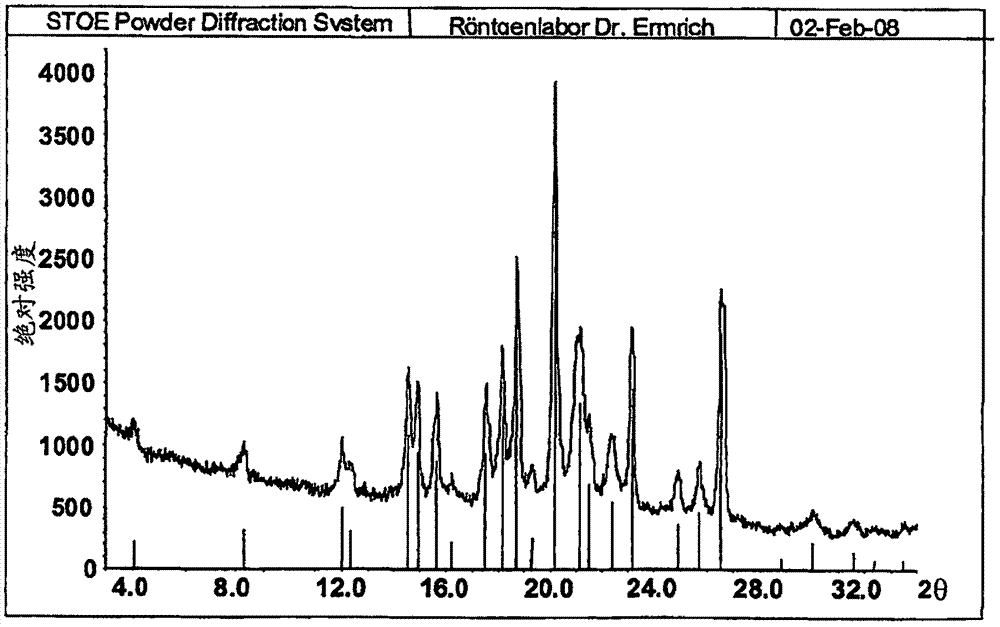
本发明的第三方面涉及(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的氢溴酸盐、甲磺酸盐、半乙基-1,2-二磺酸盐、苯磺酸盐、甲苯磺酸盐和2-萘磺酸盐各自的某些多晶型物,其特征在于它们各自的粉末X-射线衍射图并且特别是它们各自的粉末X-射线衍射图的主峰。
附图简述
图1:部分无定形的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑 -4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的XRPD图
图2:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的多晶型A的XRPD图
图3:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的多晶型B的XRPD图
图4:(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺单盐酸盐的XRPD图
图5:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺二盐酸盐的XRPD图
图6:部分无定形的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲磺酸盐的XRPD图
图7:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲磺酸盐的XRPD图
图8:(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺半乙基-1,2-磺酸盐的XRPD图
图9:(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺苯磺酸盐的XRPD图
图10:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型A的 XRPD图
图11:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型B的XRPD 图
图12:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型C的XRPD 图
图13:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型D的 XRPD图
图14:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型E的XRPD 图
图15:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型F的XRPD 图
图16:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型G的 XRPD图
图17:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型H的XRPD图
图18:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2-磺酸盐的多晶型A+B的 XRPD图
图19:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2-磺酸盐的多晶型A+B的 XRPD图
图20:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2-磺酸盐的多晶型C的XRPD 图
实施发明的最佳方式
本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的盐能够通过将该化合物的游离碱溶解在适当溶剂(例如,诸如丙酮、甲基乙基酮或甲基异丁酮的酮,诸如乙醚、四氢呋喃或二噁烷的醚,诸如亚甲基氯或氯仿的氯代烃,或者诸如甲醇、乙醇或异丙醇的低分子量的脂肪醇)中获得,所述溶剂中含有期望的酸,或者随后向所述溶剂中加入期望的酸。通过过滤、再沉淀、用加成盐的非溶剂沉淀或蒸发溶剂获得盐。能够通过碱化或酸化将所获得的盐转化成游离化合物,其又能够被转化为另外的盐。这样,能够将药理学不可耐受的盐转化为药理学可耐受的盐。
根据所用的反应条件,盐中含有的各个酸性阴离子的量可以为游离碱的约0.1mol至约5mol当量,更精确地为约0.3mol至约3mol 当量,更精确地为约0.6mol至约2.4mol当量,由本领域已知的方法确定,如滴定或NMR-法。
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的结晶盐能够通过包括以下步骤的方法获得:在溶液中用酸将任意形态或任意形态的混合物结晶或重结晶,所述溶液包含有机溶剂(例如诸如甲醇或乙醇的醇,或者诸如丙酮的酮) 或有机溶剂的混合物,或有机溶剂与水的混合物,或只有水。
能够通过许多本领域已知的方法获得多晶型物。这样的方法包括但不限于溶剂(重)结晶、用非溶剂沉淀、快速蒸发、缓慢蒸发、快速冷却、缓慢冷却等。本发明所述的溶剂化物或特别是盐的水合物能够以本身已知的方式制备,例如在合适的溶剂的存在下。水合物可以从水或从水与极性有机溶剂(例如诸如甲醇、乙醇或异丙醇的醇,或诸如丙酮的酮)的混合物中获得。本发明所述的盐包括每种溶剂化物和能够与其形成的水合物,和每种结晶的、半结晶的或无定形形态。结晶形态通常是优选的。
下面的实施例是为了进一步举例说明而不是限制本发明。
实施例
下面给出的XRPD(X-射线粉末衍射)测量是在透射中进行的(U= 40kV,I=30mA,Cu-Kα)。
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺
部分无定形
将3.82g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺二盐酸盐悬浮在38ml水中,并加入2.7 mL氨水溶液(25%)。搅拌该悬浮液1h并过滤。用19mL水洗涤滤饼并干燥。得到灰白色固体(3.09g)。
表1基本上总结了该盐的X-射线粉末衍射图的特征峰并且图1基本上显示了其特征峰。
表1:部分无定形的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑 -4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型A
用300ml THF和375ml Na2CO3水溶液(8%)的混合物处理10.0g (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺二盐酸盐(19.2mmol)。分离水相并用100ml THF萃取。用235ml水处理合并的有机相并蒸发混合物中的有机部分。由此,游离碱以褐色固体形式分离。轻轻倒出水溶液,并将残余物溶解在120 ml THF中,吸附在100g硅胶-60(Merck)上,并用470g硅胶-60(Merck) 层析。用CHCl3/MeOH(20∶1)将该化合物洗脱。小心蒸发含有产物的流分。得到6.00g无色固体。
表2基本上总结了该盐的X-射线粉末衍射图的特征峰并且图2基本上显示了其特征峰。
表2:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的多晶型A的XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型B
将20.0g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺二盐酸盐悬浮在200mL水和100mL乙醇中。加入8.7mL的氨水溶液(25%)并搅拌该悬浮液1h。过滤悬浮液;用100mL水洗涤滤饼并干燥。得到灰白色固体(16.4g)。将该固体(10.0 g)悬浮在200mL乙醇中并回流10min。在冷却至室温后过滤该悬浮液并干燥。得到灰白色固体(8.8g)。
表3基本上总结了该盐的X-射线粉末衍射图的特征峰并且图3基本上显示了其特征峰。
表3:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的多晶型B的XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺单盐酸盐
向含225mg(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺(0.50mmol)的20ml热甲醇中逐滴加入HCl的甲醇溶液(3.13mL,0.5mmol)(向4mL 4N HCl水溶液中加入甲醇至最终为100mL=0.16mmol/mL)。立刻分离出微黄色油状物。通过加入乙醚(10mL)完成充分分离。过夜干燥所得固体。产量:248mg (102%);微黄色固体;MP:150-164℃,熔结。该化合物含0.91HCl/Mol。
表4基本上总结了该盐的X-射线粉末衍射图的特征峰并且图4基本上显示了其特征峰。
表4:(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺单盐酸盐的XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺二盐酸盐
将5.0g[2-((E)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯 -3-基}-丙烯酰氨基)-苯基]-氨基甲酸叔丁基酯悬浮在90mL THF和7.5 mL水中。加入7.5mL盐酸水溶液(37%),并在60℃下搅拌该悬浮液 4h。冷却至室温后过滤该悬浮液,用20mL THF洗涤滤饼并干燥。得到灰白色固体(3.7g)。该化合物含1.82HCl/Mol。
表5基本上总结了该盐的X-射线粉末衍射图的特征峰并且图5基本上显示了其特征峰。
表5:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺二盐酸盐的XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺氢溴酸盐
向含0.21g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺的4ml THF中逐滴加入含0.169ml 48%-HBr(169μL,1.5mmol)的4ml THF。分离固体,用乙醚处理。将所得结晶固体分离并干燥过夜。产量:287mg(100%);MP:200℃,熔结。该化合物含1.86HBr/Mol。
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲磺酸盐
部分无定形
将500mg(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺、10ml水和1ml甲醇加热至130℃。加入0.435ml甲磺酸。将混合物接近溶解。然后立刻在冰浴中冷却该混合物。在冷却过程中,分离出褐色固体。用超声处理该混合物。随后,收集所得固体并干燥。游离碱与甲磺酸的摩尔比率为1∶0.95。
表6基本上总结了该盐的X-射线粉末衍射图的特征峰并且图6基本上显示了其特征峰。
表6:部分无定形的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑 -4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲磺酸盐的XRPD图,其包括如下的峰(相对强度>10)
晶体
将250mg(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺、5ml水、0.5ml甲醇和0.112ml甲磺酸加热至130℃,持续10min。在环境温度下搅拌过夜,然后收集固体并干燥。游离碱与甲磺酸的摩尔比率为1∶0.66。
表7基本上总结了该盐的X-射线粉末衍射图的特征峰并且图7基本上显示了其特征峰。
表7:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲磺酸盐的XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺半乙基-1,2-磺酸盐
将1.00g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在20mL水中。加入含512mg乙二磺酸水合物的5ml水并搅拌该悬浮液18h。过滤该悬浮液并干燥。得到灰白色固体(1.09g)。游离碱与乙磺酸的摩尔比率为1∶0.5。
表8基本上总结了该盐的X-射线粉末衍射图的特征峰并且图8基本上显示了其特征峰。
表8:(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺半乙基-1,2-磺酸盐的XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺苯磺酸盐
将1.65g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在30mL水中并加入642mg苯磺酸。搅拌该悬浮液26h,过滤并干燥。得到灰白色固体(2.04g)。游离碱与苯磺酸的摩尔比率为1∶0.99。
表9基本上总结了该盐的X-射线粉末衍射图的特征峰并且图9基本上显示了其特征峰。
表9:(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺苯磺酸盐的XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐
结晶的多晶型A
将5.0g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在150mL甲醇中并加入2.38g对甲苯磺酸水合物。搅拌该溶液1h并用硅藻土(hyflow)过滤。真空浓缩滤液至体积为50mL并搅拌2h。过滤沉淀并干燥。得到形态A的多晶型物,其为灰白色固体(5.4g)。
表10基本上总结了该盐的X-射线粉末衍射图的特征峰并且图10 基本上显示了其特征峰。
表10:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型A的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型B
将100.0g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在800mL异丙醇中。加入含46.8 g对甲苯磺酸水合物的200mL异丙醇的溶液并搅拌该悬浮液22h。过滤悬浮液并干燥至产生形态B的多晶型物,其为灰白色固体(139.4g)。
表11基本上总结了该盐的X-射线粉末衍射图的特征峰并且图11 基本上显示了其特征峰。
表11:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型B的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型C
将(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的形态B的多晶型物1.0g 悬浮在10mL甲醇中并在60℃下搅拌48h。将悬浮液冷却至室温、过滤并干燥。获得形态C的多晶型物,其为灰白色固体(825mg)。
表12基本上总结了该盐的X-射线粉末衍射图的特征峰并且图12 基本上显示了其特征峰。
表12:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型C的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型D
将5.0g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在75mL MIBK中并加入2.34g对甲苯磺酸水合物。搅拌该悬浮液4h,过滤并干燥。获得形态D的多晶型物,其为灰白色固体(6.6g)。
表13基本上总结了该盐的X-射线粉末衍射图的特征峰并且图13 基本上显示了其特征峰。
表13:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型D的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型E
将(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的形态B的多晶型物1.0g 悬浮在9mL甲醇和1mL水中并在室温下搅拌24h。过滤该悬浮液并干燥。获得形态E的多晶型物,其为灰白色固体(826mg)。
表14基本上总结了该盐的X-射线粉末衍射图的特征峰并且图14 基本上显示了其特征峰。
表14:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型E的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型F
将(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的形态A的多晶型物200 mg悬浮在1.8mL乙基甲基酮和0.2mL水中并搅拌18h。过滤该悬浮液并干燥。获得形态F的多晶型物,其为灰白色固体(101mg)。
表15基本上总结了该盐的X-射线粉末衍射图的特征峰并且图15 基本上显示了其特征峰。
表15:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型F的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型G
将(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的形态C的多晶型物1.00g 悬浮在9mL丙酮和1mL水中并搅拌24h。过滤该悬浮液并干燥。获得形态G的多晶型物,其为灰白色固体(867mg)。
表16基本上总结了该盐的X-射线粉末衍射图的特征峰并且图16 基本上显示了其特征峰。
表16:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型G的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型H
将7.0g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺(15.6mmol)悬浮在126ml丙酮与水的 5∶1的混合物中。将悬浮液加热至回流直至溶解所有的原料。用玻璃纤维过滤器过滤该热溶液并用4ml热溶剂混合物洗涤该过滤器。合并滤液。在真空下蒸馏107ml溶剂,同时再次结晶游离碱。过滤沉淀并且不用干燥直接使用。
在室温下,将12.0g水含量为42%的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺(游离碱,15.6mmol)悬浮在53ml 2-丙醇与107ml水的混合物中。将3.6g对甲苯磺酸一水合物(18.8mmol)溶解在32ml 2-丙醇和8ml 水中。在1小时的时间内将该溶液逐滴加入游离碱的悬浮液中。在室温下再搅拌该悬浮液3天。滤出沉淀,并用5ml结晶用溶剂混合物洗涤,于40℃下在真空中干燥18小时。产量:9.43g;由卡尔·费歇尔滴定法测定水含量:2.7%。
表17基本上总结了该盐的X-射线粉末衍射图的特征峰并且图17 基本上显示了其特征峰。
表17:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺甲苯-4-磺酸盐的多晶型H的 XRPD图,其包括如下的峰(相对强度>10)
(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2磺酸盐
结晶的多晶型A+B
将2.00g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在40mL异丙醇中。加入1.46g萘-2-磺酸(70%)并搅拌该悬浮液24h。过滤该悬浮液,用20mL异丙醇洗涤滤饼并干燥。得到灰白色固体(2.72g)。
表18基本上总结了该盐的X-射线粉末衍射图的特征峰并且图18 基本上显示了其特征峰。
表18:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2-磺酸盐的多晶型A+B的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型A+B
将2.00g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在40mL异丙醇中。加入1.46g萘 -2-磺酸(70%)并搅拌该悬浮液21h。过滤该悬浮液并干燥。得到灰白色固体(2.82g)。
表19基本上总结了该盐的X-射线粉末衍射图的特征峰并且图19 基本上显示了其特征峰。
表19:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2-磺酸盐的多晶型A+B的 XRPD图,其包括如下的峰(相对强度>10)
结晶的多晶型C
将1.00g(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺悬浮在15mL甲醇中。加入1.46g萘-2- 磺酸(70%)并过滤该溶液。向滤液中加入晶种并搅拌悬浮液1h。过滤该悬浮液并干燥。得到灰白色固体(1.28g)。
表20基本上总结了该盐的X-射线粉末衍射图的特征峰并且图20 基本上显示了其特征峰。
表20:结晶的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺萘-2-磺酸盐的多晶型C的XRPD 图,其包括如下的峰(相对强度>10)
商业用途
本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐具有有价值的药理学性质和效果,这使得它们可以在商业上应用,例如其与抑制组蛋白脱乙酰酶的活性和功能相关的性质就可在商业上使用。
“组蛋白脱乙酰酶”(HDAC)是指对底物蛋白中赖氨酸残基的ε-乙酰基具有活性的酶。HDAC底物为组蛋白H2A、H2B、H3或H4蛋白和同种型,但存在不同于组蛋白的底物蛋白,例如但不限于热休克蛋白90(Hsp90)、微管蛋白或肿瘤抑制蛋白p53。特别是组蛋白脱乙酰酶催化这些底物蛋白中赖氨酸残基的ε-乙酰基的水解,形成赖氨酸的游离氨基。
本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐对组蛋白脱乙酰酶的抑制是指抑制一种或多种HDAC同工酶的活性和功能,特别是选自迄今为止已知的组蛋白脱乙酰酶,即HDAC 1、2、3和8(I型)及HDAC 4、5、6、 7、9和10(II型),HDAC 11以及NAD+依赖的III型(Sir2同源物)的同工酶。在某些优选的实施方案中,这种抑制为至少约50%,更优选为至少75%并且再更优选为大于90%。优选地,这种抑制对特定的组蛋白脱乙酰酶类型(例如HDAC I型酶)是特异的,其选择具有最高病理生理学相关性的同工酶(例如HDAC 1、2、3酶)或单一同工酶(例如 HDAC 1酶)。因此在本发明的含义中,组蛋白脱乙酰酶抑制剂是能够与组蛋白脱乙酰酶相互作用并抑制其活性,特别是其酶活性的化合物。在本文中,“首基(head group)”是指组蛋白脱乙酰酶抑制剂中负责与酶的活性位点如Zn2+离子相互作用的残基。
由各种形式和来源的酶活性的生物化学分析测定组蛋白脱乙酰酶的抑制。所用的HDAC活性来自细胞核或细胞提取物或者通过大肠杆菌(E.coli)、昆虫细胞或哺乳动物细胞中确定的HDAC同工酶的异源表达来得到。由于HDAC同工酶在多蛋白复合体中有活性并形成同源或异源二聚体,所以优选来自人类癌细胞如人宫颈癌细胞系HeLa的细胞核提取物。这些细胞核提取物包含I型和II型酶,但富含I型酶。对于重组HDAC同工酶的表达,优选哺乳动物表达体系,如HEK293 细胞。HDAC同工酶被表达为具有诸如FLAG表位的亲和标记物的融合蛋白。通过亲和色谱法,标签蛋白被单独纯化或与内源性蛋白(例如其它HDAC同工酶和共活化剂/平台蛋白)复合的形式被纯化。生物化学分析被很好地描述过并且为本领域技术人员所熟知。使用组蛋白、来自组蛋白或其它HDAC底物的肽以及乙酰化的赖氨酸类似物作为底物。一种优选的混杂HDAC底物是与荧光团7-氨基甲基香豆素(AMC) 偶联的三肽Ac-NH-GGK(Ac)。
本发明进一步涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在抑制细胞和组织中的组蛋白脱乙酰酶活性,从而引起底物蛋白的高度乙酰化以及产生例如基因表达的诱导或抑制、蛋白降解的诱导、细胞周期停滞、分化的诱导和/或细胞凋亡的诱导的结果中的用途。
组蛋白脱乙酰酶抑制剂的细胞活性包括与组蛋白脱乙酰酶抑制有关的任何细胞作用,特别是与蛋白高度乙酰化,转录抑制和激活,细胞凋亡、分化和/或细胞毒性的诱导有关的任何细胞作用。
术语“细胞凋亡的诱导”和类似的术语是用于鉴定可导致与该化合物接触的细胞程序性细胞死亡的化合物。“细胞凋亡”是由被接触细胞中的复杂生物化学事件定义的,例如半胱氨酸特异性蛋白酶(“胱门蛋白酶”)的活化和染色质的断裂。与化合物接触的细胞中细胞凋亡的诱导可能不一定伴随着细胞增殖或细胞分化。优选地,增殖的抑制、分化的诱导和/或细胞凋亡的诱导对异常生长的细胞是有特异性的。
“细胞毒性”通常是指在体外的哺乳动物细胞特别是人癌细胞中阻止增殖和/或诱导细胞凋亡细胞死亡。
“分化的诱导”被定义为导致可逆或不可逆的细胞周期停滞在G0 和某些特定正常细胞类型或组织的基因亚型再表达(例如乳脂蛋白和乳房癌细胞中的脂肪的再表达)的细胞重编程的过程。
“细胞毒性”通常是指在体外的哺乳动物细胞特别是人癌细胞中阻止增殖和/或诱导细胞凋亡细胞死亡。
细胞增殖、细胞凋亡或分化的定量分析为专家所熟知并且代表本领域技术发展水平。例如,与细胞增殖有关的代谢活动是用阿尔玛蓝/ 刃天青分析(Alamar Blue/Resazurin assay)(O′Brian et al.Eur j Biochem 267,5421-5426,2000)量化的,并且细胞凋亡的诱导是通过用由Roche 商业化的细胞死亡检测ELISA测量染色质片段来量化的。检测HDAC 底物高度乙酰化的细胞分析的实例通过经由蛋白印迹法用特异性抗体测量核心组蛋白乙酰化给出,采用各自的应答性启动子或启动子元件 (例如p21启动子或作为应答元件的sp1位点)进行报道基因分析,或最后使用乙酰化特异性抗体对核心组蛋白再次进行图像分析给出。
本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐能够在商业上应用是因为其具有 HDAC抑制、抗增殖和/或诱导细胞凋亡的活性,该活性可以有益于治疗或预防对其应答的疾病,例如任何本文提及的那些疾病。
本发明还涉及抑制、治疗、改善或预防细胞瘤形成的方法,所述方法为通过对哺乳动物、特别是需要这样治疗的人给予有效量的本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐。“瘤形成”被定义为表现出异常细胞增殖和/或存活和/或分化受阻的细胞。术语“瘤形成”包括良性瘤形成,其被描述为细胞的过度增殖,不能在体内形成侵袭性转移肿瘤,和形成对照的恶性肿瘤,其被描述为具有多细胞的和生物化学异常的细胞,能够形成全身性疾病,例如形成远距离器官中的肿瘤转移。
本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐能够具体地用于也被描述为癌症的恶性瘤形成的治疗,所述癌症的特征在于最终转移至远距离器官或组织中的肿瘤细胞。用本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐治疗的恶性瘤形成的实例包括实体瘤和血液肿瘤。实体瘤的实例为乳腺、膀胱、骨、脑、中枢和外周神经系统、结肠、内分泌腺(例如甲状腺和肾上腺皮质)、食道、子宫内膜、生殖细胞、头颈部、肾、肝、肺、喉及下咽部、间皮瘤、卵巢、胰腺、前列腺、直肠、肾脏、小肠、软组织、睾丸、胃、皮肤、输尿管、阴道和外阴的肿瘤。恶性瘤形成包括遗传性癌症,例如视网膜母细胞瘤和肾母细胞瘤。此外,恶性瘤形成包括所述器官中的原发性肿瘤和远距离器官中相应的继发性肿瘤(“肿瘤转移”)。血液肿瘤例如侵袭性和无痛型白血病和淋巴瘤,即非何杰金氏病、慢性和急性髓细胞性白血病(CML/AML)、急性成淋巴细胞性白血病(ALL)、何杰金氏病、多发性骨髓瘤和T-细胞淋巴瘤。还包括骨髓增生异常综合征、浆细胞瘤形成、瘤外综合征、原发部位未知的癌以及AIDS相关性恶性肿瘤。
应当注意,癌症以及恶性瘤形成不一定需要形成远距离器官转移。某些肿瘤通过其侵入性生长特性对原发器官本身产生破坏性影响。这些能够导致组织和器官结构的破坏,最终导致该器官功能衰竭。
瘤细胞增殖还可以影响正常细胞行为和器官功能。例如,被描述为新血管形成的过程的新血管的形成是由肿瘤或肿瘤转移诱导产生的。本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐能够在商业上应用于良性细胞增殖或癌细胞增殖引起的病理生理学相关过程的治疗,例如但不限于血管内皮细胞的非生理性增殖引起的新血管形成。
耐药性对于频发的标准癌症治疗的失败特别重要。该耐药性是由各种细胞和分子机制引起的,比如药物外排泵的超表达、由染色体易位形成的细胞靶蛋白或融合蛋白中的突变。本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐的商业适用性不限于患者的一线治疗。对癌症化学治疗或靶向特异的抗癌药有抵抗力的患者也能够用这些(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐进行例如二或三线治疗周期的治疗。突出的实例通过具有 PML-RARα融合蛋白的急性早幼粒细胞白血病患者给出,其对用维甲酸类进行的标准治疗具有抵抗力。通过用诸如本发明的(E)-N-(2-氨基- 苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐的HDAC抑制药物治疗,能够使这些患者对维甲酸类再次敏化。
本发明进一步提供了治疗患有不同于细胞瘤形成的疾病的对组蛋白脱乙酰酶抑制剂治疗敏感的哺乳动物、特别是人的方法,所述方法包括向所述哺乳动物给予有药理活性的和治疗有效以及耐受量的本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐。这些非恶性疾病包括:
(i)关节病和骨病理学疾病,例如风湿性关节炎、骨关节炎、痛风、多发性关节炎和银屑病关节炎,
(ii)自身免疫病,例如系统性红斑狼疮和移植排斥,
(iii)高增殖性疾病,例如银屑病或平滑肌细胞增殖,包括血管增殖性疾病、动脉粥样硬化和再狭窄,
(iv)急慢性炎性疾病和皮肤疾病,例如溃疡性结肠炎、克罗恩氏病、变应性鼻炎、过敏性皮炎、囊性纤维化、慢性阻塞性支气管炎和哮喘,
(v)子宫内膜异位、子宫纤维瘤、子宫内膜增生和良性前列腺增生,
(vi)心脏机能障碍,
(vii)抑制免疫抑制疾病,如HIV感染,
(viii)神经病理性疾病,如帕金森氏病、阿尔兹海默病或多谷氨酰胺相关疾病,和
(ix)可通过增强内源基因表达以及提高基因治疗中的转基因表达治疗的病理性疾病。
本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐可以在商业上应用于治疗、预防或改善如本文所述的良性和恶性性质的疾病,例如(高)增殖性疾病和/或对细胞凋亡的诱导响应的病症和/或对细胞分化响应的病症,如良性或恶性瘤形成,特别是癌症,如任何上述那些癌性疾病。
鉴于本文所述的它们的性质、功能和可用性,预期本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐以与其相关的有价值和期望的作用而著称,如低毒、优异的总体生物利用度(如良好的肠吸收)、优异的治疗窗口、无显著副作用和/或与它们的治疗和药学适应性相关的其它有益效应(如溶解行为)。
本发明进一步包括治疗患有上述疾病状态、不适、病症或疾病之一的包括人在内的哺乳动物的方法。该方法包括对需要这样的治疗的个体给予有药理学活性、治疗有效以及耐受量的一种或多种本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,其通过抑制组蛋白脱乙酰酶并且一般而言通过调节蛋白乙酰化、诱导各种细胞效应,特别是诱导或抑制基因表达、终止细胞增殖、诱导细胞分化和/或诱导细胞凋亡而起作用。
本发明还包括治疗患有疾病和/或病症的包括人在内的哺乳动物的疾病和/或病症的方法,所述疾病和/或病症对组蛋白脱乙酰酶的抑制响应或敏感,特别是上述疾病,例如细胞瘤形成或上述不同于细胞瘤形成的疾病,所述方法包括对有需要的所述哺乳动物给予有药理学活性和治疗有效以及耐受量的一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐。
本发明还包括可用于调节上述疾病特别是癌症中体内的蛋白乙酰化、基因表达、细胞增殖、细胞分化和/或细胞凋亡的治疗方法,所述方法包括对需要这样的治疗的个体给予有药理学活性和治疗有效以及耐受量的一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,其通过抑制组蛋白脱乙酰酶起作用。
本发明还提供了通过使细胞与本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐接触来调节内源性或异源性启动子活性的方法。
本发明进一步涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备用于治疗和/或预防和/或改善本文所述的疾病、病症、不适和/或疾病状态的药物组合物中的用途。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备药物组合物中的用途,所述药物组合物用于治疗和/或预防对组蛋白脱乙酰酶的抑制响应或敏感的疾病和/或病症,特别是上述那些疾病,如细胞瘤形成或上述不同于细胞瘤形成的疾病。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备具有组蛋白脱乙酰酶抑制活性的药物组合物中的用途。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备用于抑制或治疗细胞瘤形成的药物组合物中的用途,所述细胞瘤形成如良性或恶性瘤形成,如癌症。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备药物组合物中的用途,所述药物组合物能够用于治疗、预防或改善对终止异常细胞生长响应的疾病,如良性或恶性性质的(高)增殖性疾病,如任何本文所述的那些疾病,特别是癌症,如任何上文所述的那些癌性疾病。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备药物组合物中的用途,所述药物组合物能够用于治疗、预防或改善对细胞凋亡的诱导响应的病症,如任何本文所述的那些疾病,特别是癌症,如任何上文所述的那些癌性疾病。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备药物组合物中的用途,所述药物组合物能够用于治疗、预防或改善对分化的诱导响应的病症,如任何本文所述的那些疾病,特别是癌症,如任何上文所述的那些癌性疾病。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备药物组合物中的用途,所述药物组合物能够用于治疗、预防或改善良性或恶性瘤形成,特别是癌症,如任何上文所述的那些癌性疾病。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备药物组合物中的用途,所述药物组合物用于治疗不同于细胞瘤形成和对组蛋白脱乙酰酶抑制剂治疗敏感的疾病,如前述的非恶性疾病。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在制备用于药物组合物中的用途,所述药物组合物在治疗疾病中用于抑制组蛋白脱乙酰酶活性,所述疾病对所述抑制响应或对其产生的结果响应。
本发明还涉及治疗、预防或改善哺乳动物、特别是人类患者的本文所述的疾病、病症、不适和/或疾病状态的方法,所述方法包括对有需要的所述哺乳动物给予有药理学活性和治疗有效以及耐受量的一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐。
本发明还涉及本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在治疗和/或预防疾病、特别是所提及的疾病中的用途。
本发明还涉及药物组合物,其包含一种或多种的本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐和药物可接受的载体或稀释剂。
本发明还涉及药物组合物,其包含一种或多种的本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐以及药物可接受的辅料和/或赋形剂。
本发明还涉及组合,其包含一种或多种的本发明的(E)-N-(2-氨基- 苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐以及药物可接受的稀释剂、赋形剂和/或载体,所述组合用于例如治疗、预防或改善良性或恶性性质的(高)增殖性疾病和/或对细胞凋亡的诱导响应的病症,例如良性或恶性瘤形成,如癌症,如任何上文所述的那些癌性疾病。
本发明还涉及具有组蛋白脱乙酰酶抑制活性的本发明的药物组合物。
本发明还涉及具有细胞凋亡诱导活性的本发明的药物组合物。
本发明还涉及具有抗增殖活性的本发明的药物组合物。
本发明还涉及具有细胞分化诱导活性的本发明的药物组合物。
本发明还涉及包含一种或多种的本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐以及药物可接受的载体或稀释剂的药物组合物在制备用于治疗和 /或预防所提及的疾病的诸如商业包装的药品中的用途。
此外,本发明涉及包括包装材料和含在所述包装材料中的药剂的制品,其中该药剂在治疗上对抑制组蛋白脱乙酰酶的作用、改善组蛋白脱乙酰酶介导病症的症状是有效的,并且其中该包装材料包括标签或包装说明书,其显示了该药剂对预防或治疗组蛋白脱乙酰介导的病症是有效的,并且其中所述药剂包含一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐。该包装材料、标签和包装说明书在其它方面相当于或类似于通常被认为用于具有相关效用的药物的标准包装材料、标签和包装说明书。
通过本身已知的并为本领域技术人员所熟悉的方法制备本发明的药物组合物。作为药物组合物,本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐(=活性化合物)或者单独使用,或者优选与合适的药用辅料和/或赋形剂组合使用,例如以片剂、包衣片剂、胶囊剂、囊片剂、栓剂、贴剂(如作为TTS)、乳剂、悬浮剂、凝胶或溶液的形式使用,该活性化合物的有利含量为0.1%至95%,并且其中通过适当选择辅料和/或赋形剂,能够获得正好适于该活性化合物和/或适于期望起效的给药形式 (如延迟释放形式或肠道形式)。
由于他/她的专业知识,本领域技术人员熟悉适用于期望药物剂型、制剂或组合物的辅料、溶媒、赋形剂、稀释剂、载体或助剂。除溶剂外,能够使用凝胶形成剂、软膏基质和其它活性化合物赋形剂,例如抗氧化剂、分散剂、乳化剂、防腐剂、增溶剂、着色剂、络合剂或渗透促进剂。
可以任何本领域现有的广泛接受的给药方式进行本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐、药物组合物或组合的给予。合适的给药方式的示例性实例包括静脉内、口服、鼻内、肠胃外、局部、经皮和直肠递送。口服和静脉内递送是优选的。
对于皮肤病的治疗,特别以适用于局部应用的那些药物组合物的形式给予本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐。对于药物组合物的生产,优选将本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐(=活性化合物)与适当的药用辅料混合并且进一步加工成合适的药物剂型。合适的药物制剂为例如粉剂、乳剂、悬浮剂、喷雾剂、油剂、软膏剂、脂肪软膏剂、乳膏剂、糊剂、凝胶剂或溶液剂。
通过本身已知的方法制备本发明的药物组合物。以组蛋白脱乙酰酶抑制剂的常用量实施本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐(=活性化合物) 的剂量。因此,用于治疗皮肤病的局部应用形式(例如软膏)含有活性化合物的浓度为例如0.1%至99%。全身治疗(p.o.)的常规剂量可以为每日0.03mg/kg至60mg/kg,(i.v.)可以为0.03mg/kg/h至60mg/kg/h。在另一实施方案中,全身治疗(p.o.)的常规剂量为每日0.3mg/kg至30 mg/kg,(i.v.)为0.3mg/kg/h至30mg/kg/h。
本领域技术人员基于他/她的专业知识能够确定每种情况所需的最佳剂量方案和治疗持续时间的选择,特别是最佳剂量和活性化合物的给药方式的选择。
根据要治疗或预防的具体疾病,可以任选地将通常用于治疗或预防该疾病的其它治疗活性剂与本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐共同给药。本文所用的通常用于治疗或预防具体疾病的其它治疗剂是已知的适用于正在治疗的疾病的治疗剂。
例如,可以将本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H- 吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐与一种或多种用于治疗前述疾病的标准治疗剂或放射疗法联用。
因此,在一具体的实施方案中,可以将本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐与一种或多种本领域已知的抗癌剂联用,如与一种或多种下述的本领域已知的化学治疗剂和/或靶向特异性抗癌剂联用,和/或与放射疗法联用。
联合治疗中频繁使用的已知的化学治疗抗癌剂的实例包括但不限于(i)烷基化剂/氨基甲酰化剂,例如环磷酰胺异环磷酰胺噻替派(噻替派)、美法仑或氯乙基亚硝基脲(BCNU);(ii)铂衍生物,如顺铂(BMS)、奥沙利铂或卡铂(BMS);(iii)抗有丝分裂剂/微管蛋白抑制剂,如长春花生物碱类(长春新碱、长春碱、长春瑞滨),诸如紫杉醇多西紫杉醇和类似物的紫杉烷类及其新的制剂和轭合物,诸如埃坡霉素B氮杂埃坡霉素或全合成埃坡霉素B类似物ZK-EPO的埃坡霉素类;(iv)拓扑异构酶抑制剂,如蒽环类(如多柔比星/)、表鬼臼脂素(如依托泊苷/ )以及喜树碱和喜树碱类似物(如伊立替康/或拓扑替康/);(v)嘧啶拮抗剂,如5-氟尿嘧啶(5-FU)、卡培他滨阿拉伯糖胞嘧啶/阿糖胞苷或吉西他滨(vi)嘌呤拮抗剂,如6-巯基嘌呤6-巯基鸟嘌呤或氟达拉滨和最后(vii)叶酸拮抗剂如甲氨蝶呤或培美曲塞
实验或标准癌症治疗中使用的靶向特异性抗癌药类型的实例包括但不限于(i)激酶抑制剂,如伊马替尼ZD-1839/吉非替尼Bay43-9006(索拉非尼)、SU11248/舒尼替尼或 OSI-774/厄洛替尼(ii)蛋白酶体抑制剂,如PS-341/硼替佐米(iii)热休克蛋白90抑制剂,如17-烯丙基氨基格尔德霉素(17-AAG);(iv)诸如combretastin A4磷酸酯或 AVE8062/AC7700的血管靶向剂(VTA),和诸如VEGF抗体的抗血管生成药物,如贝伐单抗或者诸如PTK787/ZK222584(瓦他拉尼)的KDR酪氨酸激酶抑制剂;(v)单克隆抗体,如曲妥珠单抗或利妥昔单抗(美罗华/)或阿仑单抗或托西莫单抗(tositumab)或C225/西妥昔单抗或阿瓦斯丁(见上)以及单克隆抗体的突变体和缀合物,如吉妥珠单抗奥唑米星或替伊莫单抗和抗体片段;以及单克隆抗体和抗体片段的突变体和缀合物;(vi)基于寡核苷酸的治疗药,如G-3139/奥利默森(vii)诸如的Toll-样受体 /TLR 9激动剂,诸如咪喹莫特或艾沙托立宾及其类似物的 TLR 7激动剂,或诸如雷西莫特的TLR 7/8激动剂以及作为TLR 7/8 激动剂的免疫刺激RNA;(viii)蛋白酶抑制剂;(ix)激素疗法,如抗雌激素(如他莫昔芬或雷洛昔芬)、抗雄激素(如氟他胺或康士得)、LHRH 类似物(如亮丙瑞林、戈舍瑞林或曲普瑞林)和芳香酶抑制剂。
能够用于联合治疗的其它已知靶向特异性抗癌剂包括博莱霉素,诸如全反式维甲酸(ATRA)的类视黄醇类,诸如2-脱氧胞苷衍生物地西他滨和5-氮杂胞苷的DNA甲基转移酶抑制剂,阿拉诺新,诸如白介素2的细胞因子,诸如干扰素α2或干扰素-γ的干扰素,诸如 TRAIL的死亡受体激动剂,DR4/5激动剂抗体,FasL和TNF-R激动剂,以及最后的不同于本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基 -1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐的组蛋白脱乙酰酶抑制剂,如SAHA、PXD101、MS275、MGCD0103、缩酚酸肽/FK228、 NVP-LBH589、NVP-LAQ824、丙戊酸(VPA)和丁酸酯。
作为与本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐在本文所述的联合治疗中联用的抗癌剂的实例,可以提及但不限于下述任何药物:5FU、放线菌素D、阿巴瑞克、阿昔单抗、阿柔比星、阿达帕林、阿仑单抗、六甲蜜胺、氨鲁米特、氨普立糖、氨柔比星、阿那曲唑、安西他滨、青蒿素、硫唑嘌呤、巴利昔单抗、苯达莫司汀、贝伐单抗、百克沙(BEXXAR)、比卡鲁胺、博莱霉素、硼替佐米、溴尿苷、白消安、阿来佐单抗 (CAMPATH)、卡培他滨、卡铂、卡波醌、卡莫司汀、西曲瑞克、苯丁酸氮芥、氮芥、顺铂、克拉屈滨、克罗米芬、环磷酰胺、达卡巴嗪、利珠单抗、更生霉素、红比霉素、地西他滨、德舍瑞林、右雷佐生、多西紫杉醇、去氧氟尿苷、多柔比星、屈洛昔芬、屈他雄酮、依地福新、依氟鸟氨酸、乙嘧替氟、表柔比星、环硫雄醇、依铂、爱必妥、埃罗替尼、雌莫司汀、依托泊苷、依西美坦、法倔唑、非那雄胺、氟尿苷、氟胞嘧啶、氟达拉滨、氟尿嘧啶、氟他胺、福美司坦、膦甲酸 (FOSCARNET)、磷雌酚、福莫司汀、氟维司群、吉非替尼、奥利默森、吉西他滨、格列卫、戈舍瑞林、胍立莫司、曲妥珠单抗、伊达比星、碘苷、异环磷酰胺、伊马替尼、英丙舒凡、英夫利昔单抗、伊立替康、伊沙匹隆、兰瑞肽、来曲唑、亮丙瑞林、洛铂、罗氮芥、LUPROLIDE、美法仑、巯基嘌呤、甲氨蝶呤、美妥替哌、米铂、米非司酮、米替福新、米立司亭、双脒腙、二溴卫矛醇、丝裂霉素、米托蒽醌、咪唑立宾、莫特沙芬、吉妥单抗、那托司亭、NEBAZUMAB、奈达铂、尼鲁米特、尼莫司汀、奥曲肽、奥美昔芬、奥沙利铂、紫杉醇、帕利珠单抗、埃坡霉素B(PATUPILONE)、培门冬酶、聚乙二醇化非格司亭、培美曲塞、喷曲肽、喷司他丁、培磷酰胺、嗪消安、吡柔比星、普卡霉素、泼尼氮芥、甲基苄肼、丙帕锗、丙螺氯铵、雷洛昔芬、雷替曲塞、雷莫司汀、豹蛙酶、拉布立酶、雷佐生、利妥昔单抗、利福平、利曲舒凡、罗莫肽、甲磺酸一水合物(RUBOXISTAURIN)、沙格司亭、赛特铂、西罗莫司、索布佐生、索拉非尼、螺莫司汀、链脲菌素、舒尼替尼、它莫西芬、他索纳明、喃氟啶、替莫泊芬、替莫唑胺、替尼泊苷、睾内酯、噻替派、胸腺法新、硫米嘌呤、拓扑替康、托瑞米芬、 TRAIL、曲妥珠单抗、曲奥舒凡、三亚胺醌、三甲曲沙、曲普瑞林、曲洛磷胺、尿烷亚胺、戊柔比星、瓦他拉尼、维替泊芬、长春花碱、长春新碱、长春地辛、长春瑞滨、伏氯唑和泽娃灵。
作为本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐的联用药物的上文所述的抗癌剂意在包括其药物可接受的衍生物,如它们的药物可接受的盐。
本领域技术人员基于他/她该方面的专业知识能够知道,一起给予的其它一种或多种治疗剂的总日剂量和给药方式。所述总日剂量能够在大范围内变动。
在本发明的实践中,取决于它们上述用途的细节、特点或目的,本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐可在联合治疗中与一种或多种标准治疗剂,特别是本领域已知的抗癌剂(化学治疗剂和/或靶向特异性抗癌剂),如任何上述的那些药物,分开、连续、同时、并行或按时间顺序交错给药(如作为合并的单位剂型,作为分开的单位剂型,作为相邻的不连续的单位剂型,作为固定或非固定的组合,作为试剂盒或作为混合物)。
在本文中,本发明进一步涉及组合,其包含
第一活性成分,其为至少一种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,和
第二活性成分,其为至少一种本领域已知的标准治疗剂,例如本领域已知的抗癌剂,如一种或多种的上文所述的那些,
用于在治疗中,如在任何本文所述的那些疾病的治疗中,分开、连续、同时、并行或按时间顺序交错使用。
本发明所述的术语“组合”可以是固定组合、非固定组合或试剂盒。
“固定组合”被定义为其中所述第一活性成分和所述第二活性成分同时存在于一个单位剂量或单一实体中的组合。“固定组合”的一实例是其中所述第一活性成分和所述第二活性成分存在于同时给药的混合物中、例如剂型中的药物组合物。“固定组合”的另一实例是其中所述第一活性成分和所述第二活性成分不以混合物的形式存在于一个单位中的药物组合物。
“试剂盒”被定义为其中所述第一活性成分和所述第二活性成分存在于多于一个单位中的组合。“试剂盒”的一实例为其中所述第一活性成分和所述第二活性成分单独存在的组合。“试剂盒”的组分可以分开、连续、同时、并行或按时间顺序交错给药。
本发明还涉及药物组合物,其包含
第一活性成分,其为至少一种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,和
第二活性成分,其为至少一种本领域已知的抗癌剂,如一种或多种的上文所述的那些,和,任选地,
药物可接受的载体或稀释剂,
用于在治疗中,例如在对组蛋白脱乙酰酶的抑制响应或敏感的疾病的治疗中分开、连续、同时、并行或按时间顺序交错使用,所述疾病特别是(高)增殖性疾病和/或对细胞凋亡的诱导响应的病症,如任何本文所述的那些疾病,如良性或恶性瘤形成,特别是癌症,尤其是任何上述的那些癌性疾病。
本发明还涉及组合产品,其包含
a.)与药物可接受的载体或稀释剂配制的至少一种本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,和
b.)与药物可接受的载体或稀释剂配制的至少一种本领域已知的抗癌剂,如一种或多种的上文所述的那些。
本发明还涉及试剂盒,其包含第一活性成分和药物可接受的载体或稀释剂的制剂,该第一活性成分为本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐;第二活性成分和药物可接受的载体或稀释剂的制剂,该第二活性成分为本领域已知的抗癌剂,如上述的那些之一;用于在治疗中同时、并行、连续、分开或按时间顺序交错使用。任选地,所述试剂盒包括其在治疗中的使用说明,如治疗对组蛋白脱乙酰酶的抑制响应或敏感的疾病,如细胞瘤形成或上述不同于细胞瘤形成的疾病,特别是癌症,如任何上述的那些癌性疾病。
本发明还涉及组合制剂,其包含同时、并行、连续或分开给予的至少一种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐和至少一种本领域已知的抗癌剂。
在这方面,本发明还涉及具有组蛋白脱乙酰酶抑制活性的本发明的组合、组合物、剂型、制剂或试剂盒。
同样在这方面,本发明还涉及具有抗(高)增殖和/或细胞凋亡诱导活性的本发明的组合、组合物、剂型、制剂或试剂盒。
此外,本发明还涉及在联合治疗中治疗患者疾病的方法,所述疾病为对组蛋白脱乙酰酶的抑制响应或敏感的疾病,如上述的那些疾病,如(高)增殖性疾病和/或对细胞凋亡的诱导响应的病症,如癌症,所述方法包括对有需要的患者给予如本文所述的组合、组合物、剂型、制剂或试剂盒。
此外,本发明还涉及治疗患者疾病的方法,所述疾病为对组蛋白脱乙酰酶的抑制响应或敏感的疾病,如癌症,所述方法包括在联合治疗中对有需要的所述患者分开、同时、并行、连续或按时间顺序交错给予有药学活性和治疗有效以及耐受量的药物组合物,所述药物组合物包含本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐和药物可接受的载体或稀释剂,以及有药学活性和治疗有效以及耐受量的一种或多种本领域已知的抗癌剂,如一种或多种的本文所述的那些。
另外,本发明还涉及治疗、预防或改善患者疾病的方法,所述疾病为(高)增殖性疾病和/或对细胞凋亡的诱导响应的病症,如良性或恶性瘤形成,如癌症,特别是任何本文所述的那些癌性疾病,所述方法包括对有需要的所述患者分开、同时、并行、连续或按时间顺序交错给予一定量的第一活性化合物,所述第一活性化合物为本发明的 (E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐,和一定量的至少一种第二活性化合物,所述至少一种第二活性化合物为标准的治疗剂,特别是至少一种本领域已知的抗癌剂,例如一种或多种的本文所述的那些化学治疗剂和靶向特异性抗癌剂,其中一定量的第一活性化合物和所述第二活性化合物产生治疗效果。
另外,本发明还涉及治疗、预防或改善患者疾病的方法,所述疾病为(高)增殖性疾病和/或对细胞凋亡的诱导响应的病症,如良性或恶性瘤形成,如癌症,特别是任何本文所述的那些癌性疾病,所述方法包括给予本发明的组合。
此外,本发明还涉及本发明的组合物、组合、剂型、制剂或试剂盒在制备用于治疗、预防或改善对组蛋白脱乙酰酶的抑制响应或敏感的疾病,特别是本文所述的那些疾病,如良性或恶性瘤形成,特别是癌症的诸如商业包装或药剂的药品中的用途。
本发明还涉及商业包装,其包括一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐以及说明书,用于与一种或多种化学治疗剂和/或靶向特异性抗癌剂,如任何本文所述的那些同时、并行、连续或分开使用。
本发明还涉及商业包装,其基本上由作为唯一的活性成分的一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)- 苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐和说明书组成,用于与一种或多种化学治疗剂和/或靶向特异性抗癌剂,如任何本文所述的那些同时、并行、连续或分开使用。
本发明还涉及商业包装,其包括一种或多种化学治疗剂和/或靶向特异性抗癌剂,如任何本文所述的那些以及说明书,用于与一种或多种本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐同时、并行、连续或分开使用。
本发明的在联合治疗的上下文中提及的组合物、组合、制剂、剂型、试剂盒或包装还可以包括多于一种的本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐和/或多于一种的所述的本领域已知的抗癌剂。
本发明的组合或试剂盒的第一和第二活性成分可以作为分开的剂型(即相互独立)提供,其随后被放在一起以在联合治疗中同时、连续、分开或按时间顺序交错使用;或者包装后再放在一起作为组合包装的独立组分以在联合治疗中同时、并行、连续、分开或按时间排列交错使用。
本发明的组合或试剂盒的第一和第二活性成分的药物剂型的类型能够是相似的,即两种成分都被配制成独立的片剂或胶囊,或者能够是不同的,即适用于不同的给药形式,如一种活性成分被配制成片剂或胶囊并且另一种被配制成用于例如静脉内给药。
本发明的组合、组合物或试剂盒的第一和第二活性成分的量可以共同组成治疗有效量以治疗、预防或改善对组蛋白脱乙酰酶的抑制响应或敏感的疾病,例如本文所述的那些疾病之一,如良性或恶性瘤形成,特别是癌症,如任何一种本文所述的那些癌性疾病。
此外,本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐能够用于手术前或手术后的癌症治疗。
另外,本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4- 基)-苯磺酰基]-1H-吡咯-3-基}-丙烯酰胺盐能够与放射治疗联用,特别是用于使癌症患者对标准放射治疗敏感的致敏中。
本发明的组合能够指在固定组合(固定的单位剂型)中包含本发明的(E)-N-(2-氨基-苯基)-3-{1-[4-(1-甲基-1H-吡唑-4-基)-苯磺酰基]-1H- 吡咯-3-基}-丙烯酰胺盐和其它一种或多种活性抗癌剂的组合物,或包含两种或多种活性成分作为分离的独立剂型(非固定组合)的药物包。对于包含两种或多种活性成分的药物包,优选将该活性成分装入适于提高依从性的吸塑卡中。
每个吸塑卡优选包含一天的治疗要服用的药物。如果要在一天中的不同时间服用药物,能够根据每天需要服用药物的一天中的不同时间范围(例如早晨和晚上或者早晨、中午和晚上)将药物装入吸塑卡上的不同区域。使准备在每日特定时间一起服用的药物的泡罩腔适应于一天中各自的时间范围。当然也要将一天的不同时间以清晰可见的方式置于泡罩上。当然,还能够例如指出服药时间,如注明时间。
每天的部分可以占吸塑卡的一行,然后在该列中按时间顺序区分一天中的时间。
将必须在每日特定时间一起服用的药物放在一起置于吸塑卡的合适时间位置上,优选距离接近,使它们易于被推出泡罩,并具有不忘记从泡罩中取出剂型的作用。
- 还没有人留言评论。精彩留言会获得点赞!