利用内胚层干细胞规模化制备功能性胆管细胞的方法及其应用与流程
本发明涉及生物技术和细胞治疗领域。具体地,本发明涉及利用内胚层干细胞规模化制备功能性胆管细胞的方法及其应用。
背景技术:
肝脏由多种细胞类型组成,包括肝实质细胞、胆管细胞、内皮细胞、间充质细胞、枯丕细胞及循环血液细胞。肝脏实质细胞是肝脏的主要细胞组成,其为上皮样细胞,主要参与解毒、代谢调控及蛋白合成。此外,肝脏的另一类上皮样细胞为胆管细胞,其主要参与肝内胆管及肝外胆管的形成,负责肝细胞所生成的胆汁向小肠内的运输、修饰及分泌。
目前,成人与儿童内,胆管疾病均具有较高的致病率与死亡率。该疾病是胆管内上皮样细胞在遗传或环境因素的作用下表现出一系列紊乱行为的疾病,并最终导致终末肝病或恶变的转化。该疾病种类较多,如发育相关的alagille综合症,遗传相关的多囊纤维化肝脏疾病,自身免疫相关的原发性硬化胆管炎及原发性胆管坏死,不明原因的胆管闭锁。但对于这些疾病并无较为有效的治疗方案,对于较为严重的患者肝脏移植则为相对有效的治疗方法。胆管疾病有效治疗方案的发展往往受限于对发病机理研究的不足,多因原代胆管组织或细胞在体外较难获得及培养,而动物模型则又很难精准的模拟人类疾病。因此,发展较为可靠的,研究人类胆管发育及疾病发生的体外方案,将为胆管疾病的研究提供较为理想的平台。
然而目前的制备成熟胆管细胞的方案均高度依赖细胞外基质matrigel,因此,极大限制成熟胆管细胞的规模化制备。
并且,多能干细胞分化存在以下几点问题:1)安全性问题——任何残留在分化体系中的未分化多能干细胞都有可能在体内形成肿瘤(畸胎瘤/teratoma);2)分化细胞的功能问题——由多能干细胞直接分化为功能性细胞十分困难,目前由多能干细胞直接分化的终末分化细胞和成体细胞相比,在功能上都有很大的差距;3)分化细胞的纯度问题——多能干细胞的分化多能性决定了:诱导分化成的目标细胞中会参杂相当比例的同一和其他胚层的细胞类群,因而纯化目标细胞十分困难,同时,也使有关胚层之间相互作用的研究难以进行。此外,目前的研究发现,胚胎干细胞或诱导多能干细胞经体外诱导分化虽然可形成具有一定功能的胆管细胞,但其分化效率低,不能规模化制备,同时具有成瘤的危险。
因此,本领域迫切需要开发一种能够规模化制备可用于疾病模型及细胞移植的功能性胆管细胞或胆管细胞群的方法。
技术实现要素:
本发明公开了一种能够规模化制备可用于疾病模型及细胞移植的功能性胆管细胞或胆管细胞群的方法。
在本发明第一方面,提供了一种诱导人类内胚层干细胞分化为胆管细胞和/或胆管细胞群的方法,包括步骤:
(a)在第一培养条件下,在培养体系中培养内胚层干细胞,从而获得经肝脏特化的肝向内胚层(hepaticendoderm)细胞团;其中,所述培养体系包括bfgf、vegf、egf、和bmp4因子;
(b)在适合培养的条件下,在培养体系中培养步骤(a)获得的肝向内胚层(hepaticendoderm)细胞团,从而获得肝母细胞;
(c)在适合培养的条件下,在培养体系中培养步骤(b)获得的肝母细胞,从而获得胆管前体细胞;和
(d)在第二培养条件下,在培养体系中培养步骤(c)获得的胆管前体细胞,从而获得胆管细胞和/或胆管细胞群;其中,所述培养体系包括hgf、egf、tgfβ、dex、和tppb因子。
在另一优选例中,所述第一培养条件含有第一培养基。
在另一优选例中,所述第一培养基选自下组:sfd、dmem、dmem/f12、或其组合。
在另一优选例中,在步骤(b)中,所述培养体系为含有第二培养基和添加物的培养液,所述添加物包括bfgf、vegf、egf、hgf、osm、和dex因子;
在另一优选例中,在步骤(c)中,所述培养体系为含有第三培养基和添加物的培养液,所述添加物包括fgf10、activin-a、和retinoicacid。
在另一优选例中,所述的内胚层干细胞来源于人胚胎干细胞或人诱导多能干细胞。
在另一优选例中,所述多能干细胞选自下组:人胚胎干细胞系(如h9、hes2)、人诱导多能干细胞系(如wt-b5-g7)、或其组合。
在另一优选例中,所述的内胚层干细胞选自下组:h9、hes2、wt-b5-g7、或其组合。
在另一优选例中,所述第二培养基选自下组:sfd、dmem、dmem/f12、或其组合。
在另一优选例中,所述第三培养基选自下组:sfd、dmem、dmem/f12、或其组合。
在另一优选例中,所述第二培养条件含有第四培养基。
在另一优选例中,所述第四培养基中选自下组:bdm、sfd、dmem、或其组合。
在另一优选例中,在步骤(a)中,将内胚层干细胞在第一培养条件下培养2-15天,较佳地,3-10天,更佳地,6-7天。
在另一优选例中,在步骤(b)中,将肝向内胚层(hepaticendoderm)细胞团培养2-15天,较佳地,3-10天,更佳地,6-7天。
在另一优选例中,在步骤(c)中,将肝母细胞培养2-15天,较佳地,3-10天,更佳地,4-5天。
在另一优选例中,在步骤(d)中,将胆管前体细胞在第二培养条件下,培养2-15天,较佳地,3-10天,更佳地,6-7天。
在另一优选例中,所述方法具有选自下组的一个或多个特征:
(i)高胆管细胞和/或胆管细胞群分化率,所述分化率为80-98.5%,较佳地,90-95%;
(ii)在培养过程中,每1ml的培养液中接种1×106个内胚层干细胞,可产生3×106个胆管细胞和/或胆管细胞群;
(iii)胆管细胞和/或胆管细胞群为封闭的具有中空结构的单层细胞球囊,球囊直径大小200-400μm,球囊表面胆管细胞大小30-80μm,细胞层厚度5-10μm。
在另一优选例中,在步骤(a)-(d)中,所述培养体系中还含有促进分化的其他物质,选自下组:基质胶(matrigel)、层粘连蛋白(laminin)、基底膜提取物(basementmembraneextracts)、或其组合。
在另一优选例中,所述方法包括治疗性和非治疗性的。
在另一优选例中,所述的培养体系中,内胚层干细胞的密度为0.5-2x106细胞/ml,较佳地,0.8-1.5x106细胞/ml。
在另一优选例中,所述的培养体系为体积50-125ml,较佳地80-125ml,最佳地为80-100ml。
在另一优选例中,所述的获得的胆管细胞和/或胆管细胞群的数量m2与所述内胚层干细胞的数量m1之比m2/m1为1-3,较佳地1-2,更佳地1-1.5。
在另一优选例中,所述胆管细胞和/或胆管细胞群为功能性胆管细胞和/或胆管细胞群。
本发明第二方面提供了一种诱导人类内胚层干细胞分化为肝向内胚层细胞团的方法,包括步骤:
在第一培养条件下,在培养体系中培养内胚层干细胞,从而获得经肝脏特化的肝向内胚层(hepaticendoderm)细胞团;其中,所述培养体系包括bfgf、vegf、egf、和bmp4因子。
在另一优选例中,所述第一培养条件含有第一培养基。
在另一优选例中,所述第一培养基选自下组:sfd、dmem、dmem/f12、或其组合。
本发明第三方面提供了一种胆管细胞和/或胆管细胞群,所述胆管细胞和/或胆管细胞群为封闭的具有中空结构的单层细胞球囊,其中,所述胆管细胞和/或胆管细胞群的球囊直径大小200-400μm,球囊表面胆管细胞大小50-80μm,细胞层厚度5-10μm。
在另一优选例中,所述的胆管细胞和/或胆管细胞群具有选自以下一种或多种特征:
(a)95-98%的细胞为sox9表达阳性(sox9+);
(b)90-98%的细胞为和ck7表达阳性(ck7+);
(c)90-98%的细胞为cftr表达阳性(cftr+);
(d)85-95%的细胞为sox9与ck19、ck7共表达阳性;
(e)85-95%的细胞为cftr与ck7共表达阳性;
(f)95-98%的细胞为hnf4a表达阴性。
在另一优选例中,所述的胆管细胞和/或胆管细胞群由权利要求1所述方法制备获得。
在另一优选例中,所述的胆管细胞和/或胆管细胞群由内胚层干细胞诱导获得。
在另一优选例中,所述的胆管细胞和/或胆管细胞群的制备方法如下:
(a)enscs经由0.25%胰酶消化为单个细胞,并以1x106细胞每毫升的细胞密度于125ml的搅拌瓶生物反应器内进行胆管定向分化;
(b)在以sfd为基础培养基、添加bfgf、vegf、egf、bmp4因子的诱导作用下通过六天的连续培养完成肝脏特化,形成hepaticendoderm(肝向内胚层)细胞团;
(c)在以sfd为基础培养基、添加bfgf、vegf、egf、hgf、osm、dex因子的肝母细胞诱导条件下经由六天的定向分化形成肝母细胞;
(d)在以sfd为基础培养基、添加fgf10、activin-a、retinoicacid因子的胆管细胞特化条件下,经过4天的连续培养形成胆管前体细胞;
(e)在以bdm为基础培养基、添加hgf、egf、tgfβ、dex、tppb因子的诱导条件下形成成熟的胆管细胞;分化过程中每两天换液一次。
在另一优选例中,所述胆管细胞和/或胆管细胞群具有选自下组的一个或多个特征:
(a)sox9基因高表达;
(b)ck7基因高表达;
(c)cftr基因高表达;
(d)sox9与ck19、ck7共表达;
(e)cftr与ck7共表达;
(f)hnf4a基因不表达。
本发明第四方面提供了一种本发明第三方面所述胆管细胞和/或胆管细胞群的用途,用于(a)筛选促进胆管细胞和/或胆管细胞群分化的药物;和/或(ii)评估药物对胆管细胞和/或胆管细胞群毒性。
本发明第五方面提供了一种诱导培养基,所述诱导培养基含有基础培养基和添加物;其中所述基础培养基选自下组:sfd、dmem、dmem/f12、bdm、或其组合;并且,所述添加物包括bfgf、vegf、egf、和bmp4因子。
在另一优选例中,所述添加物还包括bfgf、vegf、egf、hgf、osm、和dex因子。
在另一优选例中,所述添加物还包括fgf10、activin-a、和retinoicacid。
在另一优选例中,所述添加物还包括hgf、egf、tgfβ、dex、和tppb因子。
本发明第六方面提供了一种诱导组合物,包括:
(a)第一诱导因子,所述第一诱导因子包括bfgf、vegf、egf、和bmp4因子;
(b)第二诱导因子,所述第二诱导因子包括bfgf、vegf、egf、hgf、osm、和dex因子;
(c)第三诱导因子,所述第三诱导因子包括fgf10、activin-a、和retinoicacid;
(d)第四诱导因子,所述第四诱导因子包括hgf、egf、tgfβ、dex、和tppb因子;和
(e)促进分化的其他物质,所述促进分化的其他物质选自下组:基质胶(matrigel)、层粘连蛋白(laminin)、基底膜提取物(basementmembraneextracts)、或其组合。
本发明第七方面提供了本发明第六方面所述的诱导组合物的用途,用于诱导内胚层干细胞分化为胆管细胞和/或胆管细胞群。
本发明第八方面提供了一种筛选或确定促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂的方法,包括步骤:
(a)在测试组中,在培养体系中,在测试化合物的存在下,培养内胚层细胞一段时间t1,检测测试组所述培养体系中的胆管细胞和/或胆管细胞群的数量m1;
并且在不存在所述测试化合物且其他条件相同的对照组中,检测对照组所述培养体系中的胆管细胞和/或胆管细胞群的数量m2;和
(b)将上一步骤所检测的m1、m2进行比较,从而确定所述测试化合物是否是促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂;
其中,如果m1显著高于m2,则表示所述测试化合物是促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂。
在另一优选例中,所述“显著高于”指m1/m2≥2,较佳地,≥3,更佳地,≥4。
在另一优选例中,所述的方法是非诊断和非治疗性的。
本发明第九方面提供了一种评估待测化合物对胆管细胞和/或胆管细胞群的毒性的方法,包括步骤:
(a)在测试组中,在培养体系中,在测试化合物的存在下,培养胆管细胞和/或胆管细胞群一段时间t1,检测测试组所述培养体系中的胆管细胞和/或胆管细胞群的选自下组的一种或多种指标:形态(如囊腔状结构完整性、球体通透情况、细胞贴附情况)、或细胞凋亡;
并且在不存在所述测试化合物且其他条件相同的对照组中,检测对照组所述培养体系中的胆管细胞和/或胆管细胞群的选自下组的一种或多种指标:形态(如囊腔状结构完整性、球体通透情况、细胞贴附情况)、或细胞凋亡;和
(b)将上一步骤所检测的一种或多种指标进行比较,从而评估待测化合物对胆管细胞和/或胆管细胞群是否具有毒性;
其中,如果测试组的囊腔状结构破坏、球体不通透、细胞贴附差或脱落,细胞出现凋亡现象,则表示待测化合物对胆管细胞和/或胆管细胞群具有毒性。
在另一优选例中,所述的方法是非诊断性和非治疗性的。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
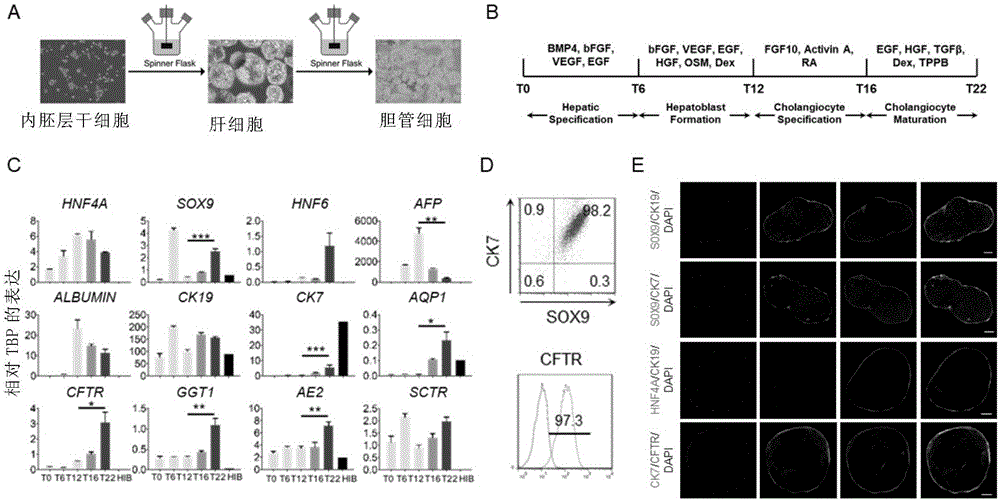
图1显示了内胚层干细胞规模化制备胆管细胞;其中,
a.利用转瓶生物反应器由ensc规模化制备胆管细胞流程图。
b.用于胆管细胞规模化制备的分步分化方案。
c.实时定量pcr结果显示胆管细胞形成过程中相关基因动态表达变化。在胆管细胞形成过程中,其经历肝向内胚层特化(t6)、肝母细胞形成(t12)、胆管前体特化(t16)及终末胆管细胞等阶段。终末胆管细胞中,成熟胆管相关因子sox9、hnf6、ck7、aqp1表达显著增加,肝母细胞及肝实质细胞标识物afp、albumin的表达逐步减弱。
d.流式细胞分析ensc所得胆管细胞中sox9、ck7共表达及cftr表达情况,终末所得胆管细胞ck7+sox9+细胞高于98%,cftr阳性细胞可高达97%,证实所得细胞为胆管细胞。
e.e-cho细胞免疫荧光分析表明,终末形成的胆管细胞为中空囊腔状结构,胆管重要转录因子sox9与重要膜蛋白ck19、ck7呈现共表达状态。并且,获得的胆管细胞不表达肝细胞标志物hnf4a。此外,胆管功能性标志物cftr与成熟胆管标识物ck7亦呈现共表达状态。以上结果显示内胚层干细胞能够规模化高效制备胆管细胞。
图2显示了e-chos胆管体外功能鉴定;其中,
a.h9来源e-chos对胆汁荧光素(clf)的外排实验。fitc为对照组荧光染料。比例尺:50μm
b.利用imagej测量胆汁荧光素(clf)及对照组荧光染料(fitc)荧光变化值。
c.胆汁荧光素(clf)及对照组荧光染料(fitc)荧光变化值的统计结果。***:p<0.0001。
d.h9来源e-chos在matrigel中形成三维囊腔结构。比例尺:100μm
e.e-chos三维囊腔结构中细胞极性蛋白zo1与胆管功能蛋白cftr免疫荧光染色。图片由激光共聚焦显微镜(olympusfv1200)采集完成。比例尺:50μm
f.h9来源e-chos三维囊腔结构中mdr1功能检测。rhodamine通过mdr1被转运至腔内。在mdr1抑制剂verapamil的作用下,抑制rhodamine的转运。比例尺:50μm
g.利用imagej测量rhodamine与verapamil的作用下的荧光值变化。
h.rhodamine及verapamil荧光变化值的统计结果。***:p<0.0001。
i.e-chos三维囊腔吸收fd的荧光染料,并将代谢荧光素分泌至囊腔内。比例尺:50μm
j.利用imagej测e-chos三维囊腔内fd荧光染料去除0min与去除30min的荧光变化值。
k.fd荧光染料去除0min与去除30min的荧光变化值的统计结果。***:p<0.0001。
l.h9来源e-chos三维囊腔对camp信号激活剂forskolin具有膨大响应。处理时间为4小时。对囊腔结构分别进行三个不同轴向的测量。
m.h9来源e-chos三维囊腔对camp信号激活剂forskolin膨大响应的统计结果。***:p<0.0001。
n.e-chos三维囊腔对分泌素secretin具有膨大响应。处理时间分别为30min、90min。对囊腔结构分别进行三个不同轴向的测量。
o.e-chos三维囊腔对分泌素secretin膨大响应的统计结果。***:p<0.0001。
图3显示了e-chos胆管体内功能鉴定;其中,
a植入nsg小鼠肾包膜下的胆管细胞ck7与ki67的免疫荧光染色,表明植入的胆管细胞在体内获得了增殖的能力并保持胆管特性。比例尺:50μm;
b.植入nsg小鼠肾包膜下的胆管细胞ck7与sox9的免疫荧光染色,表明植入的胆管细胞在体内保持胆管特性并形成管状结构。比例尺:50μm。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,在本发明的第一培养条件下,在培养体系中培养内胚层干细胞,能够获得经肝脏特化的肝向内胚层(hepaticendoderm)细胞团。
并且,本发明还意外的发现,在适合培养的条件下,进一步培养肝向内胚层(hepaticendoderm)细胞团,可获得胆管前体细胞,将胆管前体细胞在第二培养条件下培养,可获得成熟的功能性的胆管细胞和/或胆管细胞群,并且本发明的胆管细胞和/或胆管细胞群的分化率>90%(如98%),胆管细胞和/或胆管细胞群具有>95%,如98%的纯度。并且,本发明的胆管细胞和/或胆管细胞群为三维的具有中空结构的球囊,还可用来筛选促进胆管细胞和/或胆管细胞群分化的药物;和/或评估药物对胆管细胞和/或胆管细胞群毒性。在此基础上,本发明人完成了本发明。
术语
如本文所用,如非特指单个细胞,术语“胆管细胞”、“胆管细胞群”、能互换使用,指的是经本发明方法制备获得的胆管细胞群,所述胆管细胞和/或胆管细胞群为封闭的具有中空结构的单层细胞球囊结构,其中,所述胆管细胞和/或胆管细胞群的球囊直径大小200-400μm,球囊表面胆管细胞大小30-80μm,细胞层厚度5-10μm,并且其还具有以下一种或多种特征:
(a)sox9基因高表达;
(b)ck7基因高表达;
(c)cftr基因高表达;
(d)sox9与ck19、ck7共表达;
(e)cftr与ck7共表达;
(f)hnf4a基因不表达。
内胚层干细胞
如本文所用,术语“人类内胚层干细胞”、“内胚层干细胞”能互换使用,均指由人类多能干细胞建立的内胚层干细胞。本文的内胚层干细胞可以来源于胚胎干细胞或诱导多能干细胞。
胆管细胞和/或胆管细胞群的诱导培养方法
本发明的胆管细胞和/或胆管细胞群的起始细胞为人类胚胎干细胞,在第一培养条件下进行培养,从而获得经肝脏特化的肝向内胚层(hepaticendoderm)细胞团,其中,所述第一培养条件下的培养体系包括bfgf、vegf、egf、和bmp4因子。
接着,在适合培养的条件下(如在含有第二培养基和添加物(包括bfgf、vegf、egf、hgf、osm、和dex因子)的条件下),对经肝脏特化的肝向内胚层(hepaticendoderm)细胞团进一步培养,获得肝母细胞。
在适合培养的条件下(如在含有第三培养基和添加物(包括fgf10、activin-a、和retinoicacid)的条件下),对肝母细胞进一步培养,获得胆管前体细胞。
然后,在第二培养条件下,对胆管前体细胞进行培养,获得功能性的胆管细胞和/或胆管细胞群;其中,所述第二培养条件下的培养体系包括hgf、egf、tgfβ、dex、和tppb因子。
在一优选实施方式中,本发明的培养体系中还含有促进分化的其他物质,选自下组:基质胶(matrigel)、层粘连蛋白(laminin)、基底膜提取物(basementmembraneextracts)、或其组合。
在一优选实施方式中,本发明的诱导人类内胚层干细胞分化为胆管细胞和/或胆管细胞群的方法包括:
enscs经由0.25%胰酶消化为单个细胞,并以1x106细胞每毫升的细胞密度于125ml的搅拌瓶生物反应器内进行胆管定向分化。其在以sfd为基础培养基、添加bfgf、vegf、egf、bmp4因子的诱导作用下通过六天的连续培养完成肝脏特化,形成hepaticendoderm(肝向内胚层)细胞。随后,在以sfd为基础培养基、添加bfgf、vegf、egf、hgf、osm、dex因子的肝母细胞诱导条件下经由六天的定向分化形成肝母细胞。在以sfd为基础培养基、添加fgf10、activin-a、retinoicacid因子的胆管细胞特化条件下,经过4天的连续培养形成胆管前体细胞。最终,在以bdm为基础培养基、添加hgf、egf、tgfβ、dex、tppb因子的诱导条件下形成成熟的胆管细胞。分化过程中每两天换液一次。
在一优选实施方式中,第一培养条件下的第一培养基、第二培养基、第三培养基中的基础培养基为sfd(serumfreedifferentiationmedium),包括以下组分:
75%iscove的改良dulbecco's培养基(imdm)(cellgro),添加有0.5倍n2和b27补充剂(gibco-brl),1%青霉素/链霉素,0.05%牛血清白蛋白的25%ham'sf12培养基(cellgro)。
在本发明中,第二培养条件下的第四培养基为bdm(biliarydifferentiationmedium),为添加有10mm烟酰胺(sigma-aldrich),17mm碳酸氢钠(sigma-aldrich),0.2mm2-磷酸-1-抗坏血酸三钠盐(sigma-aldrich),6.3mm丙酮酸钠(invitrogen),14mm葡萄糖(sigma-aldrich),20mmhepes(invitrogen),its+预混物(bdbiosciences),0.1μm地塞米松(r&dsystems),2mmglutamax(invitrogen),100u/ml青霉素,100μg/ml链霉素的william'se培养基(gibco,lifetechnologies)。
筛选或确定促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂的方法
在本发明中,提供了筛选或确定促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂的方法,包括步骤:
(a)在测试组中,在培养体系中,在测试化合物的存在下,培养内胚层细胞一段时间t1,检测测试组所述培养体系中的胆管细胞和/或胆管细胞群的数量m1;
并且在不存在所述测试化合物且其他条件相同的对照组中,检测对照组所述培养体系中的胆管细胞和/或胆管细胞群的数量m2;和
(b)将上一步骤所检测的m1、m2进行比较,从而确定所述测试化合物是否是促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂;
其中,如果m1显著高于m2,则表示所述测试化合物是促进内胚层干细胞分化为胆管细胞和/或胆管细胞群的潜在治疗剂。
在另一优选例中,所述“显著高于”指m1/m2≥2,较佳地,≥3,更佳地,≥4。
在另一优选例中,所述的方法是非诊断和非治疗性的。
评估待测化合物对胆管细胞和/或胆管细胞群的毒性的方法
在本发明中,提供了一种评估待测化合物对胆管细胞和/或胆管细胞群的毒性的方法,包括步骤:
(a)在测试组中,在培养体系中,在测试化合物的存在下,培养胆管细胞和/或胆管细胞群一段时间t1,检测测试组所述培养体系中的胆管细胞和/或胆管细胞群的选自下组的一种或多种指标:形态(如囊腔状结构完整性、球体通透情况、细胞贴附情况)、细胞凋亡;
并且在不存在所述测试化合物且其他条件相同的对照组中,检测对照组所述培养体系中的胆管细胞和/或胆管细胞群的选自下组的一种或多种指标:形态(如囊腔状结构完整性、球体通透情况、细胞贴附情况)、细胞凋亡;和
(b)将上一步骤所检测的指标进行比较,从而评估待测化合物对胆管细胞和/或胆管细胞群是否具有毒性;
其中,如果测试组的囊腔状结构破坏、观察球体不通透、细胞贴附差或脱落,细胞出现凋亡现象,则表示待测化合物对胆管细胞和/或胆管细胞群具有毒性。
本发明的主要优点包括:
(1)本发明首次发现,本发明在培养体系中培养内胚层干细胞,可获得极高分化率(高达98%)的功能性胆管细胞和/或胆管细胞群,并且本发明的胆管细胞和/或胆管细胞群为具有三维结构的封闭的具有中空结构的球囊,并且本发明的功能性胆管细胞和/或胆管细胞群的纯度也非常高,高达98%。
(2)本发明首次以内胚层特异的干细胞为起点,结合三维培养技术,优化培养条件,并在体外合适诱导剂的作用下,规模化制备可用于疾病模型及细胞移植的功能性胆管细胞,可为胆管疾病的研究及治疗源源不断的提供功能细胞。
(3)本发明首次通过优化体外诱导分化条件,利用悬浮培养的三维培养方法来制备功能性胆管细胞。并验证其胆管样细胞的生理功能,最终利用规模化培养技术得到足够数量的可用于细胞移植的功能性胆管细胞。
(4)用本发明的诱导方法所得的胆管细胞具有广泛的应用前景:a)为胆管疾病药物筛选提供很好的模式细胞;b)为人类胆管发育提供较好的体外研究模型;c)为组织工程肝脏体外构建提供用于胆管化构建种子细胞。
(5)本发明所获得的胆管细胞和/或胆管细胞群可用于(a)筛选促进胆管细胞和/或胆管细胞群分化的药物;和/或(ii)评估药物对胆管细胞和/或胆管细胞群毒性。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
除非另有说明,否则本发明实施例中所用的试剂和材料均为市售产品。
通用材料和方法
1.内胚层干细胞(enscs)的制备与维持
人类多能干细胞在高浓度activina的体外诱导作用下形成定向内胚层(d’amouretal.,2006;nostroetal.,2011)。进而通过流式细胞分选技术分离定向内胚层中cxcr4+cd117+细胞类群,在含有bmp4、bfgf、egf、vegf的无血清培养条件下维持内胚层干细胞系。
2.由内胚层干细胞(enscs)规模化制备胆管细胞
该系统利用h9、hes2、wt-b5-g7人类多能干细胞来源的内胚层干细胞来制备胆管细胞。其在以sfd为基础培养基、添加bfgf、vegf、egf、bmp4因子的诱导作用下通过六天的连续培养完成肝脏特化,形成hepaticendoderm(肝向内胚层)细胞。随后,在以sfd为基础培养基、添加bfgf、vegf、egf、hgf、osm、dex因子的肝母细胞诱导条件下经由六天的定向分化形成肝母细胞。在以sfd为基础培养基、添加fgf10、activin-a、retinoicacid因子的胆管细胞特化条件下,经过4天的连续培养形成胆管前体细胞。最终,在以bdm为基础培养基、添加hgf、egf、tgfβ、dex、tppb因子的诱导条件下形成成熟的胆管细胞。分化过程中每两天换液一次。
3.流式细胞检测
分化形成的胆管细胞球在经由胶原酶b消化处理两个小时后,利用0.25%胰酶进一步消化20分钟,最终细胞球消化为单个细胞。对于细胞表面标志物的染色则在含有0.2%bsa的pbs溶液中进行。对于ck19、ck7、sox9的染色,细胞则利用4%的多聚甲醛进行固定,染色缓冲液为含有10%fbs的pbs溶液。利用流式细胞仪(caliburbd)对染色后细胞进行比例分析。
4.细胞免疫荧光
分化形成的细胞球在37度,4%pfa条件下固定一小时,随后用0.3%triton-100通透处理5分钟,pbs室温清洗三次,3%bsa常温封闭两小时。一抗四度过夜,pbs清洗三次,二抗常温两小时,pbs清洗三次,利用dapi进行细胞核染色。leicatcssp5激光共聚焦显微镜对染色细胞球进行结果分析。
5.组织免疫荧光
组织经4%pfa固定后,oct包埋,冰冻切片;取片pbs清洗两遍;0.2%tritonx-100室温处理5分钟,pbs洗三遍;用pbs稀释的1%bsa室温封闭60分钟;用封闭液稀释一抗,四度过夜,pbs洗三遍;用封闭液稀释二抗,室温避光孵育40分钟,pbs洗三遍;封片,进行激光共聚焦显微观察。
6.胆管三维结构的形成
内胚层来源的胆管细胞经胶原酶与胰酶消化处理后,可形成单个细胞悬液。细胞与鼠尾胶原及matrigel混合物充分混合,将细胞混合物置于24孔transwell内,37度放置三小时。在含有20ng/mlhgf与50ng/mlegf的培养条件下进行囊腔结构的形成。
7.cftr功能实验
三维囊状细胞结构经dpbs冲洗三次,利用含有camp激活剂forskolin(10μm)的dpbs在37℃培养四小时。图片利用leica图像软件拍摄,对胆管类器官的三个随机方向进行直径测量,后期通过imagej软件进行结果分析。
8.secretin功能实验
三维囊状细胞结构经dpbs冲洗三次,利用含有secretin(100nm)的dpbs在37℃分别培养30分钟及90分钟。图片利用leica图像软件拍摄,对胆管类器官的三个随机方向进行直径测量,后期通过imagej软件进行结果分析。
9.fda功能实验
三维囊状细胞结构经dpbs冲洗三次,利用含有fda(2.5μg/ml)的dpbs在37℃分别培养15分钟。随后,将培养液更换为dpbs继续培养30分钟,进一步诱导fda转运至囊腔结构中。利用激光共聚焦显微镜(olympusfv1200)对fda转运前后的细胞进行拍摄。图片利用olympus图像软件拍摄。每个胆管类器官的荧光强度变化在一个直径方向进行测量,并利用imagej软件进行结果分析。
10.利用罗丹明对mdr1转运体功能分析
三维囊状细胞结构经dpbs冲洗三次,利用含有罗丹明(100μm)的dpbs在37℃培养10分钟。随后,将培养液更换为dpbs继续培养40分钟,进一步诱导罗丹明转运至囊腔结构中。为了抑制mdr1活性,在加入罗丹明之前,细胞球预先利用verapamil(20μm)37℃培养30分钟。利用激光共聚焦显微镜(olympusfv1200)对不同条件处理的细胞进行拍摄。图片利用olympus图像软件拍摄。每个胆管类器官的荧光强度变化在一个直径方向进行测量,并利用imagej软件进行结果分析。
11.cholyl-lysyl-fluorescein(clf)转运实验
胆管细胞球经dpbs冲洗三次,利用含有clf(20μm)的dpbs在37℃培养30分钟。随后,细胞经dpbs冲洗三次。在第三次冲洗结束后,利用荧光显微镜(olympusix71)对细胞球进行连续观察10分钟。为证实细胞球中荧光的丢失是clf通过转运体送至细胞外,我们利用fitc(5μm)荧光染料对细胞球进行同样时间的培养处理,及进行细胞球的连续观察。每个胆管球的荧光强度变化在一个直径方向进行测量,并利用imagej软件进行结果分析。
12.胆管细胞球的肾包膜移植
购买免疫缺损型小鼠模型nsg,对其进行麻醉处理后,取适量胆管球细胞(约2百万胆管细胞)植入一侧小鼠肾脏。饲养两个月后,牺牲实验小鼠取其肾脏进行组化结果分析。
实施例1内胚层干细胞规模化制备胆管细胞
早期研究表明,人类多能干细胞体外分化能够形成胆管细胞。但这些系统多基于二维贴壁分化系统或高度依赖基质胶的分化系统,从而限制胆管细胞的规模化获取。在此,我们以内胚层干细胞为种子细胞,利用搅拌瓶生物反应器规模化制备胆管细胞(e-chos)(图1,a)。同时,经过反复尝试,我们发明适合内胚层干细胞向胆管方向定向发育的分化方法(图1,b)。实时定量pcr结果表明定向分化第六天内胚层干细胞完成肝脏特化,伴随内胚层转录因子sox17与eomes基因表达的显著下调,以及tbx3的瞬时高表达。基因afp与ck19及sox9的共表达表明在细胞分化第十二天形成肝母细胞(图1,c)。随着肝母细胞逐渐成熟为胆管细胞,肝向标识物hnf4a、afp、albumin的表达逐步减弱,胆管成熟相关因子sox9、hnf6、ck7、aqp1、cftr、ggt1、ae2表达显著增加(图1,c)。成熟胆管重要标志物sox9、ck7流式细胞染色显示,终末分化胆管细胞(e-chos)纯度高达98%(图1,d)。胆管功能性标志物cftr染色显示终末分化细胞约97%表达cftr(图1,e)。e-chos细胞免疫荧光分析表明分化所形成细胞球为中空囊腔球状结构,胆管重要转录因子sox9与重要膜蛋白ck19、ck7呈现共表达状态(图1,e)。此外,胆管功能性标志物cftr与成熟胆管标识物ck7亦呈现共表达状态(图1,e)该分化系统中,1个内胚层干细胞能够形成3.09±0.12个成熟胆管细胞。该结果进一步表明我们能够利用内胚层干细胞规模化制备胆管细胞。
实施例2e-chos体外功能评估
胆管细胞为胆管内上皮样细胞,肝脏细胞重要组份。其能够在内源或外源刺激作用下被激活,其不仅具有合成一定胆汁的能力,还能够通过特定转运体来调节胆汁的体积与组成。首先,我们证实终末所得e-chos具有极性胆汁及胆汁盐受体(asbt)介导的胆汁酸转运活性。相比于对照组荧光素fitc,e-chos能够将所吸收胆汁荧光素(clf)排除细胞外(图2,a,b,c)。通过10天的三维matrigel培养,e-chos能够形成囊腔结构,进一步证实其胆管特性。紧密连接分子zo1与胆管功能膜蛋白cftr的免疫荧光染色进一步证明所得囊腔结构具有顶端基底极性(图2,d,e)。在极性结构形成之后,我们进一步评估胆管囊腔结构通过mdr1转运体介导的运输过程,e-chos能将吸收的罗丹明123荧光底物运送至腔内。相反,verapamil作为mdr1的抑制剂,其能够有效阻止mdr1所介导的运输作用(图2,f,g,h)。此外,囊腔中的胆管细胞能够吸收fd荧光染料,并将代谢荧光素分泌至囊腔内(图2,i,j,k)。同时,胆管囊腔具有cftr所介导的囊腔膨胀能力,因此,我们利用camp信号激活剂forskolin对胆管结构进行处理,结果显示在处理四小时后,囊腔结构膨大约8.47±1.47%(图2,l,m),证实其具有cftr介导的膨胀能力。此外,有研究表明激素类如分泌素能够促进成体肝脏组织中囊状结构的膨胀。分泌素处理30分钟后囊腔结构膨大约4.41±0.35%,处理90分钟后膨大比例为5.06±0.43%(图2,n,o)。以上体外试验证实,ensc所得胆管细胞为功能能性胆管细胞。
实施例3e-chos体内功能评估
胆管细胞的体内生长能力对于其在再生医学领域的应用至关重要。将胆管细胞球通过肾包膜植入nsg小鼠内,两个月后牺牲小鼠进行细胞整合与存活研究。组织免疫荧光染色结果显示,e-chos能够成功形成胆管状结构并重新获得增殖能力(3,a,b)。
讨论
(1)由多能干细胞获得成熟胆管细胞的研究相对较少,多以期高度模仿体内发育状态。然而,多能干细胞作为起始细胞需经历较多的分化步骤,如中内内胚层、定向内胚层、肝向内胚层、肝母细胞、及终末胆管细胞等阶段。因此,终末细胞的总体分化效率与细胞纯度具有一定的局限性。更为重要的是,多能干细胞分化系统中任何未分化的细胞在受体病人内具有形成畸胎瘤的风险。此外,这些分化方案均依赖高浓度的基质胶。因此,进一步限制终末细胞的规模化制备。为克服以上不足,本发明选择内胚层干细胞作为分化的起点,其体内无成瘤性,以规模化制备成熟胆管细胞。
(2)干细胞所得胆管细胞在胆管疾病模型研究、体外肝脏器官构建及胆管疾病细胞治疗等应用中具有广阔的前景,这进一步要求我们能够在体外规模化制备成熟胆管细胞。在此,本发明以内胚层干细胞为起点,建立高效三维悬浮分化系统以规模化制备成熟胆管细胞。
(3)该三维分化系统优势体现在以下几方面:1)增殖能力极强的内胚层干细胞在三维悬浮分化条件下能够高效形成极性囊腔状类器官;2)内胚层干细胞所得成熟胆管细胞具有极高的细胞纯度;3)内胚层干细胞所得成熟胆管细胞具有较强的胆管细胞体外功能。4)内胚层干细胞所得成熟胆管细胞具有体内成管能力。
(4)未来,本发明将会发挥内胚层干细胞所得成熟胆管细胞在人类胆管疾病模型研究、肝脏器官体外重构及胆管疾病细胞治疗等应用中的重要作用。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!