一种磁性水凝胶微球的制备方法与流程
本发明涉及污水处理领域,尤其涉及一种具有磁性的石墨烯基复合水凝胶微球的制备方法。
背景技术:
工业废水中含有大量的污染物如重金属离子和有机染料等,其处理方式是近些年来的研究热点。相比于传统的电沉积和过滤等处理方式而言,物理吸附具有成本低、操作简单、不引起二次污染等优点。尽管如此,传统的吸附材料包括活性炭、木屑、煤渣、火山灰等普遍存在吸附效率低、选择吸附性差、难回收等缺点。水凝胶内部的多孔结构赋予其巨大的比表面积,可以为污染物吸附提供大量的附着位点。因此,被视作一种良好的污染物吸附材料受到众多研究人员的亲赖。
然而,目前所研究的水凝胶体系如甲壳素水凝胶对污染物的吸附量和吸附速率普遍较低,如文献Water Res., 2004, 38, 2643-2650; J. Mater. Chem. A, 2013, 1, 1992-2001; Carbon, 2011, 49, 827-837。吸附量低的原因主要是聚合物基体与污染物本身相互作用较弱,吸附速率低主要是由于水凝胶较大的体积和有限的开孔率不利于污染物在其中的扩散。针对吸附量低的问题人们普遍将无机纳米粒子引入到水凝胶体系,进而增强复合水凝胶与污染物的相互作用。然而,对于吸附速率低的问题却未能很好地解决。此外,上述水凝胶还存在制备效率低、成本高、难以规模化生产的问题。
技术实现要素:
针对上述问题,本发明的目的是提供一种工艺简单,吸附速率高、微球易于分离并可循环利用的适合工业化生产的磁性水凝胶微球的制备方法,使得到的水凝胶微球对重金属粒子(如六价铬离子Cr6+)和有机染料具有优异的吸附性能。
为达到本发明目的,采用如下技术方案:
所述的磁性水凝胶微球的制备方法包括如下步骤:
(1)将氧化石墨分散于去离子水中,超声剥离,得到氧化石墨烯的分散液。而后在惰性气氛下加入Fe2+铁盐和Fe3+铁盐和碱性物质,反应后得到氧化石墨烯(GO)和纳米Fe3O4的混合物GO@Fe3O4。
(2)将水溶性高分子溶解在蒸馏水中,而后在其中加入交联剂和GO@Fe3O4,超声分散后再搅拌。最后,将混合溶液通入喷雾干燥机制备出具有磁性的水凝胶微球。
所述步骤(1)中氧化石墨既可以通过Hummer法制备,也可以通过Staudenmaier法制备。
惰性气氛可以是氮气和氩气中的一种或两种按任意比混合而成。
Fe2+铁盐选FeSO4、FeCl2·4H2O、Fe(NO3)2中的一种或几种,Fe3+铁盐选Fe2(SO4)3、FeCl3·6H2O、Fe(NO3)2中的一种或几种。碱性物质可以是NH3·H2O、NaOH、Ca(OH)2中的一种或几种。
所述步骤(1)中氧化石墨烯的分散液的浓度为1-10 mg/mL,铁源中Fe2+和Fe3+的摩尔比为2:1-1:3,碱性物质加入量占溶液总重量的1-10 wt.%。
所述步骤 (2)中的水溶性高分子可以是纤维素衍生物如甲基纤维素、乙基纤维素、羟乙基纤维素、羧甲基纤维素、羟丙基甲基纤维素等的一种或几种,交联剂是柠檬酸、乙二醛、戊二醛、二乙烯基砜、多元酸酐、环氧氯丙烷中的一种或几种。
所述步骤(2)中的水溶性高分子的固含量为1-2%;交联剂的添加量为水溶性高分子重量的1-10 wt.%;GO@Fe3O4的添加量占水溶性高分子重量的1-20 wt.%。优选:GO@Fe3O4的添加量占水溶性高分子重量的8-10 wt.%。
所述步骤(2)中喷雾干燥装置的参数设置为进口温度为110~160 °C,进样量为500-800 mL/h,空气流量为60~90%。
与现有技术相比,本发明将氧化石墨烯(GO)和纳米四氧化三铁Fe3O4粒子同时引入到水溶性的天然高分子体系中并通过喷雾干燥法制备出磁性的水凝胶微球。该类材料和方法具有以下优点:(1)GO和纳米Fe3O4可以提高水凝胶对污染物的吸附种类和吸附量;(2)Fe3O4纳米粒子赋予微球一定的磁性,使之易于分离;(3)微球的结构设计赋予了该类水凝胶较大的比表面积,大幅提升了对污染物的吸附效率;(4)所得GO@Fe3O4的产率高,为80-95%。且喷雾干燥法制备复合微球具有工艺简单、成本低、易规模化生产的优点。该方法具有良好的市场应用前景。
附图说明
图1为本发明实施例1所制备的磁性水凝胶微球的扫描电镜(SEM)图。
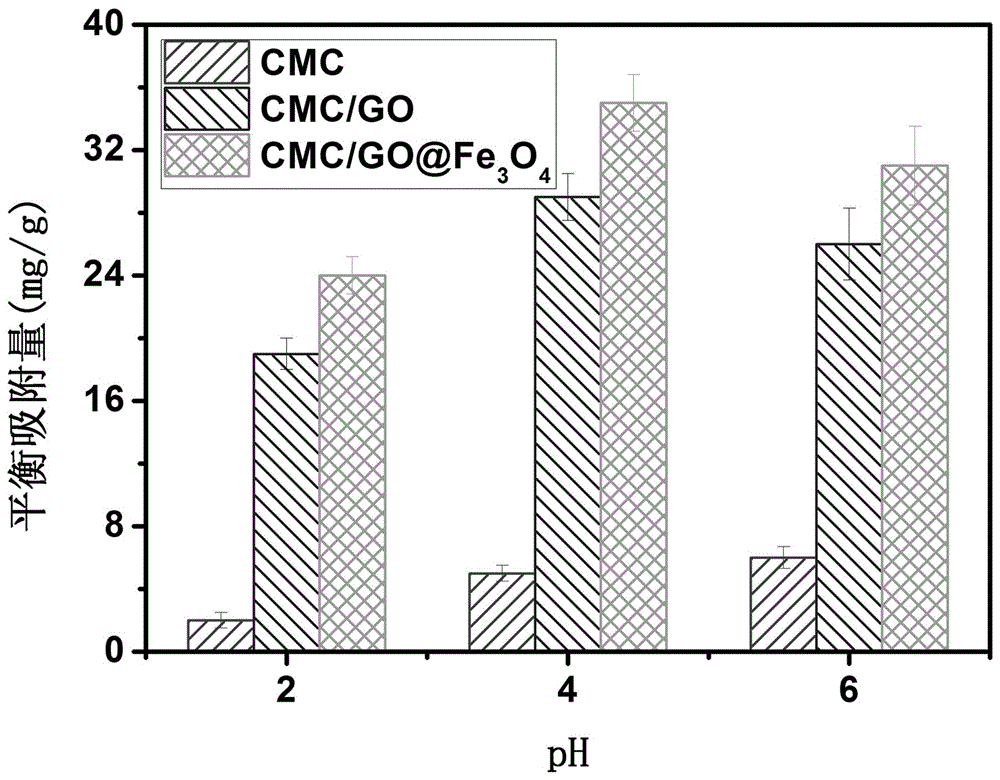
图2为本发明实施例1所制备的水凝胶微球在不同pH下,Cr6+的吸附量变化直方图。
具体实施方式
为更好地说明本发明,便于理解本发明的技术方案,本发明的典型但非限制性的实施例如下:
实施例1:
(1)将0.5 g的Hummers法所制备的氧化石墨超声分散于100 mL去离子水中,得到浓度为5 mg/mL的GO分散液。然后,在氮气氛围下,在其中加入1.5 g的铁盐(Fe2+和Fe3+的摩尔比为1:2)和0.2g NaOH溶液,反应30 min,得到GO@Fe3O4的混合物,离心分离后干燥待用。
(2)取5 g CMC于60 °C下溶于500 mL蒸馏水中,然后在其中加入0.435 g的GO@Fe3O4和0.2 g的柠檬酸,超声分散后磁力搅拌3 h,再用喷雾干燥机制备GO@Fe3O4含量为8 wt%的CMC复合微球,标记为CMC/GO@Fe3O4。所述喷雾干燥装置的参数设置为进口温度为150~160 °C,进样量为600-800 mL/h,空气流量为80~90%。最后,将所得到的复合微球在90 °C的烘箱中干燥5 h后密封备用。
此外,纯CMC微球(标记为CMC)和仅含有GO的CMC微球(标记为CMC/GO)也用相同的方法制备出来并用作对比例。
本发明制得的复合微球的SEM分析结果表明:CMC/GO@Fe3O4复合微球的粒径为2-5 μm(图1),微球具有良好的可控性和单分散性。以Cr6+为污染物模型,对微球的吸附性能测试(Cr6+的初始浓度为200 mg/L,测试温度15 °C),图2数据表明:(1)在pH = 4时,CMC基水凝胶微球的吸附量接近最大值;(2)GO的存在大幅增强了复合水凝胶微球对Cr6+的吸附量,而纳米Fe3O4粒子的引入不仅提高了其对重金属离子的吸附量,同时复合微球的磁性还加快了复合微球的分离速率,便于其循环使用。例如,8 wt% GO@Fe3O4含量的CMC复合微球对Cr6+的饱和吸附量达到了35 mg/g,较对比例中的CMC和CMC/GO的吸附量有显著的提高且该复合微球可在30 min内达到吸附平衡。复合微球的特殊结构有效保证了其对污染物的快速吸附。并且易于分离,利于循环使用。
实施例2:
本实施例2按实施例1相同的方式制备CMC/GO@Fe3O4复合水凝胶微球,区别仅在于本实施例中的复合微球的GO@Fe3O4的含量为2 wt%。结果表明,本实施例中的水凝胶微球在pH = 4时对六价铬离子的吸附量为9 mg/g。
实施例3:
本实施例3按实施例1相同的方式制备CMC/GO@Fe3O4复合水凝胶微球,区别仅在于本实施例中的复合微球的GO@Fe3O4的含量为4 wt%。结果表明,本实施例中的水凝胶微球在pH = 4时对六价铬离子的吸附量为17 mg/g。
实施例4:
本实施例4按实施例1相同的方式制备CMC/GO@Fe3O4复合水凝胶微球,区别仅在于本实施例中的复合微球的GO@Fe3O4的含量为6 wt%。结果表明,本实施例中的水凝胶微球在pH = 4时对六价铬离子的吸附量为24 mg/g。
实施例5:
(1)将1 g的Staudenmaier法所制备的氧化石墨超声分散于100 mL去离子水中,得到浓度为10 mg/mL的GO分散液。然后,在氮气氛围下,在其中加入1.5 g的铁盐(Fe2+和Fe3+的摩尔比为1:1)和0.1 g NH3·H2O溶液,反应30 min,得到GO@Fe3O4的混合物,离心分离后干燥待用。
(2)取5 g甲基纤维素溶于500 mL蒸馏水中,然后在其中加入1 g的GO@Fe3O4和1 g戊二醛,超声分散后磁力搅拌3 h,再用喷雾干燥机制备GO@Fe3O4含量为10 wt%的CMC复合微球,标记为CMC/GO@Fe3O4。所述喷雾干燥装置的参数设置为进口温度为120~130 °C,进样量为500-600 mL/h,空气流量为70~80%。最后,将所得到的复合微球在90 °C的烘箱中干燥5 h后密封备用。结果表明,本实施例中的水凝胶微球在pH = 4时对六价铬离子的吸附量为47 mg/g。
所制备的复合微球在水处理方面可用作一类广谱型吸附剂,具有绿色、高效、易分离等特点,良好的市场应用前景。
- 还没有人留言评论。精彩留言会获得点赞!