用CD37-特异性和CD20-特异性结合分子减少B-细胞的制作方法
本申请根据35U.S.C.§119要求美国专利申请No.60/702,499(申请日2005年07月25日)和美国专利申请No.60/798,344(申请日2006年05月16日)的利益,该各项专利申请在此整体并入作为参考。
技术领域:
总体来说,本发明提供了在个体中用CD37-特异性结合分子减少B-细胞的方法。具体地,本发明提供了用单独CD37-特异性结合分子,或者CD37-特异性结合分子和CD20-特异性结合分子的组合,在某些情况下协同组合,减少B-细胞的方法。本发明还提供了治疗涉及异常B-细胞活性的疾病的材料和方法。
背景技术:
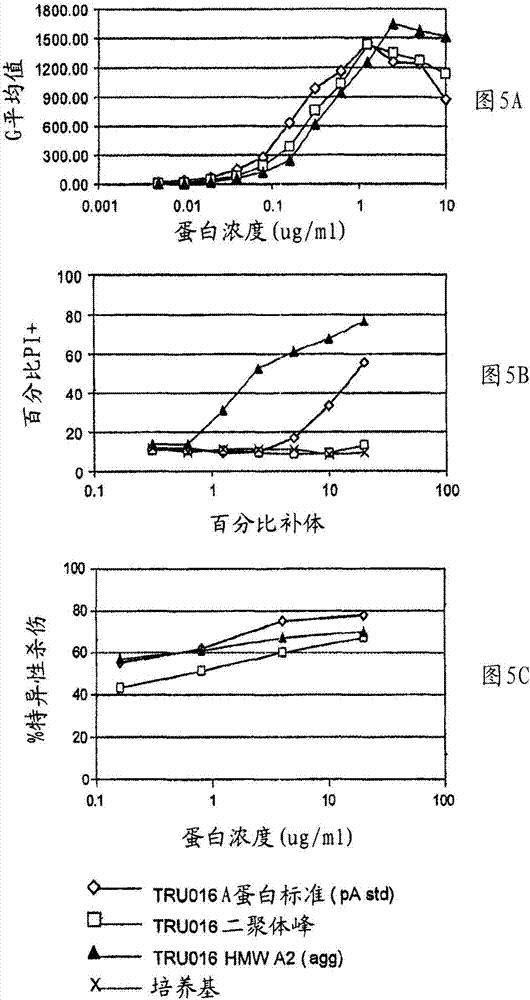
:在其通常作用中,人免疫系统保护身体免受外来物质和病原体的损伤。免疫系统保护身体的方式之一,是产生称为B淋巴细胞或B-细胞的特化细胞。B-细胞产生结合并在某些情况下介导外来物质或病原体破坏的抗体。尽管在某些情况下,人免疫系统,且特别是人免疫系统B淋巴细胞产生差错而导致疾病。有许多癌症涉及不受控制的B-细胞增殖。也有许多自身免疫疾病涉及B-细胞抗体产生,所述抗体不结合外来物质和病原体而是结合身体部分。这样的抗体有时称为自身抗体。此外,还有多种自身免疫和炎症疾病在其病理学中涉及B-细胞,例如,通过不适当的B-细胞抗原呈递到T-细胞,或者通过其它涉及B-细胞的途径。例如,B-细胞缺陷的有自身免疫倾向的小鼠,不发展自身免疫性肾病、脉管炎或自身抗体。参见Shlomchik等,JExp.Med.,180:1295-306(1994)。有意思的是,这些具有B-细胞但免疫球蛋白产生缺陷的相同有自身免疫倾向的小鼠,在如Chan等,JExp.Med.,189:1639-48(1999)记载实验诱导时的确发展自身免疫疾病,这表明B-细胞在自身免疫疾病发展中起主要作用。B-细胞可通过其细胞表面分子鉴定。CD20是由单克隆抗体鉴定的第一个人B-细胞谱系特异表面分子。它是非糖基化的疏水35kDaB-细胞跨膜磷蛋白,其氨基和羧基末端都位于细胞内。参见,Einfeld等,EMBOJ.,7:711-17(1998)。CD20由所有正常成熟B-细胞表达,但不被前体B-细胞或浆细胞表达。还没有鉴定出CD20的天然配体,且CD20在B-细胞生物学中的功能仍未完全了解。另一B-细胞谱系特异细胞表面分子是CD37。CD37为高度糖基化的40-52kDa蛋白,其属于细胞表面抗原四穿膜区蛋白跨膜家族的成员。该蛋白横越细胞膜四次,从而形成了两个胞外环,并在胞质暴露其氨基和羧基末端。CD37高度表达于产正常抗体(sIg+)的B细胞,但在前B-细胞或浆细胞中不表达。CD37在静息和激活的T细胞、单核细胞和粒细胞上表达低,且在NK细胞、血小板或红细胞中没有可检测的CD37表达。参见,Belov等,CancerRes.,61(11):4483-4489(2001);Schwartz-Albiez等,J.Immunol.,140(3):905-914(1988);和Link等,J.Immunol.,137(9):3013-3018(1988)。除正常B-细胞外,几乎所有B-细胞起源的恶性肿瘤的CD37表达都为阳性,包括CLL、NHL和毛细胞性白血病[Moore等,JournalofPathology,152:13-21(1987);Merson和Brochier,ImmunologyLetters,19:269-272(1988);和Faure等,AmericanJournalofDermatopathology,12(3):122-133(1990)]。CD37参与了B-细胞功能调节,因为发现缺乏CD37的小鼠的血清IgG1水平低并在其对病毒抗原和模式抗原的体液应答中有所损害。它似乎作为非典型共刺激分子,或者经由与MHCII类分子的复合物形成通过直接影响抗原呈递,而起作用。参见Knobeloch等,Mol.Cell.Biol.,20(15):5363-5369(2000).CD37也似乎在TCR信号传导中起作用。参见VanSpriel等,J.Immunol.,172:2953-2961(2004)。基于如下设想已进行了研究和药物开发,B-细胞谱系特异性细胞表面分子,例如CD37或CD20,自身可作为抗体靶,所述抗体将结合并介导破坏,在其表面上具有CD37或CD20的导致癌症和自身免疫疾病的B-细胞。术语“免疫治疗”是指,将结合CD37或CD20的非人类动物制备的抗体(或基于该制备抗体的抗体),给予患者以耗尽导致癌症或自身免疫疾病的B-细胞。一种CD37抗体已经用131I标记,并在用于治疗NHL的临床实验中对其进行测试。参见Press等,J.Clin.Oncol.,7(3):1027-1038(1989);Bernstein等,CancerRes.(Suppl.),50:1017-1021(1990);Press等,Front.Radiat.Ther.Oncol.,24:204-213(1990);Press等,Adv.Exp.Med.Biol.,303:91-96(1991)以及Brown等,Nucl.Med.Biol.,24:657-663(1997)。抗体MB-1,为缺乏Fc效应子功能例如抗体依赖性细胞毒性(ADCC)的鼠IgG1单克隆抗体,且MB-1在体内异种移植模型中并不抑制肿瘤生长,除非它已用同位素标记(Buchsbaum等,CancerRes.,52(83):6476-6481(1992)。131I-MB-1的有益生物分布在低肿瘤负荷(<1kg)的淋巴瘤患者中可见,且对这些患者治疗导致持续4-11个月的完全肿瘤缓解(Press等,1989和Bernstein等1990)。此外,由与G28-1(另一抗-CD37抗体)连接的药物阿霉素组成的免疫缀合物,也在小鼠中进行了评估并显示出通过药物内化和胞内释放的作用。参见Braslawsky等,CancerImmunol.Immunother.,33(6):367-374(1991)。各研究小组已经研究了抗-CD20抗体在治疗B-细胞相关疾病中的应用。一种治疗由以放射性核素形式制备的用于治疗B-细胞淋巴瘤的抗-CD20抗体(例如131I-标记的抗-CD20抗体),以及用于缓解前列腺和乳癌转移所致骨痛的89Sr-标记形式组成[Endo,GanToKagakuRyoho,26:744-748(1999)]。另一研究小组开发出了对CD20特异性的嵌合单克隆抗体,其由与人IgG1重链和人κ轻链恒定区融合的鼠源重链和轻链可变区组成。嵌合抗体,据报道,保留了结合CD20的能力和介导ADCC及结合补体的能力。参见,Liu等,J.Immunol.139:3521-26(1987)。然而,另一嵌合抗-CD20抗体由IDEC杂交瘤C2B8组成,且命名为利妥希玛(rituximab)。利妥希玛抗肿瘤活性机理,据认为是几种活性的组合,包括ADCC,补体结合,促进恶性B-细胞中细胞凋亡的信号触发,尽管该较大尺寸的嵌合抗体阻止分子最佳分散至含恶性B-细胞的淋巴组织,从而限制其抗肿瘤活性。ADCC是细胞介导的反应,其中表达Fc受体(FcRs)的非特异性细胞毒性细胞(例如自然杀伤(NK)细胞、嗜中性粒细胞和巨噬细胞)识别靶细胞上的结合抗体,且由此导致靶细胞裂解。补体结合,或依赖补体的细胞毒性(CDC),是指在补体存在情况下,分子裂解靶的能力。补体激活途径,由补体系统第一组分(C1q)与复合有关联抗原的分子(例如抗体)相结合而启动。该利妥希玛大的尺寸阻止了分子最佳分散至含恶性B-细胞的淋巴组织,从而限制了其抗肿瘤活性。利妥希玛一般以每周输注4次施用,通常用于治疗低级或滤泡B-细胞性非何杰金淋巴瘤[McLaughlin等,Oncology,12:1763-1777(1998);Leget等,Curr.Opin.Oncol.,10:548-551(1998)]和复发III/IV期滤泡性淋巴瘤[White等,Pharm.Sci.Technol.Today,2:95-101(1999)]。用利妥希玛治疗的其它病症包括滤泡中心细胞淋巴瘤(FCC)、套细胞淋巴瘤(MCL)、弥散性大细胞淋巴瘤(DLCL)以及小淋巴细胞性淋巴瘤(SLL)[Nguyen等,EurJHaematol.,62:76-82(1999)]。每周输注施用利妥希玛也可用于治疗CLL[Lin等,SemOncol.,30:483-92(2003)]。抗-CD20抗体也可用于治疗患有与B-细胞产生自身抗体相关的自身免疫疾病的患者。例如,利妥希玛对包括RA在内的多种自身免疫/炎症疾病患者,显示出耗尽CD20+B-细胞的显著临床益处[Edwards,NEnglJMed.,350:2546-2548(2004);Cambridge等,ArthritisRheum.,48:2146-54(2003)]。RA患者接受连续给药的甲氨蝶呤(MTX)和4剂过程的利妥希玛输注(Edwards,同前)。与对照组相比较,这些患者显示出改进的美国风湿病学会(AmericanCollegeofRheumatology)(ACR)应答。在全身性红斑狼疮(SLE)治疗实验中[Leandro等,ArthritisRheum.,46:2673-2677(2002)],对患者施用两次高剂量的利妥希玛输注,且显示B-细胞减少和疾病状态改善。在SLE中B-细胞减少的第二次研究中[Looney等,ArthritisRheum.,50:2580-2589(2004)],对患者给予单次输注100mg/m2(低剂量)、单次输注375mg/m2(中剂量)或者4次输注(间隔1周)375mg/m2(高剂量)的利妥希玛。这些患者显示B-细胞减少和疾病评分提高,但治疗没有改变自身抗体水平。利妥希玛实验也在Waldenstrom氏巨球蛋白血症中进行[Treon等,Immunother.,24:272-279(2000)],其中4次输注利妥希玛后,患者显示出血细胞比容(HCT)和血小板(PLT)计数增加。利妥希玛治疗多发性硬化(一种影响中枢神经系统的自身免疫疾病)患者的近期报告显示,治疗过程耗尽外周B-细胞但对脑脊液B-细胞影响很小。参见Monson等,Arch.Neurol.,62:258-264(2005)。其它关于利妥希玛应用的公开包括:Stashi等″Rituximabchimericanti-CD20monoclonalantibodytreatmentforadultswithchronicidiopathicthrombocytopenicpurpura″Blood98:952-957(2001);Matthews,R.″MedicalHeretics″NewScientist(7Apr.,2001);Leandro等″Clinicaloutcomein22patientswithrheumatoidarthritistreatedwithBlymphocytedepletion″AnnRheumDis61:833-888(2002);Leandro等″Lymphocytedepletioninrheumatoidarthritis:earlyevidenceforsafety,efficacyanddoseresponse.ArthritisandRheumatism44(9):S370(2001);Leandro等″AnopenstudyofBlymphocytedepletioninsystemiclupuserythematosus″,ArthritisRheum.46:2673-2677(2002);Edwards等,″SustainedimprovementinrheumatoidarthritisfollowingaprotocoldesignedtodepleteBlymphocytes″Rheumatology40:205-211(2001);Edwards等″B-lymphocytedepletiontherapyinrheumatoidarthritisandotherautoimmunedisorders″Biochem.Soc.Trans.30(4):824-828(2002);Edwards等″Efficacyandsafetyofrituximab,aB-celltargetedchimericmonoclonalantibody:Arandomized,placebocontrolledtrialinpatientswithrheumatoidarthritis.ArthritisRheum.46:S197(2002);Levine等,″IgMantibody-relatedpolyneuropathies:B-celldepletionchemotherapyusingrituximab″Neurology52:1701-1704(1999);DeVita等″EfficacyofselectiveB-cellblockadeinthetreatmentofrheumatoidarthritis″ArthritisRheum46:2029-2033(2002);Hidashida等″TreatmentofDMARD-Refractoryrheumatoidarthritiswithrituximab.″PresentedattheAnnualScientificMeetingoftheAmericanCollegeofRheumatology;October24-29;NewOrleans,La.2002;Tuscano,J.″SuccessfultreatmentofInfliximab-refractoryrheumatoidarthritiswithrituximab″PresentedattheAnnualScientificMeetingoftheAmericanCollegeofRheumatology;October24-29;NewOrleans,La.2002.利妥希玛治疗相关问题仍然存在。例如,大多数利妥希玛治疗的癌症患者,通常在约6-12个月内复发,以及已报道24小时内利妥希玛输注的致命输注反应。这些致命反应由输注反应复征引起,所述输注反应复征包括缺氧、肺浸润、急性呼吸窘迫综合征、心肌梗死、心室纤维性颤动或心源性休克。在用利妥希玛治疗后肿瘤裂解综合征情况下,已报道有致命结果情形的、需要透析的急性肾衰竭,该急性肾衰竭有严重的粘膜皮肤反应,一些有致命结果。此外,要求静脉内注射高剂量利妥希玛,因为分子大、为约150kDa,且如上所述,其分散至许多肿瘤细胞所在淋巴组织受到限制。由于正常成熟B-细胞也表达CD37和CD20,所以,用抗-CD37(Press等,1989)或抗-CD20抗体治疗[Reff等,Blood,83:435-445(1994)],正常B-细胞将被耗尽。然而,在治疗完成后,正常B-细胞可从CD37-和CD20-阴性B-细胞前体再生;因此,用抗-CD37或抗-CD20治疗的患者并不经历显著免疫抑制。单克隆抗体技术和基因工程方法,已经导致开发了免疫球蛋白分子用于诊断和治疗人类疾病。蛋白工程已用于提高抗体对其关联抗原的亲和性,以减少免疫原性相关问题,以及改变抗体效应子功能。免疫球蛋白的域结构可以工程改造,因为抗原结合域和赋予效应子功能的域可在免疫球蛋白类和亚类之间交换。免疫球蛋白的结构和功能,例如在Harlow等,Eds.,Antibodies:ALaboratoryManual,Chapter14,ColdSpringHarborLaboratory,ColdSpringHarbor(1988)中有综述。关于重组抗体技术所有方面的详细介绍和详细信息,可见于教科书″RecombinantAntibodies″(JohnWiley&Sons,NY,1999)。详细抗体工程改造实验室规程的综合搜集,可见于R.Kontermann和S.(eds.),″TheAntibodyEngineeringLabManual″(SpringerVerlag,Heidelberg/NewYork,2000)。最近,已构建小免疫球蛋白分子用于克服全免疫球蛋白治疗的相关问题。单链Fv(scFv)包括用短接头肽连接到抗体轻链可变结构域的抗体重链可变结构域[Huston等,Proc.Natl.Acad.Sci.USA,85:5879-5883(1988)]。除了可变区,每抗体链有一个或多个恒定区。轻链只有一个恒定区结构域。因此,轻链有一个可变区和一个恒定区。重链有几个恒定区结构域。IgG、IgA和IgD抗体中的重链有三个恒定区结构域,分别命名为CH1、CH2和CH3,而IgM和IgE抗体中的重链有四个恒定区结构域,CH1、CH2、CH3和CH4。因此,重链有一个可变区和三个或四个恒定区。免疫球蛋白重链也可分为三个功能区:Fd区(含VH和CH1的片段,即,重链的两个N-末端结构域),铰链区,和Fc区(“可结晶段”区,其由恒定区得来、且由胃蛋白酶消化形成)。Fd区与轻链组合,形成Fab(“抗原结合段”)。由于抗原将立体化学地与各Fab氨基末端的抗原结合区反应,所以IgG分子为二价的,即其能与两个抗原分子结合。Fc包含与细胞上的免疫球蛋白受体和补体级联系统初始元件相互作用的结构域。因此,通常认为Fc片段负责免疫球蛋白效应子功能,例如补体结合和与Fc受体结合。由于scFv分子尺寸小,所以与全免疫球蛋白相比,其显示出极其迅速的血浆和组织清除,和更有效的组织穿透。与相应的嵌合抗体相比,抗肿瘤scFv显示出更迅速的肿瘤穿透和更均匀的在肿瘤块内的分布[Yokota等,CancerRes.,52,3402-3408(1992)]。scFv与另一分子,例如毒素融合,利用特异抗原结合活性和递送毒素至靶组织的scFv的小尺寸。[Chaudary等,Nature,339:394(1989);Batra等,Mol.Cell.Biol.,11:2200(1991)]。虽然scFv分子有许多优点,但是其使用也存在几个缺点。尽管scFv的迅速清除可减少正常细胞中的毒性效应,但这样的迅速清除会阻止递送最小的有效剂量至靶组织。制备施用于患者的足量scFv,已经受到挑战,因为scFv的表达和分离中的困难,所述困难不利地影响了产量。在表达过程中,scFv分子缺乏稳定性,且经常由于不同分子可变区配对而聚集。而且,哺乳动物表达系统中scFv分子生产水平低下,从而有效制备用于治疗的scFv分子的潜力受到限制[Davis等,JBiol.Chem.,265:10410-10418(1990);Traunecker等,EMBOJ,10:3655-3659(1991)。对用于提高生产的策略已经进行了探索,包括在可变区添加糖基化位点[Jost,C.R.U.S.Pat.No.5,888,773,Jost等,J.Biol.Chem.,69:26267-26273(1994)]。用scFv治疗的另一缺点是,其缺乏效应子功能。scFv没有与免疫球蛋白恒定区相关的细胞溶解功能、ADCC和依赖补体的细胞毒性(CDC),其可能对治疗疾病无效。即使scFv技术的发展于超过12年前已经开始,但当前却没有scFv产品被批准用于治疗。此外,已提出scFv与另一分子,例如毒素的融合,可利用特异抗原结合活性和递送毒素至靶组织的scFv的小尺寸。Chaudary等,Nature339:394(1989);Batra等,Mol.Cell.Biol.11:2200(1991)。因此,毒素与scFvs的缀合或融合,提供了一种供应有效抗原特异性分子的可选择策略,但该缀合物或嵌合物的给药由于该制剂的毒素部分而受到过量和/或非特异性毒性的限制。毒性效应可包括肝酶超生理性(supraphysiological)升高,和血管渗漏综合征,和其它不良效应。此外,免疫毒素本身在施用于宿主后,具有高免疫原性,且针对免疫毒素产生的宿主抗体限制了其用于重复治疗性治疗个体的有效性潜力。其它称为小型模块免疫药物(SMIPTM)产品的工程改造的融合蛋白,在共有的美国专利公开2003/133939、2003/0118592和2005/0136049,以及共有的国际专利公开WO02/056910、WO2005/037989和WO2005/017148中有记载,所有文献都并入本文作为参考。SMIP产品为新的结合域-免疫球蛋白融合蛋白,其特征为关联结构结合域,所述关联结构例如抗原、反受体等;具有零个、一个或两个半胱氨酸残基的IgG1、IGA或IgE铰链区多肽或突变IgG1铰链区多肽;以及免疫球蛋白的CH2和CH3结构域。SMIP产品能产生ADCC和/或CDC效应。虽然对基于抗体的治疗开展了广泛的研究,但本领域仍需要治疗与异常B-细胞活性相关疾病的改进方法。本文记载和要求保护的本发明方法,提供了这样的改进方法以及其他优点。技术实现要素:本发明提供了用CD37-特异性结合分子减少B-细胞的方法。在本发明某些方法中,使用CD37-特异性结合分子(一种或多种CD37-特异性结合分子)和CD20-特异性结合分子(一种或多种CD20-特异性结合分子)的组合,导致增强的B-细胞减少。在某些该方法中,组合具有协同作用。在相关的方面,本发明提供了治疗患有或疑似患有与异常B-细胞活性相关疾病个体的方法。本发明也提供了人源化CD37-特异性结合分子(例如,人源化TRU-016构建体)和用这些分子减少B-细胞的方法。在本发明方法的某些实施方案中,预期使用人源化TRU-016构建体和一种或多种CD20-特异结合分子的组合。在另一方面,本发明提供了治疗患有或疑似患有与异常B-细胞活性相关疾病的方法。本发明相关方面,涉及预防任一所述疾病的方法和改善与所述疾病相关症状的方法,所述方法包括施用有效治疗或预防该疾病或者改善该疾病症状的剂量的人源化CD37-特异性结合分子。“异常B-细胞活性”是指偏离正常、正确或期望过程的B-细胞活性。例如,异常B-细胞活性可包括,DNA或其它细胞组分已经损伤或缺陷的细胞不适当增殖。异常B-细胞活性可以包括细胞增殖,所述细胞增殖的特征与由不适当高水平细胞分裂、不适当低水平细胞凋亡、或者两者所致、介导、或以其为结果的疾病相关。这样的疾病可以,以例如单个或多个局部细胞、细胞群或组织群的异常增殖为特征,不论是癌性还是非癌性、是良性还是恶性。异常B-细胞活性也可包括异常抗体产生,例如自身抗体产生,或者通常在正常水平产生时所需的抗体的超量产生。预期异常B-细胞活性,可在某种B-细胞亚群发生而在其它亚群不发生。异常B-细胞活性也可包括对T-细胞的不适当刺激,例如通过不适当B-细胞抗原呈递给T-细胞或通过涉及B-细胞的其它途径。“治疗”是指治疗性治疗或预防性/防护性治疗。治疗性治疗,可以改善接受治疗个体的至少一种疾病症状,或者可以延迟个体进行性疾病的恶化,或者可以阻止其它相关疾病发病。CD20-特异结合分子的“治疗有效剂量”或“有效剂量”是指,足以导致改善一种或多种所治疗疾病症状的化合物量。当应用于单独施用的个别活性成分时,治疗有效剂量是指该单独成分。当应用于组合时,治疗有效剂量是指导致疗效的活性成分的组合量,无论是顺序施用还是同时施用。本发明具体预期,根据本发明方法各以有效剂量施用一种或多种特异性结合分子。“患有或疑似患有与异常B-细胞活性相关疾病的个体”是指,疾病或病症症状可由异常B-细胞活性所致、可由异常B-细胞活性所加剧、或者可通过B-细胞活性调节而缓解的个体。这样的疾病实例为B-细胞癌(例如,B-细胞淋巴瘤、B-细胞白血病或B-细胞骨髓瘤),以自身抗体产生为特征的疾病,或者以不适当T-细胞刺激为特征的疾病,其中所述不适当T-细胞刺激由不适当B-细胞抗原呈递给T-细胞所引起或者由其它涉B-细胞途径所引起。在一个示例性方面,本发明方法治疗个体显示出的治疗应答与对利妥希玛的治疗应答相比更好或得到改善。相对于利妥希玛的治疗改善的应答是指这样的临床应答,其中本发明方法治疗所产生的患者临床应答,好于接受利妥希玛治疗(例如利妥希玛)患者的临床应答。改善的应答通过本领域公知和本文记载的临床标准比较进行评估。示例性的标准包括但不限于,B细胞耗尽持续时间,总的B细胞数目减少,生物样品中B细胞数目减少,肿瘤大小减小,治疗后存在和/或出现的肿瘤数目减少,以及患者自己和医师评价的全面应答改善,例如使用国际预后指数(InternationalPrognosticIndex)。改善可以是在一种或超过一种临床标准中的。本发明方法的改善的应答,可以是由于先前或当前利妥希玛治疗的不充分应答,例如因为利妥希玛治疗的毒性和/或效力不足。B-细胞癌包括B-细胞淋巴瘤[例如各类何杰金氏疾病,非何杰金氏淋巴瘤(NHL),或中枢神经系统淋巴瘤],白血病[例如急性成淋巴细胞性白血病(ALL),慢性淋巴细胞性白血病(CLL),毛细胞性白血病,以及慢性成肌细胞性白血病],以及骨髓瘤(例如多发性骨髓瘤)。其它的B细胞癌包括,小淋巴细胞性淋巴瘤,B-细胞前淋巴细胞性白血病,淋巴浆细胞性淋巴瘤,脾边缘区淋巴瘤,浆细胞骨髓瘤,骨单发性浆细胞瘤,骨外浆细胞瘤,粘膜相关淋巴组织(MALT)结外边缘区B-细胞淋巴瘤,结边缘区B-细胞淋巴瘤,滤泡性淋巴瘤,套细胞淋巴瘤,弥散性大B-细胞淋巴瘤,纵隔(胸腺)大B-细胞淋巴瘤,血管内大B-细胞淋巴瘤,原发性渗漏出淋巴瘤,伯基特淋巴瘤/白血病,不确定恶性潜能的B-细胞增殖,淋巴瘤样肉芽肿病,以及移植后淋巴组织增生紊乱。以自身抗体产生为特征的病症通常认为是自身免疫疾病。自身免疫疾病包括但不限于:关节炎,类风湿性关节炎,青少年类风湿性关节炎,骨关节炎,多软骨炎,牛皮癣性关节炎,牛皮癣,皮炎,多肌炎/皮肌炎,内含体肌炎,炎性肌炎,中毒性表皮坏死松解,全身性硬皮病和硬化,CREST综合征,炎性肠病相关反应,Crohn氏病,溃疡性结肠炎,呼吸窘迫综合征,成人呼吸窘迫综合征(ARDS),脑膜炎,脑炎,葡萄膜炎,结肠炎,肾小球肾炎,变应性状况,湿疹,哮喘,涉及T细胞浸润和慢性炎症反应的状况,动脉粥样硬化,自身免疫心肌炎,淋巴细胞粘着缺乏症,全身性红斑狼疮(SLE),亚急性皮肤红斑狼疮,盘状狼疮,狼疮性脊髓炎,狼疮性脑炎,青少年糖尿病,多发性硬化,变应性脑脊髓炎,视神经脊髓炎,风湿热,Sydenham氏舞蹈病,与由细胞因子和T-淋巴细胞介导的急性和迟发型超敏反应相关的免疫应答,结核,肉样瘤病,包括Wegener氏肉芽肿病和Churg-Strauss疾病在内的肉芽肿病,粒细胞缺乏症,脉管炎(包括过敏性脉管炎/血管炎,ANCA和类风湿性脉管炎),再生障碍性贫血,DiamondBlackfan贫血,包括自身免疫性溶血性贫血(AIHA)在内的免疫性溶血性贫血,恶性贫血,纯红细胞再生障碍(PRCA),VIII因子缺陷,A型血友病,自身免疫嗜中性白细胞减少症,各类血细胞减少症,白细胞减少,涉及白细胞渗出的疾病,中枢神经系统(CNS)炎症失调,多器官损伤综合征,重症肌无力,抗原-抗体复合物介导的疾病,抗-肾小球基底膜病,抗磷脂抗体综合征,变应性神经炎,Behcet疾病,Castleman氏综合征,Goodpasture氏综合征,Lambert-Eaton肌无力综合征,Reynaud氏综合征,Sjorgen氏综合征,Stevens-Johnson综合征,实体器官移植排斥,移植物抗宿主疾病(GVHD),大疱性类天疱疮,天疱疮,自身免疫多内分泌腺病,血清阴性脊椎关节病,Reiter氏病,僵体综合征,巨细胞性动脉炎,免疫复合物肾炎,IgA肾病,IgM多神经病或IgM介导的神经病,特发性血小板减少性紫癜(ITP),血栓形成性血小板减少性紫癜(TTP),Henoch-Schonlein紫癜,自身免疫性血小板减少症,包括自身免疫性睾丸炎和卵巢炎在内的睾丸和卵巢自身免疫疾病,原发性甲状腺机能减退,包括自身免疫性甲状腺炎在内的自身免疫内分泌疾病,慢性甲状腺炎(Hashimoto氏甲状腺炎),亚急性甲状腺炎,特发性甲状腺机能减退,Addison氏病,Grave氏病,自身免疫性多腺体综合征(或多腺体内分泌病综合征),I型糖尿病也称为胰岛素依赖性糖尿病(IDDM)和Sheehan氏综合征,自身免疫性肝炎,淋巴间质性肺炎(HIV),闭塞性支气管炎(非移植)vsNSIP,Guillain-Barre氏综合征,大脉管脉管炎(包括风湿性多肌病和巨细胞性(Takayasu氏)动脉炎),中脉管脉管炎(包括Kawasaki氏病和结节性多动脉炎),结节性多动脉炎(PAN)强直性脊柱炎,Berger氏病(IgA肾病),快速进行性肾小球肾炎,原发性胆汁性肝硬变,口炎性腹泻(麸质肠病),冷球蛋白血症,肝炎相关冷球蛋白血症,肌萎缩性脊髓侧索硬化(ALS),冠心病,家族性地中海热,显微多脉管炎,Cogan氏综合征,Whiskott-Aldrich综合征,以及血管闭塞性脉管炎。类风湿性关节炎(RA)是以关节发炎、从而导致肿胀、疼痛、以及功能丧失为特征的慢性疾病。长时间段RA患者通常显示出进行性关节破坏、畸形、残疾、甚至过早死亡(prematuredeath)。Crohn氏病和相关的疾病,溃疡性结肠炎是属于称为炎性肠病(IBD)的疾病组的两种主要疾病种类。Crohn氏病是引起消化道或胃肠道(GI)炎症的慢性病症。虽然该疾病累及口至肛门的GI道的任何区域,但是它最常感染小肠和/或结肠。在溃疡性结肠炎中,所累及的GI道限于结肠。Crohn氏病以抗嗜中性粒细胞抗原的抗体,即“核周抗-嗜中性粒细胞抗体”(pANCA),和抗啤酒糖酵母(Saccharomycescervisiae)抗体,即“抗-啤酒糖酵母抗体”(ASCA)为特征。许多溃疡性结肠炎患者血液中含有pANCA抗体,但没有ASCA抗体,而许多Crohn氏病患者则显示有ASCA抗体,而没有pANCA抗体。一种评价Crohn氏病的方法是使用Crohn氏病活性指数(CDAI),该指数基于18项医师所收集的预测值变量得分。CDAI值在150及以下,与静止疾病相关;高于其的值显示活性疾病,且高于450的值被认为患有极严重疾病[Best等,″DevelopmentofaCrohn′sdiseaseactivityindex.″Gastroenterology70:439-444(1976)]。然而,从最初研究开始,一些研究者用“主观值(subjectivevalue)”200-250作为健康得分。全身性红斑狼疮(SLE)是多器官中血管周期性损伤所致的自身免疫疾病,所述器官包括肾、皮肤和关节。在SLE患者中,T细胞和B-细胞之间的错误相互作用,导致攻击细胞核的自身抗体产生。这是自身抗体引致SLE的共识,因此,耗尽B-细胞谱系、从而允许新B-细胞从前体产生时免疫系统复原的新治疗,将给SLE患者带来持久获益的希望。多发性硬化(MS)也是自身免疫疾病。它以中枢神经系统炎症和髓磷脂破坏为特征,所述髓磷脂在脑、脊髓和身体中用于绝缘神经细胞纤维。尽管MS原因未知,但一般认为自身免疫T细胞是发病的主要原因。然而,高水平的抗体存在于MS患者脑脊液中,因此一些理论预言,导致抗体产生的B-细胞应答,在介导疾病中起重要作用。自身免疫性甲状腺疾病,是由刺激甲状腺以导致甲状腺机能亢进(Graves氏病)或者破坏甲状腺以导致甲状腺机能减退(Hashimoto氏甲状腺炎)的自身抗体产生所致。甲状腺刺激由结合并激活促甲状腺素(TSH)受体的自身抗体所引起。甲状腺破坏则可由与其它甲状腺抗原反应的自身抗体所引起。Sjogren氏综合征,是以身体产湿腺(moisture-producinggland)破坏为特征的自身免疫疾病。免疫性血小板减少性紫癜(ITP),是由结合血小板并导致其破坏的自身抗体所致的。重症肌无力(MG),是以结合表达于神经肌肉接头处的乙酰胆碱受体从而导致随意肌群衰弱的自身抗体为特征的慢性自身免疫神经肌肉病症。牛皮癣,以皮肤自身免疫性炎症为特征,且也与30%病例的关节炎、硬皮病、包括Crohn氏病和溃疡性结肠炎在内的炎性肠病相关。也预期治疗特发性炎性肌病(IIM),包括皮肌炎(DM)和多肌炎(PM)。炎性肌病已经用多种分类方案进行分类。Miller氏分类方案(Miller,RheumDisClinNorthAm.20:811-826,1994)区分了两种特发性炎性肌病(IIM),多肌炎(PM)和皮肌炎(DM)。多肌炎和皮肌炎是累及肌肉并且在DM情况下累及皮肤的慢性致虚弱性炎性疾病。这些疾病少见,据报告在美国每年,年度发病率为每百万成年人约5-10例,以及每百万儿童约0.6-3.2例(Targoff,CurrProblDermatol.1991,3:131-180)。特发性炎性肌病与显著的致病率和死亡率相关,最高一半感染的成年人遭受重大损伤(Gottdiener等,AmJCardiol.1978,41:1141-49)。Miller(RheumDisClinNorthAm.1994,20:811-826和ArthritisandAlliedConditions,Ch.75,Eds.KoopmanandMoreland,LippincottWilliamsandWilkins,2005)设置了五组用于诊断IIM的标准,即特发性炎性肌病标准(IIMC)评估,包括肌肉衰弱、肌肉退化活组织检查证据、肌肉相关酶血清水平升高、肌病电磁三素组(electromagnetictriad)、皮肌炎疹证据,且也包括自身抗体证据作为第二标准。IIM相关因素包括肌相关酶和自身抗体,包括但不限于肌酸激酶(CK),乳酸脱氢酶,醛缩酶,C-反应蛋白,天冬氨酸转氨酶(AST),丙氨酸氨基转移酶(ALT),和抗核自身抗体(ANA),肌炎特异性抗体(MSA),以及抗可提取的核抗原的抗体。本发明的“结合分子”,例如可以是结合靶的蛋白(“蛋白”可以是多肽或肽)、核酸、碳水化合物、脂质或者小分子化合物。本发明预期的蛋白结合分子的类型为抗体或保留结合活性的抗体片段。结合分子可根据本领域标准方法修饰,以提高其结合亲和力、减少其免疫原性、改变其效应子功能和/或改进其在个体身体中的有效性。这样的修饰可以包括,例如作为融合蛋白的氨基酸序列修饰或表达。这样的融合蛋白也是本发明的结合分子。本发明示例性的结合分子为小型模块免疫药物(SMIPTM)。对靶“特异性”的结合分子,与任何其它靶相比,以更高亲和力结合该靶。例如,CD37-特异性结合分子以比任何其它靶更高亲和力结合CD37,且CD20-特异性结合分子以比任何其它靶更高亲和力结合CD20。本发明结合分子对其靶的亲和力Ka,可以大于或等于约104M-1,优选大于或等于约105M-1,更优选大于或等于约106M-1,且甚至更优选大于或等于约107M-1。甚至大于或等于约107M-1的亲和力,仍是更优选的,例如亲和力等于或大于约107M-1,约108M-1,和约109M-1,以及约1010M-1。本发明结合分子的亲和力,可用常规技术容易地确定,例如Scatchard等,Ann.N.YAcad.Sci.51:660(1949)中记载的那些。本发明预期的某些CD37-特异性结合分子,其对CD37的亲和力为约0.5-约10nM。本发明预期的某些CD20-特异性结合分子,其对CD20的亲和力为约1-约30nM。本发明预期的某些CD37-结合分子和CD20-结合分子的另一特性是,它们的循环半衰期为约7-约30天。第三次HLDA研讨会(ThirdHLDAWorkshop)中表征CD37抗原的CD37-特异性抗体,为HD28、G28-1、HH1、BI14、WR17和F93G6。参见,Ling和MacLennan,pp.302-335inLeucocyteTypingIII.WhiteCellDifferentiationAntigens,OxfordUniversityPress(1987)。其它有记载的CD37-特异性抗体,包括RFB-7、Y29/55、MB-1、M-B371、M-B372和IPO-24。参见,Moldenhaurer,J.Biol.,Regul.Homeost.Agents,14:281-283(2000),该文指出所有这些抗体仅只识别一种CD37表位。Schwartz-Albiez等,14:905-914(1988)指出,表位位于CD37的碳水化合物部分。另一CD37-特异性抗体为S-B3(Biosys)。记载CD20抗体的专利和专利公开,包括美国专利号5,776,456、5,736,137、6,399,061和5,843,439,以及美国专利申请号US2002/0197255A1和US2003/0021781A1(Anderson等);美国专利号6,455,043B1和WO00/09160(Grillo-Lopez,A.);WO00/27428(Grillo-Lopez和White);WO00/27433(Grillo-Lopez和Leonard);WO00/44788(Braslawsky等);WO01/10462(Rastetter,W.);WO01/10461(Rastetter和White);WO01/10460(White和Grillo-Lopez);美国申请号US2002/0006404和WO02/04021(Hanna和Hariharan);美国申请号US2002/0012665A1和WO01/74388(Hanna,N.);美国申请号US2002/0009444A1和WO01/80884(Grillo-Lopez,A.);WO01/97858(White,C);美国中请号US2002/0128488A1和WO02/34790(Reff,M.);WO02/060955(Braslawsky等);WO02/096948(Braslawsky等);WO02/079255(Reff和Davies);U.S.Pat.No.6,171,586B1,和WO98/56418(Lam等);WO98/58964(Raju,S.);WO99/22764(Raju,S.);WO99/51642,美国专利号6,194,551B1,美国专利号6,242,195B1,美国专利号6,528,624B1和美国专利号6,538,124(Idusogie等);WO00/42072(Presta,L.);WO00/67796(Curd等),WO01/03734(Grillo-Lopez等);美国申请号US2002/0004587A1和WO01/77342(Miller和Presta);美国申请号US2002/0197256(Grewal,I.);美国专利号6,090,365B1、6,287,537B1、6,015,542、5,843,398和5,595,721(Kaminski等);美国专利号5,500,362、5,677,180、5,721,108和6,120,767(Robinson等);美国专利号6,410,391B1(Raubitschek等);美国专利号6,224,866B1和WO00/20864(Barbera-Guillem,E.);WO01/13945(Barbera-Guillem,E.);WO00/67795(Goldenberg);WO00/74718(Goldenberg和Hansen);WO00/76542(Golay等);WO01/72333(Wolin和Rosenblatt);美国专利号6,368,596B1(Ghetie等);美国申请号US2002/0041847A1,(Goldenberg,D.);美国申请号US2003/0026801A1(Weiner和Hartmann);WO02/102312(Engleman,E.),各篇这些文献在此明确并入作为参考。也参见,美国专利号5,849,898和欧洲申请号330,191(Seed等);美国专利号4,861,579和EP332,865A2(Meyer和Weiss);以及WO95/03770(Bhat等)。利妥希玛以已被批准为人类临床应用。被认为是本发明CD20特异性结合分子。小型模块免疫药物(SMIPs)被认为是一类本发明结合分子。制备SMIPs的方法已先前记载在共有的美国申请号10/627,556和美国专利公开号20030133939、20030118592、20050136049中,这些文献在此整体并入作为参考。SMIPs是新型结合域-免疫球蛋白融合蛋白,其通常以对诸如抗原、反受体等等的关联结构的结合域,含有0、1或2个半胱氨酸残基的IgG1、IGA或IgE铰链区多肽或突变的IgG1铰链区多肽,以及免疫球蛋白CH2和CH3结构域为特征。在一个实施方案中,结合域分子在铰链区含有1个或2个半胱氨酸(Cys)残基。在相关实施方案中,当结合域分子包括2个Cys残基时,参与重链与轻链结合的第一Cys不缺失或被氨基酸取代。预期本发明方法有用分子结合域含有一个或多个结合区,例如来自一种或多种免疫球蛋白超家族成员例如免疫球蛋白的可变轻链和可变重链结合区。而且,这些区通常被接头肽分隔,所述接头肽可以是任何本领域已知的、与结合分子结构域或区连接相容的接头肽。示例性的接头是基于Gly4Ser接头基序的接头,例如(Gly4Ser)n,其中n=1-5。用于本发明方法中的分子,也含有来自免疫球蛋白恒定区的足够氨基酸序列以提供效应子功能,优选提供ADCC和/或CDC。因此,所述分子将含有来自免疫球蛋白CH2结构域,或一种或多种免疫球蛋白的CH2和CH3结构域的序列。SMIPs能产生ADCC和/或CDC效应,但形成二硫键连接的多聚体的能力受损。本发明包括显示与SEQIDNO:2所示多肽至少80%同一性的人源化CD37-特异性SMIP多肽,其中该人源化CD37-特异性SMIP多肽结合CD37。一方面,人源化CD37-特异性SMIP多肽包括选自下列的任意氨基酸序列:SEQIDNOS:6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、80、82、84、86和88。另一方面,人源化CD37-特异性SMIP多肽包括在选自下列的互补性决定区(CDR)中的至少一个氨基酸修饰:轻链CDR1、重链CDR1、轻链CDR2、重链CDR2、轻链CDR3和重链CDR3。在一个实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链CDR1包括氨基酸序列SEQIDNO:61(RASENVYSYLA)。本发明也包括人源化CD37-特异性SMIP多肽,其中轻链CDR1包括氨基酸序列SEQIDNO:62(RTSENVYSYLA)。本发明进一步包括人源化CD37-特异性SMIP多肽,其中重链CDR1包括氨基酸序列SEQIDNO:63(GYMNM)。在另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链CDR2包括氨基酸序列SEQIDNO:64(FAKTLAE)。本发明也包括人源化CD37-特异性SMIP多肽,其中重链CDR2包括氨基酸序列SEQIDNO:65(NIDPYYGGTTTYNRKFKG)。在进一步的实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链CDR3包括氨基酸序列SEQIDNO:66(QHHSDNPWT)。本发明进一步包括人源化CD37-特异性SMIP多肽,其中重链CDR3包括氨基酸序列SEQIDNO:67(SVGPFDY)。本发明进一步包括人源化CD37-特异性SMIP多肽,其中重链CDR3包括氨基酸序列SEQIDNO:68(SVGPFDS)。本发明也包括人源化CD37-特异性SMIP多肽,其中重链CDR3包括氨基酸序列SEQIDNO:69(SVGPMDY)。另一方面,本发明包括人源化CD37-特异性SMIP多肽,其包括至少一种、至少两种、或至少三种序列的选自下列的轻链CDR氨基酸序列:SEQIDNOS:61、62、64和66。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其包括轻链CDR1氨基酸序列SEQIDNOS:61或62,或SEQIDNOS:61或62的一个或两个氨基酸已经改变的其变体;轻链CDR2氨基酸序列SEQIDNO:64,或SEQIDNO:64的一个或两个氨基酸已经改变的其变体;以及轻链CDR3氨基酸序列SEQIDNO:66,或SEQIDNO:66的一个或两个氨基酸已经改变的其变体。再一方面,本发明包括人源化CD37-特异性SMIP多肽,其包括至少一种、至少两种、或至少三种选自下列的重链CDR氨基酸序列:SEQIDNOS:63、65和67-69。在进一步的实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其包括重链CDR1氨基酸序列SEQIDNO:63,或SEQIDNO:63的一个或两个氨基酸已经改变的其变体;重链CDR2氨基酸序列SEQIDNO:65,或SEQIDNO:65的一个或两个氨基酸已经改变的其变体;以及选自SEQIDNOS:67-69组的重链CDR3氨基酸序列,或SEQIDNOS:67-69任一序列的一个或两个氨基酸已经改变的其变体。本发明也包括人源化CD37-特异性SMIP多肽,其包括在选自下列的构架区(FR)的至少一个氨基酸修饰:轻链FR1、重链FR1、轻链FR2、重链FR2、轻链FR3、重链FR3、轻链FR4和重链FR4。在一个实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链第一构架区(FR1)包括氨基酸序列SEQIDNO:70(EIVLTQSPATLSLSPGERATLSC)。在另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR1包括氨基酸序列SEQIDNO:71(EVQLVQSGAEVKKPGESLKISCKGSGYSFT)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR2包括氨基酸序列SEQIDNO:72(WYQQKPGQAPRLLIY)。在进一步的实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR2包括氨基酸序列SEQIDNO:73(WVRQMPGKGLEWMG)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR3包括氨基酸序列SEQIDNO:74(GIPARFSGSGSGTDFTLTISSLEPEDFAVYYC)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR3包括氨基酸序列SEQIDNO:75(QVTISADKSISTAYLQWSSLKASDTAMYYCAR)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR4包括氨基酸序列SEQIDNO:76(FGQGTKVEIK)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR4包括氨基酸序列SEQIDNO:77(WGQGTLVTVSS)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR4包括氨基酸序列SEQIDNO:78(WGRGTLVTVSS)。本发明进一步包括人源化CD37-特异性SMIP多肽,其包括选自下列的至少一种、至少两种、或至少三种序列的轻链FR氨基酸序列:SEQIDNOS:70、72、74和76。在一个实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其包括轻链FR1氨基酸序列SEQIDNO:70,或SEQIDNO:70的一个或两个氨基酸已经改变的其变体;轻链FR2氨基酸序列SEQIDNO:72,或SEQIDNO:72的一个或两个氨基酸已经改变的其变体;轻链FR3氨基酸序列SEQIDNO:74,或SEQIDNO:74的一个或两个氨基酸已经改变的其变体;以及轻链FR4氨基酸序列SEQIDNO:76,或SEQIDNO:76的一个或两个氨基酸已经改变的其变体。此外,本发明包括人源化CD37-特异性SMIP多肽,其包括选自下列的至少一种、至少两种、或至少三种序列的重链FR氨基酸序列:SEQIDNOS:71、73、75、77和78。在一个实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其包括重链FR1氨基酸序列SEQIDNO:71,或SEQIDNO:71的一个或两个氨基酸已经改变的其变体;重链FR2氨基酸序列SEQIDNO:73,或SEQIDNO:73的一个或两个氨基酸已经改变的其变体;重链FR3氨基酸序列SEQIDNO:75,或SEQIDNO:75的一个或两个氨基酸已经改变的其变体;以及重链FR4氨基酸序列SEQIDNOS:77或78,或SEQIDNOS:77或78的一个或两个氨基酸已经改变的其变体。本发明也包括分离的核酸分子,其包含核苷酸序列,所述核苷酸序列编码显示与SEQIDNO:2所示多肽有至少80%同一性的人源化CD37-特异性SMIP多肽,其中所述人源化CD37-特异性SMIP多肽结合CD37。这样的分离的核酸分子可包括选自下列的核苷酸序列:SEQIDNOS:5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、79、81、83、85和87。在一个实施方案中,本发明包括含有这些核酸分子的载体和含该载体的宿主细胞。本发明也包括生产本文记载的多肽的方法,所述方法包括在表达多肽的合适条件下,培养宿主细胞,以及任选地从培养物分离多肽。再一方面,本发明包括包含本发明人源化CD37-特异性SMIP多肽和药学上可接受载体的组合物。本发明进一步包括在任何本发明方法中使用本文记载的CD37-特异性SMIP或CD37-特异性结合分子。这样的方法包括使用,含选自下列的氨基酸序列的任一CD37-特异性SMIP或CD37-特异性结合分子:SEQIDNOS:6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、80、82、84、86和88。再一方面,本发明包括用于减少B-细胞的含本发明组合物的试剂盒;以及用该试剂盒减少B细胞的规程。这样的试剂盒可进一步包括一种或多种CD20-特异性结合分子。本发明预期这样的CD20-特异性结合分子是TRU-015。本发明也包括显示与SEQIDNO:2所示多肽有至少80%同一性、含CDR1、CDR2和CDR3的人源化CD37-特异性SMIP多肽。这样的CD37-特异性SMIP多肽,可进一步包括分隔各CDR1、CDR2和CDR3的人构架结构域。另一方面,本发明包括显示与SEQIDNO:2所示多肽有至少80%同一性的人源化CD37-特异性SMIP多肽,其中人源化CD37-特异性SMIP多肽结合CD37并且包括包含选自下列的氨基酸序列的铰链区多肽:SEQIDNOS:90、92、94、96、98、100、102、104、106、108110、112、114、115、116、118、120、122、124、126和127。本发明也预期显示与SEQIDNO:2所示多肽有至少80%同一性的人源化CD37-特异性SMIP多肽,其中人源化CD37-特异性SMIP多肽结合CD37并包括包含(Gly4Ser)n的接头,其中n为1、2、3、4、5或6。进一方面,本发明包括人源化CD37-特异性SMIP多肽,其中轻链CDR1包括选自下列的氨基酸序列:SEQIDNOS:128(RTSQNVYSYLA)、129(RTSESVYSYLA)、130(RASQSVYSYLA)、131(RASQSVSSYLA)和132(RASQSVSYYLA)。在另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链CDR1包括选自下列的氨基酸序列:SEQIDNOS:133(SYMNM)和134(SYWIG)。在进一步的实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中轻链CDR2包括选自下列的氨基酸序列:SEQIDNOS:135(AASSLQS)、136(GASTRAT)和137(DASNRAT)。在进一步的另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链CDR2包括选自下列的氨基酸序列:SEQIDNOS:138(IIYPGDSDTRYSPSFQG)和139(RIDPSDSYTNYSPSFQG)。本发明也包括人源化CD37-特异性SMIP多肽,其中轻链CDR3包括氨基酸序列SEQIDNO:220(QHHSDNPWT)。在另一实施方案中,本发明包括人源化CD37-特异性SMIP多肽,其中重链CDR3包括选自下列的氨基酸序列:SEQIDNOS:211(SVGPMDY)、212(SVGPFDY)、213(SVGPMDV)、214(SVGPFDS)、215(SVGPFDP)、216(SVGPFQH)、217(SVGPFDV)、218(SVGPFDI)和219(SVGPFDL)。再进一方面,本发明包括含有选择性(alternative)构架区的CD37-特异性SMIP多肽。一方面,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR1包括选自下列的氨基酸序列:SEQIDNOS:170-181。另一方面,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR1包括选自下列的氨基酸序列:SEQIDNOS:140-146。再一方面,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR2包括选自下列的氨基酸序列:SEQIDNOS:182-193。再另一方面,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR2包括选自下列的氨基酸序列:SEQIDNOS:147-153。再一方面,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR3包括选自下列的氨基酸序列:SEQIDNOS:194-205。再另一方面,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR3包括选自下列的氨基酸序列:SEQIDNOS:154-160。再一方面,本发明包括人源化CD37-特异性SMIP多肽,其中轻链FR4包括选自下列的氨基酸序列:SEQIDNOS:206-210。再另一方面,本发明包括人源化CD37-特异性SMIP多肽,其中重链FR4包括选自下列的氨基酸序列:SEQIDNOS:161-169。用在本发明中的示例性CD37-特异性SMIPs,包括但不限于:G28-1scFv(SSS-S)HWCH2WCH3,其由连接区或铰链区中的所有三个半胱氨酸残基都被突变成丝氨酸残基的G28-1单链Fv,与野生型CH2和CH3结构域组成;G28-1scFvIgAHWCH2WCH3,其包括IgA铰链和WTIgG1结构域;G28-1scFvVHL11S(SSS-S)HWCH2CH3,其中连接区或铰链区中的所有三个半胱氨酸残基都被突变成丝氨酸残基,并且重链可变区第11位亮氨酸被丝氨酸取代;G28-1scFvVHL11S(CSS-S)HWCH2CH3,其中半胱氨酸残基在第二、第三位被丝氨酸取代;G28-1scFvVHL11S(CSC-S)HWCH2CH3,其中半胱氨酸残基在第二位被丝氨酸取代;G28-1scFvVH11S(SSC-P)HWCH2WCH3(本文也称为TRU-016),其中连接区或铰链区中的第一和第二半胱氨酸残基被突变为丝氨酸残基,并且重链可变区第11位亮氨酸被丝氨酸取代;G28-1scFvVH11S(SCS-S)HWCH2WCH3,其中铰链区中的第一和第三半胱氨酸残基被突变为丝氨酸残基;G28-1scFvVHL11S(CCS-P)HWCH2WCH3,其中铰链区中的第三半胱氨酸残基被丝氨酸取代;G28-1scFvVHL11S(SCC-P)HWCH2WCH3,其中第一半胱氨酸被丝氨酸取代;G28-1scFvVHL11SmIgECH2CH3CH4,其包括重链可变区第11位亮氨酸被丝氨酸取代的小鼠IgECH2-4区;G28-1scFvVHL11SmIgAWIgACH2T4CH3,其包括小鼠IgA铰链,以及野生型IgACH2和缺乏4个羧基氨基酸GTCY的截短型IgACH3结构域;G28-1scFvVHL11ShIgECH2CH3CH4,其包括重链可变区第11位亮氨酸被丝氨酸取代的IgECH区;以及G28-1scFvVHL11ShIgAHWIgACH2TCH3,其包括IgA铰链、野生型IgACH2、和截短型IgACH2、以及缺乏4个羧基氨基酸GTCY的截短型IgACH3结构域。用在本发明的示例性CD20-特异性SMIPs,包括来自美国专利公开2003133939和20030118592所记载的抗-CD20单克隆抗体2H7的SMIPs。该SMIPs包括2H7scFv-Ig或其的衍生物。衍生物包括:CytoxB-MHWTG1C,其具有人IgG1Fc结构域和突变IgG1铰链结构域;CytoxB-MHMG1C,其包括突变Fc结构域;MG1H/MG1C,其包括具有突变的第234位亮氨酸残基的Fc受体;CytoxB-IgAHWTHG1C,其包括与野生型人Fc结构域融合的人IgA铰链部分;2H7scFv-大羊驼(llama)IgG1,其包括大羊驼IgG1铰链和CH2CH3区;2H7scFv-大羊驼IgG2,其包括大羊驼IgG2铰链和CH2CH3区;2H7scFv-大羊驼IgG3,其包括大羊驼IgG3铰链区和CH2CH3区。2H7scFvMTH(SSS)WTCH2CH3,其中连接区或铰链区中的所有三个半胱氨酸残基都突变为丝氨酸残基,并且其含有野生型CH2和CH3结构域;2H7scFvMTH(SSC),其中前两个半胱氨酸残基被丝氨酸残基取代;2H7scFvMTH(SCS),其中第一和第三半胱氨酸被丝氨酸残基取代;2H7scFvMTH(CSS)WTCH2CH3,其半胱氨酸残基在第二和第三位被丝氨酸取代;2H7scFvVH11SERIgGMTH(SSS)WTCH2CH3,其中重链可变区第11位亮氨酸被丝氨酸取代;2H7scFvIgA铰链-IgG1CH2-CH3,其包括IgA铰链区和WTIgG1结构域;2H7scFvIgA铰链-CH2-CH3,其包括IgA铰链、CH2-3区;2H7IgAWHIgACH2-T4CH3,其包括IgA铰链、野生型IgACH2、和缺乏4个羧基氨基酸GTCY的截短型IgACH3结构域。IgGCH3区突变衍生物包括:2H7scFvMTHWTCH2MTCH3Y405,其中第405位苯丙氨酸残基(根据上文Kabat等编号)被酪氨酸取代;2H7scFvMTHWTCH2MTCH3A405,其中第405位的苯丙氨酸被丙氨酸取代;scFvMTHWTCH2MTCH3A407,其中第407位的酪氨酸残基被丙氨酸取代;scFvMTHWTCH2MTCH3Y405A407,其包括两个突变;以及scFvMTHWTCH2MTCH3A405A407,其包括两个突变。2H7scFvMTH(CCS)WTCH2CH3,为IgG1铰链区第三半胱氨酸残基被丝氨酸取代的构建体。2H7scFvIgGMTH(SSS)MTCH2WTCH3SMIP包括突变的铰链(MT(SSS)),和残基第238位脯氨酸(根据Ward等)被丝氨酸取代的突变CH2结构域。2H7scFv-Ig衍生物,也包括在可变重链区具有点突变的的2H7scFv突变体。下列构建体都包括重链可变区中第11位亮氨酸被丝氨酸取代的突变:2H7scFvVH11SERIgGMTH(SSS-S)WTCH2CH3、2H7scFvVHL11S(CSS-S)HWCH2WCH3,其包括如上所述的突变铰链区;2H7scFvVHL11S(CSC-S)HWCH2WCH3,其包括如上所述的突变铰链区;2H7scFvVHL11SIgAHIgACH2T4CH3,其包括IgA铰链区、WTIgACH2和截短型IgACH3;2H7scFvVHL11SIgECH2CH3CH4,其包括IgECH2-4区;2H7VHL11SscFv(SSS-S)IgECH3CH4,其包括突变铰链区和IgECH3和CH4区;2H7scFvVHL11SmIgECH2CH3CH4,其包括小鼠IgE区;2H7scFvVHL11SmIgAHWIGACH2T4CH3,其包括如上所述的突变,以及由野生型CH2区和突变CH3区组成的鼠IgA恒定区;2H7scFvVHL11S(SSS-S)HK322SCH2WCH3,其包括人IgG1CH2区第322位残基赖氨酸至丝氨酸的突变;2H7scFvVHL11S(CSS-S)HK322SCH2WCH3,其包括如上所述的突变铰链区,以及先前描述的突变CH2区;2H7scFvVHL11S(SSS-S)HP331SCH2WCH3,其包括如上所述的突变铰链区,以及第331位脯氨酸改变为丝氨酸的突变CH2区;2H7scFvVHL11S(CSS-S)HP331SCH2WCH3,其包括突变铰链区,以及CH2区中第331位残基脯氨酸至丝氨酸的突变;2H7scFvVHL11S(SSS-S)HT256NCH2WCH3,其包括突变铰链区,以及CH2区中第256位残基苏氨酸至天冬酰胺的突变;2H7scFvVHL11S(SSS-S)HRTPE/QNAK(255-258)CH2WCH3,其包括突变的铰链区,以及残基255-258位分别从精氨酸、苏氨酸、脯氨酸、谷氨酸突变至谷氨酰胺、天冬酰胺、丙氨酸和赖氨酸的一系列突变;2H7scFvVHL11S(SSS-S)HK290QCH2WCH3,其包括突变的铰链区,以及第290位赖氨酸至谷氨酰胺的改变;2H7scFvVHL11S(SSS-S)HA339PCH2WCH3,其包括突变的铰链区,以及第339位丙氨酸至脯氨酸的改变;SMIP2H7scFv(SSS-S)HP238SCH2WCH3,其包括突变的铰链区,以及CH2中第238位脯氨酸至丝氨酸的改变,其与2H7scFvIgGMTH(SSS)MTCH2WTCH3相同。2H7scFvIgAHIGAHCH2T18CH3包括野生型IgA铰链,和在羧基末端有18个氨基酸截短的CH2区和CH3区。本发明的结合分子可以包括改进了结合分子活性、来自另一蛋白的天然或工程改造的胞外域。在一个实施方案中,胞外域选自CD154和CTLA4。CD37-特异性结合分子和CD20-特异性结合分子的“协同组合”,是指该组合效果大于单独施用时结合分子的效果之和。本发明一方面,将结合分子以一种或多种药物组合物进行施用。为施用结合分子至人或实验动物,优选将结合分子制成含有一种或多种药学上可接受载体的组合物。短语“药学上或药理学上可接受的”是指,当用如下所述本领域公知途径施用时,分子实体和组合物不产生变应性或其它不利反应。“药学上可接受的载体”包括任何和所有临床上使用的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延缓剂、等等。此外,化合物可用水或常规有机溶剂形成溶剂化物。也预期这样的溶剂化物。结合分子组合物可以经口、局部、经皮、肠胃外、通过吸入喷雾、阴道、直肠、或通过颅内注射施用。本文所用术语肠胃外,包括皮下注射、静脉内、肌内、脑池内注射或输注技术。也预期通过静脉内、皮内、肌内、乳房内、腹膜内、鞘内、眼球后、肺内注射,和/或在特定位点的外科手术植入施用。通常,组合物基本上不含致热原以及其它对接受者可能有害的杂质。优选注射,特别是静脉内注射。含本发明方法所用结合分子的本发明药物组合物,根据施用途径,可以包含药学上可接受的载体或添加剂。该载体或添加剂的实例,包括水,药学上可接受的有机溶剂,胶原,聚乙烯醇,聚乙烯吡咯烷酮,羧乙烯基聚合物,羧甲基纤维素钠,聚丙烯酸钠,藻酸钠,水溶性葡聚糖,羧甲基淀粉钠,果胶,甲基纤维素,乙基纤维素,黄原胶,阿拉伯胶,酪蛋白,明胶,琼脂,双甘油,甘油,丙二醇,聚乙二醇,凡士林,石蜡,十八烷醇,硬脂酸,人血清清蛋白(HSA),甘露糖醇,山梨糖醇,乳糖,药学上可接受的表面活性剂,等等。取决于发明剂型,使用的添加剂在适当条件下选自但不限于上述物质或它们的组合。药物组合物制剂,将根据所选施用途径进行变化(例如溶液、乳剂)。包含待施用抗体的合适组合物,可在生理可接受的运载体或载体中制备。对于溶液或乳剂而言,合适的载体例如包括,水或者醇/水溶液、乳剂或悬浮液,包括盐水和缓冲介质。肠胃外运载体可以包括氯化钠溶液,Ringer氏葡萄糖,葡萄糖和氯化钠,乳酸化(lactated)Ringer′s,或固定油。静脉内运载体可以包括各种添加剂,防腐剂,或者流体、营养物或电解质补充剂。多种含水载体,例如水、缓冲的水、0.4%盐水,0.3%甘氨酸或含水悬浮液,可包含与适合制备含水悬浮液的赋形剂混合的活性化合物。这样的赋形剂是悬浮剂,例如羧甲基纤维素钠,甲基纤维素,羟丙基甲基纤维素,藻酸钠,聚乙烯吡咯烷酮,西黄蓍胶,和阿拉伯胶;分散剂或湿润剂,可以是天然存在的磷脂,例如卵磷脂,或者烯化氧与脂肪酸的缩合产物,例如聚氧乙烯硬脂酸酯,或者环氧乙烷与长链脂族醇的缩合产物,例如heptadecaethyl-eneoxycetanol,或者环氧乙烷与来自脂肪酸和己糖醇的偏酯的缩合产物,例如聚氧乙烯山梨糖醇单油酸酯,或者环氧乙烷与来自脂肪酸和己糖醇酐的偏酯的缩合产物,例如聚乙烯山梨糖醇酐单油酸酯。含水悬浮液也可以包括一种或多种防腐剂,例如乙基或正丙基对羟基苯甲酸酯。结合分子组合物可以冷冻干燥以用于储藏,且在使用前重构于合适载体中。该技术已显示出对常规免疫球蛋白有效。任何合适的冷冻干燥和重构技术都可使用。本领域技术人员将理解,冷冻干燥和重构可导致不同程度的抗体活性丧失且由此应调整使用水平以进行补偿。适于加水制备含水悬浮液的可分散粉末和颗粒,提供与分散剂或湿润剂、悬浮剂和一种或多种防腐剂混合的活性化合物。合适的分散剂或湿润剂以及悬浮剂,可以上述记载的那些为例。这些制剂中的结合分子浓度,可根据所选特定施用模式而广泛变化,例如为按重量计低于约0.5%、通常为或至少约1%,至高达15或20%,并且其主要基于流体体积、粘度等等而选择。因此,用于肠胃外注射的一般药物组合物,可以制成含1mL无菌缓冲的水和50mg抗体。用于静脉内输注的一般组合物,可以制成含250ml无菌林格液和150mg抗体。制备肠胃外施用组合物的实际方法,将是本领域技术人员已知或显而易见的,且这些方法较详细地记载在,例如Remington′sPharmaceuticalScience,15thed.,MackPublishingCompany,Easton,Pa.(1980)。抗体的有效剂量为每次施用每kg体重0.01mg-1000mg。药物组合物可以为无菌可注射的含水、含油悬浮液、分散体或者用于即席制备无菌注射液或分散体的无菌粉末。悬浮液可根据已知工艺,用上述提到的合适分散剂或湿润剂及悬浮剂而制备。无菌注射制剂也可以是在非毒性肠胃外可接受稀释剂或溶剂中的无菌注射溶液或悬浮液,例如在1,3-丁二醇中的溶液。载体可以是溶剂或分散介质,其包含例如水,乙醇,多元醇(例如甘油、丙二醇、和液体聚乙二醇、等等),其适当混合物,植物油,林格液,和等渗氯化钠溶液。此外,无菌固定油,通常也用作溶剂或悬浮介质。为此目的,可以使用任何温和固定油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸例如油酸,发现也可用于注射制剂。在所有情况下,形式必须无菌并且必须为在存在容易的可注射性的程度流动的。合适的流动性可以通过下列方式予以维持:例如通过使用包衣、如卵磷脂,在分散体情况下通过维持所需颗粒大小,以及通过使用表面活性剂。制剂在制备和存储条件下必须稳定,且必须能抗微生物例如细菌和真菌的污染而保存。微生物作用的预防,可通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯代丁醇、苯酚、山梨酸、硫柳汞、等等,来实现。在多种情况下,需要包括等渗剂,例如糖或氯化钠。延长吸收注射用组合物,可通过在组合物中使用延长吸收试剂例如单硬脂酸和明胶来实现。用于施用的组合物,可与摄入或吸收增强剂一起制备以增强其功效。这样的增强剂包括例如,水杨酸盐,甘氨胆酸盐/亚油酸盐,glycholate,抑酶肽,杆菌肽,SDS,癸酸盐,等等。参见,例如,Fix(J.Pharm.Sci.,85:1282-1285,1996)和Oliyai和Stella(Ann.Rev.Pharmacol.Toxicol.,32:521-544,1993)。此外,预期用于本发明的组合物的亲术性和疏水性特性可以充分平衡,由此增强其体外且尤其是体内使用的效用,而缺乏这样平衡的其它组合物的效用相当低。具体地,预期用于本发明的组合物,具有在含水介质中允许在身体中的吸收和生物利用率的适当溶解度程度,同时,该组合物也具有在脂质中允许化合物横越细胞膜至推定作用位点的溶解度程度。因此,当它们可送递至靶抗原活性位点时,预期的抗体组合物将最有效。一方面,本发明方法包括结合分子组合物的施用步骤。可以用任何医学上可接受的引导治疗剂直接或间接进入哺乳动物个体的手段实施本发明方法,所述手段包括但不限于注射,经口摄食,鼻内,局部,经皮,肠胃外,吸入喷雾,阴道,或直肠施用。本文所用术语肠胃外,包括皮下、静脉内、肌内和脑池内注射、以及导管或输注技术。也预期通过皮内、乳房内、腹膜内、鞘内、眼球后、肺内注射,和/或在特定位点的外科手术植入施用。在一个实施方案中,通过直接注射至位点,或者通过能内部递送制剂的持续递送或持续释放机理,在需要治疗的癌或病变组织位点,进行施用。例如,能持续递送组合物(例如可溶性多肽,抗体,或小分子)的生物可降解小球体或胶囊,或者其它生物可降解的聚合物构造,可包括在在癌附近植入的本发明制剂中。治疗组合物也可以多位点递送至患者。多重施用可以同时进行或在一定时间段内进行。在某些情况下,提供治疗组合物的连续流是有利的。另外的治疗可基于周期施用,例如每小时、每天、每周、或每月。本发明结合分子组合物可以包括一种或可以包括超过一种结合分子。本发明也预期将结合分子组合物与第二试剂一起施用。本发明预期的第二试剂,在下文段落中列出。第二试剂可以是B-细胞相关分子。本发明预期的其它B-细胞相关分子,包括结合B-细胞表面非CD37或CD20的分子的结合分子。B-细胞相关分子包括但不限于,CD19(B-淋巴细胞抗原CD19,也称为B-淋巴细胞表面抗原B4,或Leu-12),CD21,CD22(B-细胞受体CD22,也称为Leu-14,B-淋巴细胞粘附分子,或BL-CAM),CD23,CD40(B-细胞表面抗原CD40,也称为肿瘤坏死因子受体超家族成员5,CD40L受体,或Bp50),CD80(T淋巴细胞激活抗原CD80,也称为激活B7-1抗原,B7,B7-1,或BB1),CD86(T淋巴细胞激活抗原CD86,也称为激活B7-2抗原,B70,FUN-1,或BU63),CD137(也称为肿瘤坏死因子受体超家族成员9),CD152(也称为细胞毒性T-淋巴细胞蛋白4或CTLA-4),L6(肿瘤相关抗原L6,也称为跨膜4超家族成员1,膜组分表面标记1,或M3S1),CD30(淋巴细胞激活抗原CD30,也称为肿瘤坏死因子受体超家族成员8,CD30L受体,或Ki-1),CD50(也称为胞间粘附分子-3(ICAM3),或ICAM-R),CD54(也称为胞间粘附分子-1(ICAM1),或主群鼻病毒受体),B7-H1(激活的T-细胞、B-细胞和髓样细胞所表达的免疫抑制受体的配体,也称为PD-L1;参见Dong,等,″B7-H1,athirdmemberoftheB7family,co-stimulatesT-cellproliferationandinterleukin-10secretion,″Nat.Med.,5:1365-1369(1999)),CD134(也称为肿瘤坏死因子受体超家族成员4,OX40,OX40L受体,ACT35抗原,或TAX-转录激活的糖蛋白1受体),41BB(4-1BB配体受体,T-细胞抗原4-1BB,或T-细胞抗原ILA),CD153(也称为肿瘤坏死因子配体超家族成员8,CD30配体,或CD30-L),CD154(也称为肿瘤坏死因子配体超家族成员5,TNF相关激活蛋白,TRAP,或T细胞抗原Gp39),和Toll受体。上述所列构建体靶和/或靶抗原,仅为示例而并非穷举。细胞因子和生长因子是本发明预期的第二试剂,且其包括但不限于一种或多种TNF、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-14、IL-15、IL-16、IL-17、IL-18、IFN、G-CSF、Meg-CSF、GM-CSF、血小板生成素、干细胞因子和红细胞生成素。本发明的药物组合物也可包括其它已知的血管形成素(angiopoietin),例如Ang-1、Ang-2、Ang-4、Ang-Y和/或人血管形成素样多肽,和/或血管内皮生长因子(VEGF)。用于本发明药物组合物的生长因子,包括血管生成素(angiogenin)、骨形态发生蛋白-1、骨形态发生蛋白-2、骨形态发生蛋白-3、骨形态发生蛋白-4、骨形态发生蛋白-5、骨形态发生蛋白-6、骨形态发生蛋白-7、骨形态发生蛋白-8、骨形态发生蛋白-9、骨形态发生蛋白-10、骨形态发生蛋白-11、骨形态发生蛋白-12、骨形态发生蛋白-13、骨形态发生蛋白-14、骨形态发生蛋白-15、骨形态发生蛋白受体IA、骨形态发生蛋白受体IB、脑源神经营养因子、睫状神经营养因子、睫状神经营养因子受体α、细胞因子诱导的嗜中性粒细胞趋化因子1、细胞因子诱导的嗜中性粒细胞趋化因子2α、细胞因子诱导的嗜中性粒细胞趋化因子2β、β内皮细胞生长因子、内皮素1、表皮生长因子、上皮源嗜中性粒细胞引诱剂、成纤维细胞生长因子4、成纤维细胞生长因子5、成纤维细胞生长因子6、成纤维细胞生长因子7、成纤维细胞生长因子8、成纤维细胞生长因子8b、成纤维细胞生长因子8c、成纤维细胞生长因子9、成纤维细胞生长因子10、酸性成纤维细胞生长因子、碱性成纤维细胞生长因子、胶质细胞系衍生神经营养因子受体α1、胶质细胞系衍生神经营养因子受体α2、生长相关蛋白、生长相关蛋白α、生长相关蛋白β、生长相关蛋白γ、肝素结合表皮生长因子、肝细胞生长因子、肝细胞生长因子受体、胰岛素样生长因子I、胰岛素样生长因子受体、胰岛素样生长因子II、胰岛素样生长因子结合蛋白、角质形成细胞生长因子、白血病抑制因子、白血病抑制因子受体α、神经生长因子、神经生长因子受体、神经营养蛋白-3、神经营养蛋白-4、胎盘生长因子、胎盘生长因子2、血小板衍生内皮细胞生长因子、血小板衍生生长因子、血小板衍生生长因子A链、血小板衍生生长因子AA、血小板衍生生长因子AB、血小板衍生生长因子B链、血小板衍生生长因子BB、血小板衍生生长因子受体α、血小板衍生生长因子受体β、前-B细胞生长刺激因子、干细胞因子、干细胞因子受体、转化生长因子α、转化生长因子β、转化生长因子β1、转化生长因子β1.2、转化生长因子β2、转化生长因子β3、转化生长因子β5、潜在转化生长因子β1、转化生长因子β结合蛋白I、转化生长因子β结合蛋白II、转化生长因子β结合蛋白III、肿瘤坏死因子受体I型、肿瘤坏死因子受体II型、尿激酶型纤溶酶原激活物受体、血管内皮生长因子以及它们的嵌合蛋白和生物或免疫活性片段。预期作为第二试剂的化学治疗剂实例,包括但不限于烷化剂,例如氮芥(如,氮芥、环磷酰胺、异环磷酰胺、美法仑和苯丁酸氮芥);亚硝基脲(如,卡氮芥(BCNU)、罗氮芥(CCNU)和赛氮芥(甲基CCNU));氮丙啶/甲基蜜胺(如,三乙撑蜜胺(TEM)、乙胺硫磷(噻替派)和六甲蜜胺(HMM,六甲聚腈胺));烷基磺酸酯(如,白消安);以及三嗪(如,达卡巴嗪(DTIC));抗代谢物,例如叶酸类似物(如,甲氨蝶呤、曲美沙特和培美曲塞(pemetrexed)(多靶向的叶酸抗代谢物(antifolate)));嘧啶类似物(如,5-氟尿嘧啶(5-FU)、氟尿脱氧核苷、吉西他滨、胞嘧啶阿拉伯糖苷(AraC,阿糖胞苷)、5-氮杂胞苷和2,2′-二氟脱氧胞苷);以及嘌呤类似物(如,6-巯基嘌呤、6-硫鸟嘌呤、硫唑嘌呤、2′-去氧助间型霉素(喷司他丁)、赤式羟基壬基腺嘌呤(erythrohydroxynonyladenine)(EHNA)、磷酸氟达拉滨、2-氯脱氧腺苷(克拉屈滨,2-CdA));I型拓朴异构酶抑制剂,例如喜树碱(CPT)、拓扑替康和伊立替康;天然产品,例如足叶草乙甙(如,依托泊甙和替尼泊甙);以及长春花生物碱(如,长春碱、长春新碱和长春烯碱);抗肿瘤抗生素,例如放线菌素D、阿霉素和博来霉素;辐射敏化剂,例如5-溴脱氧尿苷(5-bromodeozyuridine)、5-碘脱氧尿苷和溴脱氧胞苷;铂配位化合物,例如顺铂、卡铂和奥沙利铂;取代脲类,例如羟基脲;以及甲肼衍生物,例如N-甲肼(MIH)和甲苄肼。化学治疗剂、放射治疗剂和其它活性和辅助试剂的非限制性实例,也显示在表1中。表1本发明预期用于治疗自身免疫疾病的第二试剂称为对治疗的个体免疫系统起抑制或掩蔽作用的免疫抑制剂。免疫抑制剂包括例如,非类固醇抗炎药(NSAIDs),止痛剂,糖皮质激素,治疗关节炎的缓解疾病的抗风湿性药物(DMARDs),或生物应答调节剂。DMARD叙述中的组合物,也可用于治疗除RA以外的许多其它自身免疫疾病。示例性的NSAIDs选自:布洛芬,萘普生,甲氧萘丙酸钠,诸如罗非克西和西乐葆的Cox-2抑制剂,以及唾液酸化物(sialylate)。示例性的止痛剂选自:醋氨酚,羟可酮,盐酸丙氧芬的曲马多。示例性的糖皮质激素选自:可的松,地塞米松,氢化可的松,甲基强的松龙,强的松龙,或强的松。示例性的生物应答调节剂包括但不限于:抗细胞表面标记(例如CD4、CD5等等)的分子,细胞因子抑制剂,例如TNF拮抗剂(例如依那西普(etanercept)(Enbrel)、阿达木单抗(adalimumab)(Humira)和英夫单抗(Remicade)),趋化因子抑制剂,以及粘附分子抑制剂。生物应答调节剂包括单克隆抗体及分子的重细形式。示例性的DMARDs包括但不限于:硫唑嘌呤,环磷酰胺,环孢菌素,甲氨蝶呤,青霉胺,来氟洛米,柳氮磺吡啶,羟氯喹,金[经口(金诺芬)和肌内],和二甲胺四环素。预期结合分子组合物与第二试剂同时在相同制剂中给予。可选地,试剂以独立制剂但同时施用,同时是指试剂在相互30分钟内给予。另一方面,将第二试剂在结合分子组合物施用之前施用。之前施用是指,施用第二试剂在抗体治疗前1周之内,直至在抗体施用前30分钟施用。也预期第二试剂在施用结合分子组合物之后施用。之后施用是指,抗体治疗后30分钟至最多抗体施用后1周施用。也预期当结合分子与第二试剂组合施用时,其中第二试剂为细胞因子或生长因子或化学治疗剂,施用也包括使用放疗剂或放射治疗。与抗体组合物组合施用的放射治疗,由治疗医师确定施用,并且以一般给予癌症治疗患者的剂量。给定剂量中的结合分子量,将根据施用治疗的个体大小和待治疗病症的特性而变化。在示例性治疗中,可能需要施用约1mg/天、约5mg/天、约10mg/天、约20mg/天、约50mg/天、约75mg/天、约100mg/天、约150mg/天、约200mg/天、约250mg/天、约500mg/天或约1000mg/天。剂量也可基于患者体重施用,以约0.01-约50mg/kg的剂量。在相关实施方案中,结合分子可以约0.015-约30mg/kg剂量范围施用。在进一步的实施方案中,结合分子以约0.015、约0.05、约0.15、约0.5、约1.5、约5、约15或约30mg/kg的剂量施用。这些组合物可以以单剂或多剂施用。标准剂量反应研究——先动物模型然后临床实验,揭示对特定疾病状态和患者群体的最佳剂量。施用结合分子组合物在单剂治疗后,减少B-细胞群体至少20%。在一个实施方案中,B-细胞群体被减少了至少约20、约30、约40、约50、约60、约70、约80、约90或约100%。B-细胞减少定义为绝对B-细胞计数低于正常范围下限的减少。B-细胞恢复定义为绝对B-细胞计数回复至下列之一:受试者基线值的70%或正常范围。施用CD20-特异性结合分子,也导致特定B-细胞亚群增强的细胞凋亡。细胞凋亡是指诱导细胞的程序性细胞死亡,其表现为DNA断裂、细胞收缩、细胞破碎、膜小泡形成、或者如膜联蛋白V染色所评估的膜脂质组成改变且由其评估。而且,施用本发明结合分子组合物,导致对所治疗疾病或病症产生所需的临床效果。例如,在类风湿性关节炎患者中,一方面,施用以临床显著量[例如,实现了美国风湿病协会初步改善检测(AmericanCollegeofRheumatologyPreliminaryDetectionofImprovement)(ACR20)],和/或疼痛和肿胀关节改善20%和3/5剩余ACR测量改善20%(Felson等,ArthritisRheum.1995,38:727-35)改善患者状况。施用CD37-特异性和CD20-特异性结合分子后,RA患者改善的生物学测量包括测量细胞因子水平变化,所述变化经由蛋白或RNA水平测量。目的细胞因子包括但不限于,TNF-α,IL-1,干扰素,Blys,和APRIL。细胞因子变化可能是因为B细胞数目减少或激活的T细胞减少。在RA患者中,在施用CD20-特异性结合分子之前和之后,测量骨周转(骨再吸收或骨质侵蚀)相关标记。相关标记包括但不限于,碱性磷酸酶,骨钙蛋白,胶原分解片段,羟脯氨酸,酒石酸抗性酸性磷酸酶,和RANK配体(RANKL)。其它RA改善相关读数包括测量C反应蛋白(CRP)水平,红细胞沉降速率(ESR),类风湿因子,CCP(环瓜氨酸肽(cycliccitrullinatedpeptide))抗体,以及通过流式细胞术评估全身B细胞水平和淋巴细胞计数。特异性因子也可从RA患者滑膜测量,包括评估来自滑膜活组织检查的滑膜B细胞水平,RANKL水平,以及如上所述的其它骨因子和细胞因子。在相关方面,组合施用对其它疾病的效果根据本领域已知标准进行测量。例如,预期根据本发明治疗的Crohn氏病患者,实现了Crohn氏病活性指数(CDAI)约50-约70单位的改善,其中缓和为150单位(Simonis等,Scand.JGastroent.1998,33:283-8)。150或200得分据认为属正常,而450得分据认为属严重疾病。还需要施用CD37-特异性和CD20-特异性结合分子使炎性肠病患者中的核周抗嗜中性粒细胞抗体(pANCA)和抗啤酒糖酵母抗体(ASCA)减少。也预期根据本发明治疗的成人型和青少年肌炎患者实现了核心组评估的改善,例如6组核心组中3组取得了约20%改善并且至多2组核心测量值有约25%恶化(参见Rider等,ArthritisRheum.2004,50:2281-90)。也预期根据本发明治疗的SLE患者,实现了全身性狼疮活性测量(SLAM)或SLE疾病活性指数(SLEDAI)得分至少1点的改善(Gladman等,JRheumatol1994,21:1468-71)(Tan等,ArthritisRheum.1982,25:1271-7)。SLAM得分>5,或SLEDAI得分>2,据认为属于临床活跃疾病。治疗应答可定义为,在在2种疾病活性测量(SLE疾病活性指数[SLEDAI]和全身性狼疮活性测量)和2种生活质量测量(患者综合评估和Krupp疲劳严重性量表)上的改善或稳定化(Petri等,ArthritisRheum.2004,50:2858-68.)。也预期施用给SLE患者该结合分子,导致抗双链DNA抗体减少。此外,改善可用不列颠群岛狼疮评估组标准(BritishIslesLupusAssessmentGroupCriteria)(BILAG)评估。也预期根据本发明治疗的多发性硬化患者,实现了Kurtzke扩张的残疾状态量表(KurtzkeExpandedDisabilitystatusscale)(EDSS)(Kurtzke,F.,Neurology1983,33:1444-52)至少0.5临床得分的改善,或者Kurtzke量表至少1.0的临床疾病恶化的延迟(Rudick等,Neurology1997,49:358-63)。也预期接受CD37-特异性和CD20-特异性结合分子的IIM患者,实现了特发性炎性肌病标准(IIMC)评估中所列五项标准之至少一项的减少(Miller,F.,同前)。也预期施用给IIM患者导致选自下列的IIM相关因子减少:肌酸激酶(CK)、乳酸脱氢酶、醛缩酶、C-反应蛋白、天冬氨酸转氨酶(AST)、丙氨酸氨基转移酶(ALT)以及抗核自身抗体(ANA)、肌炎特异性抗体(MSA)和抗可提取的核抗原的抗体。此外,患者满足Rider等,ArthritisRheum.,50(7):2281-2290(2004)中所列6项标准之3项标准,并且仅仅2项标准恶化。在一些实施方案中,患B细胞癌的患者接受本发明的治疗,且基于本领域公知和常用以及如下所述临床标准,例如肿瘤大小减小、肿瘤数目减少和/或疾病症状改善,显示出对治疗全面有益的应答。示例性的临床标准在美国国家癌症研究院(U.S.NationalCancerInstitute)(NCI)中提供,其将某些种类癌症分为临床种类“顽固性”和“攻击性”淋巴瘤。顽固性淋巴瘤包括滤泡细胞淋巴瘤,分离至细胞学“等级”,弥散性小淋巴细胞性淋巴瘤/慢性淋巴细胞性白血病(CLL),淋巴浆细胞样/Waldenstrom氏巨球蛋白血症,边缘区淋巴瘤和毛细胞性白血病。攻击性淋巴瘤包括弥散性混合和大细胞淋巴瘤,伯基特淋巴瘤/弥散型小非切割细胞淋巴瘤,成淋巴细胞性淋巴瘤,套细胞淋巴瘤和AIDS-相关淋巴瘤。在某些情况下,国际预后指数(IPI)可用于攻击性和滤泡性淋巴瘤病例。IPI考虑的因素包括,年龄(<60岁年龄对>60岁年龄),血清乳酸脱氢酶(正常水平对升高水平),性能状态(0或1对2-4)(参见下列定义),疾病分期(I或II对III或IV),以及结外位点累及(0或1对2-4)。有两项或更多项风险因素的患者,五年内不复发和总体存活的机会小于50%。攻击性IPI的性能状态定义如下:等级描述:0完全活性,能不受限制开展所有疾病前工作;1在身体上费力的行动中受限,但能走动,且能做轻松或坐着做的工作,例如轻家务,办公室工作;2能走动,且生活能全部自理,但在最多或大约50%以上清醒时间,不能做任何工作;3仅能有限的自理,50%以上清醒时间,被约束在床或椅子上;4完全残疾,生活不能任何自理,完全约束于床或椅子上;以及,5死亡(参见,TheInternationalNon-Hodgkin′sLymphomaPrognosticFactorsProject.Apredictivemodelforaggressivenon-Hodgkin′slymphoma.NEnglJMed.329:987-94,1993)。通常,淋巴瘤等级用下述标准进行临床评估:低等级淋巴瘤通常表现为结节疾病,并且通常为顽固性或缓慢生长。中-和高-等级疾病通常表现为具有大结外大块肿瘤的更显攻击性的疾病。AnnArbor分类系统也用于测量肿瘤进展,特别是非何杰金淋巴瘤。在该系统中,依赖于患者具有明确定义一般症状(B)还是不具有(A),将成人NHL的I、II、III和IV期分为A类和B类。B是指患者具有下列症状:在诊断前6个月内体重有10%以上不明原因的减轻,温度超过38C的不明原因发热,以及湿透的盗汗。分期定义如下:I期-累及单淋巴结区或局部累及单淋巴外器官或位点。II期-累及隔相同侧两个或更多个淋巴结区,或者局部累及单个关联淋巴外器官或位点及其局部淋巴结,在隔相同侧有或没有其它淋巴结区。III期-累及膈两侧淋巴结区,并可能伴随局部累及淋巴外器官或位点、累及脾或者两者都累及。IV期-有或没有关联淋巴结累及的散布地(多病灶)累及一个或多个淋巴外位点,或者有远(非区域)结节累及的孤立的淋巴外器官累及。进一步细节,可参见TheInternationalNon-Hodgkin′sLymphomaPrognosticFactorsProject:Apredictivemodelforaggressivenon-Hodgkin′slymphoma,NewEnglandJ.Med.(1993)329:987-994。一方面,本发明方法的治疗效果根据应答水平确定,例如将部分应答定义为肿瘤减小至小于初始大小一半。完全应答则定义为,用临床或放射学评估证实的疾病完全消除。在一个实施方案中,接受本发明治疗的个体显示出至少部分治疗应答。根据Cheson与国家癌症研究院合作开发的NHL评估标准(Cheson等,JClinOncol.1999,17:1244;Grillo-Lopez等,AnnOncol.2000,11:399-408),完全应答在所有疾病可检测的临床和放射照相证据和疾病相关症状完全消失,所有淋巴结回复至正常大小,脾大小复原,且骨髓中淋巴瘤已被清除时获得。未经证实的完全应答在患者显示出疾病完全消失及脾脏大小复原,但淋巴结只有75%以上复原且骨髓不确定时获得。未经证实的完全应答满足并且超出了部分应答标准。总体应答是指,总体肿瘤负荷减少至少50%。已经开发了各种其他形式的癌症或过度增殖性疾病的类似标准,且它们可被本领域技术人员容易获得。参见,例如,Cheson等,ClinAdvHematolOncol.2006,4:4-5,该文记载了CLL评价标准;Cheson等,JClinOncol.2003,21:4642-9,该文记载了AML标准;Cheson等,Blood2000,96:3671-4,该文记载了脊髓发育不良综合征标准。另一方面,B细胞癌患者的治疗应答,与未接受治疗患者相比,显示出疾病进展减缓。减慢的疾病进展或任一上述因子的测量,可用本领域公知技术进行,包括骨扫描,CT扫描,镓扫描,淋巴管造影照片,MRI,PET扫描,超声,等等。如果传统治疗与本发明治疗组合施用则可修改给药将是显而易见的。另一方面,本发明包括以便于用于实施本发明方法方式进行包装的、用于本发明方法的、含一种或多种化合物或组合物的试剂盒。在最简单的实施方案中,该试剂盒包含,在容器例如密封瓶或管中包装的、用于实施本发明方法的本文所记载的化合物或组合物,以及粘贴于该容器或包含于该包装中的、记载使用该化合物或组合物以实施本发明方法的标签。优选地,将化合物或组合物以单位剂量形式包装。根据优选的施用途径或为了实施筛选方法,试剂盒可进一步包括施用组合物的适宜装置。试剂盒也可包含记载在本发明方法中应用结合分子组合物的标签。本发明也包括制品。这样的制品包括,任选地与药用载体或稀释剂一起出现的CD37-特异性结合分子或者CD37-特异性和CD20-特异性结合分子,以及至少一种记载本发明使用结合分子的方法的标签。这样的制品也任选包括,至少一种连同结合分子施用的第二试剂。本发明也请求保护,含CD37-特异性结合分子或CD37-特异性和CD20-特异性结合分子的组合物,在制备治疗或预防涉及异常B-细胞活性的疾病的药物中的用途。附图说明图1A图解了TRU-016分子结构;图1B显示了SDS-PAGE分析结果,结果显示,表达的蛋白在非还原条件下以Mr约为110kDa迁移,且在还原条件下约为52kDa;且图1C显示,用流式细胞术分析时,TRU-016分子对人外周血B淋巴细胞,显示出高水平特异性结合,而对非B-细胞淋巴细胞门其它细胞亚群(CD19阴性群体),显示出更低水平结合。图2A-E显示了不同CD37靶向的试剂的结合抑制。图3A显示了在含或不含眼镜蛇毒因子(CVF)的人正常血清中,与RamosB细胞温育的FITCC1q与TRU-016分子形式的结合;图3B显示了在含或不含CVF的人正常血清中,与RamosB细胞温育的TRU-016分子形式的CDC活性;且图3C显示了与RamosB细胞和人或兔补体温育的TRU-016分子形式的CDC活性。图4显示了获自GPC纯化TRU-016的HPLC大小排阻层析(SEC)轨迹,该图绘制了收集的不同级分的吸光度对停留时间。图5A显示了SEC级分的结合特性;图5B显示了SEC级分的CDC活性;且图5C显示了SEC级分的ADCC活性。图6显示了TRU-015、rituxan、TRU-016或它们的组合对RamosB细胞的CDC活性。图7显示了TRU-016对于TRU-015对DHL-4B细胞的CDC活性的作用。图8显示了TRU-016对于TRU-015和rituxan的CDC活性的作用。图9显示了在CDC测定中TRU-016对TRU-015的作用。图10显示了在CDC测定中TRU-016对rituxan的作用。图11显示了TRU-015和TRU-016在使用BJAB细胞的ADCC测定中的相互作用。图12显示了TRU-015和TRU-016在使用Daudi细胞的ADCC测定中的相互作用。图13显示了TRU-015和TRU-016在使用Ramos细胞的ADCC测定中的相互作用。图14显示了rituxan、TRU-016以及它们的组合对BJAB细胞的特异性杀伤的作用。图15显示了rituxan、TRU-016以及它们的组合对BJAB细胞的特异性杀伤的作用。图16显示了TRU-015、TRU-016以及它们的组合对BJAB细胞的特异性杀伤的作用。图17显示了TRU-015、TRU-016以及它们的组合对BJAB细胞的特异性杀伤的作用。图18A-D显示了TRU-016二聚体形式单独不介导CDC,但是体外加强利妥希玛CDC活性。图19A-B显示了蛋白A纯化的TRU-016诱导Ramos和Daudi细胞的细胞凋亡,而二聚体形式需要交联。图20显示了TRU-016优先耗尽PBMC培养物中的正常B细胞。图21显示了TRU-016与huIgG、rituxan、以及TRU-016与rituxan组合治疗相比较,对动物肿瘤体积的功效。图22A和B显示了TRU-016二聚体形式表现出显著抗肿瘤活性,如通过对肿瘤体积和小鼠异种移植肿瘤模型百分比存活的作用所测量的。图23显示了TRU-016二聚体不增强MHCII、CD19、CD80/86或CD45特异性试剂治疗所产生的CDC活性。图24显示了用TRU-016、利妥希玛或它们的组合治疗后,Ramos肿瘤小鼠百分比存活(最高90天)。图25和26显示了用TRU-016或利妥希玛治疗后,Daudi肿瘤小鼠百分比存活(最高90天)。图27显示了TRU-016有效降低氟达拉滨治疗的细胞的相对细胞生存力,因此加强单独氟达拉滨的细胞毒性效应。图28显示了在利妥希玛抗性细胞系中,TRU-016诱导比赫赛汀(herceptin)或利妥希玛更强的细胞毒性。图29显示了TRU-016诱导CD19+初级CLLB细胞的酪氨酸磷酸化。图30A显示了人源化TRU-016构建体No.019001(SEQIDNO:6)与TRU-016(SEQIDNO:2)Kabat编号的共有氨基酸序列;图30B显示了三种人源化TRU-16构建体(019001、019008和109009)的氨基酸序列比对。图31显示了三种人源化TRU-016构建体(019001、019041和019044)的DNA和氨基酸序列比对。图32显示了上述相同的三种人源化TRU-016构建体(019001、019041和019044)的FASTA格式序列比对。具体实施方式实施例本发明的其它方面和细节,从下列实施例记载将显而易见,这些实施例的目的在于解释而不是限制。实施例1记载了制备CD37-特异性结合分子;实施例2显示TRU-016和各种CD37-特异性抗体识别相同或重叠的表位;实施例3显示了TRU-016在结合C1q并激活传统补体激活途径上存在不足;实施例4显示了TRU-016多聚体的活性和结合;实施例5记载了制备CD20-特异性结合分子;实施例6显示TRU-016与TRU-015或fituxan组合协同增强B细胞的细胞凋亡;实施例7显示TRU-016与CD20-特异性抗体或SMIPs组合,协同增强CDC;实施例8显示TRU-016增强CD20-特异性抗体和SMIPS的ADCC和CDC活性;实施例9显示TRU-016诱导B细胞的细胞凋亡;实施例10显示CD37-特异性SMIP与CD20-特异性抗体组合,协同减少鼠肿瘤异种移植模型的肿瘤体积;实施例11显示单独CD37-特异性SMIP也减少鼠肿瘤异种移植模型的肿瘤体积;实施例12显示TRU-016不影响其它B细胞表面受体的CDC活性;实施例13显示TRU-016不增强包括MHCII、CD19、CD80/86和CD40在内的各种靶向的受体的CDC活性;实施例14提供了显示TRU-016体内增强肿瘤小鼠存活的进一步数据;实施例15显示TRU-016体外增强氟达拉滨诱导的CLL细胞的细胞死亡;实施例16显示TRU-016诱导利妥希玛抗性细胞的直接细胞毒性;实施例17显示TRU-016诱导CD19+初级CLLB细胞的酪氨酸磷酸化;以及实施例18给出了人源化TRU-016分子。实施例1CD37-特异性结合分子的制备CD37-特异性SMIPs记载在共有的美国申请No.10/627,556和美国专利公开Nos.2003/133939、2003/0118592和2005/0136049中。示例性的SMIP——TRU-016制备如下。TRU-016[G28-1scFvVH11S(SSC-P)HWCH2WCH3]为结合CD37抗原的重组单链蛋白。结合域基于前段所列专利公开文献先前公开的G28-1抗体序列,这些公开文献在此并入作为参考。结合域通过修饰的铰链区连接于效应域——人IgG1的CH2和CH3结构域。TRU-016在溶液中以二聚体存在,且该二聚体理论分子量约为106,000道尔顿。G28-1杂交瘤总RNA,用TrizolRNA(Gibco)试剂按制造商使用说明,进行分离。cDNA用5μgRNA、随机引物和SuperscriptIl逆转录酶(GIBCOBRL)制备。可变结构域用不同鼠VK或VH基因家族的简并引物库克隆。将G28-1杂交瘤可变结构域克隆至PCR2.1TOPO克隆载体(Invitrogen)中,并对具有正确大小插入片段的转化体DNA测序。将来自正确克隆的重链和轻链可变区用作G28-1scFv缝合(sewing)PCR扩增模板,所述G28-1scFv用15aa(gly4ser)3接头以VL-VH方向连接在一起。将抗-CD37scFv,与修饰的人IgG1铰链、CH2和CH3结构域附着(参见图1A)。为确保哺乳动物细胞足够表达,选择允许哺乳动物细胞表达显著增加的那些可变区修饰。具体地,将scFv第11位的亮氨酸改变为丝氨酸。预计成熟肽长度为473氨基酸。编码TRU-016的多核苷酸序列和TRU-016氨基酸序列,分别如SEQIDNOs:1和2所示。TRU-016在中国仓鼠卵巢(CHO)哺乳动物细胞表达系统中,用重组DNA技术进行生产。将生产SMIP的转化的CHO细胞,用专有的培养基培养于生物反应器。将TRU-016SMIPs用A蛋白亲和层析,从CHO培养物上清液进行纯化。用dPBS以5.0mls/分钟(150cm/小时),对50mL重组A蛋白(rProteinA)FF琼脂糖柱(GEHealthcarerProteinASepharoseFF,Catalog#17-0974-04)平衡1.5柱体积(CV)。将培养物上清液用AKTAExplorer100Air(GEhealthcareAKTAExplorer100Air,Catalog#18-1403-00)以1.7mls/分钟流速,加载至重组A蛋白琼脂糖FF柱,从而捕获重组TRU-016。用dPBS洗涤柱5柱体积(CV),然后为1.0MNaCl,20mM磷酸钠,pH6.0,且然后为25mMNaCl,25mMNaOAc,pH5.0。这些洗涤步骤可从重组A蛋白柱,去除非特异性结合的CHO宿主细胞蛋白,这有助于洗脱后的产品沉淀。用100mM甘氨酸,pH3.5,将重组TRU-016从柱洗脱。回收10mL级分洗脱的产品,然后,用20%洗脱体积的0.5M2-(N-吗啉代)乙磺酸(MES)pH6.0,将洗脱的产品调整至pH5.0。该洗脱的产品通过样品浓缩至约25mg/mLTRU-016,然后在用于GPC纯化的制备中过滤灭菌,而制备用于GPC纯化。接着,将纯化的蛋白进行GPC大小排阻层析(SEC),以从高分子量聚集体中获得TRU-016(二聚体)分子的进一步纯化。用dPBS以12.6mls/分钟(38cm/小时),将含1LSuperdex200FF琼脂糖的XK50/100柱(GEhealthcareXK50/100空层析柱,Catalog#18-8753-01)平衡1.5柱体积(CV)。将最大体积54mls(3%CV)样品上柱。以12.6ml/分钟连续运行所述柱,且在40mL级分处分级分离洗脱的蛋白。用分析型HPLC分析各级分产品质量,且将>95%POI(非聚集的)TRU-016的洗脱的级分汇合。该所得库以0.22μm过滤灭菌。然后将该材料浓缩,用20mM磷酸钠和240mM蔗糖配制,所得pH为6.0。组合物过滤后,以10mg/mL浓度装满入玻璃小瓶中。每玻璃小瓶含5mLTRU-016(50mg/小瓶)。对TRU-016蛋白,也进行4-20%NovexTris-甘氨酸凝胶(Invitrogen,SanDiego,CA)上的SDS-PAGE分析。样品95℃加热3分钟后,用NovexTris-甘氨酸SDS样品缓冲液(2X),在还原(加入1/10体积NuPAGE样品还原剂)或非还原条件下加载,而后,进行于150V电泳90分钟。用1XNovexTris-甘氨酸SDS电泳缓冲液(Invitrogen)进行电泳。电泳后在考马斯SDSPAGER-250染料中将凝胶搅拌染色30分钟,然后脱色至少1小时。该成熟肽预测分子量为51.5kDa。在还原条件下,融合蛋白在期望的分子量迁移。在非还原条件下,分子在约150kDa处迁移(图1B)。也进行相关实验以确定,亲本抗体对CD37细胞表面受体的结合特异性在TRU-016中予以保持。将人PBMCs在LSM密度梯度上分离,并与未缀合的TRU-016和PE-缀合的抗人CD19温育。洗涤细胞,且将细胞与1∶100FITCGAHIgG(Fc特异性)在冰上温育45分钟。洗涤细胞,且在FACsCalibur仪器上使用CellQuest软件,通过双色流式细胞术进行分析。通过CD19染色门控确定(gate))细胞为B淋巴细胞还是非-B淋巴细胞。随着TRU-016浓度增加,B淋巴细胞(CD19阳性门控)FITC信号从0.01-1.0μg/ml迅速增加,直至达到约1μg/mL饱和或1000平均荧光强度(MFI)。与此相对照,也可检测到非-B淋巴细胞群体的染色,但非常低,且随着scFvIg浓度增加缓慢增加。因此,G28-1鼠单克隆抗体染色模式在TRU-016中予以保持(图1C)。本发明CD37-结合分子描述了结构(抗体来源的结合域,铰链变体,相同或不同CH2CH3区,以及各种同种型)。实施例2TRU-016与各种CD37-特异性抗体结合相同或重叠CD37表位进行实验,以鉴定TRU-016和其它先前记载的CD37-特异性抗体结合的CD37表位。非缀合的MB371(#555457)和FITC-缀合的MB371(#555456)从BDPharmingen(SanJose,CA)获得,FITC-缀合的BL14(#0457)从Immunotech/BeckmanCoulter(Fullerton,CA)获得,FITC-缀合的NMN46(#RDI-CBL136FT)和非缀合的NMN46(#RDI-CBL136)从RDI(Flanders,NJ)获得,FITC-缀合的IPO24(#186-040)和非缀合的IPO-24(#186-020)从AncellCorporation(Bayport,MN)获得,FITC-缀合的HHI(#3081)和非缀合的HH1(#3080)从DiaTec.Com(Oslo,挪威)获得,以及FITC-缀合的WR17(YSRTMCA483F)和非缀合的WR17(YSRTMCA483S)从AccurateChemical&Scientific(Westbury,NY)获得。TRU-016蛋白以实施例1所述制备。按制造商说明书如下所述在Trubion用MolecularProbesFluororeporterFITC标记试剂盒(F6434)将TRU-016与FITC缀合:用PBS将13.5mg/mLTRU-016目标蛋白峰(POI)调整至5mg/mL。将1mg(200ul)加至带搅拌棒的试剂盒管中,然后加入1MNaHCO3(用6NNaOH调整至pH8.5)至0.1M终浓度。将50μlDMSO加至370μgFITC中,并以FITC:蛋白摩尔比15、20、30和40将其加至管,其中使用下列公式确定所加FITCμl数:[所加FITC溶液μl数=5mg/mL蛋白x0.2mLx389x100x所需摩尔比/TRU-016分子量(110,000)]。反应在室温下避光且连续搅拌75分钟。将反应物加至试剂盒所记载的制备的旋转柱,且于1100g旋转5分钟,以备缓冲液更换为具有叠氮化物的PBS、并除去未缀合的FITC。280nM和494nMOD用2μl滴,在Nanodrop上确定;对于该仪器通过读取初始未缀合的SMIP的稀度,实验测定TRU-016消光系数,各缀合物浓度为4.25mg/ml,并且下列FITC:蛋白比被确定:2.7FITC/TRU-016比率为15;3.7FITC/TRU-016比率为20;4.4FITC/TRU-016比率为30;以及5.1FITC/TRU-016比率为40。加入BSA至3mg/ml,以帮助稳定蛋白。各级分的结合,在Ramos上以100-24,300x范围稀度评估,且在人PBMC上以3200-25,600范围稀度评估。除MR30比以外,其它所有结合都选择用于进一步使用,因为这些结合具有在所用滴定范围以上,良好维持的高MFI,从而表明结合抗体亲抗原性(avidity)在该反应中受影响最小。在最初结合研究中,将FITC标记的抗体缀合物从10ng/mL至10μg/mL滴定,以确定用于阻断研究的最佳量。所选水平刚好在饱和量以下,并且在后续测定中保持恒定,同时阻断抗体的水平增加超过10倍范围。数据以最大结合百分比对阻断抗体浓度绘出,由此,更高水平显示更低效阻断,而更低水平显示更高效阻断活性。所有实验的抗体均显示在没有未标记的试剂情况下的最大结合的阻断活性(图2)。然后,将BJAB-细胞,一种成B类淋巴母细胞B-细胞系(courtesyofEdClark,UniversityofWashington),用一组各种克隆的抗-CD37MAbs,包括MB371、BL14、NMN46、IPO24、HH1、WR17和TRU-016SMIP,进行染色。为进行竞争结合测定,在存在指定浓度(2.5、1.25、0.6或0.3μg/ml)未缀合的抗-CD37MAb或染色介质情况下,在含1.25μg/mLFITC-缀合的抗-CD37MAbs的染色介质(含2%小鼠血清的PBS)中,将2.5X105BJAB细胞于96-孔V-底板中在黑暗中于冰上温育45分钟。阻断抗体与FITC标记的抗体缀合物于细胞加入之前加至反应物。将细胞接着用PBS洗涤2.5次,然后用1%多聚甲醛(#19943,USB,Cleveland,Ohio)固定。用FACsCalibur仪器和CellQuest软件(BDBiosciences,SanJose,CA),通过流式细胞术对细胞进行分析。为进行FACs交叉阻断测定,在存在5μg/mL染色介质的未缀合的抗-CD37MAb的情况下,在染色介质(含2%小鼠血清的PBS)中将2.5X105BJAB细胞于96-孔V-底板中,在黑暗中于室温温育45分钟。然后,加入FITC-缀合的抗-CD37MAbs至终浓度2μg/ml,由此导致未标记的试剂被稀释至3.3μg/ml。反应物然后进一步于室温在黑暗中温育45分钟。将反应物用PBS洗涤2.5次,接着用溶于PBS中的1%多聚甲醛(#19943,USB,Cleveland,Ohio)固定。用FACsCalibur仪器使用CellQuest软件(BDBiosciences,SanJose,CA),通过流式细胞术对细胞进行分析。为进行细胞结合测定,将细胞以约4x106细胞/mL浓度悬浮于含2%FBS(#16140-071,Gibco/lnvitrogen,GrandIsland,NY)的PBS(#14040-133,Gibco/lnvitrogen,GrandIslandNY)(染色介质)中。接着,将细胞铺平板,然后将在染色介质中稀释的测试样品,以1∶1加至指定终浓度。反应物在冰上温育45分钟。将样品离心并用PBS洗涤2次。以1∶50终稀度加入FITC山羊抗人IgG(#H10501,CalTag,BurlingameCA),且在冰上温育45分钟。将样品离心,在PBS中洗涤,并在200μl溶于PBS中的1%多聚甲醛(#19943,USB,Cleveland,Ohio)中固定。用FACsCalibur仪器使用CellQuest软件(BDBiosciences,SanJose,CA),通过流式细胞术对细胞进行分析。各抗体显示出剂量依赖性结合抑制,从而表明所有测试的分子都结合相同或紧密相关表位。对各抗体观察到不同结合抑制能力。TRU-016SMIP具有最高水平的所有测试的分子的阻断活性,而HH1具有中间水平的阻断活性,以及,WR17、IPO24阻断比MB371高;但与其它两种未标记的分子相比,其阻断较不有效(图2)。除分析阻断活性外,进行测试各CD37靶向的抗体相互竞争结合CD37受体能力的类似系列实验。这些实验结果,与所有测试的分子的阻断研究所获得的结果相似,显示各CD37靶向的抗体和TRU-016具有相同或紧密重叠的表位。实施例3TRU-016不足以结合C1q并激活传统补体激活途径进行实验,以探求TRU-016二聚体峰不能介导显著水平补体依赖性B细胞靶杀伤的原因。一种可能性是,TRU-016二聚体相对于正常人IgG1抗体,显示出对补体级联系统组分结合降低。因此,进行实验以通过寻找与C1q结合的TRU-016,确定TRU-016是否激活传统补体激活途径。C1q为激活血清补体系统的C1酶复合物亚基,且其是传统补体激活途径的识别组分。按先前文献记载(Cragg等,Blood2004,103:2738-2743)进行C1q结合研究。简而言之,将在不含血清的Iscoves培养基(#12440-053,Gibco/lnvitrogen,GrandIsland,NY)中的RamosB-细胞,以100μl5X105/孔铺平板于96-孔V底板中。将细胞与试剂于37℃温育15分钟,然后向各孔加入50μl体积的在Iscoves中稀释的正常人血清(NHS,#A113,QuidelCorp.,SanDiego,CA),至人血清终浓度10、5、2.5或1.25%。加入50μl培养基到对照孔中。对眼镜蛇毒因子(CVF)实验而言,在加血清至补体测定之前,以20单位CVF/mL血清将CVF加入至人血清补体样品,37℃进行90分钟,且在作样品稀释时,由CVF进行血清稀释。将细胞加补体源于37℃再温育5分钟,用冷PBS(#14040-133,Gibco/lnvitrogen,GrandIsland,NY)通过离心洗涤2次,再重悬于100μlPBS中。将各孔50μl转移至第二板,以备第二步对照染色。用FITC羊抗-HUC1q(#C7850-06A,USBiological,Swampscott,Mass)或FITC羊IgG(#11904-56P,USBiological,Swampscott,Mass),将两板在黑暗中于冰上染色15分钟。洗涤样品,重悬于冷PBS中,在FACsCalibur流式细胞仪上立即读数,并用CellQuest软件分析(BectonDickinson,SanJose,CA)。FITCC1q不良好结合任何SEC纯化的TRU-016亚级分,尽管更高分子量(HMW)或A2凝集级分,显示出比其它形式更好的结合(图3A)。与此相对照,Rituxan显示出显著水平的C1q结合,特别是在低水平NHS情况下。CVF存在并不能完全阻断该结合,尽管与单独培养基相比,其MFI水平显著降低。然后,在存在或不存在CVF和人血清补体情况下,进行CDC测定,以比较TRU-016纯化形式的不同级分与Rituxan介导细胞杀伤的能力(图3B)。用碘化丙锭染色进行CDC测定,以区分靶细胞与抗体、融合蛋白、腹水、TRU-016各分子形式或培养基,以及补体源例如人血清温育后的活细胞和死细胞。简而言之,在加补体前,将3x105RamosB-细胞与测试试剂于37℃预温育30-45分钟。将预结合的样品离心,洗涤,以指定浓度重悬于具有人血清的Iscoves(#A113,Quidel,SanDiego,CA)中,然后于37℃温育90分钟。洗涤样品,且在PBS中加碘化丙锭(#P-16063,MolecularProbes,Eugene,OR)至终浓度0.5μg/mL。将细胞与碘化丙锭在黑暗中于室温温育15分钟,然后在FACsCalibur仪器上用CellQuest软件(BectonDickinson),通过流式细胞术进行分析。TRU-016的A2级分和Rituxan两者介导的细胞杀伤,在CVF存在情况下显著减少,尽管CVF不能完全阻断C1q结合(图3B)。然后,在TRU-016存在情况下,对人和兔补体的CDC活性进行比较。测量与RamosB细胞和人或兔补体温育的TRU-016分子形式的CDC活性(图3C)。将RamosB细胞加至无血清培养基的孔。接着,将Rituxan,或TRU-016的二聚体,HMWA2或pA级分,加至细胞至终浓度10μg/ml,于37℃温育15分钟,之后在无血清培养基中洗涤1.5X,接着加入10、5或2.5%正常人血清(NHS)或兔补体(Pelfreez)。于37℃温育细胞加补体源90分钟。将细胞用冷PBS洗涤1次,且在冷PBS中加入碘化丙锭(MolecularProbes#P3566)至0.5μg/mL终浓度。在黑暗中于RT温育细胞和PI15分钟,并用流式细胞术进行分析。补体级分来源影响所获CDC结果(图3C)。在TRU-016分子形式存在情况下,与人补体相比,兔补体介导更高水平CDC。有趣的是,TRU-016的二聚体形式,用兔补体介导良好CDC,而在人补体存在情况下,CDC活性极低。实施例4TRU-016多聚体的活性和结合进行实验,以检查溶液中TRU-016多聚体形式(TRU-016多聚体)的生物活性。首先,为确定溶液中TRU-016融合蛋白大小,将A蛋白纯化的材料用SECHPLC分析,且揭示TRU-016在溶液中以多聚体形式存在(图4)。HPLC大小排阻层析(SEC)轨迹,获自TRU-016的GPC纯化,该轨迹绘制了收集的不同级分的吸光度对停留时间(图4)。TRU-016通过使用A蛋白琼脂糖的亲和层析,最初纯化自细胞培养物上清液。用100mM甘氨酸,pH3.5将重组分子从柱洗脱。回收10mL级分的洗脱的产品,然后,将洗脱的产品用20%洗脱体积的0.5M2-(N-吗啉代)乙磺酸(MES)pH6.0,调整至pH5.0。将洗脱物通过样品浓缩至约25mg/mLTRU-016,然后在用于GPC纯化的制备中过滤灭菌,而制备用于GPC纯化。用GEhealthcareXK柱和制备级Superdex200(GEHealthcare),在GEHealthcareAKTAExplorer100Air装置上进行大小排阻层析。HMW或A2库显示停留时间为大约6.23分钟,而最主要形式则显示停留时间为8.38分钟。本文所用参照标准(pA标准或std),为含二聚体和HMW多聚物形式两者的A蛋白纯化的材料,如图4第1幅图所示。在停留时间8.38分钟迁移的最主要形式,很可能对应于非还原SDS-PAGE所观察到的二聚体分子,而几种次要形式很可能对应于通过非共价相互作用结合的多聚体,因为它们在非还原SDS-PAGE下不太明显。为分离这些不同形式的TRU-016,将A蛋白琼脂糖亲和层析培养物上清液所获材料,进一步用GPC和HPLC分级分离进行纯化,以从更高分子量多聚体(称为HMW或A2agg级分)分离二聚体形式(称为“二聚体”或“二聚体峰”)。然后,用结合、ADCC和CDC测定,对这三种亚级分的每种,分别进行体外功能活性分析。为探求从SEC分离的级分是否显示出不同结合特性,对TRU016SEC各级分进行Ranos细胞结合测试。为确定SEC级分的结合特性,将细胞以约4x106细胞/mL浓度悬浮于染色介质,然后以染色介质中50μl/孔(2x105细胞/孔)铺平板。接着,将SEC级分的系列稀释物加至顺序的孔,温育45分钟,洗涤,并用FITC山羊抗人IgG检测结合活性。在200μl溶于PBS中的1%多聚甲醛固定样品。将细胞在FACsCalibur仪器上用CellQuest软件(BDBiosciences,SanJose,CA),通过流式细胞术进行分析(Figure5A)。为确定SEC级分的CDC活性,将细胞以5x105细胞/孔悬浮于75μlIMDM中。将TRU016SEC级分(75μl),以两倍指示浓度加至细胞。允许结合反应进行45分钟,之后离心,且在无血清Iscoves中洗涤。将细胞以指示浓度重悬于含人血清的Iscoves(#A113,Quidel,SanDiego,CA)中。将细胞于37℃温育60分钟,洗涤,并重悬于含0.5μg/mL碘化丙锭(PI,#P-16063,MolecularProbes,EugeneOR)的染色介质。将样品于室温在黑暗中温育15分钟,之后用FACsCalibur和CellQuest软件(BectonDickinson),通过流式细胞术进行分析(图5B)。为确定SEC级分的ADCC活性,将BJAB、Ramos和Daudi类淋巴母细胞B细胞(107)在IMDM/10%FBS中,用500μCi/mL51Cr铬酸钠于37℃标记2小时。PBMCs通过在淋巴细胞分离介质(LSM,ICNBiomedical)梯度上分级分离从肝素化人全血分离。将试剂样品加至含10%FBS的RPMI培养基,且制备各试剂的五种系列稀释物。对于组合,可将试剂预混合并稀释后再加至孔。以(2x104细胞/孔)加入51Cr标记的BJAB。然后,以(5x105细胞/孔)加入PBMCs,直至终比率为25∶1效应物(PBMC):靶(BJAB)。在96孔板的一式四份的孔中建立反应。将TRU-016SEC级分以10ng/mL-20μg/mL终浓度范围加至孔,如图所示。每数据系列绘制了,所述滴定范围的不同SEC级分。允许反应在37℃5%CO2下进行6小时,之后收获并计数。用PackardTopCounNXT从50μl干燥培养物上清液,测量释放的CPM。百分比特异性杀伤以减法计算:(样品[一式四份样品平均值]cpm-自发释放cpm)/(最大释放cpm-自发释放cpm)x100(图5C)。图5A显示了不同SEC级分结合Ramos细胞的滴定曲线。除最高测试浓度以外,所有分级分离的分子都以相似结合曲线结合CD37,其中HMW材料与pA标准和二聚体峰形式相比,显示出更好结合(更高荧光强度)。也进行实验,以确定TRU016SEC级分是否显示出不同水平功能活性,例如CDC和ADCC介导的靶细胞杀伤。图5B所示图表显示,仅纯化的HMW多聚体级分使用人补体介导抗RamosB细胞的显著水平的CDC活性。pA标准在更高浓度下,显示出某些CDC活性,而二聚体峰形式在所有测试浓度,显示非常小或根本不显示CDC活性。用标记的BJABB细胞作为靶,以及用人PBMC作为效应细胞,对各种TRU-016大小级分,进行ADCC测定。将TRU016SEC级分以10ng/mL-20μg/ml终浓度范围加至各孔,如图5C图表所示。各数据系列绘制了,所述滴定范围的不同SEC级分。数据以%特异性杀伤对蛋白浓度绘制。所有SEC亚级分,包括pA标准、HMW或A2级分、以及二聚体峰,都介导针对BJAB靶细胞的有效、剂量依赖性ADCC。相似的结果,用Ramos细胞作为标记的靶也可获得(数据未显示)。实施例5CD20-特异性结合分子的制备CD20-特异性SMIPs记载在共有的美国专利公开2003/133939、2003/0118592和2005/0136049中。示例性的CD20-特异性SMIP,TRU-015的生产如下。TRU-015为结合CD20抗原的重组(鼠/人)单链蛋白。结合结构域基于公众可获得的人CD20抗体序列。将结合结构域通过修饰的CSS铰链区,与效应结构域——人IgG1的CH2和CH3结构域相连。TRU-015在溶液中以二聚体存在,且该二聚体理论分子量约为106,000道尔顿。编码TRU-015的核苷酸序列和TRU-015氨基酸序列,分别如SEQIDNOs:3和4所示。就SEQIDNO:4所示氨基酸序列而言,TRU-015包括2e12前导肽氨基酸1-23克隆序列;可变区有第11位残基赖氨酸至丝氨酸(VHL11S)氨基酸取代的2H7鼠抗-人CD20轻链可变区,该取代反映在第34位;起始于第129位残基的asp-gly3-ser-(gly4ser)2接头,所述接头末端含有额外的丝氨酸以整合用于盒改组的Sacl限制位点;重链区末端缺乏丝氨酸残基的2H7鼠抗-人CD20重链可变区,即从VTVSS变成VTVS;包括含(CSS)序列的修饰铰链区和野生型CH2和CH3结构域的人IgG1Fc结构域。将生产TRU-015的CHO细胞,用专有的培养基培养于生物反应器。用一系列层析和过滤步骤,包括病毒减少过滤器,对TRU-015进行纯化。然后,将材料浓缩,用20mM磷酸钠和240mM蔗糖配制,所得pH为6.0。将组合物过滤后,以10mg/mL浓度装满至玻璃小瓶中。每玻璃小瓶含5mLTRU-015(50mg/小瓶)。实施例6TRU-016与TRU-015或Rituxan组合协同增强B细胞的细胞凋亡进行实验,所述实验检查B细胞靶向的SMIPS对B细胞系的细胞凋亡的作用。各SMIP单独测试,再组合测试。在温育反应开始后24和48小时,分析样品。膜联蛋白/PI分析进行如下:在含10%FBS的Iscoves(Gibco)完全培养基中,以3X105细胞/mL和20μg/mLSMIP蛋白,将BJAB(courtesyofEdClark,UniversityofWashington)、Ramos(ATCC#CRL-1596)和Daudi细胞在37℃5%CO2下,温育24或48小时。另外,加入20μg/mL山羊抗人IgG至反应物,以交联细胞表面上的试剂。用BDPharmigen细胞凋亡检测试剂盒I(#556547),用膜联蛋白V-FITC和碘化丙锭将细胞染色并按试剂盒说明书进行加工。简而言之,将细胞用冷PBS洗涤两次,并以1X106细胞/mL重悬于“结合缓冲液”中。然后,将100μl溶于结合缓冲液中的细胞,用5μl膜联蛋白V-FITC和5μl碘化丙锭染色。轻微涡旋细胞,且在室温在黑暗中温育15分钟。然后,将400μl结合缓冲液加入至各样品。随后在FACsCalibur(BectonDickinson)仪器上用CellQuest软件(BectonDickinson)读取并分析它们。下表2显示,在存在交联情况下用TRU-016处理,与单独TRU-015相比,具有更显著的对细胞系细胞凋亡的作用,尽管单独使用时两分子都诱导某些细胞凋亡。该增强随细胞系而变化。表2Bjab膜联蛋白V阳性无SMIP17.5CD20SMIP27CD37SMIP30.6CD19SMIP29.1CD20+CD37SMIP41CD20+CD19SMIP37.1CD37+CD19SMIP35.3+GAMRamos膜联蛋白V阳性膜联蛋白V阳性仅细胞33.3CD20MAb1.43.1CD37Mab18.38.7CD19MAb3.73.1CD40MAb3.98.3CD20+CD3732.335.7CD20+CD19510.5CD20+CD405.719.4CD19+CD3726.950CD19+CD408.218.4实施例7TRU-016与CD20-特异性抗体或SMIPs的组合协同增强CDC进行实验,以确定TRU-016与CD20-特异性抗体或SMIPs的组合针对B细胞的CDC活性。组合实验所选试剂量为0.5μg/mlTRU-016,同时TRU-015也为0.5μg/ml。Rituxan浓度通常为0.04-0.06μg/mL,因为其在单试剂CDC实验中具有较高活性。在某些实验中,将CD20试剂浓度,以次最佳浓度保持恒定,而将TRU-016浓度进行变化,以探求观察到对CDC增强作用所需的CD37指向的试剂的最低水平。将细胞以75μl,5x10E5细胞/孔悬浮于Iscoves(#12440-053,Gibco/lnvitrogen,GrandIsland,NY)中。将TRU-016(75μl)、TRU-015、rituxan或这些试剂的组合,以两倍指定浓度加入至细胞。允许结合反应进行45分钟,之后离心并在无血清Iscoves中洗涤。将细胞以指定浓度重悬于含人血清的Iscoves(#A113,Quidel,SanDiego,CA)中。于37℃温育细胞60分钟。将细胞通过离心洗涤,并重悬于含2%FBS的125μlPBS(#16140-071,Gibco,Invitrogen,GrandIsland,NY)染色介质中。将细胞转移至FACS成串管(clustertube)中(#4410,CoStar,Corning,NY),且将含5μl碘化丙锭PI,#P-16063,MolecularProbes,EugeneOR)的125μl染色介质加入。样品于室温在黑暗中温育15分钟,之后用FACsCalibur和CellQuest软件(BectonDickinson),通过流式细胞术进行分析。图6显示,以单试剂杀伤次最佳浓度,TRU-015和Rituxan,与TRU-016组合,显示出高水平CDC活性。单独TRU-016不能介导CDC,除非存在聚集体。从反应物耗尽C1q,导致所观察所有CDC活性消除。图7显示了在DHL-4B细胞上进行的组合实验。将TRU-016加至CDC反应物,使TRU-015杀伤曲线下移,从而表明在各测试浓度下杀伤更有效,尽管TRU-016单独显示少的或根本没有活性。图8显示了样品试剂以下述比率混合的另一CDC实验:0.5μ/mLTRU-015、0.5μg/mLTRU-016和0.06μg/mLrituxan。同样,单试剂以次最佳浓度使用,以观察TRU-016存在情况下的增强作用。对TRU-015和rituxan两者而言,TRU-016加入到测定时,增强CDC杀伤水平。图9和10显示了CDC测定数据的图示,其中TRU-015或rituxan浓度保持恒定,而TRU-016浓度增加。同样,当TRU-016加至反应物时,CDC活性更大,但TRU-016从0.5μg/mL至2.5μg/mL浓度增加,并不显著增加这些实验中的CDC-介导的杀伤。实施例8TRU-016增强CD20-特异性抗体和SMIPs的ADCC和CDC活性进行实验,以确定TRU-016SMIP与CD20-特异性抗体或SMIPs组合,是否能增强针对B细胞靶的ADCC和CDC活性。将BJAB、Ramos和Daudi类淋巴母细胞B细胞(10E7)在IMDM/10%FBS中,用500μCi/mL51Cr铬酸钠于37℃标记2小时。在RPMI/10%FBS中洗涤标记的BJAB细胞三次,并以4x10E5细胞/mL重悬于RPMI中。从匿名内部供体,获取肝素化人全血,并通过在淋巴细胞分离介质(LSM,ICNBiomedical)梯度上分级分离来分离PBMC。收获血沉棕黄层,在RPMI/10%FBS中洗涤两次,之后,以3x10E6细胞/mL终浓度重悬于RPMI/10%FBS。使用血细胞计数器通过锥虫蓝排除对细胞计数,然后用于后续测定。将试剂样品以4倍终浓度加至含10%FBS的RPMI培养基,并制备各试剂的五个系列稀释物。对于组合,将试剂预混合且稀释,之后添加至孔。然后,将这些试剂以50μl/孔指定终浓度,加至96孔U底板。将51Cr标记的BJAB,以50μl/孔(2x10E4细胞/孔)加至板中。然后,将PBMCs以100μ/孔(3x10E5细胞/孔)加至板,终比率为15∶1效应物(PBMC):靶(BJAB)。将效应物与靶加至单独培养基,以测量背景杀伤。将51Cr标记的BJAB加至单独培养基,以测量51Cr自发释放,且加至含5%NP40(#28324,Pierce,Rockford,IL)的培养基,以测量51Cr最大释放。反应在96-孔板的一式四份孔中建立。将SMIPs以12ng/mL-10μg/mL范围终浓度加至孔,如图所示。对SMIP组合,将试剂在加至各孔前混合。每数据系列绘制了,所述滴定范围的不同单个SMIP或组合。允许反应在37℃5%CO2下进行6小时,之后收获并计数。然后将各孔50μl上清液转移至Luma96板(#6006633,PerkinElmer,Boston,Mass)且,室温过夜干燥。所释放的CPM在PackardTopCounNXT上测量。百分比特异性杀伤以减法计算:(样品{一式四份样品平均值}cpm-自发释放cpm)/(最大释放cpm-自发释放cpm)x100。数据以%特异性杀伤对SMIP浓度绘图。各图示出了效应物/靶比,也示出了靶细胞系。图11、12、13显示了使用相同供体,在不同细胞系(BJAB、Daudi和Ramos)上的实验数据。图14和15(rituxan+TRU-016)以及图16和17(TRU-015+TRU-016)数据显示,所用靶细胞系为BJAB的实验。各组合观察到的特异性杀伤大于相同浓度下各单独单个试剂,从而表明CD20与CD37靶向的SMIPs增强相互介导的杀伤,尽管增强作用并非完全加性的。因此,TRU-016能增强CD20-特异性SMIP或CD20-特异性抗体的ADCC介导的B细胞杀伤。设计探求TRU-016与CD20-指向的抗体组合作用的初步实验,以确定可检测到CDC协同作用的各试剂所用相对量。将Ramos细胞悬浮于IMDM,且将TRU-016、Rituxan或这些试剂的组合,加入细胞至图18所示终浓度。允许结合反应进行45分钟,之后在无血清Iscoves中离心和洗涤。将细胞重悬于含10%NHS的Iscoves中。然后,将细胞于37℃温育60分钟。在图18A-C所示实验中,将细胞通过离心洗涤,并重悬于含0.5μg/mL碘化丙锭(PI,#P-16063,MolecularProbes,EugeneOR)的染色介质中。将样品在室温在黑暗中温育15分钟,之后用FACsCalibur和CellQuest软件(BectonDickinson),通过流式细胞术进行分析。更高纯化的TRU-016二聚体峰,单独使用时是CDC的差的介质,如图18A甚至在高浓度情况下的平直剂量反应曲线所示的。由于CD20指向的试剂为CDC活性的有效诱导物,所以在组合实验中,需要非饱和量的CD20指向的试剂,由此这些试剂之间的协同作用可被检测。根据这些初步研究,组合实验所选试剂通常量为,0.5μg/mL或2μg/mLTRU-016。Rituxan浓度通常为0.04-0.06μg/mL,这是由于其在单试剂CDC实验中较高的活性。在某些实验中,CD20试剂浓度以次最佳浓度保持恒定,而TRU016浓度进行变化,以探求观察到对CDC的增加作用所需的CD37指向的试剂的最低水平。综上,单独TRU-016不能介导CDC,除非存在聚集体。图18B显示了Rituxan单独使用或与2.5μg/mlTRU-016组合使用时,在所示滴定范围(0.06-0.5μg/ml)内观察到的活细胞(PI阴性)百分比图。以作为单试剂杀伤的次最佳剂量范围使用的Rituxan,与TRU-016组合时,在各浓度都显示出较高水平的CDC活性(图18B)。从反应物耗尽C1q,导致所有观察到的CDC活性的消除(图3B)。在图18C中,将样品也与FITC抗-C1q在冰上温育45分钟,之后用流式细胞术分析。在受损细胞上进行淋巴细胞门控。该门的细胞百分比随Rituxan浓度增加而增加,且绘制了该细胞群的相对MFI图。图18C显示了样品试剂以TRU-0160.5μg/mL与Rituxan0.06μg/mL-0.5μg/mL比率混合,并且细胞在使用流式细胞术之前用PI染色的CDC实验结果。结果显示,MFI随Rituxan剂量增加而剂量依赖性增加。在各浓度Rituxan下,TRU-016二聚体形式的加入导致MFI额外增加。在保持Rituxan浓度恒定、且增加TRU-016浓度情况下,进行类似系列CDC测定。此外,当TRU-016加至Rituxan反应物时,CDC活性更大,但TRU-016浓度从0.5μg/mL-2.5μg/mL增加并不显著增加在这些实验中的CDC介导的杀伤(数据未显示)。用与CDC测定所用相似的浓度范围,体外比较了Rituxan和TRU-016蛋白单独使用以及相互组合的ADCC活性。图18D显示了用TRU-016或Rituxan单独和相互组合,在指定浓度范围内、在标记的Ramos细胞靶与人PBMC效应细胞以效应物:靶比为25∶1情况下的ADCC测定结果。以效应物∶靶比为12.5∶1,获得类似数据。TRU-016二聚体形式和Rituxan都介导显著水平的,针对表达CD20和CD37靶抗原的Ramos细胞的ADCC;然而,两试剂组合并不导致杀伤水平显著增加。实施例9TRU-016诱导B细胞的细胞凋亡进行实验,所述实验检查TRU-016对B细胞系的细胞凋亡的作用。用仍含高级聚集体的A蛋白纯化的材料,进行靶向不同B细胞受体的TRU-016分子对细胞凋亡的作用的初步测定。用膜联蛋白V阳性细胞百分比作为细胞凋亡活性的量度并用Ramos和BJAB细胞作为结合靶,在CD37抗体或工程改造的TRU-016分子处理24小时后,在多重实验中,观察到类似细胞凋亡增加的模式(数据未示出)。图19A显示B细胞系与非分级分离的TRU-016温育后,细胞凋亡显著增加。图19A显示了Ramos细胞与TRU-016(10μg/mL)温育24小时后的膜联蛋白V-PI染色的点图。膜联蛋白V-PI双阳性细胞%,从总群体的11.3%增加至32.8%,且膜联蛋白V阳性-PI阴性细胞%,从8.5%增加至19.7%,从而表明接触TRU-016后诱导了细胞凋亡。在这些测定中,无论是Ramos还是BJAB细胞用作结合靶,都获得了相似数据。用更高度纯化的TRU-016二聚体形式进行进一步实验,所述实验检查TRU-016对B细胞系的细胞凋亡的作用(图19B)。在温育反应开始后第24和第48小时分析样品。用20μg/mLTRU-016蛋白,在几个细胞类型上进行膜联蛋白/PI分析。由于用TRU-016二聚体形式减少细胞凋亡,所以将20μg/mL山羊抗人IgG加至反应物,以交联细胞表面上的试剂。将细胞然后用膜联蛋白V-FITC和碘化丙锭染色。图19B所示数据显示,TRU-016二聚体峰在24-48小时后诱导了Daudi细胞的细胞凋亡,但交联试剂,例如抗人IgG的存在,导致显著增加CD37靶向的细胞凋亡水平。也用人PBMCs进行实验,以确定TRU-016对培养中的正常人B细胞的作用。图20A和20B用下列柱形图显示了一种所述实验的结果:用单独介质,TRU-016,或Rituxan处理48-72小时,在PBMC培养物中存在的CD19或CD40阳性淋巴细胞(B细胞)的百分比。人PBMCs通过LSM密度离心,从全血分离。将细胞与1μg/mLRituxan或TRU-016温育48或72小时。在实验开始后48小时并再次在72小时,收获部分温育反应物。洗涤PBMCs,且与FITC抗-CD19、FITC抗-CD40或FITC抗-CD3在冰上温育45分钟。然后,将用这些试剂染色的总淋巴细胞的百分比制成表格,且与用相似条件温育但不加测试试剂、并以与处理的样品同样染色的PBMC样品进行比较。图20A和B显示了用指定试剂48和72小时后,给出阳性FACs信号的总淋巴细胞群体级分(%)的柱形图。图20C显示了类似实验的复合图,显示PBMCs与TRU-016(1μg/ml)温育24和72小时后,表达指定CD抗原的淋巴细胞(即CD19、CD40或CD3阳性)相对于原始数目的百分比减少。在存在交联情况下,用TRU-016二聚体形式或Rituxan处理,导致如CD19和CD40阳性染色测量的、在PBMC培养物中的B淋巴细胞百分比减少。尽管培养物中B淋巴细胞百分比在实验开始时低,但与Rituxan或TRU-016共培养降低PBMC培养物中CD19和CD40阳性淋巴细胞数目,48小时后降低到约2/3-1/2,且72小时后降低到低于1/3。48-72小时后B细胞耗尽的该总体模式,在所有测试的正常PBMC培养物中都可再现,而无论这些培养物中B淋巴细胞初始百分比如何,该百分比依赖于样品为总淋巴细胞的约3%-多达7%。图20C显示了在与TRU-016温育24-72小时的短期PBMC培养物中,B淋巴细胞与T淋巴细胞相比较的耗尽百分比柱形图。这些数据表明,TRU-016能从正常外周血培养物中特异性耗尽CD37阳性B淋巴细胞,而TRU-016低水平结合非-B淋巴细胞(图1C)不足以介导从细胞群体显著耗尽这些淋巴细胞。实施例10TRU-016与利妥希玛组合协同减小鼠肿瘤异种移植模型的肿瘤体积用裸鼠(Harlan)和Ramos或Daudi人肿瘤系,进行小鼠肿瘤异种移植研究,所述研究探求组合治疗。将Ramos或Daudi肿瘤细胞在IMDM/10%FBST150瓶中生长,直至它们达到80%汇合。将五百万(5x106)细胞用作每只小鼠的肿瘤接种物。将细胞用PBS以总体积0.1mL或5.0×107/mL,皮下注射于右胁腹。允许裸鼠发展肿瘤,并基于肿瘤大小/体积进行分组。对各治疗组而言,使用平均肿瘤体积约为222mm3(范围=152-296mm3)的12只小鼠。也使用一些237-251mm3的平均肿瘤体积。在0、2、4、6和8天,以单试剂用下列试剂之一静脉内(IV)注射动物:TRU-016GPCPOI(目标峰),200μg/小鼠;rituxan,200μg/小鼠;或人IgG(对照),200或400μg/小鼠;或者,以下列试剂组合:Rituxan+TRU-016,各100μg/小鼠;或Rituxan+TRU-016,各200μg/小鼠。肿瘤体积每天用卡尺测量,直至实验完成(死亡或消退)。对各动物绘制肿瘤体积-治疗时间函数图,且结果也进行每组内平均。也用较小肿瘤进行类似研究,其中小鼠分组到具有范围在153-158mm3的较小平均肿瘤体积组,以及用较大肿瘤进行类似研究,但用Daudi细胞而不是用Ramos细胞。根据公共机构动物护理和使用委员会(InstitutionalAnimalCareandUseCommittee)(IACUC)指南,用AAALAC授权的动物设施和动物使用程序,进行这些研究。图21显示了TRU-016与huIgG、rituxan以及与各100μg和200μg的组合的比较的功效,其在12只动物的每组进行平均。IV注射治疗后,绘制肿瘤体积-时间函数图。TRU-016治疗后平均肿瘤体积,小于阴性对照(huIgG)所观察到的平均肿瘤体积。当绘制%存活或%无肿瘤动物的图时,更高剂量组合治疗在该体内肿瘤模型中,显示出更高抗肿瘤活性。然而,在较低剂量(各100μg),组合治疗不如更高剂量各单试剂那样有效。这些数据显示,TRU-016治疗以合适剂量与Rituxan组合使用时,比Rituxan单独治疗在治疗患者肿瘤中,功效更高。实施例11TRU-016减少肿瘤体积并增加鼠肿瘤异种移植模型存活用裸鼠(Harlan)和Ramos或Daudi人肿瘤系,进行小鼠肿瘤异种移植研究。用TRU-016或其它测试试剂,基于治疗时肿瘤类型和肿瘤大小,进行三种不同研究。培养Ramos或Daudi肿瘤细胞,且将(5x106)细胞右胁腹皮下注射以用肿瘤接种每只治疗的小鼠。允许裸鼠发展肿瘤,且基于肿瘤大小/体积分组。在初始研究中,对各治疗组,使用平均肿瘤体积155-237mm3的12只小鼠。将动物在0、2、4、6和8天静脉内(IV)注射下列一种试剂:利妥希玛,200μg/小鼠;TRU-016GPC二聚体峰,200μg/小鼠;或人IgG(对照),400μg/小鼠。肿瘤体积用卡尺每天测量,直至实验完成(死亡或消退)。对各动物绘制肿瘤体积-治疗时间函数图,且结果也进行各组内平均。图22A显示了组平均值,而图22B则显示了各组小鼠百分比存活数据-时间函数之间的比较。图22A显示了在Ramos肿瘤模型中,TRU-016与huIgG和Rituxan比较的功效,其在12小鼠的每组进行平均。IV注射治疗后,绘制肿瘤体积-时间函数图。TRU-016治疗后平均肿瘤体积,小于用阴性对照(huIgG)所观察到的平均肿瘤体积。图22B显示了huIgG、Rituxan和TRU-016相比较、不同治疗组之间的存活曲线图。用基线肿瘤体积增大的更严格Ramos肿瘤模型,TRU-016施用相对于人IgG,导致肿瘤生长抑制(数据未示出)。将TRU-016施用于Ramos肿瘤较小的小鼠,导致肿瘤生长抑制并增加存活时间中值。实施例12TRU-016不影响其它B细胞表面受体的CDC活性为确定TRU-016分子是否增加利用针对除CD20之外的其它B细胞表面受体,例如MHCII、CD19、CD80/86和CD40,的抗体治疗产生的CDC活性水平,进行与方才记载的关于CD20-CD37指向的组合的那些类似的系列实验。将Ramos细胞加至含10%FBS的Iscoves完全培养基孔。将MAbs(试剂B:HD37-抗CD19,试剂C:9.4-抗-CD45),融合蛋白(试剂D:CTLA-4muIg-IgG2a,Ancell#501-820),和腹水(试剂A:HB10a-抗-MHCII),以指定稀度加入(参见图23),且在含或不含所加利妥希玛(0.05μg/ml)或TRU-016(2μg/ml)情况下,建立一式两份反应。反应物在37℃下温育30分钟。洗涤细胞,且加入NHS至无血清培养基中10%的终浓度。将细胞与补体源于37℃温育90分钟。洗涤细胞;在PBS中加入碘化丙锭至终浓度0.5μg/mL;于室温在黑暗中温育细胞15分钟;然后将细胞通过流式细胞术分析。图23的A-D各图绘制了%PI阳性细胞-指定滴定范围图。总体来说,当指向这些受体的抗体单独或与TRU-016组合使用时,数据显示,CDC活性水平没有显著差异(图23A-D)。当与次最佳浓度TRU-016一起使用时,CD19和CD45指向的试剂,CDC水平有轻微增加。然而,CDC水平差异远不如CD20-CD37组合中观察到的那样显著。除了当CD20和CD37指向的试剂组合使用时CDC的增加以外,使用抗-类型II(HB10a)、抗-CD19、抗-CD45(9.4)或CTLA4Ig与次最佳剂量Rituxan的组合,观察到了杀伤水平似乎增加。实施例13TRU-016不增加包括MHCII、CD19、CD80/86和CD40在内的其它靶向的受体的CDC活性为确定TRU-016分子是否增加针对除CD20之外其它B细胞表面受体的抗体治疗所产生的CDC活性水平,进行与记载的关于CD20-CD37指向的组合的那些类似的系列实验(参见实施例8)。这些实验结果显示在图23中。总体来说,当针对这些受体的抗体单独使用或与TRU-016组合使用时,CDC活性水平没有显著差异。当与次最佳浓度TRU-016一起使用时,响应于CD19和CD45指向的试剂,CDC水平轻微增加。然而,CDC水平差异远不如CD20-CD37组合观察的那样显著(参见实施例8)。除了当CD20和CD37指向的试剂组合使用时CDC的增加以外,使用抗-MHCII(HB10a)、抗-CD19、抗-CD45(9.4)或CTLA4Ig与次最佳剂量Rituxan的组合,观察到了杀伤水平似乎增加。实施例14TRU-016增加鼠肿瘤异种移植模型的存活用裸鼠(Harlan)和Ramos或Daudi人肿瘤细胞系,进行实施例11记载以外的小鼠肿瘤异种移植研究,以检查TRU-016在增加长期存活中的功效。将Ramos和Daudi肿瘤细胞分别生长,且将(5x106)细胞于小鼠右胁腹皮下注射,以启动小鼠肿瘤异种移植形成。在发展肿瘤后,基于肿瘤大小/体积将小鼠分组(第0天)。在第0、2、4、6和8天,用下列试剂之一静脉内(IV)注射动物:利妥希玛,200μg/小鼠;TRU-016,200μg/小鼠;利妥希玛+TRU-016,100或200μg/小鼠;或人IgG(对照),400μg/小鼠。用卡尺每周三次盲测肿瘤体积,直至实验完成(死亡或消退)。对各动物绘制肿瘤体积-治疗时间函数图,且结果在各组内平均。图24显示了用TRU-016、利妥希玛或它们组合治疗后,Ramos肿瘤小鼠的百分比存活(至最高90天)。TRU-016+利妥希玛组合治疗,与单独单个试剂治疗相比,显著增加了存活时间中值。图25和26显示了用TRU-016或利妥希玛治疗后,Daudi肿瘤小鼠的百分比存活(至最高90天)。TRU-016治疗,在确立的Daudi肿瘤中,增加了存活时间中值(图25)。在维持Daudi肿瘤小鼠存活上,TRU-016比利妥希玛更有效(图26)。TRU-016以单试剂施用于患有确立的Ramos肿瘤的小鼠,显示出与利妥希玛作为单试剂施用相当的肿瘤生长抑制和存活时间改善,但优于HuIgG对照治疗的小鼠。从3个实验汇合的数据显示,TRU-016和利妥希玛组合治疗,与TRU-016(p=0.028)或利妥希玛(p=0.045)单一疗法相比,导致统计学显著存活时间改善。TRU-016和利妥希玛组合组,也增强了完全肿瘤消退。TRU-016+利妥希玛200μg组合组的42%能获得长期完全肿瘤消退,相比之下,TRU-016或利妥希玛单独治疗小鼠,只有20%肿瘤消退率(参见表3和图24)。表3.确立的Ramos肿瘤的治疗后存活在Daudi肿瘤异种移植模型中TRU-016治疗后,发现肿瘤生长减少和存活时间提高(参见表4,图25和26)。与对照组相比,TRU-016施用显著增加存活时间。在该模型中SMIP-016治疗,与对照和利妥希玛组相比,也观察到无肿瘤小鼠百分比增加。表4.确立的Daudi肿瘤的治疗后存活第90天无肿瘤小鼠百分比存活时间中值(天)TRU-016(100μg)2524利妥希玛(100μg)017HuIgG015在Ramos肿瘤异种移植模型中减少肿瘤体积和增加存活时间上,CD37-指向的SMIP(TRU-016)治疗,与利妥希玛单一疗法一样有效。TRU-016+利妥希玛组合治疗,与利妥希玛或TRU-016单一疗法相比,在Ramos肿瘤异种移植模型中减少肿瘤体积和显著提高存活时间上,显示出增强的益处。在Daudi异种移植模型中,TRU-016治疗的小鼠,与HuIgG对照相比,显示出统计学显著增加的存活时间中值。利妥希玛治疗,与对照鼠相比,并不延长存活时间。这些数据着重显示了在这些NHL异种移植模型中,CD37-指向的治疗的功效。实施例15在体外CLL细胞中,TRU-016增强氟达拉滨诱导的细胞死亡氟达拉滨是用于治疗血液恶性肿瘤的化疗药。氟达拉滨是通过干扰核糖核苷酸还原酶和DNA聚合酶而抑制DNA合成的嘌呤类似物。氟达拉滨对分裂细胞和静息细胞都有活性。氟达拉滨可高效用于治疗慢性淋巴细胞性白血病(CLL),其比烷化剂,例如单独苯丁酸氮芥,可产生更高应答率(Rai等,N.Engl.J.Med.343:1750-1757,2000)。氟达拉滨可用于与环磷酰胺、米托蒽醌、地塞米松和利妥希玛的各种组合,以用于治疗顽固性淋巴瘤和非何杰金淋巴瘤。然而,对氟达拉滨的抗性也已经在治疗中观察到。氟达拉滨在CLL细胞中诱导胱天蛋白酶(caspase)依赖性细胞凋亡,而TRU-016介导的细胞凋亡看来与胱天蛋白酶活化无关。本研究检查了TRU-016与氟达拉滨对CLL细胞的作用。将细胞用TRU-016以0.1-100μg/mL剂量并用氟达拉滨以0-20μM剂量,进行处理(参见图27)。TRU-016由TrubionPharmaceuticals提供(Seattle,WA)。氟达拉滨(F-araA)购自SIGMA(St.Louis,MO)。RPMI1640培养基购自Invitrogen(Carlsbad,CA)。异硫氰酸荧光素(FITC)标记的膜联蛋白V和碘化丙锭(PI)购自BDPharmingen,SanDiego,CA。溴化[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑(MTT)购自Sigma(St.Louis,MO)。B-CLL细胞用ficoll密度梯度离心(Ficoll-PaquePlus,AmershamBiosciences,Piscataway,NJ),在捐献之后立即分离。在37℃5%CO2气氛中,将分离的单核细胞温育于补加有10%热失活胎牛血清(FBS,HycloneLaboratories,Logan,UT),2mML-谷氨酰胺(Invitrogen,Carlsbad,CA),和青霉素(100U/mL)/链霉素(100μg/ml;Sigma-Aldrich,St.Louis)的RPMI1640培养基中。新鲜分离的B-CLL细胞,用于除表面染色之外的本文所有记载的实验。对于低于90%B细胞的那些样品,按照制造商建议规程用B细胞分离试剂盒II(MiltenyiBiotec,Auburn,CA)或来自StemCellTechnologies的″Rosette-Sep″试剂盒(Vancouver,BritishColumbia,加拿大),应用负选择以耗尽非-B细胞。Raji(人伯基特氏淋巴瘤细胞系)细胞系购自ATCC,并维持于补加青霉素、链霉素和谷氨酰胺的含10%FBS的RPMI1640培养基中。当细胞密度达到1x106/mL时,将细胞以1∶3分裂。培养基在每研究前夜更换,以确保使用新鲜细胞。将细胞按本文记载方法体外处理。通过转移2mL含药物培养基至含6mL空白培养基的下一个孔,在6孔板中制备1∶4系列稀释的氟达拉滨(44、11、2.8、0.7、0.17和0.04μM)。在独立6-孔板中,用相同稀释法制备,TRU-016于培养基中的1∶4系列稀释(44、11、2.8、0.7、0.17和0.04μg/ml)。从各板,转移0.45mL培养基至48-孔板指定孔,以制备培养基中混合的药物溶液(每孔总计0.9mL)。然后,将1x107细胞/mL密度的培养基中悬浮的CLL细胞(0.1mL),加至0.9mL各孔的培养基,以得到终密度1x106细胞/mL。对Raji细胞而言,细胞终密度为5x104细胞/mL。因此,所用细胞悬浮液为5x105细胞/mL。对MTT测定而言,药物系列稀释物在96-孔板中制备,并转移至其它96-孔板以与细胞温育。温育总体积为200μL(90μL氟达拉滨溶液,90μLTRU-016溶液,和20μL细胞悬浮液)。细胞生存力用MTT测定在48小时时评估;且细胞凋亡用膜联蛋白V/PI在24小时时测量。如本文所述,进行MTT测定以测量细胞生存力。简而言之,将106CLL细胞接种至96-孔板。将细胞温育48小时。将50μlMTT工作液(2mg/ml,从与RPMI1640以2∶3v/v混合的5mg/mLMTT试剂制备)加至各孔,且将细胞温育8小时。将板离心,取出上清液并溶解于100μl裂解液中。用板读数器在O.D.540处,测量样品。细胞生存力以与培养基对照相比的生存力百分比来表示。与抗体温育后的CLL细胞的细胞凋亡,用膜联蛋白V-FITC/碘化丙锭(PI)染色与FACS分析进行测量。将在200μl1x结合缓冲液(BDPharmingen)中的5x105细胞,用5μL膜联蛋白V(BDPharmingen)和5μLPI(BDPharmingen)染色,于室温在黑暗中静置15分钟,之后用300μl1x缓冲液悬浮,并用流式细胞术进行分析。制备未染色细胞,仅用膜联蛋白V染色的细胞,和仅用PI染色细胞。对所有流式细胞术实验而言,用Beckman-CoulterEPICSXL细胞计数器(Beckman-Coulter,Miami,FL)进行FACS分析。荧光团在488nm处激发。FITC-荧光用FL1测量,而PI和PE荧光用FL3测量。系统II软件包(Beckman-Coulter),用于分析数据。各样品计数的细胞数目设置为10,000。用等效剂量分析法(isobologram)确定协同作用。为鉴定协同作用,将药物组合的作用与各药物单独的作用进行比较。这基于下列等式:Ca/Ca,b+Cb/Cb,a=CI,其中Ca和Cb分别为产生所需作用(例如50%细胞死亡)的药物A和药物B浓度。Ca,b和Cb,a分别为产生相同作用的组合中药物A和药物B的浓度。CI为组合指数。测定引起50%死亡(IC50)的氟达拉滨和TRU-016浓度,并显示于图27C中[氟达拉滨IC50(I)和TRU-016IC50(II)]。轴上两点之间的直线,为加性作用线。结果,在生存力研究中也测定了,达50%细胞死亡的氟达拉滨和TRU-016的不同组合,并将其绘制在相同图上。当点位于加性线以下时,表示存在协同作用。当点位于所述线以上时,表示存在拮抗作用。当点位于线上时,表示加性作用。图27显示,TRU-016有效降低氟达拉滨治疗的细胞中的相对细胞生存力,从而加强了单独氟达拉滨的细胞毒性效应。因此,该研究提供证据表明,TRU-016可与氟达拉滨共施用,从而在治疗血液恶性肿瘤中,导致产生增加的有效性(即,协同减少CLL细胞)。实施例16TRU-016在利妥希玛-抗性细胞中,诱导直接细胞毒性正如本文所公开,利妥希玛是用于治疗NHL、FCC、MCL、DLCL、SLL和CLL的单克隆抗体。采取本研究以确定TRU-016在利妥希玛抗性细胞中,诱导直接细胞毒性的功效。在五倍过量山羊抗人IgG存在情况下,将利妥希玛-抗性细胞(1X106细胞)(Raji4RH和RL4RH,提供自Dr.MyronS.Czuczman,RoswellParkCancerInstitute,Buffalo,NY)用赫赛汀(10μg/mL)、利妥希玛(10μg/mL)或TRU-016(5μg/mL)处理24小时。通过膜联蛋白/PI染色,测量直接细胞毒性,并相对于对照细胞(用赫赛汀处理的细胞)计算细胞生存力(百分比)。TRU-016在利妥希玛抗性细胞系中,诱导比利妥希玛更强的细胞毒性(参见图28)。因此,TRU-016为诱导利妥希玛抗性细胞中细胞毒性的有效试剂,由此使其可用作特征在于或涉及利妥希玛抗性细胞,例如某些B细胞的疾病的治疗剂。实施例17TRU-016在CD19+初级CLLB细胞中,诱导酪氨酸磷酸化为确定TRU-016如何诱导B细胞中的信号传导,进行实验以检查TRU-016对酪氨酸磷酸化的作用。将新鲜分离自CLL患者的CD19+细胞(~50-100x106),在5X106/mlPBS浓度悬浮。然后,将细胞与对照,司徒曼步(赫赛汀),或终浓度5ug/ml的TRU-016,在37℃5%CO2下温育10分钟。将细胞离心沉淀,取出上清液,并将细胞重悬于初始体积的新鲜PBS中。加入山羊抗人Fc片段特异性交联剂(25μg/ml),并将细胞再温育5分钟。将细胞再次离心沉淀,取出上清液,并在含蛋白酶和磷酸酶抑制剂的1mlRIPA裂解缓冲液(10mMTris,ph7.4,150mMNaCl,1%TritonX-100,1%脱氧胆酸0.1%SDS和5mMEDTA,所有都在终浓度)中裂解细胞。使用Sigma蛋白酶抑制剂混合物cat#P-8340;Sigma磷酸酶抑制剂混合物:丝氨酸/苏氨酸磷酸酶抑制剂混合物cat#P-2850;以及酪氨酸磷酸酶抑制剂cat#P-5726;PMSF(100mM)。将抑制剂使用之前以1∶100稀度,立即加入裂解缓冲液。裂解物中的蛋白浓度,用bicinchoninicacid(BCA)法(Pierce,Rockford,IL)定量。用双向凝胶电泳(pH范围3-10)(第一向)和10%SDS-PAGE(第二向)分离对照和处理的蛋白样品(总蛋白50μg)。用标准规程,将蛋白转移至0.2Nm硝酸纤维素膜(Schleicher&Schuell,Keene,NH),并用抗磷酸酪氨酸抗体克隆4G10(UpstateBiotechnology),进行免疫印迹分析。将辣根过氧化物酶(HRP)缀合的山羊抗兔IgG用作第二抗体。用化学发光底物(SuperSignal,PierceInc.Rockford,IL)检测磷蛋白。TRU-016在CD19+初级CLLB细胞中,诱导酪氨酸磷酸化,如双向凝胶分析所示(参见图29)。因此,这些实验显示,TRU-016的作用途径之一,为经由酪氨酸磷酸化途径。实施例18人源化TRU-016分子如实施例1所示,CD37-特异性SMIPs(例如TRU-016)记载在共有的美国申请No.10/627,556和美国专利申请公开Nos.2003/133939、2003/0118592和2005/0136049中。这些文献在此并入作为参考。本文仅制备并记载,示例性的CD37-特异性SMIP,TRU-016多肽(SEQIDNO:2)。本实施例提供了人源化TRU-016SMIPs。人源化抗体是本领域已知的,且在美国专利申请公开No.2006/0153837中已有讨论。为了人源化SMIPs,特别是人源化TRU-016,本申请应用了涉及抗体人源化的技术(讨论如下)。期望“人源化”产生抗体,所述抗体是低免疫原性的,但完全保留了原分子的抗原结合特性。为保留原抗体的所有抗原结合特性,抗原结合部位的结构应当在“人源化”版本中重新出现。这可以通过下述实现,在保留或不保留关键构架残基情况下,仅将非人CDRs嫁接至人可变构架结构域和恒定区(Jones等,Nature321:522(1986);Verhoeyen等,Science239:1539(1988)),或者通过重组整个非人可变结构域(以保留配体结合特性),但通过暴露的残基的明智取代,用人样表面将其“掩蔽”(以减少抗原性)(Padlan,Molec.Immunol.28:489(1991))。本质上,通过CDR嫁接人源化,涉及仅非人抗体CDRs,重组至人可变区构架和人恒定区上。理论上,这相当大地减少或消除了免疫原性(除非存在同种异型或独特型差异)。然而,据报道,也需要保持一些原抗体的构架残基(Reichmann等,Nature,332:323(1988);Queen等,Proc.Natl.Acad.Sci.USA,86:10,029(1989))。需要保持的构架残基,可通过计算机建模来鉴定。可选地,关键构架残基可通过比较已知抗原结合部位结构而有效鉴定(Padlan,Molec.Immun.,31(3):169-217(1994),并入本文作为参考)。有效影响抗原结合的残基,分为几组。第一组包括,与抗原位点表面邻接的残基,其因此与抗原直接接触。这些残基包括氨基末端残基和与CDRs毗邻的残基。第二组包括,通过与CDRs或抗体中另一肽链接触,可改变CDRs结构或相对排列的残基。第三组包括,能影响可变结构域结构完整性的具有包埋的侧链的氨基酸。这组残基,通常见于相同位置(Padlan,1994,同前),尽管依赖于编号系统,其鉴定的位置可能不同(参见Kabat等,″Sequencesofproteinsofimmunologicalinterest,5thed.,Pub.No.91-3242,U.S.Dept.Health&HumanServices,NIH,Bethesda,Md.,1991)。尽管本发明涉及SMIPs而不是抗体人源化,但本领域关于人源化抗体的知识,可用于本发明SMIPs中。某些人源化TRU-016分子的实例,如下表5所示。为制备本发明人源化TRU-016构建体,将TRU-016的小鼠构架区与人重链VH1和VH5构架区残基及轻链VK1和VK3残基进行比对。分析最佳匹配与小鼠可变区CDRs的构架区相容性。尽管有几种同等相容的组合可选择,但我们先前已经用VK3(X01668),VH5-51(Z12373)组合取得成功,因此,用通过15aaGly4Ser((g4s)3)scFv接头连接的这些人构架,设计人源化抗CD37SMIPs。VK3构建体用作为优选FR4匹配的JK1构建,且VH5用编码FR4的JH2构建,这与先前记载的构建体相同。SMIPs用重叠寡核苷酸PCR从头构建。将全长产物符合读框地克隆至含人IgG1铰链、CH2和CH3的SMIP表达载体中。对这些克隆验证序列,将其转染至COS-7细胞和3-天条件培养基测试对B-细胞淋巴瘤系Ramos的结合。为增加人源化,在轻链CDR1位置L25、L27和L28引入改变,且所述改变是良好耐受的,从而显示出与原人源化分子019001相等的结合活性。通过整合由各种人JH区编码的种系氨基酸H100-H102,以改变VH区CDR3的类似方式,制备其它DNA构建体。对构建体检查表达水平和结合Ramos细胞上CD37的程度。表5.人源化TRU-016构建体人源化TRU-016构建体no.019001(SEQIDNO:6;H016-019001)和非人源化TRU-016(SEQIDNO:2;016-G28-1)的氨基酸共有序列,用Kabat编号显示在图30A中。图30B显示了人源化TRU-016构建体nos.019001(SEQIDNO:6)、019008(SEQIDNO:86)和019009(SEQIDNO:88)的氨基酸序列比对。显示高CD37-特异性结合RamosB细胞的三种TRU-016人源化构建体(019001、019041和019044)的DNA和氨基酸序列比对,显示在图31中。相同三种TRU-016人源化构建体(019001、019041和019044)的FASTA格式DNA和氨基酸序列比对,显示在图32中。可用于本发明人源化TRU-016分子的其它铰链区(表6)和构架区(表7),提供如下。表6.人源化TRU-016SMIPs铰链区表7.人源化TRU-016SMIPs的构架区如上解释性实施例所示的本发明的各种修饰和改变,对本领域技术人员来说,是可以预见的。因此,仅附加要求出现的该种限制,应施加于本发明上。SEQIDNOS:79-88的DNA和氨基酸序列当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1