一种DDP-4抑制剂药物口崩片及其制备方法与流程
本发明属于医药制剂研究领域,具体涉及ddp-4抑制剂药物口崩片及其制备方法。
背景技术:
糖尿病是一种以血糖升高为共同特征的内分泌、代谢性疾病,是一种困扰全球的慢性病,目前全世界约有2.3亿病人,估计到2025年糖尿病病人数目将增加到3亿,ⅱ型糖尿病多在35~40岁之后发病,占糖尿病病人90%以上,随着生活水平的提高儿童中的发病率近年也有升高的趋势。ⅱ型糖尿病成为继肿瘤、心脑血管病之后常见的多发病,其用药市场逐年膨胀。
dpp-4是一种跨膜蛋白质分子,在血浆和很多组织的细胞上广泛存在,能够通过水解胰高血糖素样肽-1(glp-1)的n端第2位丙氨酸致使其降解失活,阿格列汀是一种用于治疗ⅱ型糖尿病的丝氨酸蛋白酶二肽基肽酶iv(dpp-4)抑制剂。它能够高度选择性地抑制dpp-4,延缓glp-1的灭活,促使胰岛细胞产生胰岛素,同时降低胰高血糖素浓度。
目前,阿格列汀已有报道和使用,但仅涉及的是普通片剂,没有该药口崩片的报道。但是,由于普通片服用时必须借助饮水以帮助吞咽,来减少对消化道的损伤。因此,对于像老年人、儿童和吞咽困难的患者依从性较差,在如外出或缺乏饮水等特殊条件下使用也受到限制。
因此,我们在cn201410845140.9申请中公开了阿格列汀的口崩片及其制备方法,采用湿法制粒将药物活性成分和辅料进行湿法制粒并压片,所制得的口崩片能在2ml37℃的水中,1min内完全崩解成小颗粒并形成均匀混悬液,与普通片剂相比,分散状态好,崩解时间短,方便了患者,尤其是老年人、儿童、吞咽困难及不能得到水的特殊条件下的患者。
随着研究的进一步深入,我们发现此口崩片存在以下缺陷:
(1)在湿颗粒干燥过程中发生了可溶性药物成分颗粒间的迁移导致药物含量不均匀。
(2)此药片在加速过程杂质有增加趋势,可能与湿法制粒的工艺有很大关系。
因此,进一步优化阿格列汀口崩片的处方,克服目前研究中存在的问题成为发明人亟待解决的问题。
技术实现要素:
针对目前阿格列汀口崩片湿颗粒干燥过程中发生了可溶性药物成分颗粒间的迁移导致药物含量不均匀,以及药片在加速过程杂质有增加的问题,公开了一种优化的ddp-4抑制剂(阿格列汀)药物口崩片及其制备方法。
本发明所提供的ddp-4抑制剂口崩片不含有粘合剂。
进一步地,所述ddp-4抑制剂药物口崩片包括ddp-4抑制剂和药用辅料,所述药用辅料包括稀释剂、崩解剂、矫味剂、润滑剂和助流剂。
其中,所述ddp-4抑制剂占药物总量的1%~45%;所述稀释剂占药物总量的1%~85%;所述崩解剂占药物总量的1%~60%;所述矫味剂占药物总量的0.01%~10%;所述润滑剂占药物总量的0.01%~15%;所述助流剂占药物总量的0.01%~12%。
所述的ddp-4抑制剂为苯甲酸阿格列汀,分子式为c18h21n5o2.c7h6o2,分子量为461.51。
所述的稀释剂为预胶化淀粉、甘露醇、乳糖、交联聚维酮中的一种或两种以上混合物。
所述的崩解剂为微晶纤维素、预胶化淀粉、交联聚维酮、l-羟丙基纤维素中的一种或两种以上混合物。
所述的矫味剂为阿斯帕坦或甜蜜素中的一种或两种混合物。
所述的润滑剂为硬脂酸镁或滑石粉中的一种或两种混合物。
所述的助流剂为微粉硅胶。
在本发明中,我们还公开了一种优选的ddp-4抑制剂药物口崩片的制备方法,包括以下步骤:
(1)将活性成分ddp-4抑制剂过80目筛,其他所有辅料过40目筛,备用;
(2)将处方量的部分药用辅料以等量递加法混匀,得混合物a,所述的部分药用辅料为稀释剂、崩解剂、矫味剂和助流剂;
(3)将处方量的ddp-4抑制剂以等量递加法直接与混合物a混匀,得混合物b;
(4)将处方量的润滑剂加入混合物b中,得到ddp-4抑制剂药物组合物;
(5)将步骤(4)制得的ddp-4抑制剂药物组合物采用粉末直接压片法压片,得到阿格列汀口崩片。
采用本发明所得的药物口崩片含量均匀度好。将药物组合物采用粉末直接压片法压片,所制备出的口崩片性质稳定,以加速条件下放置杂质未有明显变化。同时本发明所公开的口崩片表面形态光滑,亮洁,无裂片和粘冲,在口腔内能迅速崩解,无砂砾感,口感良好。在2ml水中1min内完全崩解,并通过40目筛。15min在稀盐酸溶液中的溶出度均能达到90%以上。
本发明所公开的技术方案不仅有效解决了阿格列汀等采用湿法制粒的药物在湿颗粒干燥过程中发生了可溶性药物成分颗粒间的迁移导致药物含量不均匀及长期放置过程中杂质增加问题,同时也为具有类似性质的药物提供了一种思路。
附图说明
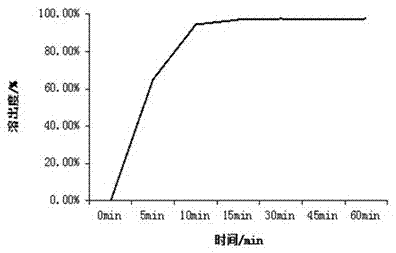
图1是本发明实施例1制备的阿格列汀口崩片在稀盐酸溶液中的溶出曲线;
图2是阿格列汀普通片在稀盐酸溶液中的溶出曲线。
具体实施方式
为进一步理解本发明,下面结合实施对本发明所公开的技术方案进行详细说明,本发明的保护范围不受以下实施例的限制。
以下实施例中所述实验方法,如无特殊说明,均为常规方法,所涉及试剂和材料,如无特殊说明,均为商业途径的市售产品。此外,所涉及的苯甲酸阿格列汀均已过80目筛,其他所有辅料均已过40目筛。
实施例1:
苯甲酸阿格列汀34g
乳糖48.5g
预胶化淀粉30g
微晶纤维素18g
l-羟丙基纤维素15g
甜蜜素1.5g
硬脂酸镁1.5g
微粉硅胶1.5g
制成1000片
制备工艺:将处方量的乳糖、预胶化淀粉、微晶纤维素、l-羟丙基纤维素、甜蜜素及微粉硅胶以等量递加法混匀,再将处方量的苯甲酸阿格列汀与上述已混匀的粉末以等量递加法混匀,最后加入处方量的硬脂酸镁混匀,确定片重和硬度,直接压片,即得阿格列汀口崩片。
外观:本法所制备的阿格列汀片口崩片为类白色,表面形态光滑。
含量均匀度:符合要求。
体外崩解:取所制备的阿格列汀口崩片1片,置于2ml37℃的水中,静置,37秒完全崩解,全部崩解并通过40目筛。
溶出度:取本阿格列汀口崩片12片以ph2.0的稀盐酸为溶出介质,15min的溶出度为95.4%。(中国药典2010年版二部附录ⅹc第二法)。
适口性:良好。
实施例2:
苯甲酸阿格列汀17g
乳糖65.5g
预胶化淀粉30g
微晶纤维素18g
l-羟丙基纤维素15g
甜蜜素1.5g
硬脂酸镁1.5g
微粉硅胶1.5g
制成1000片
制备工艺:将处方量的乳糖、预胶化淀粉、微晶纤维素、l-羟丙基纤维素、甜蜜素及微粉硅胶以等量递加法混匀,再将处方量的苯甲酸阿格列汀与上述已混匀的粉末以等量递加法混匀,最后加入处方量的硬脂酸镁混匀,确定片重和硬度,直接压片,即得阿格列汀口崩片。
外观:本法所制备的阿格列汀片口崩片为类白色,表面形态光滑。
含量均匀度:符合要求。
体外崩解:取所制备的阿格列汀口崩片1片,置于2ml37℃的水中,静置,37秒完全崩解,全部崩解并通过40目筛。
溶出度:取本阿格列汀口崩片12片以ph2.0的稀盐酸为溶出介质,15min的溶出度为95.4%。(中国药典2010年版二部附录ⅹc第二法)。
适口性:良好。
实施例3:
苯甲酸阿格列汀8.5g
乳糖74g
预胶化淀粉30g
微晶纤维素18g
l-羟丙基纤维素15g
甜蜜素1.5g
硬脂酸镁1.5g
微粉硅胶1.5g
制成1000片
制备工艺:将处方量的乳糖、预胶化淀粉、微晶纤维素、l-羟丙基纤维素、甜蜜素及微粉硅胶以等量递加法混匀,再将处方量的苯甲酸阿格列汀与上述已混匀的粉末以等量递加法混匀,最后加入处方量的硬脂酸镁混匀,确定片重和硬度,直接压片,即得阿格列汀口崩片。
外观:本法所制备的阿格列汀片口崩片为类白色,表面形态光滑。
含量均匀度:符合要求。
体外崩解:取所制备的阿格列汀口崩片1片,置于2ml37℃的水中,静置,37秒完全崩解,全部崩解并通过40目筛。
溶出度:取本阿格列汀口崩片12片以ph2.0的稀盐酸为溶出介质,15min的溶出度为96.1%。(中国药典2010年版二部附录ⅹc第二法)。
适口性:良好。
实施例4
按照实施例1中的方式,制备得到阿格列汀口崩片,并对其进行片剂稳定性考察。
方法:
按照《化学药物稳定性研究技术指导原则》进行稳定性考察,供试样品分别供试样品分别在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月,分别于第0、1、2、3及6月取样品测定,按稳定性重点考察项目(性状、含量和有关物质)进行检测,结果见表1。
表1阿格列汀口崩片稳定性考察结果
对比例1
按照专利cn201410845140.9中公开的方法制备得到阿格列汀口崩片,片剂表面光滑,但含量均匀度不能符合要求。
按照本发明实施例1中的方式获得改进型阿格列汀口崩片。片剂表面非常光滑,含量均匀度符合药典要求。
分别将25mg规格的专利cn201410845140.9中的现有阿格列汀口崩片、实施例1-3制备的改进型阿格列汀口崩片进行加速试验考察,观察外观,并测定含量及有关物质,发现现有阿格列汀口崩片含量变化不大,外观由白色变为类白色,有关物质有增加趋势。改进型阿格列汀口崩片含量,外观均无变化,有关物质未见增加。
按照实施例1~3中的方式,分别考察现有阿格列汀口崩片、改进型羟阿格列汀口崩片在水中的崩解性,改进型阿格列汀口崩片和现有阿格列汀口崩片均能在1min内完全崩解。
按照实施例1~3中的方式,分别考察现有阿格列汀口崩片、改进型羟阿格列汀口崩片在盐酸中的溶出度,改进型阿格列汀口崩片和现有阿格列汀口崩片均能在15min在稀盐酸溶液中的溶出度达到90%以上。其中实施例1制备的阿格列汀口崩片和现有阿格列汀口崩片在ph2.0盐酸溶液中的溶出曲线见图1和图2所示。
- 还没有人留言评论。精彩留言会获得点赞!