一种药物缓释型复合滴眼液及其制备方法与应用与流程
本发明属于生物医用材料领域,具体涉及一种药物缓释型复合滴眼液及其制备方法与应用。
背景技术:
白内障、青光眼等眼科疾病严重影响人类健康,每年的治疗费用高达上千亿美元。对于眼科疾病治疗,目前最方便直接的方法就是滴眼药水,但滴眼药水后由于排泄、流泪或者结膜吸收等会引起药物损失,导致药物停留时间短、给药效率低,为了获得药物长效性,通常需要频繁滴加高浓度药物来短暂维持较长时间的药效浓度,这不仅浪费金钱,而且还可能对人体产生毒副作用。因此,如何提高滴眼液的给药效率,开发长效、无毒的滴眼液给药体系有重要研究意义和应用前景。
常规滴眼药水的给药效率低,是因为药物是小分子化合物,在水溶液中的黏度很小,滴入药物后,药物与泪液混合并在2min内便离开角膜前区域,药物与角膜接触时间短,从而引起药物大量损失。为了延长药物在眼部的停留时间,目前市场上开发了一种透明质酸滴眼液。透明质酸是一种由双糖(D-葡萄糖醛酸及N-乙酰葡糖胺)结构组成的负电性糖胺聚糖,具有良好的生物相容性,存在于动物组织细胞间质和眼玻璃体中,已被广泛用于滴眼液中用来消除干眼症。目前的市场产品主要是通过透明质酸与药物混合使药液黏度增加来延长药物在角膜表面的滞留时间,从而提高药物的利用率。但是,简单依赖提高药液黏度无法实现药物的长时间缓慢释放,因为泪液会不断稀释滴眼液,小分子药物与透明质酸之间的相互作用是较弱的范德华力,无法有效阻止小分子药物向外快速迁移。因此,目前市售的透明质酸滴眼液无法实现药物在眼球部位的持续缓慢释放。
要实现透明质酸滴眼液的较长时间持续给药,需要解决两个关键技术问题:(1)透明质酸具有负载药物和缓释药物的功能;(2)透明质酸在角膜表面能有效吸附停留。环糊精是由七个吡喃葡萄糖单位通过α-1,4糖苷键连接所构成的环状分子,包括α-、β-和γ-型,具有“内腔疏水,外腔亲水”的特殊性质,是一种性能优良的吸附材料,利用空腔的疏水作用力、氢键和范德华力,可以和许多药物通过可逆的非共价相互作用形成复合物,有效增加水不溶性药物在水中的溶解度和利用度。其中,β-环糊精空腔大小适中,无毒性且生产成本低,已被广泛用于药物负载与控制释放研究,药物与β-环糊精结合越牢固,药物释放就越缓慢。因此,可以利用β-环糊精对透明质酸分子进行化学修饰来实现透明质酸的载药和缓释药物功能。另一个关键问题是如何使载药的透明质酸较长时间停留在角膜表面。人及动物角膜基质的主要成分是胶原蛋白,胶原蛋白是一种两性电解质,等电点为7.5~7.8。可见,在生理条件下(pH~7.4),角膜表面带弱正电性,可与带负电性的透明质酸分子发生静电相互作用,从而使载药的透明质酸分子固定在角膜表面。如果分别配制带正电性的胶原蛋白溶液和带负电性的载药透明质酸溶液,将可以通过改变组装层数来调控复合层的药物负载量和药物释放速率。此研究对开发具有缓释药物功能的新型治疗性滴眼液,用于眼科疾病治疗,有重要的科学研究意义和良好的应用前景。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种药物缓释型复合滴眼液。该复合滴眼液包括A液和B液,其中A液是带正电性的胶原蛋白溶液;B液是负载有目标药物的β-环糊精修饰透明质酸(β-CD-HA)溶液,带负电性。利用静电相互作用先将B液滴涂在富含胶原纤维的角膜表面,再将带负电的A液组装到B液表面,形成具有药物缓释功能的复合滴眼液涂层。可以通过改变组装层数来调控复合滴眼液涂层的载药量和药物缓释速率。
本发明的另一目的在于提供上述药物缓释型复合滴眼液的制备方法。该方法重复性好,可操作性强。
本发明的再一目的在于提供上述药物缓释型复合滴眼液的应用。
本发明的目的通过下述技术方案实现:
一种药物缓释型复合滴眼液,包括A液和B液;其中,A液是带正电性的胶原蛋白溶液;B液是负载有目标药物的β-环糊精修饰透明质酸(β-CD-HA)溶液,带负电性。
所述的胶原蛋白溶液的浓度优选为0.01~0.1g/mL。
所述的负载有目标药物的β-CD-HA溶液优选为0.01~0.1g/mL。
所述的药物缓释型复合滴眼的液制备方法,包括如下步骤:
(1)胶原蛋白溶液(A液)的制备
将胶原蛋白溶解在稀酸溶液中配成pH值为弱酸性的带正电的胶原蛋白溶液,得到A液,并在4℃下储存备用;
(2)负载有目标药物的β-CD-HA溶液(B液)的制备
①将β-CD的NaOH溶液与对甲基苯磺酰氯(p-TsCl)的乙腈溶液混合搅拌反应,抽滤后将滤液低温静置至沉淀析出,收集沉淀物并干燥,得到磺酰化β-环糊精,即磺酰化β-CD;
②将步骤①制备的磺酰化β-CD和过量己二胺溶于二甲基甲酰胺中,加热搅拌进行氨基化反应;反应结束后,反应产物用丙酮沉淀,沉淀物再用甲醇水溶液(v/v=1/1)溶解,然后再丙酮沉淀,重复此过程3次以上,以洗去未反应的己二胺;最后收集沉淀物并干燥,得到氨基化β-CD;
③将步骤②制备的氨基化β-CD和透明质酸(HA)溶解于磷酸盐缓冲液中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)和N-羟基琥珀酰亚胺(NHS),搅拌反应,然后透析、干燥,得到β-环糊精化透明质酸(β-CD-HA);
④将步骤③制备的β-CD-HA配成水溶液后装进透析袋,然后把透析袋置于药物水溶液中,利用透析法进行药物负载,最后将透析袋中的溶液进行干燥,得到负载有目标药物的β-CD-HA;将负载有目标药物的β-CD-HA再配成一定浓度的水溶液,得到负载有目标药物的β-CD-HA溶液,即B液。
步骤(1)中所述的稀酸优选为稀盐酸、稀硫酸或稀醋酸;
步骤(1)中所述的pH值优选为4.0~7.0。
步骤(2)中①所述的β-CD和p-TsCl的摩尔比优选为(1~5):1;
步骤(2)中②所述的氨基化反应的条件优选为60~80℃下搅拌反应2~8h;
步骤(2)中③所述的HA的重均分子量优选为2×104~2×106g/mol;
步骤(2)中③所述的氨基化β-CD上的氨基与HA上的羧基的摩尔比优选为(1~10):1;
步骤(2)中③所述的EDC·HCl和NHS的摩尔比优选为(1~10):1;
步骤(2)中④所述的β-CD-HA配成水溶液的浓度优选为0.01~0.1g/mL;
步骤(2)中④所述的药物优选为双氯芬酸、谷胱甘肽或毛国芸香碱;
步骤(2)中④所述的药物水溶液的浓度优选为0.5~2mg/mL。
所述的药物缓释型复合滴眼液在生物医用材料领域中的应用。
所述的药物缓释型复合滴眼液的应用方法,包括如下步骤:
先将人工角膜材料浸没在B液中,然后取出再浸没在A液中,重复此过程,由于A液和B液的静电相互作用,得到人工角膜材料表面的多层复合滴眼液涂层。
所述的多层复合滴眼液涂层优选为1~5层。
所述的人工角膜材料的制备方法,包括如下步骤:
由于人体角膜的外层主要是由胶原纤维组成,为了获得强度良好的模拟角膜材料来评价滴眼液的药物缓释性能,本发明通过聚甲基丙烯酸羟乙酯(pHEMA,市售角膜接触镜的常用基材)复合胶原纤维来制备人工角膜材料;
①将甲基丙烯酸羟乙酯、水、交联剂、引发剂、催化剂混合均匀后进行聚合反应,反应结束后,除去样品中未反应的单体、交联剂、引发剂和催化剂,干燥得到pHEMA水凝胶;
②将步骤①制备的pHEMA水凝胶浸没在胶原蛋白溶液中至完全溶胀后,再将溶胀的pHEMA水凝胶浸没在EDC·HCl/NHS混合水溶液中进行胶原交联反应,反应结束后用水清洗并干燥,得到人工角膜材料。
步骤①中所述的HEMA、水、交联剂、引发剂、催化剂的质量比优选为5:0.3:0.01:0.1:0.05;
步骤①中所述的交联剂优选为二甲基丙烯酸乙二醇酯、二乙烯基苯或N,N-亚甲基双丙烯酸胺;
步骤①中所述的引发剂优选为过硫酸铵;
步骤①中所述的催化剂优选为四甲基乙二胺;
步骤①中所述的聚合反应的条件优选为40~60℃下反应2~8h;
步骤②中所述的胶原蛋白溶液的浓度优选为0.01~0.1g/mL;
步骤②中所述的EDC·HCl和NHS的摩尔比优选为(1~10):1;
步骤②中所述的人工角膜材料中pHEMA水凝胶与胶原蛋白的质量比优选为(5~19):1。
本发明的原理在于:本发明的出发点是针对眼病治疗中传统的滴眼药液在角膜停留时间短、给药效率低,需要频繁滴加高浓度药物来短暂维持较长时间的药效浓度,不仅浪费金钱,还会引起人体毒副作用等缺点,根据人体角膜基质的主要组成(胶原蛋白),利用层层静电组装原理制备出具有载药和缓释药物功能的胶原/β-CD-HA复合滴眼液。该复合滴眼液由A液和B液两部分组成,其中A液是胶原蛋白溶液(带正电),B液是负载药物的β-环糊精修饰透明质酸溶液(带负电)。A液和B液在角膜表面静电组装,形成具有药物缓释功能的复合滴眼液涂层,如图1所示。通过改变组装层数可以调控复合滴眼液涂层的载药量和药物缓释速率。本发明对开发具有缓释药物功能的新型治疗性滴眼液,用于眼科疾病治疗,有重要的科学研究意义和良好的应用前景。
本发明相对于现有技术,具有如下的优点及效果:
(1)本发明提供的药物缓释型复合滴眼液的制备方法简单,重复性好,可操作性强;
(2)本发明制得的药物缓释型复合滴眼液,无毒且具有负载药物和缓释药物的功能,利用静电组装原理在角膜表面形成多层复合滴眼液涂层,可以延长复合滴眼液在角膜的停留时间,有效提高给药效率,是一种良好的眼科疾病治疗长效给药体系。
附图说明
图1是本发明的药物缓释型复合滴眼液的应用原理图。
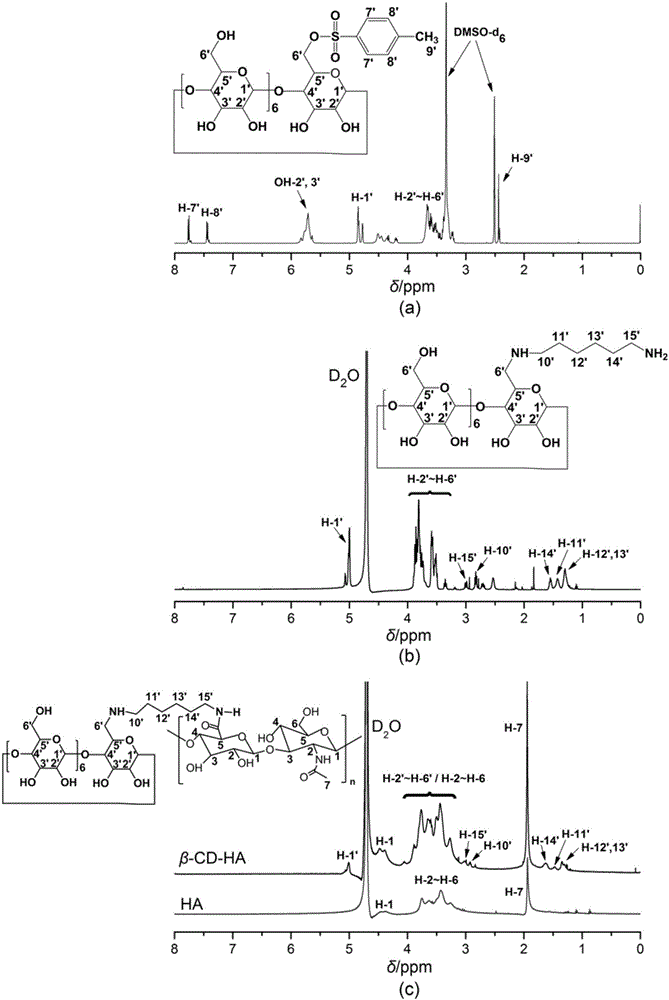
图2是实施例1所得的磺酰化β-CD、氨基化β-CD和β-CD-HA的核磁共振氢谱图。
图3是实施例1所得的载药β-CD-HA在4℃储存时的药物释放曲线示意图。
图4是实施例1所得的人工角膜及及其1层复合滴眼液涂层后的ATR-IR谱图。
图5是实施例1所得的人工角膜及及其1层复合滴眼液涂层后的扫描电子显微镜图;其中,(a)pHEMA膜;(b)人工角膜;(c)人工角膜表面1层复合滴眼液涂层。
图6是实施例1所得的人工角膜在1层复合滴眼液涂层后的载药量示意图。
图7是实施例1所得的1层复合滴眼液涂层人工角膜在37℃生理盐水中的药物释放曲线示意图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
本发明的药物缓释型复合滴眼液的应用原理图,如图1所示。
实施例1
(1)A液的制备
将0.3g胶原蛋白溶于30mL 0.1mol/L的稀盐酸中,配成浓度为0.01g/mL、pH为4.0的胶原蛋白溶液,作为A液;
(2)B液的制备
①称取0.1molβ-CD置于1000mL水中,在冰浴冷却下逐滴滴入40mL0.33g/mL的NaOH使溶液变澄清,然后再逐滴滴入60mL溶解有0.1mol对甲苯磺酰氯(p-TsCl)的乙腈溶液,搅拌反应5h。减压抽滤,除出未反应的p-TsCl,滤液用1mol/L盐酸中和至中性,然后在4℃下静置24h,所得白色沉淀经减压抽滤后真空干燥,即得到磺酰化β-CD。
图2(a)为磺酰化β-CD的1H NMR谱图,如图2(a)中谱线所示,磺酰化β-CD的各质子峰归属如下:2.42ppm(H-9′),3.24~3.67ppm(H-2’~H-6’),4.77ppm(H-1′),5.73ppm(OH-2′~3′),7.76ppm(H-7′),7.44ppm(H-8′);结果显示,磺酰化β-CD的1H-NMR谱图上确有出现7′、8′、9′号质子的吸收峰,由此说明p-TsCl与β-CD成功发生化学反应,制得磺酰化β-CD;
②取10g步骤①制得的磺酰化β-CD和20g己二胺混合溶解于60mL二甲基甲酰胺中,60℃下搅拌反应8h,冷却后加入500mL冷丙酮,析出白色沉淀物,减压抽滤,然后依次将沉淀物用50%甲醇水溶液溶解、用过量冷丙酮沉淀、减压抽滤,反复操作3次,以洗去未参加反应的己二胺。最后将产物真空干燥,得到氨基化β-CD。
图2(b)为氨基化β-CD的1H NMR谱图,如图2(b)中谱线所示,氨基化β-CD的各质子峰归属如下:3.02ppm(H-15′),2.81ppm(H-10′),5.1ppm(H-1′),3.33~3.87ppm(H-2′~H-6′),1.30~1.63ppm(H-11′~H-14′);结果显示,氨基化β-CD的1H-NMR谱图上确有11′~15′号质子吸收峰,由此说明,己二胺与磺酰化β-CD成功发生取代反应,生成氨基化β-CD;
③将0.2g重均分子量为2×104g/mol的HA溶解于300mL pH=7.4的磷酸盐缓冲液中,然后加入0.338g EDC·HCl和0.202g NHS(EDC·HCl/NHS摩尔比为1:1),搅拌反应40min后,加入0.616g步骤②制得的氨基化β-CD(氨基化β-CD上的氨基与HA上羧基的摩尔比为1:1),搅拌反应24h,然后用去离子水透析7d,冷冻干燥后得到β-CD-HA。
图2(c)是β-CD-HA的1H NMR谱图,如图2(c)中谱线所示,β-CD-HA的各质子峰归属如下:5.1ppm(H-1′),3.26~3.76ppm(H-2′~H-6′/H-2~H-6,与HA上的H部分重叠),3.02ppm(H-15′),2.81ppm(H-10′),1.94ppm(HA分子上的H-7),1.30~1.63ppm(H-11′~H-14′);结果显示,β-CD-HA的谱图上出现了H-1′~H-15′的质子吸收峰,由此说明,HA与氨基化β-CD已成功发生反应,制得β-CD-HA;
④将0.1g步骤③制备的β-CD-HA溶解于10mL生理盐水配置成浓度为0.01g/mL的水溶液并装进透析袋,然后把透析袋置于100mL浓度为0.5mg/mL的谷胱甘肽水溶液中,利用透析法进行药物负载,48h后将透析袋中的溶液进行冷冻干燥,得到负载谷胱甘肽的β-CD-HA。将载药的β-CD-HA用生理盐水配成浓度为0.01g/mL的水溶液,就得到B液。
图3是载药β-CD-HA在4℃储存时的药物释放曲线示意图。由图可见,初始的6h出现少量的药物爆释,这主要来自于粘附在β-CD-HA表面,没被包裹在β-CD-HA中的那部分药物,约占总负载药物的4.5%。从6h至28天,药物基本上不释放,这部分药物稳定储存在β-CD-HA中作为缓释药物,约占总负载药物的95.5%。由此说明,使用前B液可以在4℃下长期储存,药物会稳定储存在β-CD-HA中。
(3)人工角膜材料的制备
将HEMA、水、交联剂(二乙烯基苯)、引发剂(过硫酸铵)、催化剂(四甲基乙二胺)以质量比5:0.3:0.01:0.1:0.05混合均匀后注入平板模具中,40℃下静止反应8h,反应结束后,用索氏提取装置洗涤以除去样品中未反应的单体、引发剂及催化剂,真空干燥后得到pHEMA水凝胶。将2.0g制得的pHEMA水凝胶浸泡在5mL浓度为0.01g/mL的胶原蛋白稀盐酸溶液中,4℃下放置48h至水凝胶完全溶胀,然后取出水凝胶并浸泡在20mL含有0.034g EDC·HCl和0.02g NHS(EDC·HCl/NHS摩尔比为1:1)的水溶液中,使胶原进行交联反应,24h后取出样品并用去离子水浸泡48h除去杂质,真空干燥后得到人工角膜材料。
(4)人工角膜材料表面的滴眼液涂层组装
将人工角膜材料(表面带正电)浸没在B液(带负电)中,2min后取出获得B液涂层,由于静电相互作用,得到人工角膜材料表面的1层复合滴眼液涂层。
图4是实施例1所得的人工角膜及及其1层复合滴眼液涂层后的ATR-IR谱图。1735cm-1是pHEMA膜酯羰基的伸缩振动吸收峰;pHEMA/胶原人工角膜在1646cm-1、1550cm-1和1399cm-1出现新的吸收峰,分别对应于酰胺键的I、II和III带特征吸收峰,说明胶原蛋白已成功复合到pHEMA膜中;在pHEMA/胶原人工角膜表面进行1层复合滴眼液涂层后,1646cm-1、1550cm-1和1399cm-1吸收峰明显增强,这是因为β-CD-HA分子也含有很多酰胺键,涂层后酰胺键比涂层前要多的原因,并且1735cm-1峰消失,这是因为1层涂层后在人工角膜表面有一定的厚度,红外光在膜表面反射时,显示不出pHEMA的特征吸收峰。此外,在1154cm-1、1078cm-1、1043cm-1和946cm-1出现了透明质酸葡萄糖环的特征吸收峰。由此说明,滴眼液涂层已成功组装到人工角膜表面。
图5是实施例1所得的人工角膜及及其1层复合滴眼液涂层后的扫描电子显微镜图。由图可见,pHEMA膜的表面较光滑,pHEMA/胶原人工角膜表面变得粗糙,而1层复合滴眼液涂层后的人工角膜表面更加粗糙,明显看见在膜表面形成一定厚度的涂层。
图6是实施例1所得的人工角膜在1层复合滴眼液涂层后的载药量示意图。本实施例选用了两种1层涂层的对照样品,分别是药液和HA/药物混合液,它们在人工角膜表面的载药量分别是2.3μg/cm2和14.3μg/cm2。相比之下,在人工角膜表面1层复合滴眼液涂层后的载药量达到32.5μg/cm2,明显高于对照组,可见,使用本发明的复合滴眼液涂层可以有效提高人工角膜表面的载药量。
图7是实施例1所得的1层复合滴眼液涂层人工角膜在37℃生理盐水中的药物释放曲线示意图。本实施例选用了两种1层涂层的对照样品,分别是药液和HA/药物混合液。药液涂层的药物释放速率最快,人工角膜上的药物在5h内全部释放完毕;HA/药物混合液涂层的药物释放速率稍慢,人工角膜上的药物在20h内全部释放完毕;1层复合滴眼液涂层的药物释放速率最慢,人工角膜上的药物在48h内才全部释放完毕。可见,使用本发明的复合滴眼液涂层可以更有效地减缓药物的释放速率,达到药物缓释目的。
实施例2
(1)A液的制备
将1.5g胶原蛋白溶于30mL 0.1mol/L的稀盐酸中,配成浓度为0.05g/mL、pH为5.0的胶原蛋白溶液,作为A液;
(2)B液的制备
①称取0.1molβ-CD置于1000mL水中,在冰浴冷却下逐滴滴入40mL0.33g/mL的NaOH使溶液变澄清,然后再逐滴滴入60mL溶解有0.05mol对甲苯磺酰氯(p-TsCl)的乙腈溶液,搅拌反应5h。减压抽滤,除出未反应的p-TsCl,滤液用1mol/L盐酸中和至中性,然后在4℃下静置24h,所得白色沉淀经减压抽滤后真空干燥,即得到磺酰化β-CD。
②取10g步骤①制得的磺酰化β-CD和20g己二胺混合溶解于60mL二甲基甲酰胺中,75℃下搅拌反应4h,冷却后加入500mL冷丙酮,析出白色沉淀物,减压抽滤,然后依次将沉淀物用50%甲醇水溶液溶解、用过量冷丙酮沉淀、减压抽滤,反复操作3次,以洗去未参加反应的己二胺。最后将产物真空干燥,得到氨基化β-CD。
③将0.2g重均分子量为2×105g/mol的HA溶解于300mL pH=7.4的磷酸盐缓冲液中,然后加入1.69g EDC·HCl和0.202g NHS(EDC·HCl/NHS摩尔比为5:1),搅拌反应40min后,加入3.08g步骤②制得的氨基化β-CD(氨基化β-CD上的氨基与HA上羧基的摩尔比为5:1),搅拌反应24h,然后用去离子水透析7d,冷冻干燥后得到β-CD-HA。
④将0.5g步骤③制备的β-CD-HA溶解于10mL生理盐水配置成浓度为0.05g/mL的水溶液并装进透析袋,然后把透析袋置于100mL浓度为1mg/mL的双氯芬酸钠水溶液中,利用透析法进行药物负载,48h后将透析袋中的溶液进行冷冻干燥,得到负载双氯芬酸的β-CD-HA。将载药的β-CD-HA用生理盐水配成浓度为0.05g/mL的水溶液,就得到B液。
(3)人工角膜材料的制备
将HEMA、水、交联剂(二甲基丙烯酸乙二醇酯)、引发剂(过硫酸铵)、催化剂(四甲基乙二胺)以质量比5:0.3:0.01:0.1:0.05混合均匀后注入平板模具中,50℃下静止反应4h,反应结束后,用索氏提取装置洗涤以除去样品中未反应的单体、引发剂及催化剂,真空干燥后得到pHEMA水凝胶。将2.0g制得的pHEMA水凝胶浸泡在5mL浓度为0.05g/mL的胶原蛋白稀盐酸溶液中,4℃下放置48h至水凝胶完全溶胀,然后取出水凝胶并浸泡在20mL含有0.17g EDC·HCl和0.02g NHS(EDC·HCl/NHS摩尔比为5:1)的水溶液中,使胶原进行交联反应,24h后取出样品并用去离子水浸泡48h除去杂质,真空干燥后得到人工角膜材料。
(4)A液和B液在人工角膜材料表面的涂层组装
先将人工角膜材料浸没在B液中,2min后取出获得B液涂层,再浸没在A液中2min,重复此过程5次,由于A液和B液的静电相互作用,得到人工角膜材料表面的5层复合滴眼液涂层。
在实施例2所得的人工角膜在5层复合滴眼液涂层后的载药量测试中,本实施例选用了四种5层涂层的对照样品,分别是药液、HA/药物混合液、胶原/药物混合液以及载药β-CD-HA,它们在人工角膜表面的载药量分别是8.9μg/cm2、25.6μg/cm2、10.5μg/cm2和42.5μg/cm2。相比之下,在人工角膜表面5层复合滴眼液涂层后的载药量达到61.6μg/cm2,明显高于对照组,可见,使用本发明的复合滴眼液涂层可以有效提高人工角膜表面的载药量。
在实施例2所得的5层复合滴眼液涂层人工角膜在37℃生理盐水中的药物释放测试中,本实施例选用了四种5层涂层的对照样品,分别是药液、HA/药物混合液、胶原/药物混合液以及载药β-CD-HA。药液涂层的药物在7h内全部释放完毕;HA/药物混合液涂层的药物在24h内全部释放完毕;胶原/药物混合液涂层的药物在12h内全部释放完毕;载药β-CD-HA涂层的药物在36h全部释放完毕。相比之下,5层复合滴眼液涂层的药物释放速率最慢,人工角膜上的药物在72h内才全部释放完毕。可见,使用本发明的复合滴眼液涂层可以更有效地减缓药物的释放速率,达到药物缓释目的。
实施例3
(1)A液的制备
将3g胶原蛋白溶于30mL 0.1mol/L的稀盐酸中,配成浓度为0.1g/mL、pH为4.0的胶原蛋白溶液,作为A液;
(2)B液的制备
①称取0.1molβ-CD置于1000mL水中,在冰浴冷却下逐滴滴入40mL0.33g/mL的NaOH使溶液变澄清,然后再逐滴滴入60mL溶解有0.02mol对甲苯磺酰氯(p-TsCl)的乙腈溶液,搅拌反应5h。减压抽滤,除出未反应的p-TsCl,滤液用1mol/L盐酸中和至中性,然后在4℃下静置24h,所得白色沉淀经减压抽滤后真空干燥,即得到磺酰化β-CD。
②取10g步骤①制得的磺酰化β-CD和20g己二胺混合溶解于60mL二甲基甲酰胺中,80℃下搅拌反应2h,冷却后加入500mL冷丙酮,析出白色沉淀物,减压抽滤,然后依次将沉淀物用50%甲醇水溶液溶解、用过量冷丙酮沉淀、减压抽滤,反复操作3次,以洗去未参加反应的己二胺。最后将产物真空干燥,得到氨基化β-CD。
③将0.2g重均分子量为2×106g/mol的HA溶解于300mL pH=7.4的磷酸盐缓冲液中,然后加入3.38g EDC·HCl和0.202g NHS(EDC·HCl/NHS摩尔比为10:1),搅拌反应40min后,加入6.16g步骤②制得的氨基化β-CD(氨基化β-CD上的氨基与HA上羧基的摩尔比为1:1),搅拌反应24h,然后用去离子水透析7d,冷冻干燥后得到β-CD-HA。
④将1.0g步骤③制备的β-CD-HA溶解于10mL生理盐水配置成浓度为0.1g/mL的水溶液并装进透析袋,然后把透析袋置于100mL浓度为2mg/mL的毛国芸香碱水溶液中,利用透析法进行药物负载,48h后将透析袋中的溶液进行冷冻干燥,得到负载毛国芸香碱的β-CD-HA。将载药的β-CD-HA用生理盐水配成浓度为0.1g/mL的水溶液,就得到B液。
(3)人工角膜材料的制备
将HEMA、水、交联剂(N,N-亚甲基双丙烯酸胺)、引发剂(过硫酸铵)、催化剂(四甲基乙二胺)以质量比5:0.3:0.01:0.1:0.05混合均匀后注入平板模具中,60℃下静止反应2h,反应结束后,用索氏提取装置洗涤以除去样品中未反应的单体、引发剂及催化剂,真空干燥后得到pHEMA水凝胶。将2.0g制得的pHEMA水凝胶浸泡在5mL浓度为0.1g/mL的胶原蛋白稀盐酸溶液中,4℃下放置48h至水凝胶完全溶胀,然后取出水凝胶并浸泡在20mL含有0.34g EDC·HCl和0.02g NHS(EDC·HCl/NHS摩尔比为10:1)的水溶液中,使胶原进行交联反应,24h后取出样品并用去离子水浸泡48h除去杂质,真空干燥后得到人工角膜材料。
(4)A液和B液在人工角膜材料表面的涂层组装
先将人工角膜材料浸没在B液中,2min后取出获得B液涂层,再浸没在A液中2min,重复此过程3次,由于A液和B液的静电相互作用,得到人工角膜材料表面的3层复合滴眼液涂层。
在实施例3所得的人工角膜在3层复合滴眼液涂层后的载药量测试中,本实施例选用了四种3层涂层的对照样品,分别是药液、HA/药物混合液、胶原/药物混合液以及载药β-CD-HA,它们在人工角膜表面的载药量分别是6.1μg/cm2、20.2μg/cm2、7.5μg/cm2和32.5μg/cm2。相比之下,在人工角膜表面3层复合滴眼液涂层后的载药量达到48.6μg/cm2,明显高于对照组,可见,使用本发明的复合滴眼液涂层可以有效提高人工角膜表面的载药量。
在实施例3所得的3层复合滴眼液涂层人工角膜在37℃生理盐水中的药物释放测试中,本实施例选用了四种5层涂层的对照样品,分别是药液、HA/药物混合液、胶原/药物混合液以及载药β-CD-HA。药液涂层的药物在6h内全部释放完毕;HA/药物混合液涂层的药物在18h内全部释放完毕;胶原/药物混合液涂层的药物在10h内全部释放完毕;载药β-CD-HA涂层的药物在30h全部释放完毕。相比之下,3层复合滴眼液涂层的药物释放速率最慢,人工角膜上的药物在60h内才全部释放完毕。可见,使用本发明的复合滴眼液涂层可以更有效地减缓药物的释放速率,达到药物缓释目的。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!