包含吡啶酮羧酸衍生物的外用制剂的制作方法
本发明涉及包含吡啶酮羧酸衍生物1-环丙基-8-甲基-7-[5-甲基-6-(甲氨基)-3-吡啶基]-4-氧代-1,4-二氢-3-喹啉羧酸和/或其药学上可接受的盐作为活性成分的外用制剂,在将该外用制剂一日一次地施用于人类患者时,该外用制剂发挥抗皮肤感染以及皮肤的浅表感染(如伴有化脓性炎症的痤疮等)的治疗和/或预防效果。
背景技术:
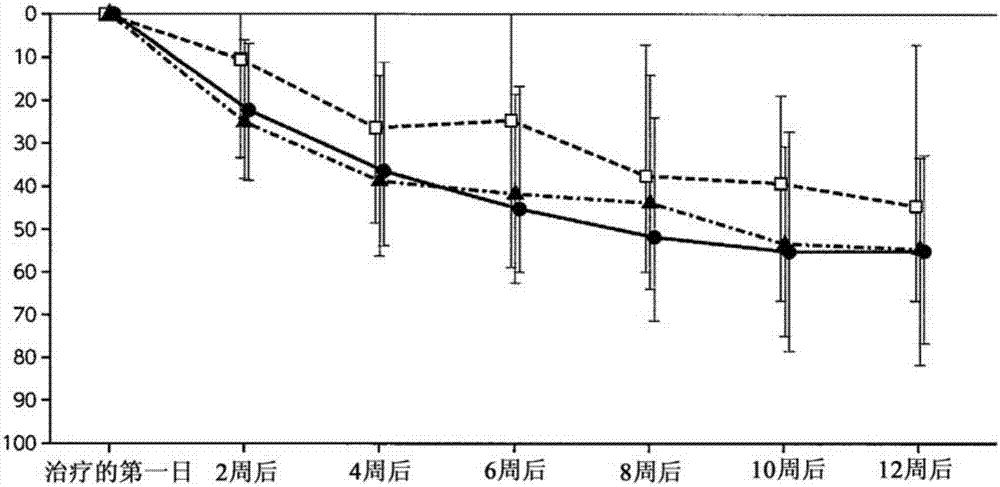
:诸如伴有化脓性炎症的痤疮以及皮肤的浅表感染之类的皮肤感染具有多种原因。然而,皮肤感染的主要原因是皮脂腺中痤疮丙酸杆菌、葡萄球菌和其他革兰氏阳性厌氧菌的增殖。伴有化脓性炎症的痤疮以及皮肤的浅表感染的常见传统治疗方法包括外用抗生素(如那氟沙星)来治疗轻度至中度的病症以及使用口服抗生素(如米诺环素和罗红霉素)来治疗中度至重度的病症。人们已经开发了包含1-环丙基-8-甲基-7-[5-甲基-6-(甲氨基)-3-吡啶基]-4-氧代-1,4-二氢-3-喹啉羧酸作为活性成分的制剂,以提供新型药物作为外用抗生素(例如,参见专利文献1和专利文献2)。为了提高治疗效果,提高患者依从性是有意义和重要的。如果患者不按预期的方式服药,那么预期有效的药物可能不会发挥作用,或者更坏的情况是可能仅发生副作用。提高患者依从性的一种方法是通过药剂师的指导。还有关于减少剂量频率的积极研究,例如通过使用缓释制剂。引用参考文献专利文献专利文献1:wo99/51588专利文献2:wo2007/015453技术实现要素:本发明要解决的问题本发明的主要目的在于提供一种外用制剂,当将该外用制剂一日一次地施用于人类患者时,该外用制剂发挥抗皮肤感染(如伴有化脓性炎症的痤疮和皮肤的浅表感染)的治疗和/或预防效果。解决问题的手段本发明人进行了深入研究,并发现可以通过使用1-环丙基-8-甲基-7-[5-甲基-6-(甲氨基)-3-吡啶基]-4-氧代-1,4-二氢-3-喹啉羧酸作为活性成分来实现上述目的。本发明是基于该发现而完成的。本发明包括(例如)以下方面。(1)一种外用制剂(以下称为“根据本发明的外用制剂”),其包含1-环丙基-8-甲基-7-[5-甲基-6-(甲氨基)-3-吡啶基]-4-氧代-1,4-二氢-3-喹啉羧酸(以下称为“根据本发明的化合物a”)和/或其药学上可接受的盐作为活性成分,并且在将所述外用制剂一日一次地施用于人类患者时,所述外用制剂发挥抗皮肤感染的治疗和/或预防效果。(2)如上述(1)中所述的外用制剂,其中皮肤感染是单纯性皮肤和软组织感染、复杂性皮肤和软组织感染、或者伴有化脓性炎症的痤疮。(3)如上述(2)中所述的外用制剂,其中单纯性皮肤和软组织感染是皮肤的浅表感染、或者深层皮肤感染。(4)如上述(3)中所述的外用制剂,其中皮肤的浅表感染是毛囊炎、须疮、脓性汗孔周围炎、或者感染性脓疱病。(5)如上述(2)中所述的外用制剂,其中伴有化脓性炎症的痤疮是寻常痤疮、新生儿痤疮、或者聚合性痤疮。(6)如上述(1)中所述的外用制剂,其具有软膏剂、凝胶剂、霜剂、乳剂、胶带剂、或者洗剂的形式。(7)如上述(1)中所述的外用制剂,其具有洗剂的形式。(8)如上述(7)中所述的外用制剂,其包含低级醇、水溶性聚合物以及多元醇,并且所述外用制剂的ph为9至12。(9)如上述(8)中所述的外用制剂,其中低级醇是乙醇或异丙醇。(10)如上述(8)中所述的外用制剂,其中水溶性聚合物是水溶性纤维素衍生物。(11)如上述(10)中所述的外用制剂,其中水溶性纤维素衍生物是羟乙基纤维素。(12)如上述(8)中所述的外用制剂,其中多元醇是1,3-丁二醇。(13)如上述(8)中所述的外用制剂,其中低级醇是乙醇,水溶性聚合物是水溶性纤维素衍生物,并且多元醇是1,3-丁二醇。(14)如上述(13)中所述的外用制剂,其中乙醇的含量是1重量%至20重量%。附图说明图1表示由伴有化脓性炎症的痤疮引起的炎症性皮疹痕迹的数目随时间的变化,其中纵轴表示炎症性皮疹痕迹的数目的减少百分比(%),横轴表示评价时间,实心圆表示一日两次地施用试验药物的组,实心三角形表示一日一次地施用试验药物的组,空白方块表示施用对照药物的组。图2表示由伴有化脓性炎症的痤疮引起的炎症性皮疹痕迹的数目随时间的变化,其中纵轴表示炎症性皮疹痕迹的数目的减少百分比(%),横轴表示评价时间,实心圆表示一日一次地施用试验药物的组,实心三角形表示一日两次地施用比较药物的组,空白方块表示施用对照药物的组。具体实施方式根据本发明的化合物a属于一组喹诺酮系的合成抗菌化合物,并且通过抑制细菌的dna复制中所涉及的dna促旋酶和拓扑异构酶iv来发挥其抗菌效果。根据本发明的化合物a具有广泛的抗菌谱,并对革兰氏阳性菌、革兰氏阴性细菌、厌氧菌、衣原体和耐药性革兰氏阳性菌具有强抗菌活性。可以使用wo99/51588中描述的方法来合成根据本发明的化合物a。根据本发明的化合物a的药学上可接受的盐的例子包括通常已知的氨基等的碱性基团的盐以及通常已知的羟基和羧基等的酸性基团的盐。碱性基团的盐的例子包括:与诸如盐酸、氢溴酸和硫酸等的无机酸的盐;与诸如酒石酸、甲酸、富马酸、马来酸、苹果酸和柠檬酸等的有机羧酸的盐;以及与诸如甲磺酸、苯磺酸、对甲苯磺酸、均三甲苯磺酸和萘磺酸等的磺酸的盐。酸性基团的盐的例子包括:与钠和钾等碱金属的盐;与钙和镁等碱土金属的盐;铵盐;以及与赖氨酸、精氨酸和鸟氨酸等氨基酸的盐,或者与三甲胺、三乙胺、三丁胺、吡啶、n,n-二甲基苯胺、n-甲基哌啶、n-甲基吗啉、二乙胺、二环己胺、普鲁卡因、二苄胺、n-苄基-β-苯乙胺、1-二苯羟甲胺(1-ephenamine)和n,n’-二苄基乙二胺等含氮有机碱的盐。利用所包含的作为活性成分的本发明化合物a的抗菌效果,可以使用本发明的外用制剂来治疗和/或预防广泛的皮肤感染。对本发明的外用制剂所针对的皮肤感染没有特别地限制,只要它们是部分由细菌感染引起的疾病即可。这些疾病的例子包括单纯性皮肤和软组织感染、复杂性皮肤和软组织感染以及伴有化脓性炎症的痤疮。单纯性皮肤和软组织感染的例子包括皮肤的浅表感染以及深层皮肤感染。特别优选的是皮肤的浅表感染。皮肤的浅表感染可分为相关附肢感染(appendage-associatedinfections)和非相关附肢感染。相关附肢感染的例子包括毛囊炎、须疮以及脓性汗孔周围炎。非相关附肢感染的例子包括触染性脓疱病。也可以将复杂性皮肤和软组织感染分为相关附肢感染和非相关附肢感染。相关附肢感染的例子包括疖、疖病以及痈。非相关附肢感染的例子包括蜂窝织炎、丹毒、淋巴管炎以及淋巴结炎。可以将复杂性皮肤和软组织感染分为慢性脓皮病以及皮肤的继发感染。慢性脓皮病的例子包括感染性粉瘤以及化脓性汗腺炎。皮肤的继发感染的例子包括皮肤溃疡等继发感染。伴有化脓性炎症的痤疮的例子包括寻常痤疮、新生儿痤疮以及聚合性痤疮。特别优选的是寻常痤疮。可以通过使用本领域技术人员公知的方法来适当地混合构成组分而制备本发明的外用制剂。对本发明的外用制剂的剂型没有特别的限制,并且可以是(例如)软膏剂、凝胶剂、霜剂、乳剂、胶带剂、或者洗剂。优选为洗剂。对本发明的外用制剂中的根据本发明的化合物a和/或其药学上可接受的盐的含量没有特别的限制,只要其为发挥治疗效果的量即可。例如,制剂中的适宜含量为0.01重量%至20重量%,优选为0.1重量%至5重量%。当将本发明的外用制剂一日一次地施用于人类患者时,本发明的外用制剂可以发挥其对皮肤感染的治疗和/或预防效果。根据患者的年龄、体重和症状来适当地选择本发明的外用制剂的剂量。通常,当以30mg/天至2,000mg/天的量经过皮肤给药时,本发明的外用制剂可发挥其药物效果。当本发明的外用制剂的剂型是洗剂时,尽管对构成组分没有特别限制,但是该制剂可以包含(例如)低级醇、水溶性聚合物、多元醇以及ph调节剂。对可以在根据本发明的洗剂中使用的低级醇没有特别限制,只要其为c1醇至c3醇即可,并且该低级醇可以为(例如)甲醇、乙醇、丙醇或异丙醇。优选的是乙醇和异丙醇。特别优选的是乙醇。相对于根据本发明的洗剂的总量,低级醇的适宜含量为1重量%至20重量%,优选为5重量%至10重量%。对可以在根据本发明的洗剂中使用的水溶性聚合物没有特别限制,只要其为通常在外用制剂和化妆品中使用的水溶性聚合物即可。水溶性聚合物的例子包括:聚乙二醇400、聚乙二醇4000、聚乙二醇20000、聚乙二醇400000、聚乙二醇600000以及聚乙二醇4000000等聚氧乙烯聚合物;聚氧乙烯-聚氧丙烯共聚物等共聚合性聚合物;聚丙烯酸钠、聚丙烯酸乙酯和聚丙烯酰胺等丙烯酸聚合物;以及甲基纤维素、疏水化羟丙基甲基纤维素、羟乙基纤维素和羟丙基纤维素等纤维素衍生物。优选的是纤维素衍生物,并且羟乙基纤维素是更优选的。这些可以单独地使用,或者两种以上组合使用。相对于根据本发明的洗剂的总量,适宜含量为0.1重量%至5重量%,优选为0.7重量%至2重量%。对可以在根据本发明的洗剂中使用的多元醇没有特别的限制,只要其在分子内具有两个以上的羟基即可,并且该多元醇为通常用于外用制剂和化妆品的多元醇。这些多元醇的例子包括乙二醇、二甘醇、三甘醇、聚乙二醇、丙二醇、二丙二醇、己二醇、1,3-丁二醇、甘油、二甘油、聚甘油、山梨糖醇、木糖醇以及甘露醇。优选的是1,3-丁二醇。这些可以单独地使用,或者两种以上组合使用。相对于根据本发明的洗剂的总量,适宜含量为1重量%至30重量%。对可以在根据本发明的洗剂中使用的ph调节剂没有特别的限制,只要其可以使ph为9至12即可,并且该ph调节剂是具有额外的缓冲能力的化合物。ph调节剂的例子包括:氢氧化钠、氢氧化钾和氢氧化锂等金属氢氧化物;单乙醇胺、单异丙醇胺、二乙醇胺、二异丙醇胺、三乙醇胺、三异丙醇胺和2-氨基-2-甲基-1,3-丙二醇等羟基低级烷基胺;以及碳酸氢钠、柠檬酸钠、乳酸钠、磷酸氢二钠和酒石酸钠等弱酸的金属盐。优选的是金属氢氧化物和弱酸的金属盐。更优选的是氢氧化钾和碳酸氢钠。这些可以单独地使用,或者两种以上组合使用。相对于根据本发明的洗剂的总量,适宜含量为0.01重量%至20重量%,优选为0.1重量%至2重量%。可以将稳定剂等与根据本发明的洗剂另外混合。对稳定剂没有特别的限制,并且可以是(例如)抗坏血酸、依地酸钠、硫代硫酸钠、亚硫酸钠、焦亚硫酸钠、亚硝酸钠、亚硫酸氢钠或光敏剂201。尽管根据本发明的洗剂在没有防腐剂的情况下也具有防腐效果,但是根据需要也可以添加防腐剂。实施例以下,使用制备例和试验例来对本发明进行更详细地描述。然而,本发明并不限于下述实施例的范围。制备例1使用wo2007/015453中描述的方法,以下列配方来制备作为本发明外用制剂的洗剂。[表1]制备例1配方重量%化合物a0.25羟乙基纤维素1.21,3-丁二醇15乙醇5氢氧化钾0.265碳酸氢钠0.5稳定剂适量纯净水余量ph10.9制备例2使用wo2007/015453中描述的方法,以下列配方来制备作为本发明外用制剂的洗剂。[表2]制备例2配方重量%化合物a0.5羟乙基纤维素1.21,3-丁二醇15乙醇5氢氧化钾0.31碳酸氢钠0.5稳定剂适量纯净水余量ph10.9制备例3使用wo2007/015453中描述的方法,以下列配方来制备作为本发明外用制剂的洗剂。[表3]制备例3配方重量%化合物a1羟乙基纤维素1.21,3-丁二醇15乙醇5氢氧化钾0.4碳酸氢钠0.5稳定剂适量纯净水余量ph10.9制备例4使用wo2007/015453中描述的方法,以下列配方来制备作为本发明外用制剂的洗剂。[表4]制备例4配方重量%化合物a2羟乙基纤维素1.21,3-丁二醇15乙醇5氢氧化钾0.58碳酸氢钠0.5稳定剂适量纯净水余量ph10.9试验例1为了评价本发明的外用制剂对寻常痤疮的治疗效果,对寻常痤疮患者进行随机化的平行组比较试验。(1)受试患者选择13岁以上、面部上存在10个以上且小于30个炎症性皮疹痕迹的患者作为受试者。即使满足上述条件,也排除了落入以下类别中的任一者的个人。1)在面部伴随有除寻常痤疮以外的痤疮(例如聚合性痤疮、类固醇痤疮、坏死性痤疮、职业性痤疮)的患者2)在面部具有被认为会影响试验药物的评价的并发症(例如湿疹、特应性皮炎、酒渣鼻)的患者3)具有由于月经周期而使痤疮症状发生明显可见变化的患者4)在治疗开始之前的2周内,向面部局部施用了药物(包括普通药物)的患者5)在治疗开始之前的4周内使用了以下全身施用的药物(例如,内服或通过注射以提供全身效果)中的任一者的患者-用于痤疮的治疗药物(包括普通药物,不包括维生素b2和b6)-类固醇-抗生素-在日本以外使用的、并且被认为会影响试验药物的功效评价的药剂(包括用于痤疮的治疗剂)6)在治疗开始之前的4周内进行了以下面部治疗中的任一者的患者-化学换肤(chemicalpeel)-激光治疗或光疗7)在治疗开始之前的2周内使用了面部磨砂膏的患者8)患有喹诺酮系的合成抗生素超敏史的患者9)患有外用制剂皮肤超敏史的患者10)通过问诊而怀疑有严重并发症的患者11)怀孕的患者、以及在治疗期间希望怀孕或将进行母乳喂养的患者12)在治疗开始之前的6个月(180天)内参加了其他试验的患者13)由进行试验的医生确定为不合适的患者(2)试验方法将受试患者分为试验药物施用组(一日一次施用组,以及一日两次施用组)、比较药物施用组以及对照药物施用组。将试验药物、比较药物或对照药物在早晨和晚上施用4周。将制备例3中制备的制剂用作试验药物。将1%那氟沙星洗剂(市售产品,一日两次)用作比较药物。将不包含化合物a的洗剂用作对照药物。对于一日一次的试验药物施用组,在早晨施用对照药物,并在晚上施用试验药物。治疗开始后每周检查面部,并对炎症性皮疹痕迹的数目进行计数。在此,炎症性皮疹是指伴随有红斑丘疹(直径不超过1cm并且匹配毛囊的红色隆起丘疹)或脓疱(伴随有偶尔的触痛,并且包括在红斑丘疹的顶部伴随有黄色脓肿的病变、以及整体呈现为黄白色的病变)的病症。(3)评价方法对于最终评价时间下的各施用组中的炎症性皮疹痕迹的数目的减少百分比,计算出概要统计量以及95%置信区间。(4)评价结果如表5所示,对于最终评价时间下的炎症性皮疹痕迹的数目的减少百分比(平均±标准偏差),试验药物施用组和比较药物施用组的减少百分比高于对照药物施用组的减少百分比。[表5]单位(%)试验例2为了评价本发明的外用制剂对寻常痤疮的治疗效果,对寻常痤疮患者进行随机化的平行组比较试验。(1)受试患者选择13岁以上且小于50岁、面部存在有11个以上40个以下的炎症性皮疹痕迹的患者作为受试者。即使满足上述条件,也排除了落入以下类别中的任一者的个人。1)在面部伴随有被认为会影响试验药物的评价的并发症(例如,除了寻常痤疮以外的痤疮、和酒渣鼻)的患者2)患有皮肤病(例如特应性皮炎)并发症的患者,该皮肤病可能在测试期间引起面部皮疹3)由于月经周期而导致痤疮症状发生可见变化,使得达到将影响功效评价的程度的患者4)在治疗开始之前的12周内内服了类视色素或起到类似类视色素的作用的药剂、或者将类视色素或这样的药剂外部施用于面部的患者。5)在治疗开始之前的12周与治疗开始之前的4周之间,使用了全身施用的药物作为抗生素的时间合计为14天以上的患者6)在治疗开始之前的4周内进行了以下治疗中的任一者的患者-使用全身施用的药物的治疗,该药物(例如)为用于痤疮的治疗药物(不包括维生素b2和b6)、类固醇和抗生素,并且被认为会影响试验药物的功效评价-化学换肤、激光治疗或光疗、痤疮提取和爆裂(popping)、以及旨在治疗痤疮的其他面部治疗7)在治疗开始之前的2周内进行了以下治疗或手术中的任一者的患者-局部施用药物于面部的使用,或者面部美容手术-使用准药物或化妆品(例如面部磨砂膏)来护理面部痤疮8)在治疗开始之前的4个月(120天)内参加了其他试验的患者9)在试验的观察期中加入的患者10)对喹诺酮系的合成抗生素有超敏史、对外用制剂有皮肤超敏史、或者有光敏史的患者11)通过问诊而怀疑有严重并发症的患者12)怀孕的患者、以及在治疗期间希望怀孕或将进行母乳喂养的患者13)在观察期间使用了禁止与其他药物并用的药物、或接受了禁止与其他治疗并用的治疗的患者14)在观察期的期间,在早晨或晚上施用试验药物的遵守率小于70%的患者15)在观察期的期间,炎症性皮疹痕迹的数目的减少百分数为30%以上的患者16)由进行试验的医生确定为不合适的患者(2)试验方法在2周的观察期内,在早晨和晚上施用对照药物。在观察期之后,将受试患者分为试验药物施用组(一日一次施用组,以及一日两次施用组)以及对照药物施用组。在12周的治疗期内,在早上和晚上施用试验药物或对照药物。将制备例4中制备的制剂用作试验药物。将不包含化合物a的洗剂用作对照药物。对于一日一次的试验药物施用组,在早晨施用对照药物,并在晚上施用试验药物。治疗开始后每两周检查面部,并对炎症性皮疹痕迹的数目进行计数。在此,炎症性皮疹是指伴随有红斑丘疹(直径不超过1cm并且匹配毛囊的红色隆起丘疹)或脓疱(伴随有偶尔的触痛,并且包括在红斑丘疹的顶部伴随有黄色脓肿的病变、以及整体呈现为黄白色的病变)的病症。(3)评价方法1)主评价项目对于最终评价时间下的炎症性皮疹痕迹的数目的减少百分比,进行了以下分析。对于各个施用组,计算出概要统计量以及95%置信区间。在对照药物施用组和试验药物施用组(一日两次组、和一日一次组)之间进行了成对比较。由于盲检显示了最终评价时间下炎症性皮疹痕迹的数目减少百分比中的异常点,因此进行了单独定级的steel试验(separate-rankingsteel'stest)。之后,计算出对照药物施用组的中值和试验药物施用组(一日两次与一日一次)的中值之差的hodges-lehmann估计值以及95%置信区间。2)子评价项目从中值数据计算出治疗期中的炎症性皮疹痕迹的数目随时间的变化。(4)评价结果如表6所示,对于最终评价时间下的炎症性皮疹痕迹的数目的减少百分比,其在试验药物施用组(一日两次组、和一日一次组)与对照药物施用组之间存在有统计学上的显著差异(单独定级的steel试验;一日两次试验药物施用组:p=0.0003,一日一次试验药物施用组:p=0.0004)。如图1所示,从2周后至12周,所有的施用组中的炎症性皮疹痕迹的数目随时间而减少。4周以后,在一日两次试验药物施用组和一日一次试验药物施用组中观察到的炎症性皮疹痕迹的数目少于在对照药物施用组中观察到的炎症性皮疹痕迹的数目。[表6]单位(%)*:单独定级的steel试验组之间的中值差;用于中值差的hodges-lehmann估计值试验例3为了评价本发明的外用制剂对寻常痤疮的治疗效果,对寻常痤疮患者进行随机化的平行组比较试验。(1)受试患者选择13岁以上且小于50岁、面部存在11个以上40个以下的炎症性皮疹痕迹的患者作为受试者。即使满足上述条件,也排除了落入以下类别中的任一者的个人。1)在面部伴随有被认为会影响试验药物的评价的并发症(例如,除了寻常痤疮以外的痤疮、和酒渣鼻)的患者2)不适合于细菌试验(炎症性皮疹的内容物的采集)的患者3)患有皮肤病(例如特应性皮炎)并发症的患者,该皮肤病可能在测试期间引起面部皮疹4)由于月经周期而导致痤疮症状发生可见变化,使得达到将影响功效评价的程度的患者5)在治疗开始之前的12周内内服了类视色素或起到类似类视色素的作用的药剂、或者将类视色素或这样的药剂外部施用于面部的患者。6)在治疗开始之前的12周与治疗开始之前的4周之间,使用了全身施用的抗生素药物的时间合计为14天以上的患者7)在治疗开始之前的4周内进行了以下治疗中的任一者的患者-使用全身施用的药物的治疗,该药物(例如)为用于痤疮的治疗药物(不包括维生素b2和b6)、类固醇和抗生素,并且被认为会影响试验药物的功效评价-化学换肤、激光治疗或光疗、痤疮提取和爆裂、以及旨在治疗痤疮的其他面部治疗8)在治疗开始之前的2周内进行了以下治疗或手术中的任一者的患者-通过局部施用被认为会影响试验药物的功效评价的药物来进行面部治疗,该药物(例如)为用于痤疮的治疗药物、类固醇和抗生素-面部美容手术-使用准药物或化妆品(例如壬二酸、过氧化苯甲酰以及面部磨砂膏)来护理面部痤疮9)在治疗开始之前的4个月(120天)内参加了其他试验的患者10)已经参加了使用包含化合物a的外用制剂的试验的患者11)已经参加了相同试验的患者12)对喹诺酮系的合成抗生素有超敏史、对外用制剂有皮肤超敏史、或者有光敏史的患者13)被怀疑患有使患者不适合参加试验的严重并发症(包括全身性疾病)的患者14)怀孕的患者、以及在治疗期间希望怀孕或将进行母乳喂养的患者15)在观察期间使用了禁止与其他药物并用的药物、或接受了禁止与其他治疗并用的治疗的患者16)在观察期的期间,在早晨或晚上施用试验药物的遵守率小于70%的患者17)在观察期的期间,炎症性皮疹痕迹的数目的减少百分数为30%以上的患者18)由进行试验的医生确定为不合适的患者(2)试验方法在2周的观察期内,在早晨和晚上施用对照药物。在观察期之后,将受试患者分为试验药物施用组、比较药物施用组以及对照药物施用组。在12周的治疗期内,在早晨和晚上施用试验药物、比较药物或对照药物。将制备例4中制备的制剂用作试验药物。将1%那氟沙星洗剂(市售产品,一日两次)用作比较药物。将不包含化合物a的洗剂用作对照药物。对于试验药物施用组,在早晨施用对照药物,并在晚上施用试验药物。治疗开始后每两周检查面部,并对炎症性皮疹痕迹的数目进行计数。在此,炎症性皮疹是指伴随有红斑丘疹(直径不超过1cm并且匹配毛囊的红色隆起丘疹)或脓疱(伴随有偶尔的触痛,并且包括在红斑丘疹的顶部伴随有黄色脓肿的病变、以及整体呈现为黄白色的病变)的病症。(3)评价方法1)主评价项目对于最终评价时间下的炎症性皮疹痕迹的数目的减少百分比,进行了以下分析。对于各个施用组,计算出概要统计量。使用双样品wilcoxon检验,在试验药物施用组与对照药物施用组之间进行成对比较(双边检验,5%显著水平)以评估优越性。如果验证了优越性,则通过确定试验药物施用组的中值与比较药物施用组的中值之差的hodges-lehmann估计值的95%置信区间下限是否高于非劣效性界限-10.1%,从而检验非劣效性。根据试验例1的结果来设定非劣效性界限。具体而言,非劣效性界限10.1%为比较药物施用组与对照药物施用组在最终评价时间下的炎症性皮疹痕迹的数目减少百分比(中值分别为50.00%和29.71%)之差20.29%的大约一半。2)子评价项目从中值数据计算出治疗期中的炎症性皮疹痕迹的数目随时间的变化。(4)评价结果如表7所示,对于试验药物施用组,其在最终评价时间下的炎症性皮疹痕迹的数目的减少百分比(中值)为54.77%,对于比较药物施用组,其在最终评价时间下的炎症性皮疹痕迹的数目的减少百分比(中值)为53.59%,并且对于对照药物施用组,其在最终评价时间下的炎症性皮疹痕迹的数目的减少百分比(中值)为41.67%。试验药物施用组与对照药物施用组之间的成对比较显示出显著的差异(p<0.001,双样品wilcoxon检验),从而确认试验药物施用组优于对照药物施用组。对于试验药物施用组与比较药物施用组之间的减少百分比的中值的差异的hodges-lehmann估计值(95%置信区间)为0.00%(-7.14%至6.35%),并且95%置信区间下限高于非劣效性界限-10.1%,从而确认试验药物施用组相对于比较药物施用组的非劣效性。如图2所示,在试验药物施用组和比较药物施用组中,在评估期开始治疗后的第2周到第12周,炎症性皮疹痕迹的数目的减少百分比随着时间的延长而增加,并且在这两个组之间的模式是相同的。从试验药物施用组与比较药物施用组之间的炎症性皮疹痕迹的数目的减少百分比的中值的估计值(95%置信区间),与对照药物施用组的比较显示出:治疗开始后2周后,在试验药物施用组与对照药物施用组之间有显著的差异。[表7]治疗的第一日(皮疹痕迹的数目),最终评价时间下(皮疹痕迹的数目),减少数(皮疹痕迹的数目),减少百分数(%):中值(四分位范围)与试验药物施用组的差:hodges-lehmann估计值(95%置信区间)试验例4为了评价本发明的外用制剂对于皮肤的浅表感染的治疗效果,对患有毛囊炎或须疮(典型的皮肤的浅表感染)的患者进行非盲试验。(1)受试患者选择13岁以上、伴随具有所有发红(新出现的发红,并且不包括暗红色的残留红斑)、肿胀(急性炎症性肿胀,并且不包括炎症后的纤维化)以及红斑丘疹和脓疱的中度或更严重症状的毛囊炎或须疮、并且在评价位置处具有多个皮疹痕迹的患者作为受试者。即使满足上述条件,也排除了落入以下类别中的任一者的个人。1)不适合细菌试验(红斑丘疹或脓疱的内容物的采集)的患者2)患有被认为会影响试验药物的评价的其他皮肤病或全身性疾病的患者3)在治疗开始之前的4周内使用了抗生素的全身施用药物的患者4)在治疗开始之前的2周内,使用了局部施用的抗生素药物的患者,该药物施用到功效评价位置处的皮疹上5)对喹诺酮系的合成抗生素有超敏史、对外用制剂有皮肤超敏史、或者有光敏史的患者6)通过问诊而怀疑有严重并发症的患者7)怀孕或母乳喂养的患者,或在试验期间不希望采取避孕措施的患者8)在治疗开始之前的4个月(120天)内参加了试验的患者9)已经参加了使用包含化合物a的外用制剂的试验的患者10)已经参加了相同试验的患者11)由进行试验的医生确定为不合适的患者b2)试验方法在治疗的第一天,从观察到的所有发红、肿胀及红斑丘疹和脓疱的中度至更严重症状的区域中指定评价位置。采用干净的指尖在整个皮疹区域(包括评价位置以外的区域)上一日一次(夜晚)地涂覆合适量的制备例4中制备的制剂7天。治疗开始后,在第3天和第7天检查评价位置,并且通过对各个项目的结果进行评分,并从观察到的皮肤状况(发红、肿胀、及红斑丘疹和脓疱)来确定有效性。使用表8中所示的标准对皮肤状况进行评分。根据表9中所示的标准来确定有效性。(3)评价方法由评价位置处观察到的皮肤状况的评分,在最终评价时间下计算有效率和有效率的95%置信区间。(4)评价结果如表10所示,有效率为70.0%。[表8][表9][表10]有效率:“显著有效”或“有效”的百分比受试者数(%)当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1